Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.29 n.2 Ciudad de México May. 2013
Evaluación de la potencialidad de una chabasita natural mexicana en la remoción de plomo en agua
Evaluation of the potentality of a Mexican natural chabazite to remove lead from water
Juana ALVARADO IBARRA1, Mérida SOTELO LERMA1*, Diana MEZA FIGUEROA2, Marisela MAUBERT FRANCO3 y Francisco Abraham PAZ MORENO2
1 Departamento de Investigación en Polímeros y Materiales, Universidad de Sonora *Autora responsable: msotelo@guaymas.uson.mx
2 Departamento de Geología, Universidad de Sonora
3 UAM-Azcapotzalco, Universidad Autónoma Metropolitana
Recibido marzo 2012,
aceptado febrero 2013
RESUMEN
En este trabajo se presenta la caracterización de una zeolita natural de tipo chabasita del yacimiento mexicano La Palma, Divisaderos, Sonora y se evalúa su potencialidad para su uso como material de intercambio iónico para remover plomo en agua. La chabasita se caracterizó con DRX, ICP-OES, ICP-MS, EDX, MEB, BET y TG/TGD. Los resultados indican presencia de Ba (1930 ppm) y Sr (1220 ppm) característicos de fases enriquecidas en aluminio. Se propone un tratamiento de modificación de la chabasita usando soluciones de NaOH (0.1 M) y NH4NO3 (1 M). Se obtuvo la cinética de remoción de plomo tanto en la zeolita natural como en sus formas químicamente modificadas, utilizando el proceso de intercambio iónico en reactores en lote. Los resultados muestran lo innecesario de la homoionización de la zeolita natural para la remoción de plomo, por lo que se obtuvo la concentración en el equilibrio de la zeolita sin modificar, para trazar la isoterma de adsorción, misma que se ajustó al modelo de Langmuir. La isoterma de Langmuir presenta un buen ajuste de los resultados en el equilibrio (R2= 0.92), lo que demuestra que la zeolita natural estudiada, en su forma natural, contiene los cationes de intercambio necesarios (Ca+2, Mg2+ y Na+) para utilizarse potencialmente como un material adsorbente/intercambiador iónico para tratamiento de aguas impactadas por plomo.
Palabras clave: zeolita, intercambio iónico, metales pesados.
ABSTRACT
The intention of this paper is to present the characterization of a natural zeolite, chabazite-type, from the Mexican reservoir La Palma, at Divisaderos, Sonora, where their potential use as ion exchange material to remove lead in water is assessed. The chabazite was characterized through XRD, ICP-OES, ICP-MS, EDX, BET and TG/TGD. The results indicate the presence of Ba (1930 ppm) and Sr (1220 ppm), which are characteristic of aluminum rich phases. A chabazite modification treatment is proposed by using solutions of NaOH (0.1 M) and NH4NO3 (1 M). The lead removal kinetics both in natural zeolite as in their chemically modified forms was obtained by using the ion exchange process in a batch reactor. The results show how unnecessary natural zeolite homoionization is for the removal of lead, thereby obtaining the equilibrium concentration of unmodified zeolite for plotting the adsorption isotherm, which was adjusted to Langmuir model. The Langmuir isotherm has a good fit of the results at equilibrium (R2 = 0.92), which demonstrates that natural zeolites studied, in its natural form, contains exchangeable cations required (Ca+2, Mg2+ and Na+) for potentially be used as an adsorbent material/ion exchanger for water treatment impacted by lead.
Key words: zeolite, ion exchange, heavy metals.
INTRODUCCIÓN
Las zeolitas se componen principalmente de estructuras tetraédricas tridimensionales de AlO4 y SiO4. Éstas se interconectan por compartición de oxígenos formando canales y cavidades bien definidos, conteniendo moléculas de agua, cationes álcali (sodio, potasio, litio y cesio) y cationes alcalino térreos (calcio, estroncio, bario y magnesio) (Tschernich 1992).
Las zeolitas han sido estudiadas intensamente desde la década de los años 50 del siglo pasado (Masters y Maschmeyer 2011, Mumpton 1999), si bien la atención se ha centrado en las zeolitas sintéticas, es a partir del descubrimiento de yacimientos a cielo abierto que el interés por las de origen natural se ha incrementado y han tenido un significativo rol industrial (Mondale et al. 1995). Los usos más importantes de las zeolitas incluyen suavización de aguas, procesos de refinación de petróleo y gas, minería, tratamiento de aguas residuales, productos de papel, entre otros. La chabasita es una de las 41 zeolitas naturales que ha sido identificada y que se encuentra con la pureza y disponibilidad para considerarse fuente natural explotable con varios cientos de miles de toneladas en minas de Estados Unidos, Japón, Italia, Bulgaria, Cuba, Yugoslavia, Alemania, Corea y México (Bosch y Shifter 1997, Cincotti et al. 2001). La chabasita es una de las primeras zeolitas en ser ampliamente estudiada por sus aplicaciones industriales y tecnológicas y principalmente por su capacidad para remover, en soluciones acuosas, cationes metálicos como el cadmio, el cobre, el níquel, el plomo, el cromo y el zinc (Pansini et al. 1991, Zamzow y Murphy 1992, Kesraoui-Ouki et al. 1994, Torraca et al. 1998), así como el arsénico (Lievremont et al. 2003, Payne y Abdel-Fattah 2005, Ruggieri et al. 2008, Mejia-Zamudio et al. 2009), el amonio (Juan et al. 2009) y cationes radiactivos (Gennaro et al. 2003).
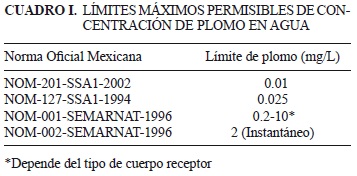
La presencia de plomo en el agua es un gran problema de riesgo ambiental y de salud, debido a su conocida toxicidad y porque su disposición es un verdadero problema. El plomo, aún en cantidades traza es muy tóxico y al ser dispuesto en cuerpos de agua causa serios trastornos a la salud humana y al ambiente (Trgo et al. 2006), su presencia en el aire, el agua y el suelo está relacionada con problemas digestivos y respiratorios, así como con daño neurológico (Shinya et al. 2006). La presencia de este tóxico en el ambiente crece año con año, no es biodegradable y tiende a acumularse en los organismos vivos (Petrus y Warchol 2003). Por lo anterior, en México se han establecido límites máximos permisibles de plomo, tanto en agua para consumo humano como en aguas residuales (Cuadro I). Sin embargo, Cajuste et al. (1991) y Vázquez-Alarcón et al. (2001) han determinado que existen concentraciones de metales tóxicos superando lo permitido por la normatividad nacional que regula el uso de agua residual con fines agrícolas. Existen métodos para remover metales potencialmente tóxicos disueltos en agua y suelo, estos incluyen intercambio iónico, precipitación, fitoextracción, ultrafiltración, ósmosis inversa, bioadsorción y electro-diálisis (Cañizares-Vilanueva 2000, Leyva-Ramos et al. 2001, Bernal et al. 2007). Los esfuerzos recientes se centran en la búsqueda de alternativas ambientalmente amigables y factibles económicamente (Rozic et al. 2000). En este contexto, el uso de zeolitas naturales para remover metales parece tener potencialidad debido a sus ventajas y a su peculiaridad sobre algunas resinas de intercambio iónico convencionales y costosas (Kesraoui-Ouki y Kavanagh 1997, Inglezakis et al. 2001, Demir et al. 2002).
El número de estudios reportados con el uso de zeolitas naturales provenientes de la República Mexicana es amplio, está representado por varios grupos de investigación que han manifestado un gran interés en la caracterización y el estudio del intercambio iónico y adsorción de varios yacimientos de diferentes tipos de zeolitas naturales en las últimas décadas (Hernández-Huesca et al. 1999, Vaca et al. 2001, Bosso y Enzweiler 2002, Englert y Rubio 2005, Díaz-Nava et al. 2005, Llanes-Monter et al. 2007, Dávila et al. 2008, Leyva-Ramos et al. 2010, Jiménez-Cedillo et al. 2011). Asimismo, dada la importancia que representan estos materiales, se han realizado algunos estudios por investigadores extranjeros (Mumpton 1973, Cochemé et al. 1996, Ostrooumov et al. 2012), por lo que el presente estudio realizado con una cha-basita mexicana relativamente poco estudiada y con un enfoque a la remediación ambiental, puede ser de gran importancia para la región.
MATERIALES Y MÉTODOS
Preparación de las muestras
La zeolita natural, designada en este trabajo como MXZ, se homogeneizó triturándola y tamizándola hasta obtener un tamaño de partícula < 425 µm (60 mesh TylerTM), se lavó con agua bidestilada y se secó en una mufla a 100 °C durante 24 horas, obteniendo un polvo de color café claro. La zeolita natural se trató químicamente con NaOH (Spectrum chemical) y NH4NO3 (Productos Químicos Monterrey, PQM). Se suspendieron 50 g de MXZ en 1000 mL de una solución de NaOH 0.1 M o de NH4NO3 1 M. Las mezclas se calentaron a 40 °C y se agitaron a 100 rpm durante 24 horas en un equipo Reciprocal Shaking Water Baths, modelo 25. Concluido ese tiempo las mezclas se separaron por decantación y se lavaron varias veces con agua desionizada para eliminar residuos de NaOH y NH4NO3, lo cual fue probado usando papel pH. Posteriormente se secaron en una estufa a 100 °C. Las zeolitas modificadas se identificaron como MXZNa y MXZNH, respectivamente. Los experimentos de intercambio iónico en lote se realizaron con una solución preparada con Pb(CH3COO)2•3H2O (PQM). La experimentación se realizó con la muestra de zeolita en su estado natural, identificada como MXZ y con sus formas químicamente modificadas.
Técnicas de caracterización
La zeolita natural, MXZ, se caracterizó mediante las siguientes técnicas:
-Difracción de rayos X (DRX), utilizando un equipo Bruker, D8 Advance, completamente automatizado, empleando la línea CuKa(λ=1.542 Å) en un intervalo de barrido de 10° - 70° (20).
-Microscopía electrónica de barrido (MEB), equipo empleado: JEOL JSM-5410LV; cada una de las muestras se colocó directamente en un portamuestras de aluminio con cinta de carbón doble adhesiva, se recubrieron con oro en atmósfera de argón para observar la morfología y no se recubrieron cuando se analizó la composición por energía dispersiva de rayos X (EDX).
-Termogravimetría, la estabilidad térmica se determinó en un equipo DSC-TGA SDT 2960 TA, en el cual se utilizó una combinación de curvas de termogravimetría (TG) y termogravimetría diferencial (TGD) en un intervalo de temperaturas de 30° - 1000 °C con un flujo de aire de 23 mL/min con una razón de calentamiento de 10 °C/min.
-El estudio de la textura de las muestras como el área específica se evaluó mediante el método de adsorción de gas nitrógeno, usando un equipo automatizado Belsorp Max Instrument Bel Japan Inc., empleando el método Brunauer-Emmett-Teller (BET); y la distribución de tamaño de poros por el método de Barrett-Joyner-Halenda (BJH). Los volúmenes totales de poros se calcularon a partir de la cantidad de nitrógeno adsorbido a la presión relativa (P/P0) de 0.97 (Hernández et al. 2005). Para este análisis, de manera previa las muestras se calentaron a 200 °C durante 24 horas al vacío.
-El análisis químico de los elementos mayores y trazas de MXZ se determinó mediante espectroscopía de emisión óptica acoplada inductivamente a plasma (ICP-OES) y espectrometría de masas con fuente de plasma acoplada inductivamente (ICP-MS), respectivamente, utilizando los servicios del laboratorio comercial ALS Laboratory Group Chemex (2012), acreditado bajo los requerimientos de ISO/IEC 17025:2005.
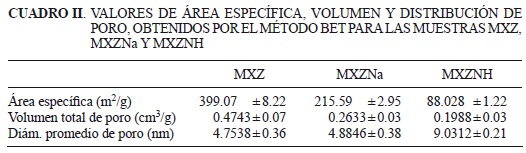
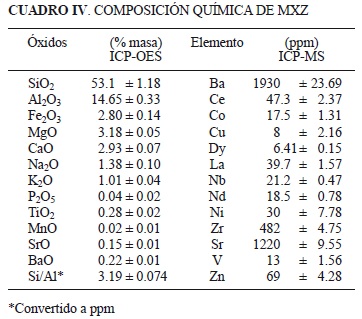
En los cuadros II, III y IV se reportan las principales propiedades físicas y químicas obtenidas.
Remoción de plomo
Los experimentos en lote se realizaron en matraces Erlenmeyer (50mL) con las muestras MXZ, MXZNa y MXZNH. En los estudios de cinética, la suspensión del sistema (1g de zeolita + 30 mL de solución de plomo [1g/L]) se agitó en un Reciprocal Shaking Water Baths, modelo 25, por periodos de tiempo de 10 a 600 minutos a una velocidad de 100 rpm y una temperatura de 25 °C.
La remoción de plomo (q) expresada como remoción de plomo por unidad de masa de MXZ, MXZNa y MXZNH, fue calculada de acuerdo con la ecuación (1), donde C0 es la concentración de plomo inicial (meqPb/L), Cf es la concentración final de plomo (meqPb/L), m es la masa de la zeolita MXZ (g) y V es el volumen en litros (L) (Orozco 1989). Los resultados obtenidos son los valores promedio de pruebas realizadas por duplicado.

Las isotermas de remoción de plomo para MXZ fueron medidas usando un procedimiento similar durante 500 minutos (tiempo suficiente para lograr el equilibrio) y variando la concentración de inicio para el plomo (100-2500 mgL-1). Después, las muestras se filtraron utilizando papel Whatman número 1 y se determinó la concentración de plomo por espectroscopía de absorción atómica (EAA), método de flama aire-acetileno, utilizando un equipo Perkin Elmer modelo 3110. Los resultados reportados son los valores promedio de pruebas por duplicado.
Se usó el modelo de Langmuir, dado en la ecua ción (2) para describir la isoterma obtenida (Lang muir 1918, Englert y Rubio 2005).

Los parámetros qmax (meq Pb/L) y K (l meq/Pb) son para adsorción en monocapa a altas concentraciones y la constante de equilibrio respectivamente. El ajuste de los datos se hizo por la linealización de la ecuación (2), presentada en la ecuación (3).
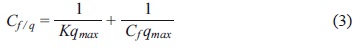
RESULTADOS Y DISCUSIÓN
Caracterización
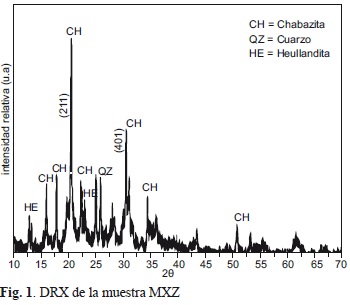
El difractograma de rayos X obtenido para la muestra MXZ se muestra en la figura 1. Las especies cristalinas del material se reconocen principalmente por los picos con planos (211) y (401) que aparecen en la posición (20) 20.528° y 30.516°, respectivamente. La especie dominante en el material es la chabasita (JCPDS 34-0137), identificando a la heulandita (JCPDS 25-144) y al cuarzo (JCPDS 33-1161) en concentraciones bajas.
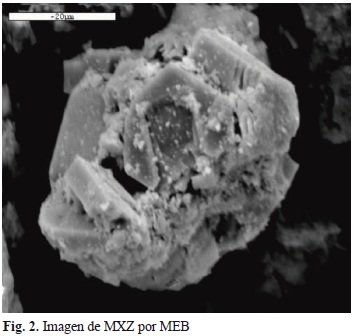
La imagen de la muestra MXZ, obtenida por MEB, se presenta en la figura 2. Se pueden observar claramente cristales romboédricos bien definidos correspondientes a la chabasita y placas (plates) propias de la heulandita, de acuerdo a lo reportado en la literatura (Mumpton y Ormsby 1976, Mumpton 1984), además de impurezas relacionadas directamente con el origen natural de la chabasita.
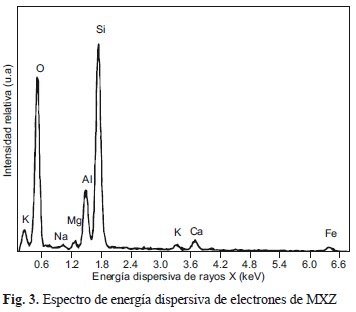
En la figura 3 se muestran los resultados obtenidos con EDX de la muestra MXZ y las señales corresponden a los elementos químicos Si, Al, O, K, Na, Ca, Mg y Fe, que están presentes en la estructura de la zeolita natural, valores que concuerdan con la composición química obtenida por ICP-OES (Cuadro IV).
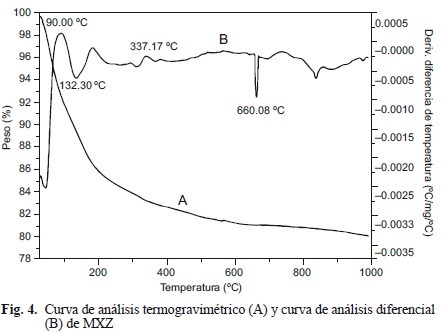
En la figura 4 se muestran las curvas obtenidas para MXZ. Del análisis gravimétrico (curva A) se puede considerar que el peso de la muestra disminuye significativamente con el aumento de temperatura hasta aproximadamente 600 °C, después de este valor se aprecia una reducción progresiva del peso muy lenta, indicando que la chabasita en estudio se deshidrata casi completamente alrededor de los 600 °C. Por otro lado, se determinó que la chabasita perdió el 20% de su peso, conformado principalmente por agua. Adicionalmente, en la curva de análisis térmico diferencial (curva B) se observa la pérdida de agua en dos pasos: el primero a 90 °C se atribuye a la pérdida de moléculas de agua (2%) adsorbidas en la zeolita y el segundo, alrededor de 130 °C, a la pérdida de agua estructural de la zeolita. Además, se observa una señal de descomposición a los 660°C, lo que permite constatar que MXZ presenta estabilidad térmica al menos hasta 600 °C. Investigaciones realizadas con chabasita natural han reportado una estabilidad térmica en un intervalo de 400 - 600 °C (Tsitsishvili et al. 1992, Kesraoui-Ouki et al. 1993). Destacando que después de los 600 °C se produce material amorfo en la estructura de la zeolita, pues estudios realizados (Zema et al. 2008) afirman que el 90% del agua zeolítica se pierde por debajo de los 450 °C.
En el cuadro II se presentan los resultados del análisis determinado por adsorción de gas de nitrógeno (modelo BET) del área específica de las muestras de zeolita, los cuales se llevaron a cabo por triplicado. Los valores para el área específica de las muestras modificadas decrecen con respecto a la natural, fenómeno que coincide con lo presentado por Susuky y Okuhara (2001). El valor del área específica obtenido para MXZ es de 399 m2/g, valor diferente a lo reportado por otros estudios para una chabasita natural, por ejemplo Payne y Abdel-Fattah (2005) determinaron un área específica de 520 m2/g, Stakebake y Fritz (1984) estudiaron varios depósitos de Estados Unidos e Irlanda y ellos determinaron que la chabasita tiene un área específica en un intervalo de 521 m2/g hasta 846 m2/g; finalmente, un estudio hecho a una chabasita mexicana reportada por Leyva-Ramos et al. (2010) presentó un área específica de 202 m2/g. Lo que nos indica que las propiedades de las zeolitas naturales variarán de una localidad a otra dependiendo de su origen. Además, los resultados del área específica se pueden explicar por las áreas de sección transversal de las moléculas de los adsorbatos, ya que los diferentes valores hacen que la accesibilidad dentro de la estructura interna de los poros sea disímil. Los valores de área específica que presentan los diversos estudios dependen del método seleccionado y de las condiciones experimentales (Ribeiero et al. 2003).
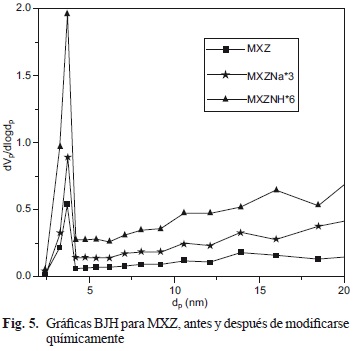
La distribución de tamaño de poro se calculó usando el método de Barrett-Joyner-Hallenda (BJH) (Barret et al. 1951) y los resultados se muestran en la figura 5, con la intención de mejorar la apreciación de las gráficas, los valores de las muestras modificadas se multiplicaron por múltiplo de tres. La International Union of Pure and Applied Chemistry (IUPAC) ha sugerido la siguiente clasificación de los poros de acuerdo con su tamaño, d: microporos (d< 2 nm), mesoporos (2 nm < d< 50 nm) y ma-croporos (d > 50 nm). Los tamaños de poro de las muestras en estudio se encuentran en el intervalo de 2.42 a 70 nm, los cuales corresponden a mesoporos y macroporos. La señal predominante se presenta en la zona de diámetro de poro dp = 3 nm. Con base en estos valores, el volumen acumulado de poros indica una fuerte evidencia que el acceso de nitrógeno al volumen de microporos de la chabasita es cinéticamente restringido debido a la condensación capilar de N2 en esta región (Suzuki y Okuhara 2001). De acuerdo con los resultados obtenidos, el diámetro promedio de poro evidencia que las moléculas de nitrógeno fueron poco accesibles a la estructura microporosa. Esto sugiere que los diámetros de poro mayores a 2.0 nm, evidentemente son de adsorción de nitrógeno y puede ser una contribución de los poros intercristalinos. Con lo anterior, se puede deducir la existencia de una estructura microporosa de tamaño uniforme que se encuentra dispersa dentro de una matriz mesoporosa.
En el cuadro III se presentan los resultados obtenidos del análisis EDX para cada una de las muestras, observándose que no hay variación significativa en la relación Si/Al, la cuál es del orden de 3. Los valores obtenidos son similares a los reportados por Zamzow et al. (1990) quienes estudiaron varias muestras de chabasita y determinaron relaciones Si/Al desde 3.2 y hasta 3.8, mientras que para una chabasita de Arizona, Estados Unidos se reporta una relación Si/Al de 4.54 (Gennaro et al. 2003) y para una chabasita de Sonora, obtenida de una zona cercana al yacimiento de este estudio, se reporta una relación Si/Al de 3.29 (Mejia-Zamudio et al. 2009).
En el cuadro IV se reportan los resultados de la composición química de MXZ obtenidos por ICP-OES e ICP-MS. Se puede ver que la muestra se compone principalmente por óxidos mayores de: silicio (53%), aluminio (15%), magnesio (3.18%), hierro (3%), calcio (3%), sodio (1%) y potasio (1%) y elementos de óxidos menores de fósforo, titanio y manganeso. MXZ presenta considerable concentración de elementos traza de bario y estroncio (1930 y 1220 mg/L, respectivamente), característica común de las chabasitas ricas en aluminio (Cochemé et al. 1996).
Con base en la composición química de MXZ y asumiendo 72 átomos de oxígeno por unidad de celda, se sugiere la siguiente fórmula molecular:
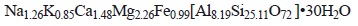
De lo anterior se obtiene que el peso molecular de MXZ es de 2838.24 g/mol y que los cationes más frecuentes en la estructura son el Mg2+>Ca2+>Na+>K+ y éstos están balanceando las cargas negativas debido a la sustitución isomorfa de los átomos de aluminio en la estructura de la zeolita.
Intercambio iónico
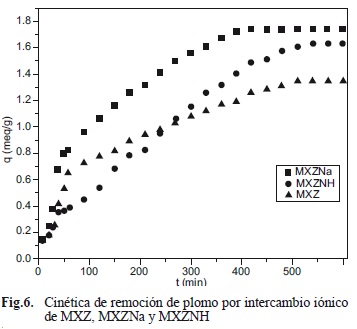
La cinética que presentan MXZ, MXZNa y MXZ-NH en el proceso de remoción de plomo se ilustra en la figura 6, donde se aprecia claramente la rápida selectividad por el ion plomo en las tres muestras. Aunque MXZNa presenta una mejor selectividad de intercambio del ion sodio por el ion plomo, la remoción con respecto a MXZ no es considerable, lo que refiere que la chabasita en estudio, en su forma natural, tiene los iones de intercambio suficientes para usarla en el proceso de tratamiento de agua contaminada. El equilibrio se logra aproximadamente a los 500 minutos de contacto, esto es importante para los procesos de tratamiento de aguas contaminadas que trabajen en operaciones continuas ya que es el indicativo para calcular los tiempos de residencia en las unidades instaladas.
Otros estudios con chabasita mexicana demuestran la utilidad de su uso en el tratamiento de aguas contaminadas. Mejía-Zamudio et al. (2009) obtienen resultados favorables (90%) en la remoción de arsénico, Leyva-Ramos y colaboradores (2010) indican que la chabasita presentó 1.43 veces más capacidad que una clinoptilolita para remover amonio y, Munive et al. (2010) presentan una propuesta para remover micotoxinas con zeolitas, encontrando que la zeolita que denominaron F2, de composición chabasita-heulandita, adsorbe fácilmente la aflatoxina.
Es importante resaltar que estos datos de remoción son válidos sólo en las condiciones en las que se obtuvieron, debido a que dependen de la concentración inicial de plomo, la relación masa de zeolita-volumen de la solución, el pH y la temperatura de la solución, incluso la composición de la chabasita varía en función de su contenido de elementos traza y el papel de estos en el potencial de remoción del material debe ser estudiado con mayor detalle.
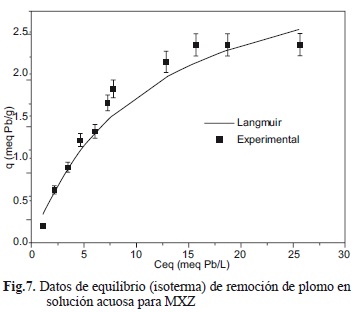
La isoterma obtenida de los estudios en lote se muestra en la figura 7, junto con la correspondiente al modelo de Langmuir (Ecuación 2). El modelo de Langmuir proporcionó buena correlación de los datos experimentales (R2 = 0.92). De los datos calculados se tiene que la máxima remoción de plomo por MXZ a través del proceso de intercambio iónico es de 2.38 meq de Pb/g. Los datos obtenidos en el equilibrio del proceso de intercambio iónico y una descripción matemática de los resultados son muy importantes para el diseño de los procesos de intercambio iónico (Perry y Green 1999).
CONCLUSIONES
En este trabajo se reporta la caracterización de una zeolita natural mexicana, el análisis de DRX reveló que la fase cristalina principal es la chabasita. La muestra al natural presenta un área específica lo suficientemente grande para el proceso de intercambio iónico y las muestras modificadas presentan un decremento significativo. La relación Si/Al de la muestra en su forma natural es de 3.19, el cual es un valor que se encuentra en el intervalo de lo reportado por otros autores. La muestra de chabasita es térmicamente estable hasta los 660 °C. Se propone la fórmula molecular para la chabasita sonorense Na1.26K0.85Ca1.48Mg2.26Fe0.99 [Al8.19Si25.11O72]•30H2O con un peso molecular de 2838.24 g/mol. El modelo de la isoterma de Langmuir presenta buena correlación (R2= 0.92) de los datos en equilibrio. No hay necesidad de modificar químicamente la muestra natural para utilizarla en el proceso de intercambio iónico y tratar la contaminación por plomo en agua. Los resultados obtenidos indican la potencialidad para la zeolita natural mexicana como un material adsorbente/intercambiador iónico para tratar agua residual contaminada y utilizarla para aplicaciones de reuso de agua.
AGRADECIMIENTOS
Este trabajo se realizó con el apoyo de la beca CONACyT con número de registro 153854.
A la Dra. Amelia Olivas y Eric Flores Aquino del CNyN-UNAM, por el apoyo en los análisis BET, a los doctores Rosa Elena Navarro y Raúl Pérez Salas de la Universidad de Sonora, por sus oportunos comentarios.
REFERENCIAS
ALS Laboratory Group Chemex (2012). [en línea]. http://www.alsglobal.com 17/08/2012. [ Links ]
Barret E.P., Joyner L.S. y Halenda P.P. (1951). The determination of pore volumen and area distributions in porous substances. I. Computations form Nitrogen Isotherms. J. Am. Chem. Soc. 73, 373-380. [ Links ]
Bernal M.P., Clemente R., Vazquez S. y Walker D.J. (2007). Aplicación de la fitorremediación a los suelos contaminados por metales pesados en Aznalcóllar. Ecosistemas 16, 1-14. [ Links ]
Bosch P. y Shifter I. (2003). La zeolita: una piedra que hierve. 3a ed. Fondo de Cultura Económica, Distrito Federal, México, 82 pp. [ Links ]
Bosso S.T. y Enzweiler J. (2002). Evaluation of heavy metal removal from aqueous solution onto scolecite. Water Res. 36, 4795-4800. [ Links ]
Cajuste L.J., Carrillo R.G., Cota E.G. y Laird R.J. (1991). The distribution of metals from wastewater in the Mexican Valley of Mezquital. Water Air Soil Pollut. 57-58, 763-771. [ Links ]
Cañizares-Vilanueva R.O. (2000). Biosorción de metales pesados mediante el uso de biomasa microbiana. Rev. Latinoam. Microbiol. 42, 131-143. [ Links ]
Cincotti A., Lai N., Orrú R.y Cao G. (2001). Sardinian natural clinoptilolites for heavy metals and ammonium removal: experimental and modeling, Chem. Eng. J. 84, 275-282. [ Links ]
Cochemé J.J., Lassauvagerie A.C., González-Sandoval J., Pérez-Segura E. y Münch P. (1996). Characterisation and potential economic interest of authigenic zeolites in continental sediments from NW Mexico. Miner. Deposita. 31, 482-491. [ Links ]
Dávila-Jiménez M.M., Elizalde-González M.P., Mattusch J., Morgenstern P., Pérez-Cruz M.A., Reyes-Ortega Y., Wennrich, R. y Yee-Madeira H. (2008). In situ and ex situ study of enhanced modification with iron of clinoptilolite-rich zeolitic tuff for arsenic sorption from aqueous solutions. J. Colloid Interf. Sci. 322, 527-536. [ Links ]
Demir A., Günay A. y Debik E. (2002). Ammonium removal from aqueous solution by ion-exchange using packed bed natural zeolite. Water S A 28, 329-336. [ Links ]
Díaz-Nava M.C., Olguín M.T., Solache-Ríos M., Alarcón-Herrera M.T. y Aguilar-Elguezabal A. (2005). Characterization and improvement of ion-exchange capacities of Mexican Clinoptilolite-rich tuffs. J. Incl. Phenom. Macro. 51, 231-240. [ Links ]
Englert A.H. y Rubio J. (2005). Characterization and environmental application of a Chilean natural zeolite.Int. J. Min. Proc. 75, 21-29. [ Links ]
Gennaro B., Colella A., Aprea P. y Colella C. (2003). Evaluation of an intermediate-silica sedimentary cha-bazite as exchanger for potentially radioactive cations. Micropor. Mesopor. Mater. 61, 159-165. [ Links ]
Green D.W. y Perry R.H. (2008). Perry's Chemical Engineer's Handbook. 8a ed. McGraw Hill. Nueva York, EUA. 2400 pp. [ Links ]
Hernández M.A., Rojas F., Corona L., Lara VH., Portillo R., Salgado M.A. y Petranoskii V. (2005). Evaluación de la porosidad de zeolitas naturales por medio de curvas diferenciales de adsorción. Rev. Int. Contam. Ambie. 21, 71-81. [ Links ]
Hernández-Huesca R., Díaz L. y Aguilar-Armenta G. (1999). Adsorption equilibria and kinetics of CO2, CH4 and N2 in natural zeolites. Sep. Purif. Technol. 15, 163-173. [ Links ]
Inglezakis V.J., Hadjiandreou K.J., Loizidou M.D. y Grigoropolou H.P. (2001). Pretreatment of natural clinoptilolite in a laboratory-scale ion exchange packed bed. Water Res. 35, 2161-2166. [ Links ]
Jiménez-Cedillo M.J., Olguín M.T., Fall Ch. y Colín A. (2011). Adsorption capacity of iron- or iron-manganese-modified zeolite-rich tuffs for As(III) and As(V) water pollutants. Appl. Clay Sci. 54, 206-216. [ Links ]
Juan R., Hernández S., Andres J.M. y Ruiz C. (2009). Ion exchange uptake of ammonium in wastewater from a sewage treatment plant by zeolitic materials from fly ash. J. Hazard. Mater. 161, 781-786. [ Links ]
Kesraoui-Ouki S., Cheeseman C.R. y Perry R. (1993). Effects of conditioning and treatment of Chabazite and clinoptilolite prior to lead and cadmium removal. Environ. Sci. Technol. 27, 1108-1116. [ Links ]
Kesraoui-Ouki S., Cheeseman C.R. y Perry R. (1994) Natural zeolite utilisation in pollution control: A review of applications to metals' effluents. J. Chem. Technol. Biotechnol. 59, 121-126. [ Links ]
Kesraoui-Ouki S. y Kavanagh M. (1997). Performance of natural zeolites for the treatment of mixed metal-contaminated effluents. Waste Manag. Res. 15, 383-394. [ Links ]
Langmuir I. (1918). Adsorption of gases on glass, mica and platinum. J. Am. Chem. Soc. 40, 1361-1403. [ Links ]
Leyva-Ramos R., Sánchez-Castillo M.A., Hernández-Sánchez M.V. y Guerrero-Coronado R.M. (2001). Remoción de metales pesados de solución acuosa por medio de clinoptilolitas naturales. Rev. Int. Contam. Ambie. 17, 129-136. [ Links ]
Leyva-Ramos R., Monsivais-Rocha J.E., Aragón-Piña A., Berber-Mendoza M.S., Guerrero-Coronado R.M., Alonso-Dávila P. y Mendoza-Barrón J. (2010). Removal of ammonium from aqueous solution by ion exchange on natural and modified chabazite. J. Environ. Manage. 91, 2662-2668. [ Links ]
Lievremont D., N'negue M. A., Behra Ph. y Lett M.C. (2003). Biological oxidation of arsenite: Batch reactor experiments in presence of kutnahorite and chabazite. Chemosphere 51, 419-428. [ Links ]
Llanes-Monter M.M., Olguín M.T. y Solache-Ríos M.J. (2007). Lead sorption by a Mexican, clinoptilolite-rich tuff. Env. Sci. Pollut. Res. 14, 397-403. [ Links ]
Masters A.F. y Maschmeyer T. (2011). Zeolites-From curiosity to cornerstone. Micropor. Mesopor. Mat. 142, 423-438. [ Links ]
Mejía-Zamudio F., Valenzuela-García J.L., Aguayo-Salinas S. y Meza-Figueroa D. (2009). Adsorción de arsénico en zeolita natural pretratada con óxidos de magnesio. Rev. Int. Contam. Ambie. 25, 217-227. [ Links ]
Mondale K.D., Carland R.M. y Aplan F.F. (1995). The comparative ion exchange capacities of natural sedimentary and synthetic zeolites. Miner. Eng. 8, 535-548. [ Links ]
Mumpton F.A. (1973). First reported occurrence of zeolites in sedimentary rocks of Mexico. Am. Mineral. 58, 287-290. [ Links ]
Mumpton F.A. y Ormsby W.C. (1976). Morphology of zeolites in sedimentary rocks by scanning electron microscopy. Clay. Clay Miner. 24, 1-23 [ Links ]
Mumpton, F.A. (1984). Natural zeolites. En: Zeo-agricul-ture: use of natural zeolites in agriculture and aqua-culture (W.G. Pond y F.A. Mumpton, Eds.). Westview Press, Boulder, Colorado, pp. 257-262. [ Links ]
Mumpton F.A. (1999). La roca magica: Uses of natural zeolites in agriculture and industry. Proc. Natl. Acad. Sci. USA. 96, 3463-3470. [ Links ]
Munive G.T., Valenzuela-García J.L. y Jordán-Hernández R. (2010). Zeolitas sonorenses para la adsorción de micotoxinas. Intec. J. 1, 15-23. [ Links ]
Orozco D.F. (1989). Análisis químico cuantitativo. Porrúa, México, 448 pp. [ Links ]
Ostrooumov M., Cappelletti P. y de Gennaro R. (2012). Mineralogical study of zeolite from New Mexican deposits (Cuitzeo area, Michoacan, Mexico). Appl. Clay Sci. 55, 27-35. [ Links ]
Pansini M., Colella C. y de Gennaro M. (1991). Chromium removal from water by ion exchange using zeolite. Desalination 83, 145-157. [ Links ]
Payne K. B. y Abdel-Fattah T.M. (2005). Adsorption of arsenate and arsenite by iron-treated active carbon and zeolites: Effects of pH, temperature and ionic strength. J. Environ. Sci. Heal. 40, 723-749. [ Links ]
Petrus R. y Warchol J. (2003). Ion exchange equilibria between clinoptilolite and aqueous solutions of Na+/ Cu2+, Na+/Cd2+ and Na+/Pb2+. Micropor. Mesopor. Mat. 61, 137-146. [ Links ]
Ribeiero T.H., Rubio J. y Smith R.W. (2003). A dried hydrophobic aquaphyte as an oil filter oil/water emulsions. Spill Sci. Technol. Bull. 8, 483-489. [ Links ]
Rozic M., Cerjan-Stefanovic S., Kurajica S., Vancina V y Hodzic, E. (2000). Ammoniacal nitrogen removal from water by treatment with clays and zeolites. Water Res. 34, 3675-3681. [ Links ]
Ruggieri F., Marin V, Gimeno D., Fernández-Turiel J.L., García-Valles M. y Gutiérrez L. (2008). Application of zeolitic volcanic rocks for arsenic removal from water. Eng. Geol. 101, 245-250. [ Links ]
SEMARNAT (1996). Norma Oficial Mexicana NOM-001- SEMARNAT-1996. Que establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. Secretaría de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación. 6 de enero de 1997. [ Links ]
SEMARNAT (1996). Norma Oficial Mexicana NOM-002- SEMARNAT-1996. Que establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales a los sistemas de alcantarillado urbano o municipal. Secretaría de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación. 3 de junio de 1998. [ Links ]
Shinya M., Funasaka K., Katahira K., Ishikawa M. y Matsui S. (2006). Lead isotope ratios in urban road runoff. Water Sci. Technol. 53. 185-191. [ Links ]
SSA (1994). Norma Oficial Mexicana NOM-127-SSA1-1994. Salud ambiental, agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización. Secretaría de Salud. Diario Oficial de la Federación. 18 de enero de 1996. [ Links ]
SSA (2002). Norma Oficial Mexicana NOM-201-SSA1-2002. Productos y servicios, agua y hielo para consumo humano, envasado y a granel. Especificaciones sanitarias. Secretaría de Salud. Diario Oficial de la Federación. 18 de octubre de 2002. [ Links ]
Stakebake J.L. y Fritz, J. (1984). Characterization of natural chabazite and 5A synthetic zeolites. Part. II. Adsorption properties and porosity. J. Colloid Interf. Sci. 100, 33-40. [ Links ]
Suzuki T. y Okuhara T. (2001). Change in pore structure of MFI zeolite by treatment with NaOH aqueous solution. Micropor. Mesopor. Mat. 43, 83-89. [ Links ]
Torraca E., Galli P., Pansini M. y Colella C. (1998). Cation exchange reactions of a sedimentary chabazite. Micropor. Mesopor. Mat. 20, 119-127. [ Links ]
Trgo M., Peric J. y Vukojevic-Medvidovic N. (2006). Investigations of different kinetic models for zinc by a natural zeolitic tuff. J. Environ. Manage. 79, 298-304. [ Links ]
Tschernich R.W. (1992). Zeolites of the World. Geoscience Press, Phoenix, Ariz., EUA. [ Links ]
Tsitsishvili G.V., Andronikashvili T.G., Kirov G.M. y Filizova L.D. (1992). Natural zeolites. Ellis Horwood, Chichester, Reino Unido, 40-52. [ Links ]
Vaca M., López R., Gehr R., Jiménez B.E. y Alvarez P.J.J. (2001). Heavy metal removal with mexican clinopti-lolite: multi-component ionic exchange. Water Res. 35, 373-378. [ Links ]
Vázquez-Alarcón A., Justin-Cajuste L., Siebe-Grabach Ch., Alcántar-González G. y de la Isla de Bauer M.L. (2001). Cadmio, níquel y plomo en agua residual, suelo y cultivos en el Valle del Mezquital, Hidalgo, México. Agrociencia 35, 267-274. [ Links ]
Zamzow M. J., Eichbaum B. R., Sandgren K. R. y Shanks D.E. (1990). Removal of heavy metals and other cations from wastewater using zeolites. Sep. Sci. Technol. 25, 1555-1569. [ Links ]
Zamzow M.J. y Murphy J.E. (1992) Removal of metal cations from water using zeolites. Sep. Sci. Technol. 27, 1969-1984. [ Links ]
Zema M., Tarantino S.C. y Montagna G. (2008). Hydration/Dehydration and cation migration processes at high temperature in zeolite chabazite. Chem. Mater. 20, 5876-5887. [ Links ]














