Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.29 no.2 Ciudad de México may. 2013
Extracción asistida por microondas y limpieza en fase sólida como método de análisis para la determinación de plaguicidas organofosforados en Ambystoma mexicanum
Microwave assisted extraction and solid phase cleaning as a method of analysis for organophosporus pesticides determination in Ambystoma mexicanum
Manuel HERNÁNDEZ QUIROZ1, Jesús HERNÁNDEZ SOTO2, Francisco ROJO CALLEJAS2, Cecilia ROBLES MENDOZA3, Cecilia VANEGAS PÉREZ1 y Claudia PONCE DE LEÓN HILL1*
1 Facultad de Ciencias, Universidad Nacional Autónoma de México, Av. Universidad 3000 Delegación Coyoacán 04510, México D.F. *Autora responsable: caplh@ciencias.unam.mx
2 Facultad de Química, Universidad Nacional Autónoma de México, Av. Universidad 3000 Delegación Coyoacán 04510, México D.F.
3 Facultad de Ciencias, Unidad Multidisciplinaria de Docencia e Investigación-SISAL, Universidad Nacional Autónoma de México, Sisal, Yucatán
Recibido junio 2012,
aceptado febrero 2013
RESUMEN
En los últimos años la población del ajolote Ambystoma mexicanum ha disminuido drásticamente en su hábitat natural en los canales de Xochimilco y Chalco. Entre otras causas se proponen la pesca furtiva, la depredación y competencia con especies no nativas introducidas en su hábitat y los efectos adversos ocasionados por contaminantes. Con respecto a este último, hay una creciente preocupación a nivel mundial acerca de los efectos subletales de los plaguicidas organofosforados en humanos y animales, incluyendo su posible papel en la disminución global de las poblaciones de anfibios. A diferencia de otros grupos de vertebrados, los anfibios presentan características que los hacen más vulnerables a los cambios ambientales como son la piel "desnuda", glandular y permeable, lo cual determina que sean considerados buenos indicadores de la calidad del ambiente. Es por ello que el desarrollar y contar con métodos óptimos para la detección de los plaguicidas organofosforados en el medio externo y en los organismos es un aspecto fundamental para estudios toxicológicos, máxime cuando estas concentraciones se encuentran en niveles subletales. El análisis de los plaguicidas en organismos acuáticos no es un procedimiento sencillo debido a que los tejidos son matrices muy complejas por la diversidad de compuestos y sustancias que contienen, muchas de ellas con la posibilidad de interferir en la determinación del contaminante. En todos los casos se requiere de al menos un paso de extracción y uno de limpieza para evitar las interferencias en la detección de los plaguicidas de interés. Es por ello que el objetivo del presente estudio es proponer un método eficiente para la determinación de los plaguicidas organofosforados etoprofos, diazinón, metil-paratión, malatión y clorpirifos en tejidos de ajolotes y su cuan-tificación por cromatografía de gases (GC). En el presente estudio se utilizó la extracción asistida por microondas (EAM) para la extracción de plaguicidas organofosforados en ajolote y se demostró que la EAM con diclorometano durante 15 min a una potencia de 1200 W, es un método de extracción adecuado, simple y eficaz que evita la pérdida de los analitos al extraerlos en un solo paso en un sistema cerrado. La limpieza del extracto con cartuchos combinados con C18-Florisil® logró recuperaciones arriba del 90 % para todos los plaguicidas organofosforados estudiados en este anfibio. Los parámetros de validación del método como linealidad, límites de detección y cuantificación, repetibilidad, reproducibilidad e índice HorRat fueron evaluados para dar confiablidad al método y tuvieron valores apropiados para la identificación de los plaguicidas organofosforados etoprofos, diazinón, metil-paratión, malatión y clorpirifos. El método pudo ser utilizado exitosamente al evaluar la bioacumulación de clorpirifos en ajolotes expuestos a 0.05 y 0.1 mg/kg del plaguicida.
Palabras clave: ajolote, anfibios, extracción asistida por microondas, cromatografía de gases.
ABSTRACT
In recent years the population of Ambystoma mexicanum has declined dramatically in their natural habitat in the canals of Xochimilco and Chalco. Among others, the proposed main causes for its decline are poaching, depredation and competition with introduced non-native species in their habitat, and adverse effects due to contaminants. The latter is of growing global concern owing to the sublethal effects of organophosphorus pesticides in humans and animals, including their possible role in the overall decline of amphibian populations. Unlike other vertebrate groups, several aspects make amphibians more vulnerable to environmental changes such as "naked", glandular and permeable skin. This feature makes amphibians to be considered as good indicators of environmental quality. In this respect, the development of optimum methods for the detection of organophosphorus pesticides in the environment and the organisms under study is a fundamental aspect for toxicological studies, especially when their concentrations are found at sublethal levels. The analysis of pesticides in aquatic organisms is not a simple procedure due to the fact that tissues are a highly complex matrix that contains a diversity of compounds and substances, all with the possibility of interfering in the determination of the pollutant. All pesticide analysis require an extraction and a cleaning step to avoid interference in the detection of the pesticides of interest. Therefore the objective of this study is to propose an efficient method for the determination of organophosphorus pesticides (ethoprophos, diazinon, methyl parathion, malathion and chlorpyrifos) in axolotl tissue with gas chromatography (GC) quantification. The present study describes the use of microwave-assisted extraction (MAE) for the extraction of organophosphorus pesticides in A. mexicanum. It was demonstrated that the use of MAE with dichloromethane for 15 min at a power of 1200 W is a suitable extraction method, simple and effective to prevent the loss of the analytes to be extracted in a single step in a closed system. The cleaning of the extract with C18-Florisil® cartridges achieved recoveries above 90% for all the organophosphate pesticides studied. The validation parameters of the method, linearity, limit of detection and quantification, repeatability, reproducibility and HorRat index were evaluated to certificate it as a trustworthy method. Appropriate values for the identification of the organophosphorus pesticides ethoprophos, diazinon, methyl parathion, malathion and chlorpyrifos in the axolotl were obtained for the validation parameters. The method was successfully used to evaluate the bioaccumulation of chlorpyrifos in axolotls exposed to sublethal concentrations (0.05 and 0.1 mg/kg) of the pesticide.
Key words: axolotl, amphibians, microwave assisted extraction, gas chromatography.
INTRODUCCIÓN
En los últimos años, la población del ajolote Ambystoma mexicanum ha disminuido drásticamente en su hábitat natural, los canales de Xochimilco y Chalco. En 2007, Zambrano y colaboradores registraron una densidad de sólo 0.001 organismos por m2. La baja densidad poblacional de este anfibio se atribuye a varios factores ambientales como son la destrucción y modificación de su hábitat, la pesca furtiva, la introducción de especies no nativas (depredadoras y competidoras por alimento), el incremento de la radiación ultravioleta, la presencia de patógenos y los efectos adversos ocasionados por la contaminación por residuos domésticos e industriales (Zambrano et al. 1999, Zambrano et al. 2007). Con respecto a este último factor, hay una creciente preocupación a nivel mundial sobre los efectos subletales de los plaguicidas organofosforados (OP) en humanos y animales (Gralewicz y Socko 1997, Azaroff 1999, Jaga y Dharmani 2003), incluyendo su posible papel en la disminución global de las poblaciones de anfibios (Schuytema et al. 1993, Taylor et al. 1999, Kiesecker 2002, Gilbertson et al. 2003).
Debido a la reducción de las poblaciones silvestres, A. mexicanum ha sido clasificada dentro de la Norma Oficial Mexicana NOM-059-SEMARNAT-2001 publicada en el Diario Oficial como especie sujeta a protección especial. A su vez, la autoridad científica mexicana perteneciente a la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES por sus siglas en inglés) ha propuesto la reclasificación de la especie del Apéndice II al Apéndice I, donde son incluidas las especies que no deben ser objeto de comercio debido a la problemática de su conservación (CITES 2005). Estas características catalogan obligatoriamente al ajolote como una especie de estudio dentro de los planes de acción para la conservación del sistema lacustre de Xochimilco, para lo cual es necesario determinar las medidas de conservación, manejo y aprovechamiento sustentable de la flora y fauna nativa del área. Dentro de los planes de acción, la diagnosis de la vulnerabilidad del ajolote ante los factores de estrés presentes en su hábitat natural es de particular importancia. Cabe resaltar que, a diferencia de otros grupos de vertebrados, los anfibios presentan características que los hacen más vulnerables a cambios ambientales como son su piel "desnuda" (por la carencia de escamas, pelo o plumas como en otros organismos), glandular y permeable, y el estadio de huevo carente de cáscara, lo que los hace estar en contacto directo con el medio circundante (agua, suelo, luz, etc.) (Lagerspetzj 1977, Álvarez et al. 1995). Por estas características los anfibios han sido considerados indicadores de la calidad del ambiente (Banerjee 1991).
Las fuentes potenciales de contaminación de los canales de Xochimilco son diversas. Tomando en cuenta que Xochimilco es uno de los principales abastecedores de hortalizas y flores del Distrito Federal y de la zona metropolitana (Banerjee 1991), se considera que el uso de compuestos agroquímicos es elevado y por ende su aportación al sistema es considerable. En México, la aplicación de compuestos organofosforados para el control de plagas en cultivos agrícolas es una práctica común y su acumulación se ha detectado en diversos organismos acuáticos vertebrados e invertebrados (Alejandre 2007). A nivel nacional se calcula que, producto de la actividad agrícola, se descargan 380 m3/s de agua conteniendo plaguicidas y fertilizantes (CNA 1996).
Los plaguicidas organofosforados han sustituido a los más perniciosos organoclorados y aunque los primeros son menos persistentes que los organo-clorados, algunos de ellos pueden presentar una elevada toxicidad (Routt y James 1999).
En México, los estudios referentes a la evaluación del destino ambiental final de los agroquímicos y de los efectos en la biota acuática y terrestre son escasos o nulos, lo cual limita el desarrollar e implementar un programa de manejo y control ambiental de sus aportes. Entre los organismos acuáticos, los peces han sido el grupo más estudiado particularmente en relación a la bioacumulación de plaguicidas, debido a su facilidad de manejo, su abundancia en los sistemas y su importancia comercial como producto de consumo humano. En el caso de los anfibios, son escasos los estudios realizados a pesar de ser considerados buenos indicadores de estrés químico debido a la permeabilidad de su piel al agua y a los electrolitos (Loumbardis et al. 1999, Berzins y Bundy 2002, Scott et al. 2006).
La determinación de la bioacumulación de plaguicidas en relación con la concentración ambiental es una herramienta valiosa para la evaluación de la exposición y de los efectos adversos potenciales de estos xenobióticos (Sparling et al. 2000). No obstante el análisis de los plaguicidas en organismos acuáticos no es un procedimiento sencillo debido a que los tejidos son matrices muy complejas por la diversidad de compuestos y sustancias que contienen, muchas de ellas con la posibilidad de interferir en la determinación del contaminante. Las técnicas de extracción para algunos plaguicidas que se han utilizado particularmente en peces, incluyen extracción por sonicación con mezcla de solventes (Kim et al. 2005), extracción acelerada con solvente (Wu et al. 2011) y extracción asistida con microondas (EAM) (Vetter et al. 1998, Weichbrodt et al. 2000). En la EAM, la aplicación de energía de microondas ocasiona un calentamiento selectivo de la matriz sobre el extractante. El aumento de la temperatura y la presión, altamente localizado, ocasiona la migración selectiva de los compuestos de estudio al área circundante, a mayor velocidad y con una recuperación similar a los métodos de extracción convencionales (Pare et al. 1997). Después de la extracción se requiere un paso de limpieza para evitar la interferencia en la detección de los plaguicidas de interés. La separación y la detección de los plaguicidas ha sido comúnmente realizada con cromatografía de gases y con detectores nitrógeno-fósforo y espectrometría de masas (Kim et al. 1998, Vetter et al. 2000, Giampiero et al. 2005). En cualquier caso, el desarrollar y contar con los métodos óptimos para la detección de los plaguicidas organofosforados en el medio externo y en las especies en estudio es un aspecto fundamental para los estudios toxicológicos, máxime cuando estas concentraciones se encuentran en niveles muy bajos que ocasionan efectos subletales. De tal manera el objetivo del presente estudio fue el desarrollar un método eficiente de extracción y limpieza para la determinación de plaguicidas organofosforados en tejidos del ajolote Ambystoma mexicanum.
MATERIALES Y MÉTODOS
Todos los reactivos utilizados fueron de grado analítico. El material utilizado fue lavado previamente con ácido nítrico, agua desionizada y acetona y fue colocado durante 2 h a 100 °C. Se prepararon disoluciones patrón por gravimetría de cinco plaguicidas organofosforados, clorpirifos, metil-paratión, diazinon, etoprofos y malatión (Pestanal®) a una concentración de 100 mg/L utilizando acetona como disolvente (J.T. Baker; grado HPLC). A partir de esta solución patrón se prepararon soluciones individuales de 1 mg/L. El estándar interno utilizado fue trifenil fosfato (Supelco®) en una concentración de 1 mg/L. Las soluciones se almacenaron a -50 °C hasta su utilización.
Los ajolotes crecidos en cautiverio fueron mantenidos libres de plaguicidas en condiciones ideales de desarrollo (Robles-Mendoza et al. 2009, Robles-Mendoza et al. 2011). Para obtener los tejidos de ajolote, organismos (etapa 57; juvenil temprano) fueron sacrificados y disecados y los tejidos resguardados a -60 °C para su posterior análisis. Para el desarrollo del método y su validación, se preparó una solución de los plaguicidas a partir de los plaguicidas individuales y con ella se enriquecieron muestras de músculo de un gramo de tejido húmedo (g PH) para obtener concentraciones de 25, 75 y 150 mg /kg PH de los plaguicidas. Se realizaron tres réplicas para cada concentración de cada plaguicida. En cada caso se dejó evaporar el solvente (acetona) a temperatura ambiente y posteriormente se dejaron reposar las muestras en la oscuridad a 4 ºC durante 24 horas.
Para los estudios de la aplicación del método, ajolotes juveniles (etapa 57) fueron expuestos al plaguicida clorpirifos (CPF) en pruebas de toxicidad con renovación del plaguicida acorde al procedimiento señalado por Robles et al. (2011). Los juveniles se expusieron a dos tratamientos (0.05 y 0.1 mg CPF/L), donde las concentraciones del plaguicida se consideraron ambientalmente realistas ya que se han reportado en la zona lacustre de Xochimilco, hábitat del ajolote (Alcántara, datos no publicados). El período de exposición al clorpirifos fue de 48 h, periodo que puede reflejar el régimen normal de aplicación del CPF en las actividades agrícolas de Xochimilco (Robles et al. 2011). En cada condición experimental se colocaron cuatro organismos en acuarios de 20 L con 18 L de las soluciones de ensayo en las concentraciones señaladas. La cantidad máxima de acetona adicionada en los acuarios experimentales como solvente acarreador del plaguicida fue del 0.01% del volumen total (18 L). Durante los ensayos el agua se mantuvo a 20 ± 1 °C, pH de 8.5±0.2 y oxígeno disuelto a saturación (> 5.6 mg/L). Al término del periodo de exposición, los organismos fueron sacrificados, disecados y los tejidos resguardados a -60 °C para su futuro análisis.
Extracción asistida por microondas (EAM)
De manera inicial, se determinó la estabilidad de extracción de los plaguicidas en el sistema EAM (MARS 5) y los parámetros de limpieza del extracto en fase sólida (tipo de adsorbente, volumen de eluyente y tiempo de extracción), se optimizaron a fin de minimizar el número de pasos involucrados en el análisis de los plaguicidas organofosforados bajo estudio. Con este propósito, a partir de la solución patrón de cada plaguicida se prepararon soluciones hijas individuales de 200 mg/L. Se llevó a cabo la extracción de los plaguicidas en EAM añadiendo 10 mL de diclorometano (DCM; grado HPLC) en una sola etapa, con una energía máxima de 1200 W. Se definieron 10 min de espera hasta llegar a la temperatura de extracción (110 °C) que se mantuvo durante 15 min sin sobrepasar una presión de 200 PSI. Posteriormente se dejó enfriar hasta temperatura ambiente para evitar la fuga de analitos. Se realizaron cinco réplicas por plaguicida. El músculo de los organismos provenientes tanto del enriquecimiento de los cinco plaguicidas organofosforados (tres muestras de tejido) como de los estudios de bioacumulación con organismos completos expuestos a concentraciones subletales del CPF en ensayos de 48 h (cuatro por concentración), fue procesado de manera similar. En cada caso, las muestras de músculo y los organismos completos fueron secados, pulverizados y homogeneizados con sulfato de sodio anhidro en una proporción 1:1 (m/m; peso/ peso) con la ayuda de un mortero. Posteriormente la muestra fue colocada dentro de los vasos de teflón del sistema EAM y se adicionó aproximadamente 10 mL de DCM por cada gramo de tejido. Las condiciones del EAM para la extracción de los plaguicidas fueron las previamente optimizadas, de 1200 W durante 15 min a 110 °C y enfriamiento posterior hasta temperatura ambiente. Los extractos se filtraron en filtros Whatman® grado 5 y se depositaron en matraces bola de fondo plano aptos para rotavapor. Todos los extractos fueron concentrados en un rotavapor (Heidolph, Laborota 4011) a 3 mL.
Limpieza de extractos
Para la optimización de esta etapa, la limpieza se llevó a cabo por el fraccionamiento de los extractos en columna con diferentes adsorbentes en fase sólida o cartuchos SPE (extracción en fase sólida por sus siglas en inglés; 1 g/6 mL; Strata™). Se analizó el comportamiento de tres adsorbentes: Florisil® (recomendado para la separación de plaguicidas), C18 (recomendado para la separación de compuestos orgánicos no polares) y sílica recomendado para compuestos polares (USEPA 3630C 1996). A la vez, se analizaron dos eluyentes: el acetato de etilo y el acetonitrilo. En esta etapa, se optimizaron además los volúmenes y el tiempo de elución para obtener la mejor recuperación de los plaguicidas bajo análisis.
Cuantificación por cromatografía de gases
Los plaguicidas en los extractos bajo análisis fueron detectados y cuantificados mediante cromatógrafo de gases con detector de nitrógeno-fósforo (GC/NPD; Agilent Technologies 6890N) bajo las siguientes condiciones: columna HP-5 de 30m x 0.25mm x 0.25 pm; temperatura del inyector = 250 °C; temperatura del detector = 300 °C; el programa del horno = 120 °C durante 1 minuto, 5 °C/min hasta 200 °C por 2 minutos, 2 °C/min hasta 205 °C por 1 minuto hasta 300 °C por 5 minutos. El tiempo de análisis fue de 35.42 minutos con un volumen de inyección de 2 mL con automuestreador y en modo split-splitless. Las concentraciones de los plaguicidas en tejido se expresaron como pg plaguicida kg/PS.
Validación del método
Para la validación del método implementado se determinaron los límites de detección, cuantificación, linealidad y exactitud, a su vez se calcularon los parámetros de precisión: repetibilidad y precisión intermedia. Para estos últimos parámetros, se utilizaron siete repeticiones a una concentración intermedia.
RESULTADOS Y DISCUSIÓN
Desarrollo del método
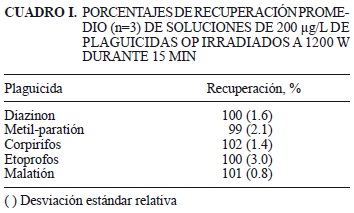
La estabilidad de extracción por EAM y los parámetros de limpieza del extracto en fase sólida (tipo de adsorbente, volumen de eluyente y tiempo de extracción), fueron optimizados, lo cual permitió minimizar el número de pasos involucrados en el análisis de los plaguicidas organofosforados en estudio. Para realizar las extracciones asistidas por microondas (EAM) es imprescindible que los analitos a determinar sean estables tanto a la radiación como al calentamiento que se suscitan en la EAM. Se ha reportado que, por ejemplo, el malatión presenta una cierta inestabilidad térmica en presencia de humedad (Koivistoinen et al. 1964); por otro lado la recuperación del clorpirifos se ha correlacionado inversamente con la temperatura en la etapa de extracción por EAM (Bouaid et al. 2000) y algunos otros grupos de plaguicidas se han degradado a altas temperaturas en la EAM (Molin et al. 2000). De esta manera, para determinar la estabilidad de los plaguicidas bajo las condiciones previstas de extracción, se irradiaron los plaguicidas organofosforados clorpirifos, metil-paratión, diazinon, etoprofos y malatión en una concentración de 200 mg/L bajo las condiciones de extracción en una sola etapa con DCM como disolvente, con el uso de una energía máxima de 1200 W. Se definieron 10 min de espera hasta llegar a la temperatura de extracción (110 °C) que se mantuvo durante 15 min sin sobrepasar una presión de 200 PSI. Posteriormente se dejó enfriar hasta temperatura ambiente para evitar la fuga de analitos. Bajo este procedimiento se obtuvieron recuperaciones promedio de 99% con desviaciones estándar relativas (DSR) menores a 3 (Cuadro I).
Una vez asegurada la estabilidad de los plaguicidas, el siguiente paso consistió en estudiar las mejores condiciones para la extracción y limpieza de los plaguicidas. Para ello se analizaron los tejidos de ajolote enriquecidos con los plaguicidas bajo estudio. Las condiciones de extracción por microondas fueron las mismas que se utilizaron para establecer la estabilidad de los plaguicidas. La potencia del magnetrón fue de 1200 W con un tiempo de extracción de 15 min. Cabe resaltar que un paso importante para evitar la pérdida de los plaguicidas por evaporación es, como se mencionó previamente, dejar enfriar completamente los vasos del sistema de microondas hasta temperatura ambiente. Las condiciones determinadas resultaron efectivas para extraer los plaguicidas de estudio.
El siguiente paso examinado fue la determinación de un método de limpieza adecuado para los extractos por microondas de los tejidos. Este paso de limpieza es absolutamente necesario ya que debido a las altas presiones y temperaturas que se alcanzan dentro de los vasos, se extrae simultáneamente con los plaguicidas diferentes compuestos de los tejidos, en general lípidos, que interfieren con la detección de los plaguicidas en estudio (Juhler 1997). El procedimiento de limpieza es el fraccionamiento del extracto en una columna con diferentes adsorbentes en fase sólida o cartuchos SPE. Estos cartuchos tienen la ventaja que la cantidad de disolvente necesario para eluir los analitos de interés es pequeña, por lo que se evita el consumo de grandes cantidades de solvente. Para la elución de los plaguicidas con Florisil® se utilizaron solventes de mediana polaridad, en este caso, acetato de etilo y acetonitrilo. De estos dos solventes, el acetonitrilo mostró mejores recuperaciones de los plaguicidas que el acetato de etilo; sin embargo, con el acetonitrilo eluyeron a la par de los plaguicidas numerosos compuestos pertenecientes a los tejidos estudiados, enmascarando la detección de los plaguicidas. Por lo que se decidió estudiar combinaciones de Florisil® con C18 y Florisil® con sílica para evitar la coelución de compuestos de la matriz de tejido junto con los plaguicidas. La combinación de los adsorbentes dio como resultado una drástica disminución de compuestos no deseados en los cromatogramas como se observa en la figura 1. A pesar de que en ambos cromatogramas la detección de los plaguicidas es cuantificable, se observó una mayor intensidad de los picos cromatográficos con la combinación C18-Florisil® , por lo que se decidió continuar con esta combinación de fases sólidas. La combinación de distintas fases sólidas también ha demostrado su eficiencia en otras determinaciones de plaguicidas en organismos, donde Florisil® igualmente ha demostrado ser muy eficiente en la remoción de ácidos grasos (Le Doux 2011).
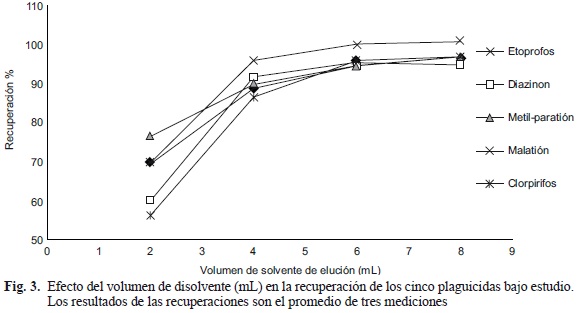
Para obtener la mejor recuperación de todos los plaguicidas bajo estudio, se continuó con la optimización de las condiciones de limpieza, para lo cual se analizaron diversas condiciones de volumen y tiempo de elución. Los resultados obtenidos de la relación entre el tiempo de elución y el volumen de elución se señalan en las figuras 2 y 3, respectivamente. Con respecto al tiempo de elución, generalmente 1 min de elución no fue suficiente para obtener una recuperación mayor al 70% para todos los plaguicidas. No obstante, esta recuperación aumentó significativamente (p < 0.05) cuando el tiempo de elución se incrementó a 3 ó 5 min si bien no hubo cambios significativos (p > 0.05) cuando los tiempos de elución fueron mayores a 5 min. Para el volumen de elución, cuatro de los cinco plaguicidas presentaron valores de recuperación menores al 70% al utilizarse 2 mL del disolvente, a excepción del metil-paratión que presentó valores de recuperación del 76%. Esta recuperación se incrementó significativamente (p < 0.05) al aumentar el volumen del disolvente hasta 6 mL, si bien con volúmenes mayores (8 mL) no se incrementó significativamente la recuperación de los plaguicidas (p > 0.05). Acorde con los resultados obtenidos, se definieron como parámetros óptimos 5 min de tiempo de elución y 6 mL de disolvente para obtener recuperaciones de los plaguicidas mayores al 90%. Estas recuperaciones son similares a las reportadas por Solé y colaboradores (2000) para plaguicidas organofosforados en bivalvos, aunque su método involucra dos pasos en la extracción, mientras que el presente trabajo involucra un solo paso de limpieza.
Parámetros de validación: exactitud
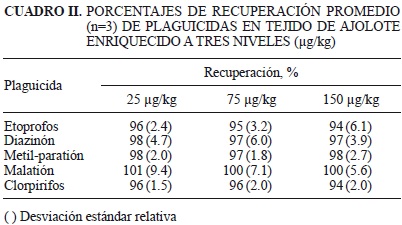
Con el objeto de evaluar la precisión del método en cuanto a la recuperación de los plaguicidas, se procedió a su extracción considerando tres concentraciones: 25, 75 y 150 mg/kg, con tres repeticiones en cada nivel. Los resultados obtenidos denotan que en las tres concentraciones, las recuperaciones fueron mayores al 90% con desviaciones estándar relativas menores al 10%, demostrando así una buena recuperación de los plaguicidas con el método utilizado (Cuadro II).
Parámetros de validación: límites de detección y cuantificación y linealidad
Como parte de los parámetros de validación se calcularon los límites de detección y cuantificación, los cuales se obtuvieron a partir de la adición al tejido de ajolote de los plaguicidas a la concentración más baja estudiada (25 mg/kg). Cabe aclarar que estos límites de detección y cuantificación se determinaron para todo el método como sugiere la Real Sociedad Química de Londres (RSOC 1987) y no se refieren sólo para el equipo CG-NPD, de esta manera se da un límite de detección realista en el análisis de muestras ambientales. El límite de detección (LD) se calculó como LD = 3 x DS x la concentración promedio (con la sustracción del blanco cuando fue necesario), donde DS es la desviación estándar de las mediciones. El límite de cuantificación (LC) se calculó como LC = 3.3 x LD (SANCO 2007).
Los resultados obtenidos señalan que los límites de detección oscilaron entre 0.03 μg/kg para etoprofos hasta 0.27 μg/kg para metil-paratión (Cuadro III). Estos límites de detección y desviaciones estándar relativas son comparables a los valores reportados en la literatura para clorpirifos, en tejido de pescado (You y Lydy 2004) y diez veces menores que para tejido de ballena (Serrano 1999) y carne de res (Juhler 1997). Por otra parte, se comprobó la linealidad del intervalo de las concentraciones de los plaguicidas bajo estudio (3 a 250 mg/kg) a partir del coeficiente de correlación de las curvas de calibración (r2) cuyos valores fueron mayores a 0.99 (p < 0.05).
Parámetros de validación: repetibilidad y precisión intermedia
Las mediciones de repetibilidad y precisión intermedia (reproducibilidad) se realizaron evaluando siete repeticiones (RSOC 1987) de los extractos de los estándares de plaguicidas obtenidos con el método descrito anteriormente a lo largo de un solo día (RSOC 1987, Horwitz y Albert 2006) y diariamente a lo largo de 15 días, utlizando la concentración de 50 μg/kg para todos los plaguicidas, concentración considerada baja pero pero no cercana al límite de detección obtenido.
La repetibilidad, que es la medida de las determinaciones llevadas a cabo por un solo operador en un mismo instrumento en un periodo corto (en un día), se estableció a partir de los valores de la desviación estándar relativa (DSR) de las mediciones. En el presente estudio, la DSR obtenida para cada plaguicida fue menor al 10%, indicando así una buena repetibilidad (Cuadro IV).
Por otro lado, la reproducibilidad o precisión intermedia, que es la medida de la variabilidad de la medición a largo plazo en un mismo laboratorio que toma en consideración las variaciones por el mismo operador, diferentes operadores, diferentes instrumentos, diferentes lotes de reactivos, estándares, etc., es la más importante medida de precisión (RSOC 1987). En el presente estudio, los resultados obtenidos demuestran que la DSR de la reproducibilidad, no fue mayor al 10%, indicando una buena precisión intermedia (Cuadro IV). Una medida adicional de la calidad de las repeticiones en un método analítico, es el índice HorRat (Horwitz y Albert 2006). Este índice se calcula como HorRat = DSR/PRSD donde PRSD es la desviación estándar predicha (por sus siglas en inglés) calculada como 2C-0.15, donde C es la concentración de estudio expresada en m/m (masa/masa) (en este caso 50 μg/ kg para cada uno de los plaguicidas) y donde DSR se calcula de la desviación estándar del día y la desviación estándar entre los días de análisis (la repetibilidad y la precisión intermedia) usando el análisis de varianza de un solo factor. Valores del índice HorRat igual a uno muestran una correspondencia entre el valor predicho y el obtenido, mientras que valores menores a uno y específicamente debajo de 0.5, describen precisiones mayores a las esperadas; valores mayores a 1 y específicamente arriba de 2, indican precisiones no aceptables (Horwitz y Albert 2006). De acuerdo con los resultados obtenidos en este estudio, el índice HorRat para todos los plaguicidas varió entre 0.4 y 0.47 indicando así una buena exactitud del método (Cuadro IV).
Aplicación del método: estudio de bioacumulación
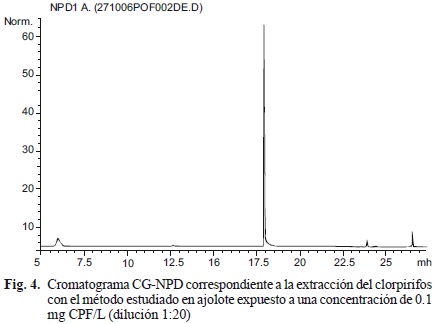
Una vez validado el método de análisis de los plaguicidas bajo estudio se procedió a analizar la concentración de clorpirifos (CPF) en músculo de ajolote en organismos expuestos a concentraciones subletales del plaguicida (0.05 y 0.1 mg CPF/L). En el cromatograma obtenido de la determinación del clorpirifos en el músculo del ajolote (Fig. 4) se observó una señal definida correspondiente al clorpirifos, sin interferencias con ningún otro compuesto proveniente de los tejidos del ajolote. De esta manera, con el método propuesto se determinaron las concentraciones de clorpirifos en ocho ajolotes sometidos a la exposición del clorpirifos y cuatro testigos (blancos) cuya bioacumulación de clorpirifos estuvo debajo del límite de detección (no mostrado). Debido al poco tejido que se obtiene de los ajolotes, no es posible obtener repeticiones de la medición para cada ajolote, pero cada nivel de exposición tiene cuatro ajolotes que nos da la bioacumulación promedio de clorpirifos en el ajolote para cada nivel de exposición (Cuadro V). Los resultados obtenidos denotaron una mayor bioacumulación del plaguicida al aumentar la concentración de exposición y demuestran claramente que aún bajo concentraciones subletales de exposición (consideradas bajas), el método desarrollado permite cuantificar la bioacumulación del plaguicida en el ajolote. De esta manera, el método desarrollado se utilizó exitosamente en el estudio de Robles y colaboradores (2011) para determinar el efecto de la exposición subletal del clorpirifos y su bioacumulación sobre la actividad enzimática de esterasas y la actividad motora en juveniles tempranos de Ambystoma mexicanum. Asimismo, el método desarrollado puede ser aplicado para estudios ambientales y ecotoxicológicos que evalúen el impacto de los plaguicidas analizados en condiciones ambientalmente realistas, tanto en anfibios como en otras especies de organismos.
CONCLUSIONES
El presente estudio demostró que el método desarrollado tiene valores de los parámetros de validación adecuados para la identificación de los plaguicidas organofosforados etoprofos, diazinón, metil-paratión, malatión y clorpirifos en anfibios, y de manera particular en ajolote. Se demostró que la extracción asistida por microondas (EAM) con DCM durante 15 min a una potencia de 1200 W, es un método de extracción adecuado, simple y eficaz que evita la pérdida de los analitos al extraerlos en un solo paso y en un sistema cerrado. La limpieza del extracto con cartuchos con C18-Florisil® logró recuperaciones arriba del 90% para todos los plaguicidas organofosforados estudiados. El método permite la determinación de los plaguicidas en un intervalo de concentraciones de 3 a 250 μg/kg con límites de detección de hasta 0.03 μg/kg. El índice HorRat demostró que la precisión intermedia del método es buena. El método desarrollado pudo ser utilizado con éxito en la evaluación de la bioacumulación de clorpirifos (CPF) en ajolotes expuestos a niveles subletales del plaguicida (0.05 y 0.1 mg CPF/kg).
AGRADECIMIENTOS
Agradecemos al Proyecto PAPIME, DGAPA, UNAM 206210.
REFERENCIAS
Alejandre S. (2007). Evaluación del efecto de plaguicidas en Mytella strigata del Estero de Urías, Mazatlán, Sinaloa: exposición in situ. Maestría en Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México. México D.F., México, 130 pp. [ Links ]
Alvarez R., Honrubia M.P. y Herráez M.P. (1995). Skeletal malformations induced by the insecticides ZZ-Aphox and Folidol during larval development of Rana perezi. Arch. Environ. Contam. Toxicol. 28, 349-356. [ Links ]
Azaroff L.S. (1999). Biomarkers of exposure to organophosphorous insecticidesamong farmers' families in rural El Salvador: factors associated with exposure. Environ. Res. Sect. 80, 138-147. [ Links ]
Banerjee S.N. (1991). Amphibian biomonitors. Biosci. 41, 371-371. [ Links ]
Berzins D.W. y Bundy K.J. (2002). Bioacumulations of lead in Xenopus laevis tadpoles from water and sediment. Env. Int. 28, 69-77. [ Links ]
Bouaid A., Martín-Esteban A., Fernández P. y Cámara C. (2000). Microwave-assisted extraction method for the determination of atrazine and four organophosphorus pesticides in oranges by gas chromatography (GC). Fresenius J. Anal. Chem. 367, 291-294. [ Links ]
CITES (2005). Periodic review of animal species included in the CITES appendices. AC 21 Doc 11.2. Convention on International Trade in Endangered Species of Wild Flora and Fauna. [en línea]. http://www.cites.org (22.06.11) [ Links ]
CNA (1996). Programa Hidráulico 1995-2000. Comisión Nacional del Agua, México. [ Links ]
Giampiero P., Gazzotti T., Zironi E. y Sticca P. (2005). Residue analysis of organophosphorus pesticides in animal matrices by dual column capillary gas chro-matography with nitrogen-phosphorus detection. J. Chrom. A 1071, 67-70. [ Links ]
Gilbertson M.K., Haffner G.D., Drouillard K.G., Albert A. y Dixon B. (2003). Immunosuppression in the northern leopard frog (Rana pipiens) induced by pesticide exposure. Environ. Toxicol. Chem. Sect. 22, 101-110. [ Links ]
Gralewicz S. y Socko R. (1997). Persisting behavioural and electroencephalographic effects of exposure to chlorphenvinphos, an organophosphorous pesticide, in laboratory animals. Int. J. Occup. Med. Environ. Health Sect. 10, 375-394. [ Links ]
Horwitz W. y Albert R. (2006). The Horwitz ratio (Hor-Rat): A useful index of method performance with respect to precision J. AOAC Int. 894, 1095-1109. [ Links ]
Jaga K. y Dharmani C. (2003). Sources of exposure to and public health implicationsof organophosphate pesticides. Rev. Panam. Salud Pública Sect 14, 171-185. [ Links ]
Juhler R.K. (1997). Optimized method for the determination of organophosphorous pesticides in meta and fatty matrices. J. Chrom. A 786, 145-153. [ Links ]
Kiesecker J.M. (2002). Synergism between trematodes infection and pesticide exposure: a link to amphibian limb deformities in nature? Ecol. Sect 99, 9900-9904. [ Links ]
Kim D.H., Heo G.S. y Lee D.W. (1998). Determination of organophosphorus pesticides in wheat flour by supercritical fluid extraction and gas chromatography with nitrogen-phosphorus detection. J. Chrom. A 824, 63-70. [ Links ]
Kim J.Y., Hecht S.S., Mukherjee S., Carmella S.G., Rodrigues E.G. y Christiani D.C. (2005). Urinary metabolite of phenanthrene as a biomarker of PAH's metabolic activation in workers exposed to residual oil fly ash. Cancer Epidem. Biomarkers Preven. 14, 687-692. [ Links ]
Koivistoinen P., Kónónen M., Karinpáá A. y Roine P. (1964). Postharvest insecticide residues, stability of malathion residues in food processing and storage. J. Agric. Food Chem. 12, 557-560. [ Links ]
Lagerspetzj K.Y.H. (1977). Interactions of season and temperature acclimation in the control of metabolism in amphibian. J. Thermal Biol. 2, 223-231. [ Links ]
Le Doux M. (2011). Analytical methods applied to the determination of pesticide residues in foods of animal origin. A review of the past two decades. J. Chrom. A 1218, 1021-1036. [ Links ]
Loumbardis N.S., Kyriakopoulou-Sklavounou P. y Zachariadis G. (1999). Effects of cadmio exposure on bioacumulation and larval growth in the frog Rana ridibunda. Env. Poll. 104, 429-433. [ Links ]
Molin C., Hogendoorn A., Dijkman E., Heusinkveld H.a.G. y Baumann R.A. (2000). Determination of linuron and related compounds in soil by micro-wave-assisted solvent extraction and reversed phase liquid chromatography. J. Chrom. A 869, 487-496. [ Links ]
SEMARNAT (2001). Norma-Oficial-Mexicana NOM-059-SEMARNAT/2001 Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Secretaría de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación, 6 de marzo del 2002. [ Links ]
Pare J.R.J., Belanger J.M.R., Li K., Llompart M.P., Singhvi R. y Turpin R.D. (1997). Gas-phase extraction method using the microwave-assisted process (MAP) for the determination of aromatic contaminants in soil Spectros.-An Int. J. 13, 89-98. [ Links ]
Robles-Mendoza C., García-Basilio C., Cram-Heydrich S., Hernández-Quiroz M. y Vanegas-Pérez C. (2009). Organophosphorus pesticides effect on early stages of the axolotl Ambystoma mexicanum (Amphibia:Caudata). Chemosphere 74, 703-710. [ Links ]
Robles-Mendoza C., Zúniga-Lagunes S.R., Ponce De León-Hill C.A., Hernández-Soto J. y Vanegas-Pérez C. (2011). Esterases activity in the axolotl Ambystoma mexicanum exposed to chlorpyrifos and its implication to motor activity. Aq. Tox. 105, 728-734. [ Links ]
Rojas R.T. (1995). Presente, pasado y futuro de las chinampas. CIESAS-Patronato del Parque Ecológico de Xochimilco. Mexico, D.F. 324 pp. [ Links ]
Routt J.R. y James R.R. (1999). Recognition and management of pesticide poisonings. 5a. ed. Environmental Protection Agency. [en línea]www.epa.gov/oppfead1/safety/healthcare/handbook/handbook.htm. [ Links ]
RSOC (1987). Recommendations for the definition, estimation and use of the detection limit. Royal Society of Chemistry, Analytical Methods Comitee, London. Analyst 112, 199-204. [ Links ]
SANCO (2007). Document SANCO/3131/2007. Method validation and quality control procedures for pesticide residues analysis in food and feed. Brussels. European Commission, DG-SANCO. [ Links ]
Scott W., Stoskopf M.K., Baynes R.E., Lewbart G.A., Taylor S.K. y Kennedy-Stoskopf S. (2006). Percutaneous malathion absorption by anuran skin in flow-through diffusion cells. Env. Tox. Pharm. 22, 255-262. [ Links ]
Schuytema G.S., Nebeker A.V., Peterson J.A. y Griffis W.L. (1993). Effects of pentachlorophenol-contami-nated food organisms on toxicity and bioaccumulation in the frog Xenopus laevis. Arch. Environ. Contam. Toxicol. 24, 359-364. [ Links ]
Serrano R.L.F., Hernandez F. (1999). Multiresidue determination of persistent organochlorine and organophosphorus compounds in whale tissues using automated liquid chromatographic clean up and gas chromatographic-mass spectrometric detection. J. Chrom. A 855, 633-643 [ Links ]
Solé M., Porte C., Barcelo D. y Albaiges J. (2000). Bivalves residue anlysis for the assessment of coastal pollution in the Ebro Delta (NW Mediterranean). Mar. Poll. Bull. 40, 746-753. [ Links ]
Taylor S.K., Williams E.S., Thorne E.T., Mills K.W., Withers D.I. y Pier A.C. (1999). Causes of mortality of the Wyoming toad. J.Wildlife Dis. 35, 49-57. [ Links ]
USEPA (1996) - EPA Method 3630C, Silica Gel Cleanup, Test Methods for Evaluating Solid Waste, Physical/ Chemical Methods, 3 a ed. United States Environmental Protection Agency. Washington, DC. pp15. [ Links ]
Vetter W., Alder L., Kallenborn R. y Schlabach M. (2000). Determination of Q1, an unknown organo-chlorine contaminant, in human milk, Antarctic air and further environmental samples. Env. Poll. Series A 110, 401-409. [ Links ]
Vetter W., Weichbrodt M., Hummert K., Glotz D. y Luckas B. (1998). Combined microwave-assisted extraction and gel permeation chromatography for the determination of chlorinated hydrocarbons in seal blubber and cod livers. Chemosphere 37, 2439-2449. [ Links ]
Weichbrodt M., Vetter W. y Luckas B. (2000). Microwave-assisted extraction and accelerated solvent extraction with ethyl acetate-cyclohexane before determination of organochlorines in fish tissue by gas chromatogra-phy with electron-capture detection J. AOAC Int. 83,1334-1343. [ Links ]
Wu G., Bao X., Zhao S., Wu J., Han A. y Ye Q. (2011). Analysis of multi-pesticide residues in the foods of animal origin by GC-MS coupled with accelerated solvent extraction and gel permeation chromatography cleanup. Food Chem. 126, 646-654. [ Links ]
You J. y Lydy M.J. (2004). Simultaneous determination of pyrethroid, organophosphate and organochlorine pesticides in fish tissue using tandem solid-phase extraction clean-up. Int. J. Env. Anal. Chem. 8, 559-571. [ Links ]
Zambrano G.L. (2007). Abundancia y estructura poblacional del axolotl Ambystoma mexicanum en los sistemas dulce acuicolas de Xochimilco y Chalco. Informe Final Proyecto AS004 CONABIO. México. [en línea]http://www.conabio.gob.mx/institucion//proyectos/resultados/InfAS004.pdf. [ Links ]














