Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.29 no.2 Ciudad de México may. 2013
Determinación de residuos de imazapir en suelos de Argentina mediante cromatografía líquida de alta resolución y espectrometría de masas
Determination of imazapir residues of soils from Argentina by means of ultra performance liquid chromatography-mass spectrometry
Valeria Rosana GIANELLI1*, Manuel José ZELAYA1, Francisco BEDMAR2 y José Luis COSTA1
1 INTA. Estación Experimental Agropecuaria Balcarce, Ruta 226 km 73.5, Balcarce, Argentina *Autora responsable: vgianelli@balcarce.inta.gov.ar
2 Universidad Nacional de Mar del Plata, Argentina, Ruta 226 km 73.5, Balcarce, Argentina
Recibido mayo 2011,
aceptado marzo 2013
RESUMEN
La extracción y cuantificación de residuos de herbicidas en el suelo resultan de gran importancia para monitorear su presencia y minimizar el riesgo de contaminación asociado al uso de los mismos. Los objetivos de este trabajo fueron a) evaluar la eficiencia de distintos extractantes en la detección y cuantificación de residuos de imazapir en suelos de Argentina y b) determinar el efecto de la concentración del herbicida y de las características edafológicas en el porcentaje de recuperación de la metodología. Para desarrollar el primer objetivo, se seleccionaron siete extractantes (KCl (0.1 M pH 7), NaOH (0.5 M), KCl (0.1 M pH 14), KOH (0.1 M), CH3OH/H20 (80:20), NaOH/CH3OH (80:20; 0.5 M) e NaOH/CH3CN (80:20; 0.5 M)), determinándose el porcentaje de recuperación con cada uno de ellos. Posteriormente, una vez seleccionado el extractante óptimo, para el segundo objetivo, se analizaron cuatro suelos de Argentina (Tres Arroyos, Balcarce, Anguil y Cerro Azul) y cuatro concentraciones de imazapir (5, 25, 50 y 100 ng/kg). El ensayo se estableció bajo un diseño completamente aleatorizado en arreglo factorial. Las determinaciones se llevaron a cabo mediante cromatografía líquida de alta resolución acoplada a espectrometría de masas. Los resultados indicaron que el porcentaje de recuperación varió significativamente en función de la disolución empleada para la extracción. La disolución de cloruro de potasio (0.1 M, pH 7) resultó superior a los demás extractantes, alcanzando una recuperación de 95 %. Se detectó efecto de interacción (p < 0.05) entre los suelos y las concentraciones evaluadas. En líneas generales, los valores de recuperación en los suelos estudiados resultaron inferiores cuando se aplicaron bajas concentraciones del herbicida. La metodología propuesta resultó adecuada para la determinación y cuantificación de imazapir en distintos suelos y en un amplio rango de concentraciones.
Palabras claves: imidazolinonas, metodología de extracción, porcentaje de recuperación.
ABSTRACT
Extraction and quantification of herbicide residues from soil are important to make monitoring studies and to minimize the pollution risk. The objectives of this research were: to evaluate the efficacy of different solvents for the extraction and quantification of imazapyr residues from Argentine soils and to determine the concentration effect and soil properties influences on herbicide recovery. Extraction solutions including 0.1M pH 7 potassium chloride (KCl), 0.5 M sodium hydroxide (NaOH), 0.1M pH 14 potassium chloride (KCl), 0.1 M potassium hydroxide (KOH), methanol/water (CH3OH/H20 80:20), 0.5 M sodium hydroxide/methanol(NaOH/CH3OH 80:20), and 0.5 M sodium hydroxide/acetonitrile (NaOH/CH3CN 80:20) to extract imazapyr from soil were investigated. Percentage recovery with each solution extraction was obtained. Then four argentine soils (Tres Arroyos, Balcarce, Anguil and Cerro Azul) and four imazapyr concentrations (5, 25, 50 and 100 ng/kg) were selected to evaluate the chosen method. Treatments were arranged in a completely randomized factorial design. The herbicide residues were determined and quantified by ultra performance liquid chromatography-mass spectrometry. The recovery obtained showed significant differences between the extraction solutions. The best recovery (95%) was obtained using 0.1 M pH 7 potassium chloride. Interaction effect between soils and concentration was detected. The lowest recovery from soils was found using low imazapyr concentrations. Results have shown that the proposed methodology was suitable to detect and quantify imazapyr residues in different soils and in a wide range of concentrations.
Key words: imidazolinones, extraction method, recovery percentage.
INTRODUCCIÓN
La extracción y cuantificación de residuos de herbicidas en el suelo resultan de gran importancia al momento de predecir su destino en el ambiente. La retención y la degradación de un herbicida son fenómenos relacionados que condicionan su potencialidad de contaminación del agua subterránea (Walker 2003). Aquellos herbicidas que presentan menor retención a los coloides del suelo por lo general poseen mayor movilidad, lo cual incrementa el riesgo de contaminación del agua subterránea. De la misma manera, los plaguicidas persistentes, permanecerán más tiempo en el suelo y por lo tanto tendrán más oportunidad de ser lixiviados.
El imazapir es un herbicida perteneciente a la familia química de las imidazolinonas. Actualmente, en Argentina este herbicida es utilizado a gran escala para el control de malezas en el cultivo de girasol Clearfield (CL) tolerante a imidazolinonas. Su mecanismo de acción consiste en inhibir la enzima acetolactato sintetasa. Esta enzima cataliza el primer paso en la biosíntesis de tres aminoácidos alifáticos esenciales de cadena ramificada: valina, leucina e isoleucina, por lo que si no está activa se inhibe la síntesis de aminoácidos, la síntesis de ADN, la síntesis proteica y el crecimiento de las células, por lo tanto las plantas susceptibles detienen su crecimiento y mueren (Senseman 2007).
El imazapir presenta alto riesgo de lixiviación dada su baja capacidad de adsorción y alta capacidad de desorción. Sumado a ello, entre sus propiedades fisicoquímicas se destaca su elevada persistencia en el suelo, lo cual incrementa el riesgo potencial de contaminación. Los rangos de vida media reportados en el suelo oscilan entre 25 y 142 días (Senseman 2007), siendo más corta en suelos arenosos y con temperaturas elevadas (Ulbrich et al. 2005).
La molécula de imazapir presenta naturaleza anfotérica (presencia de grupos ácidos y básicos funcionales). Dicha característica permite al herbicida existir en forma aniónica, neutra o catiónica, dependiendo del pH del ambiente (Fig. 1). Posee tres constantes de disociación (pKa), 1.9, 3.6 y 11.4. Cuando el pH del suelo es mayor que su pKa, el herbicida se encuentra presente en estado aniónico (-COO-), lo que causa repulsión por los coloides del suelo, y promueve una débil adsorción. Cuando el pH del suelo es menor al pKa, el herbicida se halla en forma catiónica o neutra (-COOH), pudiendo interactuar con las superficies hidrofóbicas de la materia orgánica y coloides cargados negativamente (Che et al. 1992).
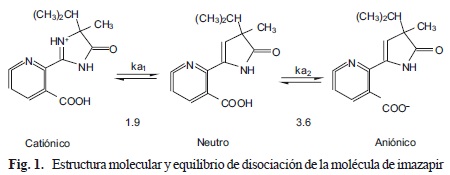
La degradación microbiana constituye su principal mecanismo de disipación. Por tal motivo, la degradación se acelera bajo condiciones que favorecen la actividad de los microorganismos del suelo, tales como temperaturas elevadas, alto contenido de humedad en el suelo y pH neutro (Wehtje et al. 1987).
En consecuencia, el movimiento y la persistencia del imazapir se encuentran fuertemente influenciados por diversas propiedades del suelo, entre ellas el pH, el contenido de arcilla y el de materia orgánica (Mangels 1991). La adsorción se incrementa a medida que el pH decrece, y es mayor en suelos con alto contenido de materia orgánica y de arcilla (Loux et al. 1989).
Existen diversas metodologías para la determinación de residuos de imazapir en muestras de suelo, las cuales emplean cromatografía líquida o gaseosa con diferentes tipos de detectores (D' Ascenzo et al. 1998, Lagana et al. 2000, Ramezani et al. 2009). No obstante, muchas son laboriosas, presentan baja sensibilidad, reproducibilidad y especificidad, originando falsos positivos.
La espectrometría de masas en tandem (EM/EM), constituye actualmente una de las herramientas analíticas más sofisticadas para el análisis de plaguicidas en diferentes tipos de matrices. Debido a que presenta alta sensibilidad y selectividad, es posible cuantificar residuos de plaguicidas en matrices ambientales a niveles traza (Lao y Jay Gan 2006).
Diversos estudios han demostrado que la determinación de residuos de imidazolinonas mediante cromatografía líquida (CL) acoplada a EM/EM es adecuada ya que dichos compuestos son eficientemente ionizados bajo la forma de electroespray (D'Ascenzo et al. 1998, Koppen y Spliid 1998, Lagana et al. 2000, Ramezani et al 2009). Sin embargo, resulta necesario optimizar las condiciones del método, en lo referente a los parámetros instrumentales y el tratamiento de la muestra, de manera que confirmen en forma inequívoca al analito, sean reproducibles, sensibles y selectivos.
La evaluación del efecto matriz es de gran importancia cuando se desarrolla un método de cuantifi-cación mediante CL- EM/EM. Los compuestos que coeluyen con el analito pueden afectar la ionización, causando incremento o supresión en la señal. De esta manera, el efecto matriz puede afectar la reproducibilidad y precisión del método (Taylor et al. 2005).
Existen en la literatura diversos procedimientos empleados para la extracción de imazapir en el suelo, que difieren en la composición de la disolución utilizada como extractante, en la separación del extracto y en el tratamiento posterior del herbicida extraído. En tal sentido, Liu et al. (1992) utilizaron una disolución extractante compuesta por metanol y agua. Por su parte, D'Ascenzo et al. (1998), determinaron que el KCl 0.1 M fue más eficiente para la extracción de imazapir sin ningún tratamiento posterior. Rame-zani et al. (2009), reportaron mayor recuperación del herbicida con NaOH 0.5 M, utilizando además extracción en fase sólida. No obstante, Lagana et al. (2000), determinaron mayor recuperación con la combinación metanol/carbonato de amonio (0.1 M, 50:50), empleando asimismo cartuchos de extracción para el lavado.
En Argentina es escasa la información relacionada al comportamiento del imazapir en el suelo. Sumado a ello, debido a las características estructurales de la molécula y a la influencia de las propiedades del suelo en su comportamiento, resulta de gran importancia optimizar la metodología de extracción en suelos que presentan propiedades diferentes a los empleados en estudios previos. Además, debido a que la dosis actual de aplicación es relativamente baja (80 g ingrediente activo ha-1), y a su prolongada persistencia en el suelo, la metodología debe permitir la determinación y cuantificación de sus residuos a muy bajas concentraciones, a fin de evaluar con precisión su comportamiento ambiental.
Con base en lo expuesto y dadas las diferentes metodologías existentes para la determinación de residuos de imazapir, los objetivos de este trabajo fueron a) evaluar la eficiencia de las distintas disoluciones extractantes y procedimientos para la detección y cuantificación de residuos de imazapir en suelos de Argentina; b) determinar el efecto del tipo de suelo y de la concentración del herbicida sobre la recuperación de imazapir, con el fin de demostrar la validez del procedimiento de análisis en presencia de cambios en la matriz, respecto de las condiciones originalmente evaluadas en el método.
MATERIALES Y MÉTODOS
Reactivos
Se utilizó un estándar de imazapir, 2-(4-isopropil-4-methil-5-oxo-2-imidazolin-2-yl)- acido nicotínico (Chem service), con 99% de pureza. Todas las disoluciones y la fase móvil fueron preparadas con agua ultra pura desionizada (Milli-Q water, Millipore). Los disolventes fueron metanol (J.T Baker), ácido fórmico (Riedel-de Haén) y acetonitrilo (J.T Baker) grado HPLC. Se empleó una disolución "stock" de imazapir (1.2 μg/mL) preparada en agua ultra pura desionizada almacenada a 4 °C hasta su uso.
Análisis instrumental
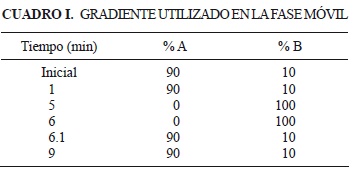
Las determinaciones se llevaron a cabo con un cromatógrafo de líquidos de alta resolución (Acquity UPLC System (Waters ®), acoplado a un espectrómetro de masas Quattro Premier XE. El sistema fue controlado con el software Micromass Masslynx V 4.1., mientras que los datos fueron procesados mediante la opción TagertLynx. Las condiciones cromatográficas se establecieron con base en la metodología propuesta por Zelaya et al. (2009). Brevemente, se empleó una columna Acquity UPLC® BEH C18 1.7 (im 2.1 x 50 mm, la fase móvil fue disolución A: 0.01% de ácido fórmico en agua, disolución B: metanol, a un flujo de 0.350 mL/min. El cuadro I ilustra el gradiente empleado. La temperatura de la columna fue 40 °C, el volumen de inyección 10 µL, y el tiempo de análisis 9 min.
El análisis cuantitativo se llevó a cabo por estándar externo empleando una curva de calibración lineal en el intervalo 0.03 - 500 μg/L (R2 > 0.99).
Se empleó un espectrómetro de masas Quattro Premier XE con electrospray como modo de ionización, polaridad positiva, 3.5 KV de voltaje del capilar. La temperatura de la fuente fue 100 °C, la de desolvatación de 350 °C. El flujo de gas del cono 5 L/h y el del gas de desolvatación de 700 L/h. El EM/EM se operó en el modo MRM (monitoreo de reacciones múltiples), cuyas transiciones analizadas fueron: 262.10 > 148.90 y 262.10 > 217.00. El tiempo de espera se estableció en 0.03 s, con voltaje del cono en 31 V, la energía de colisión en 25 y 20 V para las transiciones 262.10 > 148.90 y 262.10 > 217.00, respectivamente.
1. Selección de la metodología
Los aspectos investigados incluyeron: selección de la disolución y procedimiento de extracción óptimos de imazapir en muestras de suelo, determinación de los límites de detección y cuantificación, efecto matriz y parámetros asociados al sistema CL- EM/EM.
Para el estudio se utilizaron muestras de suelo de la localidad de Tres Arroyos, de la provincia de Buenos Aires, Argentina (Cuadro II). Las muestras se extrajeron a 0-15 cm de profundidad, se secaron a 30 °C, se tamizaron en una malla de 2 mm y se refrigeraron hasta su procesamiento. La concentración aplicada de imazapir a las muestras de suelo fue 110 (g/kg, equivalente a la dosis de campo recomendada para la zona de estudio (100 g/ha).
De acuerdo con D'Ascenzo et al. (1998), Lagana et al. (2000) y Ramezani et al. (2009), se seleccionaron siete extractantes y se determinó el porcentaje de recuperación del herbicida con cada uno de ellos. Las disoluciones evaluadas incluyeron: cloruro de potasio (KCl 0.1M pH 7), hidróxido de sodio (NaOH 0.5M), cloruro de potasio (KCl 0.1M pH 14), hidróxido de potasio (KOH 0.1M), metanol/agua (CH3OH/H20 80:20), hidróxido de sodio/metanol (0.5 M NaOH/ CH3OH 80:20) e hidróxido de sodio/acetonitrilo (0.5 M NaOH/CH3CN 80:20).
Fortificación de las muestras
Cada muestra correspondiente a 5 g de suelo seco se pesó y se colocó en Erlenmeyer de 100 mL. Posteriormente, a partir de la solución stock se aplicó el herbicida a fin de obtener a una concentración de 110 µg/kg en cada una de las muestras. El suelo se homogeneizó mediante agitación en vórtex por 30 minutos y se llevó a estufa (30 °C) durante 2 horas. Posteriormente, las muestras se colocaron en heladera a 4 °C durante 48 horas antes de la extracción.
1.1 Procedimiento de extracción
Las extracciones se llevaron a cabo en una proporción 1:4 de suelo y disolución extractante. De esta forma, se extrajeron 5 g de suelo con 20 mL de cada una de las siete disoluciones descritas. Las disoluciones se agitaron en un vórtex durante 10 min, se sonicaron por 15 min y se centrifugaron a 2500 rpm por 15 min. Este procedimiento se realizó por triplicado. Finalmente se combinaron los extractos correspondientes a cada ciclo de extracción y se homogenizaron mediante agitación por vórtex. De cada extracto final se tomó una alícuota, la cual se filtró a través de filtros jeringa de 0.2 μm y se colocó en viales de 1.5 mL para su posterior determinación por CL- EM/EM.
Como tratamiento testigo o blanco se utilizaron muestras de suelo sin contaminar, en las cuales se realizó el procedimiento de extracción descrito.
El procedimiento de validación de la metodología se realizó según las indicaciones presentadas en el documento SANCO (2009). El mismo comprendió: además de los estudios de recuperación, determinación de los límites de detección (LD) y de cuantificación (LC), evaluación del efecto matriz, precisión, linealidad y robustez del método.
Los límites de detección y cuantificación se establecieron mediante el análisis de patrones de imazapir en la matriz del suelo, en un rango de concentraciones decrecientes (120, 60, 12, 4, 1.2 µg/kg). Ambos se calcularon como la concentración en la cual la relación señal/ruido es mayor a 3 y 10 respectivamente y mediante el coeficiente de variación correspondiente a 10 inyecciones.
Para evaluar el efecto matriz se prepararon curvas de calibración por triplicado, en agua ultra pura, en la disolución extractante de KCl 0.1M pH 7 y en el extracto del suelo obtenido de la muestra testigo. Para la preparación de las curvas se tomaron 5, 10, 50, 100, 250, 500 y 1000 de una disolución estándar de imazapir (0.01 μg/mL) y se disolvieron en 995, 990, 950, 900, 750, 500 y 0 (L de las disoluciones diluyentes (agua ultra pura, KCl 0.1M pH 7 y el extracto del suelo) resultando en concentraciones de 0.05, 0.1, 0.5, 1, 2.5, 5 y 10 µg/L.
Posteriormente se compararon las áreas obtenidas de la curva preparada en agua ultra pura desionizada (A), con aquellas medidas con la disolución de KCl (B) y las del extracto de suelo posterior a la extracción (C). En tal sentido, la relación (B/Ax100) y (C/Ax100) es definida como el efecto matriz absoluto (EM %). Un valor de 100 % indica que no existe efecto matriz absoluto. Si el valor es mayor a 100 % se presenta incremento en la señal, mientras que valores menores a 100 % indican supresión de la señal (Matuszewski et al. 2003).
La precisión del método se evaluó en muestras de suelo fortificadas, por quintuplicado, con cuatro niveles de concentración (5, 25, 50 y 100 µg/kg) realizándo posteriormente el procedimiento de extracción. La precisión se estimó mediante el CV (%) de las repeticiones. Por su parte, la linealidad se determinó mediante la elaboración de curvas de calibración de cantidad recuperada de imazapir en función de la cantidad aplicada en el suelo, empleándose tres repeticiones por cada nivel. La linealidad de la curva de evaluó mediante el coeficiente de correlación de Pearson.
Finalmente, con el fin de evaluar la robustez del método se estudió la recuperación en cuatro suelos con propiedades contrastantes y con cuatro concentraciones del herbicida.
2. Efecto del tipo de suelo y de la concentración del herbicida sobre la recuperación de imazapir
Con el fin de evaluar la robustez del método se realizaron análisis para conocer si el tipo de suelo y la concentración del herbicida afecta la del método. Para ello se usaron cuatro suelos con propiedades contrastantes (Cuadro II), de las localidades de Tres Arroyos, Balcarce (provincia de Buenos Aires), An-guil (provincia de La Pampa) y Cerro Azul (provincia de Misiones).
Las muestras de suelo se recolectaron y acondicionaron como se indicó previamente en la selección de la metodología. Las concentraciones de imazapir evaluadas fueron: 5, 25, 50 y 100 µg/kg.
La metodología consistió en tres extracciones consecutivas para cada suelo con una disolución de KCl 0.1 M pH 7, basada en los mecanismos de agitación, sonicación y centrifugación anteriormente descritos. El ensayo se estableció bajo un diseño completamente aleatorizado en arreglo factorial. Los factores considerados correspondieron al tipo de suelo (4) y a las concentraciones del herbicida (4), realizándose 3 repeticiones para cada combinación.
3. Análisis estadístico
La información obtenida de los experimentos se analizó mediante el programa SAS (The SAS System versión 9.0, 2002). A tal fin, se realizaron análisis de la varianza (ANOVA), y comparaciones de promedios mediante la prueba de diferencias mínimas significativas (LSD) con un nivel de significación del 5%.
RESULTADOS Y DISCUSIÓN
1. Selección de la metodología
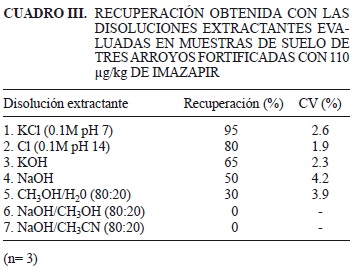
El porcentaje de recuperación varió significativamente (p < 0.05) según el extractante empleado (Cuadro III), determinándose que la disolución de KCl (0.1M pH 7) fue la que permitió el mayor porcentaje de recuperación. Se obtuvieron diferencias significativas entre todas las disoluciones, excepto para las disoluciones de NaOH/CH3OH (80:20) y NaOH/CH3CN (80:20) las cuales resultaron además menos eficientes para recuperar el herbicida.
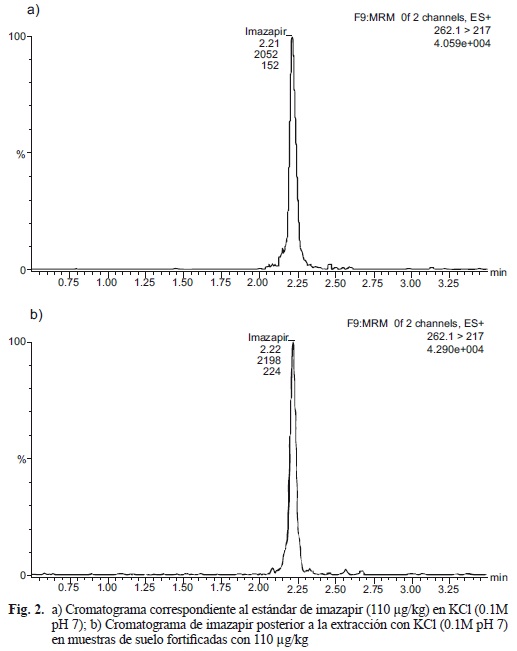
En las figuras 2 y 3 (a y b) se presentan a modo de ejemplo los cromatogramas correspondientes a la extracción de imazapir con la disolución de KCl (0.1M pH 7) y CH3OH/H20 (80:20) y sus respectivos estándares. Los números adyacentes a los cromatogramas indican el tiempo de retención y las áreas de las transiciones analizadas.

Por lo tanto, las condiciones seleccionadas para validar el método fueron tres ciclos de extracción consecutivos con la disolución de KCl 0.1M pH 7, mediante los mecanismos de agitación, sonicación y centrifugación descritos.
Los límites de detección y cuantificación fueron de 1.2 y 4 µ/kg respectivamente, con buena repetibilidad (CV < 6%). Estos valores resultaron inferiores a los límites de detección establecidos por D'Ascenzo et al. (1998) quienes reportaron valores entre 9 y 14 µg/kg.
Por su parte, no se observó efecto matriz, dado que las concentraciones de imazapir fueron equivalentes en cada una de las curvas preparadas con las distintas disoluciones (Fig. 4). Las ecuaciones correspondientes a las curvas de calibración fueron las siguientes: Agua ultra pura y= 884.19x - 15.916 R2= 0.9999; Extracto de suelo y= 831.75x - 61.079 R2= 0.9989; KCl y= 853.9x - 50.756 R2= 0.9986.
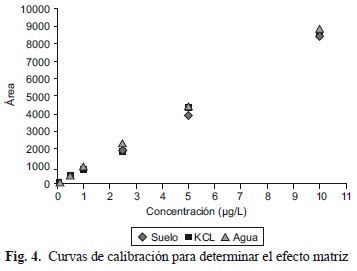
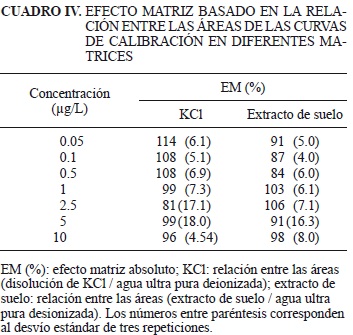
Asimismo, en el Cuadro IV se presentan las relaciones entre las áreas de las curvas de calibración en las diferentes matrices. Se puede observar la ausencia de efecto matriz dado que los valores promedio de las relaciones oscilaron entre 81 y 114 %, valores muy próximos al 100 % el cual representa la inexistencia de efecto matriz absoluto.
Respecto a la linealidad del método analítico (Fig. 5), el ajuste de los datos indicó que la recuperación del herbicida fue satisfactoriamente descrita por el modelo lineal (y=0.8877x + 1.3748; r=0.99; p<0.001), para el rango de concentraciones evaluadas (5-100 µg/kg)

En relación con los restantes parámetros de validación estudiados, la precisión, estimada mediante el coeficiente de variación, estuvo comprendida en el intervalo entre 1.2 y 3 % para el rango de concentraciones evaluadas. Asimismo, se determinó que el porcentaje de recuperación absoluto global del método analítico fue 93.2 ± 5 % (Cuadro V).
Con base en los resultados se puede establecer que las condiciones óptimas para obtener la máxima recuperación, identificación y confirmación del herbicida fueron: tres ciclos de extracción consecutivos con el extractante KCl (0.1M pH 7). Asimismo, el empleo de KCl (0.1M pH 7) como disolución extractante, de acuerdo con el procedimiento evaluado, permitió obtener un extracto final claro, sin necesidad de realizar procesos de limpieza, lo cual facilitó su inyección directa en el sistema cromatográfico, reduciendo significativamente el tiempo de procesado y análisis de las muestras.
Los resultados obtenidos en el presente estudio coinciden con los reportados por D'Ascenzo et al. (1998). No obstante, el procedimiento llevado a cabo por Ramezani et al. (2009) en donde evaluaron diferentes extractantes, establecieron al NaOH 0.5M como el más eficiente, con recuperaciones entre 93.4 y 96.8%. Sin embargo, en nuestro estudio los porcentajes de recuperación con NaOH 0.5M no pudieron ser reproducidos, obteniéndose en este caso sólo 50 % de recuperación del herbicida. Tales diferencias podrían haber sido producto de los diversos procedimientos de extracción utilizados en ambas metodologías. Además, si bien dichos autores en su estudio emplearon un suelo con propiedades similares al presente trabajo, el mismo presentaba mayor contenido de arena, lo cual no produce interacciones significativas con la molécula de imazapir, disminuyendo la retención del compuesto y aumentando en consecuencia el porcentaje de extracción en ese tipo de suelo. Por otra parte, los mencionados autores determinaron que la extracción de imazapir con KCl a pH 5.9 produjo menor recuperación que las restantes disoluciones, como consecuencia del bajo pH de la disolución de extracción.
El imazapir presenta las siguientes propiedades fisicoquímicas, peso molecular: 261.3, solubilidad en agua (mg/L) a 25 °C: 11 270, presión de vapor (Pa) a 60 °C: <1.33x10-5, pKa: 1.9, 3.6 y 11.4, coeficiente de partición en octanol - agua a 22 °C (Log Kow): 1.3. Por tal motivo, en nuestro estudio las mejores recuperaciones fueron obtenidas con KCl a pH neutro y alcalino debido a que en este rango de pH (superior al pKa de la molécula) el herbicida se encuentra en forma aniónica siendo repelido por los coloides del suelo y aumentando su solubilidad a causa de la desprotonación del compuesto (Mangels 1991, Lagana et al. 2000). No obstante, en condiciones alcalinas podría haber disminuido la estabilidad del compuesto provocando la hidrólisis del mismo, por lo cual el porcentaje de recuperación obtenido con KCl a pH 14 fue inferior al determinado con el mismo extractante pero en medio neutro, en el cual se espera la mayor estabilidad del herbicida (D'Ascenzo et al. 1998, Marchese et al. 2001).
Los restantes extractantes evaluados presentaron baja eficiencia de recuperación de imazapir en el suelo, probablemente como consecuencia de la menor solubilidad del compuesto en soluciones acuosas y en disolventes orgánicos. Asimismo, las combinaciones de NaOH/C^OH (80:20) y NaOH/ CH3CN (80:20) no fueron efectivas para lograr una correcta separación del sobrenadante, debido a la obtención de un extracto pigmentado, lo cual evidencia la presencia de compuestos húmicos y partículas en suspensión, que provocaban interferencias en la determinaciones cromatográficas de la molécula. En tal sentido, para el caso de los herbicidas iónicos, los electrolitos, tales como el KCl podrían minimizar las interacciones Van der Waals entre dichos compuestos y las arcillas o los ácidos húmicos. En consecuencia, este extractante aportaría la suficiente fuerza iónica a la disolución para desplazar al herbicida de la matriz del suelo sin interferencias. Asimismo, establecería un adecuado pH para generar la forma más soluble del herbicida y romper la interacción con las partículas cargadas del suelo (Cesio et al. 2011).
2. Efecto del tipo de suelo y de la concentración del herbicida sobre la recuperación de imazapir
Se detectó efecto de interacción (p < 0.05) para el porcentaje de recuperación, entre los suelos y las concentraciones evaluadas (Cuadro VI). En general, los porcentajes de recuperación determinados por el método de extracción seleccionado en este estudio, se encuentran dentro del rango aceptado internacionalmente para la extracción y detección de plaguicidas (SANCO 2009), dado que se indican como aceptables, valores de recuperación entre 70 y 120 % del plaguicida aplicado. De acuerdo con los resultados, solamente se obtuvieron valores de recuperación significativamente inferiores en los suelos de Balcarce, Anguil y Cerro Azul cuando se aplicaron concentraciones muy bajas (5 µg/kg), probablemente como consecuencia de la mayor cantidad de sitios disponibles para la adsorción del herbicida en el suelo, o posiblemente debido a las pérdidas en extracción en estos niveles de concentración (Cuadro VII).

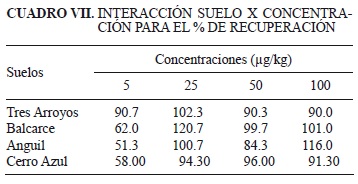
Estos resultados concuerdan con los reportados por D'Ascenzo et al. (1998), quienes empleando una metodología de extracción equivalente, no encontraron variaciones en la recuperación de imazapir en el rango de concentraciones evaluadas (50-200 (g/kg) para distintos suelos. Del mismo modo, Ramezani et al. (2009), no detectaron diferencias significativas entre los suelos analizados, con recuperaciones del herbicida mayores al 70% en todos los casos estudiados. Esta tendencia podría atribuirse a que tanto los suelos evaluados por D'Ascenzo et al. (1998) y Ramezani et al. (2009), como los del presente estudio presentaban valores de pH entre 5 y 7.6. En este rango la molécula de imazapir se encuentra en estado aniónico, provocando la repulsión por los coloides del suelo, originando en consecuencia elevada recuperación del herbicida.
En la figura 6 se presentan las concentraciones recuperadas del herbicida en cada suelo en función de las concentraciones aplicadas en el experimento, observándose que la recuperación para todos los suelos fue lineal en el rango de concentraciones evaluado. Las ecuaciones de regresión lineales obtenidas para cada suelo fueron: Balcarce y= 0.8902x +2.4355 R2: 0.9862; Anguil y= 1.1851x -6.8552 R2: 0.9804; Tres Arroyos y= 08877x +1.3748 R2: 0.9985; Cerro Azul y= 0.9241x -0.7327 R2: 0.94.

Los resultados sugieren que a pesar de la influencia comprobada de las propiedades del suelo (pH, contenido de arcilla y de materia orgánica) en la movilidad y la adsorción del herbicida (Pusino et al. 1997, Firmino et al. 2008), el KCl sería efectivo para provocar la ionización de la molécula, originando repulsión de la misma de los coloides del suelo. Asociado a este proceso, se obtendría un elevado % de recuperación del herbicida independientemente de las propiedades de los suelos.
CONCLUSIONES
El porcentaje de recuperación obtenido con la metodología evaluada varió en función de la disolución empleada para la extracción del herbicida. Los resultados indicaron que el porcentaje de recuperación del herbicida siguió el orden: KCl (0.1M pH 7)>KCl (0.1M pH 14)>KOH>NaOH>CH3OH/H20>NaOH/ CH3OH (80:20)=NaOH/CH3CN (80:20), obteniéndose valores promedio de 95 (±2.5), 80 (±1.5), 65 (±1.5), 50 (±2.1), 30 (±1.1) y 0 %. El método seleccionado resultó simple, rápido, sensible, preciso, con buen ajuste lineal y con límites de detección y cuantificación adecuados para el análisis de residuos de imazapir en muestras de suelo. Por su parte, la metodología evaluada en suelos heterogéneos (franco, franco arcillo arenoso y arcilloso), los cuales representan diferentes condiciones para el comportamiento de imazapir, demostró que resultaría factible para la detección de imazapir en suelos de Argentina con características edafológicas contrastantes y para un amplio rango de concentraciones.
AGRADECIMIENTOS
Los estudios se realizaron en el marco de los proyectos: "Estudio de la dinámica de los herbicidas glifosato e imazapir en distintos suelos de Argentina. Monitoreo de herbicidas en aguas subterráneas y superficiales". AEGA-221641. INTA y "Estudio de los procesos de transporte de glifosato e imazapir en tres suelos de la República Argentina". PICT 2007-N° 448. FONCYT.
REFERENCIAS
Cesio V., Niell S., Pareja L., Fernandez G., Asteggi-ante L., Bocking B., García C., Fernandez-alba A., Heinzen H. (2011). Critical revision and development perspectives of herbicide residues analysis in agro ecosystems, En: Herbicides and Environment (Andreas Kortekamp, Ed.), pp.126-157. InTech. [en línea] http://www.intechopen.com/books/herbicides-and-environment/critical-revision-and-development-perspectives-of-herbicide-residues-analysis-in-agro-ecosystems. (consulta: 27/08/2012). [ Links ]
Che M., Loux M.M, Traina S.J., Logan T.J. (1992). Effect of pH on sorption and desorption of imazaquin and imazethapyr on clays and humic acids. J. Environ. Qual. 21, 698-703. [ Links ]
D'Ascenzo G., Gentili A., Marchese S., Marino A., y Perret D. (1998). Rapid and simple method for extraction and determination of imidazolinone herbicide in soil. Analusis 26, 251-255. [ Links ]
Firmino L.E., Tuffi Santos L.D., Ferreira F.A., Ferreira L.R., y Tiburcio R.A.S. (2008). Sorcao do imazapyr em solos com diferentes texturas. Planta Daninha, Vicosa-MG. 26, 395-402. [ Links ]
Koppen B. y Spliid N.H. (1998). Determination of acidic herbicides using liquid chromatography with pneumatically assisted electrospray ionization, mass spec-trometric and tandem mass spectrometric detection. J. Chromatogr. A. 803, 157-168. [ Links ]
Lagana A., Fago G., Marino A., Penazzi V.M. (2000). Liquid chromatography mass spectrometry tandem for multiresidue determination of selected post-emergence herbicides after soil column extraction. Anal. Chem. 415, 41-56. [ Links ]
Lao W. y Jay Gan J. (2006). High-performance liquid chromatographic separation of imidazolinone herbicide enantiomers and their methyl derivatives on polysaccharide-coated chiral stationary phases. J. Chromatogr. A. 1117, 184-193. [ Links ]
Liu W., Pusino A. y Gessa C. (1992). High-performance liquid chromatographic determination of the herbicide imazapyr residues in water and soil. Sci. Total Environ. 123/124, 39-45. [ Links ]
Loux M.M., Liebl R.A. y Slide F.W. (1989). Adsorption of imazapyr and imazethapyr on soils, sediments, and selected adsorbents. Weed Sci. 37, 712-718. [ Links ]
Mangels G. (1991). Behavior of the imidazolinone herbicides in soil: A review of the literature. En: The imidazolinone herbicides. (D.L. Shaner y S.L. O'Connor, Eds.). CRC Press, Boca Raton, pp. 191-210. [ Links ]
Marchese S., Gentili A., Perret D. y Faberi A. (2001). Pres-surized-liquid extraction for determination of imidazolinone herbicides in soil. Chromatographia 54, 531-535. [ Links ]
Matuszewski B. K., Constanzer M. L., Chavez-Eng C. M. (2003). Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS. Anal. Chem. 75, 3019-3030. [ Links ]
Micromass Masslynx v 4.1. software .Waters Corporation., Manchester, UK. [ Links ]
Pusino A., Petretto S. y Gessa C. (1997). Adsorption and desorption of Imazapyr by Soil. J. Agric. Food Chem. 45, 1012-1016. [ Links ]
Ramezani M., Simpson N., Oliver D., Kookana R., Gill G., Prestona C. (2009). Improved extraction and clean-up of imidazolinone herbicides from soil solutions using different solid-phase sorbents. J. Chromatogr. A. 1216, 5092-5100. [ Links ]
SANCO (2009) Method validation and quality control procedures for pesticide residues analysis in food and feed. Dirección General de Salud Pública y Protección al Consumidor, Comisión Europea. [en línea]. http://ec.europa.eu/food/plant/protection/resources/qualcon-trol_en.pdf. (consulta 23/08/2011). [ Links ]
SAS Institute Inc., (2002). SAS User's Guide Statistic. Version 8. SAS Institute Inc., Cary, NC. [ Links ]
Senseman S.A. (2007). Herbicide handbook. 9a ed. Weed Sci. Soc. of Am., Lawrence, KS, EUA. 458p. [ Links ]
Taylor P. J. (2005) Matrix effects: The Achilles heel of quantitative highperformance liquid chromatography-electrospray-tandem mass spectrometry. Clin. Bio-chem. 38, 328-334. [ Links ]
Ulbrich A.V., Souza J.R.P. y Shaner D. (2005). Persistence and carryover effect of imazapic and imazapyr in Brazilian cropping systems. Weed Technol. 19, 986-991. [ Links ]
Walker A. (2003). Adsorption and degradation: from the laboratory to the real world. Pesticide in air, soil & water system. Memorias. XII Symposium Pesticide Chemistry, Piacenza, Italy. 4-6 de junio de 2003. pp.1-6. [ Links ]
Wehtje G., Dickens R., Wilcut J.W. y Hajek B.F. (1987). Sorption and mobility of sulfometuron and imazapir in five Alabama soils. Weed Sci. 35, 858-864. [ Links ]
Zelaya M., Kloster N. y Gianelli V. (2009). Direct injection for the analysis of atrazine and imazapyr using ultra performance liquid chromatography - mass spectrom-etry. 2° Workshop Latinoamericano de Residuos de Plaguicidas - LAPRW 2009. Santa Fe, Argentina. 8 al 11 de Junio de 2009. Libro de Resúmenes. pp. 119. [ Links ]














