Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 supl.1 Ciudad de México dic. 2012
Los microorganismos en los abonos orgánicos a partir de podas en la Universidad del Norte, Colombia
Microorganisms in organic fertilizer from pruning at the Universidad del Norte, Colombia
Amelia ESCUDERO DE FONSECA* y Carmen Alicia ARIAS VILLAMIZAR
Universidad del Norte, Km. 5 Antigua Vía Puerto Colombia, Barranquilla, Colombia. *Autora responsable: afonseca@uninorte.edu.co
Recibido agosto 2011
aceptado febrero 2012
Resumen
El compostaje es un proceso biológico aerobio exotérmico en el que los microorganismos descomponen biológicamente y mineralizan un sustrato orgánico logrando un producto final estable, libre de patógenos y de semillas que puede ser aplicado al suelo de forma beneficiosa. Desde 2009, en la Universidad del Norte ubicada en Barranquilla, Colombia, se ensaya el método Indore de compostaje pero modificado -sólo se usan residuos vegetales y la aireación es pasiva- buscando reducir olores y controles operativos y hacerlo atractivo en la producción artesanal de abono. En las experiencias se han variado las condiciones de entrada de la composta obteniendo abono tipo A según la norma control chilena 2880 de 2004. La investigación aquí reseñada corresponde a niveles alto y bajo en la relación carbono/nitrógeno (C/N) y a inocular o no microorganismos nativos (Aspergillus niger y Streptomyces sp.), buscando acelerar el proceso. Las respuestas de los microorganismos termófilos y mesófilos participantes, concordaron con los materiales de la composta, la relación C/N, la evolución de las variables fisicoquímicas por cuenta de los microorganismos y la aireación involucrada. La calidad del abono indica que los microorganismos cuentan con los nutrientes requeridos (presentes en los residuos vegetales utilizados) y que el sistema desarrolla una cinética bioxidativa suficiente y similar a la obtenida en otros procesos que adicionan residuos animales y aireación forzada.
Palabras clave: actividad microbiana, aireación pasiva, biotransformación, residuos vegetales, fertilizante.
Abstract
Composting is an aerobic and exothermic biological process in which microorganisms biologically decompose and mineralize an organic substrate obtaining a final product stable, pathogene-free, seed-free which can be applied to soil in a beneficial way. Since 2009, the composting method Indore has been tested in Universidad del Norte, Barranquilla, Colombia. The method has been modified-only vegetable decays are used and ventilation is passive- for reducing odor and operative controls and making it attractive in scale manufacture of fertilizer. In these composting experiences from pruning, the input conditions of compost have been changed obtaining fertilizer type A according to Chilean control standard 2880, from 2004. This article refers to a research which corresponds to high and low levels in the carbon/nitrogen (C/N) rate and to inoculate (or not) native microorganisms (Aspergillus Niger and Streptomyces sp.). in search of accelerating the process. The responses of thermophilic and mesophilic microorganisms agree with compost materials. C/N rate. physicochemical variable evolution due to microorganisms and the quality of ventilation involved. Fertilizer quality shows microorganisms have the nutrients required for their performance and that the system develops sufficient bioxidative kinetics similar to the one obtained in other processes which add animal decays and forced ventilation.
Key words: microbial activity, passive ventilation, biotransformation, vegetable decays, fertilizer.
INTRODUCCIÓN
Las enmiendas mediante abonos restauran los niveles de materia orgánica en los suelos. Ello ha incrementado considerablemente su práctica (Rogers 2002, Arrigo 2005) y las investigaciones para optimizar el compostaje. El compostaje es un proceso bioxidativo aerobio en un entorno controlado que produce composta, CO2, agua, calor e higienización del abono. Lo ejecutan microorganismos, bacterias y hongos principalmente, que se suceden en las labores de mineralización de la materia orgánica según la temperatura y otras condiciones de la composta. Durante el compostaje, la temperatura pasa de la ambiente a la adecuada para microorganismos mesófilos (hasta 40 °C), luego a la de los termófilos, entre 40 °C y 75 °C (INN 2004), luego a una nueva etapa mesófila y se enfría hasta la temperatura ambiente, en la maduración. Simultáneamente el pH baja a condiciones ácidas, sube a un máximo alcalino (alrededor de 8.5) y baja a valores cercanos a la neutralidad donde se mantiene en el abono conformado.
Cuando los materiales de la composta son residuos vegetales pueden no cumplir todos los requerimientos de un buen abono (López 2004), la maduración puede tardar hasta un año (López et al. 2005) y aplicar un abono inmaduro puede ser tóxico (Zucconi 1985, Varnero 2007). De ahí el incremento en la búsqueda de métodos que aceleren el proceso y obtengan abono de la mejor calidad dados la revalorización de residuos y el beneficio ambiental involucrados. En la Universidad del Norte, en Barranquilla, Colombia, desde 2009 se trabaja en la biotransformación aeróbica de las podas de árboles frutales y jardines por el método Indore. Las variables de control del compostaje Indore se indican en la figura 1.
El método Indore modificado sólo requiere: a. Controlar la entrada de los materiales, lo que implica vigilar las proporciones C/N, el tamaño de las partículas y evitar elementos nocivos, metales pesados principalmente; b. Garantizar la aireación pasiva desde la conformación de las pilas y c. Mantener la humedad. Este compostaje no produce olores ni exporta plagas, lo que facilita y hace atractiva su producción artesanal. Con este método, en 20092010, se logró abono tipo A, con una fertilización del 100% en los cultivos de prueba. La experiencia involucró seis celdas (o pilas) independientes habiendo abandonado el proceso en tres de ellas por invasión de plagas de procesos vecinos. El proceso y los resultados en la pila uno, una de las que culminó en abono, forman parte de las memorias del Simposio 2010 de la Red de Ingeniería en Saneamiento Ambiental (Escudero y Arias 2010).
En el presente trabajo se introdujeron tres variables en el material de composta con el fin de evaluar su incidencia en el proceso y en el abono resultante. Aquí se presenta el resultado en dos de las cuatro celdas bajo estudio. Se escogió variar las condiciones de entrada porque según la literatura científica consultada, ellas inciden en los resultados (López 2004). Las variaciones correspondieron a la relación C/N, a la inoculación de microorganismos autóctonos y a uniformar el tamaño de las podas en 25 mm, cumpliendo el rango recomendado entre 3 mm y 50 mm (Chiu-Chung 2005).
La diferente relación C/N inicial buscó conocer su influencia en la duración del proceso. La adición de microorganismos se hizo como una aproximación al proceso austriaco (desarrollado por la familia Lübke) denominado (CMC) compostaje Microbiológicamente controlado que reporta mayor productividad del abono (Diver 2004). Se habla de aproximación porque el método CMC implica la inoculación de determinados microorganismos de arranque, el control permanente de la vida microbiana y la garantía de la aireación mediante volteos, lo que no estaba previsto en el método utilizado en la investigación de la Universidad del Norte. Este documento corresponde a las dos condiciones extremas: nivel alto en C/N y en microorganismos inoculados (Aspergillus niger y Streptomyces sp.), pila 2 y nivel bajo para C/N y sin inoculación de microorganismos, pila 3.
METODOLOGÍA
Diseño experimental. El diseño de experimentos utilizado fue el factorial 22 que corresponde a 2 factores, sin réplica, con un total de 4 corridas. Se escogió para reducir el número de análisis al mínimo necesario y adaptado a los recursos económicos disponibles para el trabajo (Cuadro I).
Método de compostaje y materiales de entrada.
Se usó una modificación del Indore tradicional (Heckman 2006) porque la aireación que gobierna el proceso es la pasiva y no se utilizan residuos animales. Las podas provinieron de la flora identificada con su nombre científico y vulgar siguientes: Mangifera indica (mango), Erythrina crista-galli L (coral), Codiaeum variegatum (croto), Mes-pilus germanica L (níspero), Archontophoenix cunninghamiana (palmera), Swinglia glutinosa (swingla), Musa paradisiacal (plátano) y Cynodon dactylon (gramilla). Las podas de mango y níspero son comunes con el proceso anterior. Se variaron las cantidades de las diferentes podas participantes en cada pila para proveer la relación C/N buscada, en dos pilas valores altos y en las otras dos, bajos. La variación se hizo proporcional a los valores de C y N del material base (Cardona 2008).
Conformación de las pilas. Para la construcción de las cuatro pilas de un m3 de capacidad cada una (un m en cada lado), se utilizaron palos gruesos entrabados en altura procedentes de las podas, se instaló otro palo vertical en el centro de cada una y un fondo entramado separado del suelo, todo ello para asegurar la aireación pasiva y se protegieron del sol con polisombra, producto sintético que cumple ese propósito. La figura 2 muestra este detalle así como todo el ciclo de las podas y el resultado de la enmienda obtenida del abono.
Muestreos y análisis de laboratorio Durante todo el experimento se midieron las variables de control del proceso. La temperatura se midió en 15 puntos de cada pila, primero 2 veces al día, luego diario y al final, semanal, con una Sonda De Temperatura. Para los otros análisis se tomaron muestras compuestas procedentes de diferentes puntos de cada pila y se sometieron a los procedimientos y mediciones consagrados en los métodos normalizados D2216-10, D4972-01 (ASTM 2010) o los sugeridos por la norma chilena 2880, 2004 para compostaje (INN 2004). Los ensayos de nitrógeno y los análisis del abono fueron realizados por laboratorios externos a la universidad. Sus resultados cumplieron los siguientes protocolos: N según Kjeldahl (NTC 1556), P y B por colorimetría; S por turbidimetría; K, Ca, Mg, Na, Fe, Mn, Cu, Zn por absorción atómica. C-orgánico por calcinación, N mineral en KCl (1N), pH y C.E, en extracto de saturación, % de elementos mayores y menores, en peso a peso.
En relación con los microorganismos, a nivel macro, se identificaron las diferentes colonias por su aspecto, confirmando esta aproximación mediante pruebas bioquímicas. Para el conteo de colonias se hicieron diluciones hasta 1010 y se sembraron en medios de cultivo apropiados: agar nutritivo, para bacterias totales; Sabouraud, para hongos; caseína enriquecida con varios nutrientes, para microorganismos totales; caseína con extracto de papa, para Streptomyces sp.; y EMB para enterobacterias. Los hongos se dejaron crecer durante más de cinco días, se identificaron mediante su observación al microscopio y se diferenciaron unas colonias de otras mediante tinción en azul de lactofenol. Se buscaron patógenos mediante las pruebas bioquímicas del caso. Para microorganismos Gram negativos se acudió a confirmaciones mediante el método de BBL Crystal (NTC 5167).
RESULTADOS Y DISCUSIÓN
ANOVA. Se buscó la incidencia de los factores C/N e inoculación o no de microbiota en el abono para muchos factores de la experiencia. Como ejemplo se presentan materia orgánica (MO) en el abono y duración de las grandes poblaciones de microorganismos en la composta. El análisis confirma que el factor C/N explica el 89% y el 99.99% de la variación de la respuesta en ambos casos e indica baja probabilidad de que se rechace la hipótesis nula (Fig. 3).
La figura 3 muestra que en la pila 2 con C/N inicial alto, la MO final fue alta a pesar de la inoculación de microorganismos. Y que en la pila 3 con relación C/N inicial baja y sin inóculo, la MO final resultó significativamente menor. Ello confirma la influencia de una relación C/N inicial cercana a la teórica (35:1) en la eficiencia de la biodescomposición de la composta. El ANOVA también se aplicó a la diferencia entre MO inicial y final en cada pila y reafirmó lo anterior con una probabilidad de rechazo de la hipótesis nula de 0.072. En efecto, el consumo de MO fue sólo del 15.83% en la pila 2 con C/N inicial alto a pesar del inóculo de microbiota, mientras que llegó a 40.07% de consumo de MO en la pila 3, con C/N inicial bajo y sin inóculo. Además dado que el ANOVA muestra todos los resultados, fue fácil apreciar que de las pilas con C/N inicial bajo el mayor consumo de MO correspondió a la que recibió el inóculo. Ello implica que a C/N bajo la adición de microorganismos acelera el proceso de producción de abono.
Volviendo a la figura 3 se resalta que en las pilas con C/N inicial alto estuvieron presentes durante mayor tiempo las grandes poblaciones de microbiota. Lo que se traduce en mayor tiempo para que la composta se convierta en abono.
En resumen, de la ANOVA se deduce que la relación C/N inicial incide en el tiempo de producción del abono y que los microorganismos aceleran aun más el proceso principalmente cuando esa relación es cercana a la teórica.
Temperatura y pH. Su evolución fue la esperada en ambas pilas siendo la temperatura siempre mayor en la pila 3 que en la 2 y el pH menor. Ambas condiciones presuponen un mejor comportamiento de la microbiota. El ascenso de temperatura y pH hacia el día 50 respondió al único volteo que se les hizo a las pilas, volteo que evitó que la alta humedad ambiental reinante ocasionara condiciones anaerobias en las pilas (Fig. 4).
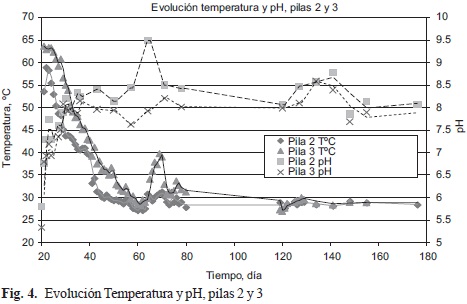
Los máximos valores de microorganismos y las condiciones fisicoquímicas. A los valores máximos alcanzados por los microorganismos en ambas pilas se les asociaron los datos de las variables de control del compostaje Indore modificado. Puede apreciarse que, en general, los valores de la temperatura y de la MO fueron más altos en la pila 3 que en la 2 y más bajos para las otras variables. El día en que ocurrió el valor máximo del microorganismo de ordinario fue más alto en la pila 3 que en la 2 con excepción de los patógenos (Cuadro II).
En relación con la microbiota el cuadro II muestra que en ambas pilas las poblaciones máximas de los microorganismos fueron similares con excepción de lo siguiente:
• Salmonella se presentó sólo un día y únicamente en la pila 2. Ello sugiere contaminación externa y su inmediata eliminación dadas las altas temperaturas de la pila (Fig. 4).
• Pseudomonas fue 9500 veces más abundante en la pila 3 que en la 2. Ello pudo deberse a que Streptomyces sp. le impidió un mayor desarrollo en la pila 2.
• Los valores máximos de microorganismos totales fueron 83 veces más altos en la pila 3 que en la 2. Se explica por el mejor hábitat de la pila 3: mayor cantidad de MO (88.9/84.9), menor relación C/N, menor % de humedad (67.8/82.6) y mayor temperatura (63.3 °C/53.5 °C).
• Streptomyces sp. sólo se desarrolló en la pila 2 donde había sido inoculada.
Se resalta que las grandes poblaciones de microorganismos se mantuvieron hasta el día 18 en la pila 3 y hasta el día 81 en la pila 2, respondiendo a la relación C/N inicial. (Zmora-Nahuma etal. 2005). Ver ANOVA de la figura 3 anteriormente presentada.
Los microorganismos y el pH. El pH es uno de los mayores diferenciadores de la microbiota presente en un hábitat (Martínez 2006) pero lo afectan otros factores, según la experiencia, a saber: en los primeros días del proceso, el pH se situó entre 7 y 8, valores adecuados para el desarrollo de Aspergillus niger,flavus y fumigatus). Sin embargo, su presencia fue nula en ambas pilas, resultado sorprendente en la pila 2 donde fue inoculado Aspergillus niger. Se explica por el amensalismo derivado de la presencia de Streptomyces sp., en la pila 2 y de Pseudomonas de la pila 3. El actinomiceto Streptomyces sp., se caracteriza por producir antibióticos que inhiben el crecimiento de otra microbiota con la que comparta hábitat (Michael 2004) y la protobacteria gama Pseudomonas es antifúngica. Más aún, es un control biológico aceptado para uso en frutas en Estados Unidos (Palou 2007). Cuando estos inhibidores del crecimiento desaparecieron, los valores de pH se mantuvieron en 8, adverso a los hongos (Roussos y Perraud-Gaime 1996). De ahí los valores bajos de Aspergillus y otros hongos.
Los microorganismos y la humedad. Streptomyces se inhibe cuando la humedad se sitúa continuadamente entre 85 y 100% y crece en condiciones más secas (Sánchez 2007). Pero fue otro su comportamiento en la pila 2 que fue la única en la que actuó y donde había sido inoculada. Allí, cuando la humedad estuvo más alta (72%), hubo un buen desarrollo de Streptomyces. Cuando la humedad bajó a 63%, el microorganismo desapareció. Se ha supuesto que las colonias de Streptomyces debieron ocupar, preferencialmente, la superficie de la pila o se situaron a poca profundidad dentro de ella donde la humedad debió ser menor al estar matizada por la temperatura interior y exterior y el aire exterior. Durante los 18 días de la gran presencia de este microorganismo la temperatura ambiente se mantuvo entre 24.5 °C y 31.5 °C (promedio: 28.7 °C). La ubicación en la superficie indicada le permitió un buen desarrollo ya que son aerobios estrictos (Droffnewr et al. 1995, Michael 2004).
Los microorganismos y la temperatura. En relación con la temperatura, al parecer especies de Streptomyces participantes en la experiencia no son de las mesófilas en las que el rango más alto tolerado es el situado entre 35 °C y 47 °C (Michael 2004) sino que pertenecen a los pocos actoninomicetos (1/3) que son termófilos o termófilos facultativos (Sánchez 2007). Este supuesto se fundamenta en que estuvieron presentes en un rango de temperatura entre 40.5 °C y 58.8 °C con poblaciones que llegaron hasta 34><106 UFC y se inhibieron cuando la temperatura descendió a 30 °C, evento coincidente con una reducción del nitrógeno.
Evolución de la microbiota. En resumen, Pseudomonas (pila 3) y Streptomyces (pila 2) primero y el pH después, inhibieron el desarrollo de los hongos y la temperatura inhibió a Pseudomonas y Strep-tomyces. La inhibición de la Pseudomonas ocurrió el día 10 y fue ocasionada por el mantenimiento de altas temperaturas desde el inicio del experimento (Erickson et al. 2009). La de Streptomyces ocurrió entre los días 19 y 26 y se debió al descenso de la temperatura a 30 °C.
Influencia de la relación C/N inicial en el compostaje. La experiencia comprobó la influencia de la relación C/N inicial sobre el proceso. Ello se evidenció en la tardanza en lograr la etapa termófila en los primeros días del compostaje, la menor temperatura alcanzada y la menor duración del mantenimiento de la temperatura más alta lograda, en la pila 2 con C/N más altos (Fig. 3). La relación C/N inicial influyó también en la duración del proceso. En la pila 3 con C/N más bajo, se obtuvo abono a los 100 días y en la pila 3, después de los 160 días (Kautsky et al. 2004, Raj y Antil 2011).
Higienización de la Composta. Requiere, entre otros pares temperatura - duración de temperatura, la de 55 °C por períodos superiores a 1 hora (Bernal et al. 1998, Laor et al. 2004, Elias 2005, Geisseler et al. 2010). Los valores obtenidos en la experiencia fueron superiores tanto en el valor como en la duración (Fig. 4). De ahí que los siguientes organismos patógenos: Salmonella, Shiguella, Klebsiella, Pseudomonas y Escheritchia coli, presentes en la entrada y en la etapa termófila fueron erradicados en ambas pilas desde el día 14.
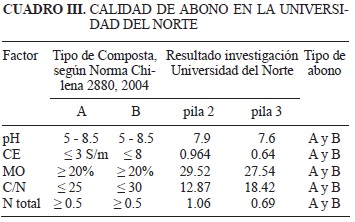
Calidad del abono. El producto obtenido se utilizó como enmienda de suelos demostrando su calidad (Fig. 2). Sus características en ambas pilas lo catalogan como tipo A según la norma chilena 2880 (2004) utilizada como testigo (Cuadro III). Además, cumple con la norma española (Norma NTP 597 2008) sobre contenido de microorganismos (Cuadro IV).
CONCLUSIONES
La investigación objeto del presente documento confirmó que con el método Indore modificado se obtiene abono tipo A, se facilitan y reducen los controles sobre el compostaje y que, si se usan podas, se beneficia el ambiente al valorizar residuos, aumentando su atractivo sobre todo para producciones artesanales.
También mostró la gran influencia que ejerce la relación C/N inicial sobre el proceso y los microorganismos (a menor relación pero cercana al 35/1 teórico, menor duración del compostaje y microbiota más abundante). El material de partida y las condiciones del hábitat a su vez, inciden en la composta y en el tipo de microorganismos que gobiernan el abono.
El logro de abono tipo A mediante el método Indore modificado indicó, además, que los microorganismos cuentan con los nutrientes requeridos para su desempeño por estar presentes en los residuos vegetales utilizados y que el sistema desarrolla una cinética bioxidativa suficiente y similar a la obtenida en otros procesos que adicionan residuos animales y aireación forzada.
REFERENCIAS
Arrigo N., Jiménez M.D., Palma R.M. y Tortarolo M.B. (2005). Residuos de poda compostados y sin compostar: uso potencial como enmienda orgánica en suelo. Ci. Suelo (Argentina) - 23, 87-92. [ Links ]
ASTM (2007). D4972-01 Standard Test Method for pH of Soils. Medición del pH de los suelos para distintos usos: agrícola, ambiental y natural. Book of Standards. 1 de septiembre de 2007. ASTM (2010). Norma D2216-10 Standard Test Methods for Laboratory Determination of Water (Moisture) Content of Soil and Rock by Mass. Determinación en laboratorio de la humedad contenida en suelo, rocas y materials similares. Book of Standards. 1 de agosto de 2010. [ Links ]
Bernal M.P. Paredes C., Sánchez-Monedero M. A y Cegarra J. (1998). Maturity and stability parameters of composts prepared with a wide range of organic wastes. Bioresource Technol. 63, 91-99. [ Links ]
Cardona Castelblanco S., Hernández Ríos L.J. (2008). Aprovechamiento de residuos de podas mediante compostaje en la base Marco Fidel Suárez. Pasantía para optar al título de Administrador Ambiental, Dir. Miller Gallego J. Universidad Autónoma de Occidente. Cali. pp. 1-117. [ Links ]
Chiu-Chung Young P.R. (2005). Food & Fertilizer Technology. Center for the Asian and Pacific Region. "What Happens during Composting?". Annual Report. [ Links ]
Diver S. (2004) Controlled Microbial Composting and Humus Management: Luebke Compost [en línea]. http://www.ibiblio.org/steved/Luebke/Luebke-compost2.html 13/01/2012 [ Links ]
Droffner M. L., Brinton W. F., Evans E. Evidence for the prominence of well characterized mesophilic bacteria in Thermophilic (50-70 °c) composting environments (1995). Biomass Bioarg. 8, 191-195. [ Links ]
Elias C. X., García J., López M., Soliva M. S. (2009). Tecnologías aplicables al tratamiento de residuos. Valorización y fabricación de materiales a partir de residuos. En: Reciclaje de Residuos Industriales (J. E. Castells, Ed.). Ediciones Díaz de Santos, España, 2da. ed. 93-171. [ Links ]
Erickson M. Liao J., Ma Li., Jiang X. y Doyle M. P. (2009). Inactivation of Salmonella spp. in cow manure composts formulated to different initial C:N ratios Bioresour. Technol. 100, 5898-5903. [ Links ]
Escudero A.R. y Arias C. A. (2010). Calidad nutricional de la biotransformación de podas. Memorias. III Simposio Iberoamericano de Ingeniería de Residuos de REDISA [en línea] http://www.redisa.uji.es/artSim2010/Outro%20Tema/Calidad%20nutricional%20de%20 la%20biotransformaci%C3%B3n%20de%20podas.pdf 30/11/11. [ Links ]
Geisseler D., Horwath W.R., Joergensen R.G. y Ludwig B. (2010). Pathways of nitrogen utilization by soil microorganisms. A review. Soil Biol. Biochem. 42, 2058-2067. [ Links ]
Hadas A., Kautsky L., Goek M. y Kara E.E. (2004). Rates of decomposition of plant residues and available nitrogen in soil, related to residue composition through simulation of carbon and nitrogen turnover. Soil Biol. Biochem. 36, 255-266. [ Links ]
Heckman, J.(2006). A history of organic farming: Transitions from Sir Albert Howard's war in the soil to USDA National Organic Program. Renew. Agr. Food Syst. 2, 143-150. [ Links ]
ICONTEC (2008). Norma Técnica Colombiana NTC 1556: Carne y productos cárnicos. Métodos para determinar el contenido de nitrógeno. Instituto Colombiano de Normas Técnicas y Certificación. 23 de agosto de 2008. [ Links ]
ICONTEC (2003). Norma Técnica Colombiana NTC 5167: Productos para la industria agrícola, productos orgánicos usados como abonos o fertilizantes y enmiendas de suelo. Instituto Colombiano de Normas Técnicas y Certificación. 28 de mayo del 2003. [ Links ]
INN (2004). Norma Chilena de Calidad de Compost NCh2880. Diario Oficial la Norma Chilena 2880 "Compost - Clasificación y requisitos". 22 de febrero de 2005. [ Links ]
INSHT (2001). NTP 597: Plantas de compostaje para el tratamiento de residuos: riesgos higiénicos. Ministerio de Trabajo y Salud de España. Notas Técnicas de Publicación. [ Links ]
Laor Y., Raviv M., Borisover M. (2004). Evaluating microbial activity in composts using microcalorimetry. Thermochim. Acta 420, 119-125 [ Links ]
López M.S. (2004). Calidad del compost: Influencia del tipo de materiales tratados. Formación de técnicos para el tratamiento y gestión de lodos de depuradora. Valsaín Ceneam/Mimam.1-20. [ Links ]
Martínez O.C. (2006). Efecto del pH sobre el crecimiento de microorganismos durante la etapa de maduración en pilas estáticas de compost. Vol. 1 No. 2. PML, Jul - Dic 2006. 87-98. [ Links ]
Michael T. y Madigan J.M.( 2004). Brock, Biología de los microorganismos. Madrid: Pearson Education. [ Links ]
Palou L. (2007). Para el trataminiento antifúngico en poscosecha de cítricos de producción integrada. Revista Especial de la Comunidad Valenciana para la investigación agroalimentaria. 82-93. [ Links ]
Raj D. y Antil R.S. (2011). Evaluation of maturity and stability parameters of composts prepared from agro-industrial wastes. Bioresour. Technol. 102, 2868-2873. [ Links ]
Rogers BF., Boyles L.S., Bamka W.J. y Heckman J.R. (2002). Guidelines for land application of non-traditional organic wastes (Food processing by products and municipal yard wastes) on farmlands in New Jersey. N. Jersey Agricultural Experiment Station. pp. 36 en Bulletin E-281. [ Links ]
Roussos S. y Perraud-Gaime I. (1996). Fisiología y Bioquímica de Microorganismos Utilizados en Procesos de Fermentación en Medio Sólido. (E. Galindo, Ed.), Fronteras en Biotecnología y Bioingeniería, Cuernavaca, México, pp. 341 -348. [ Links ]
Sánchez-Yáñez J. M., Villegas Moreno J., Márquez B. L. (2007) Los actinomicetos en la fertilidad y producción agrícola. [en línea]. http://www.monografias.com/trabajos47/actinomicetos/actinomicetos2.shtml. Fecha de consulta: 21/09/11. [ Links ]
Varnero M.T., Rojas C. y Orellana R. (2007). Índices de fitotoxicidad en residuos orgánicos durante el Compostaje. R.C.Suelo Nutr. Veg. 7, 28-37. [ Links ]
Zmora-Nahum S., Markovitch O., Tarchitzky J. y Chen Y. (2005). Dissolved organic carbon (DOC) as a parameter of compost maturity. Soil Biol. Biochem. 37, 2109-2116. [ Links ]
Zucconi F.M. (1985). Phytotoxins during the stabilization of organic matter. En: Composting of Agricultural and Other Wastes. (Gasser J.K.R. Ed.). Elsevier, Londres, pp. 73-80. [ Links ]














