Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 no.4 Ciudad de México nov. 2012
Establecimiento y respuestas fisiológicas de la simbiosis Rhizobium tropici-Leucaena leucocephala en presencia de fenantreno y naftaleno
Establishment and physiological responses of the Rhizobium tropici-Leucaena leucocephala symbiosis in presence of phenanthrene and naphtalene
Carlos LÓPEZ-ORTIZ1, Ronald FERRERA-CERRATO1, Alejandro ALARCÓN1*, Juan José ALMARAZ1, Esperanza MARTÍNEZ-ROMERO2 y Ma. Remedios MENDOZA-LÓPEZ3
1 Área de Microbiología. Postgrado de Edafología. Colegio de Postgraduados. Carretera México-Texcoco km 36.5. Montecillo 56230, Estado de México. *Autor responsable; aalarconcp@gmail.com
2 Centro de Ciencias Genómicas, UNAM. Av. Universidad s/n Col. Chamilpa Cuernavaca 62210, Morelos.
3 Unidad de Servicios de Apoyo en Resolución Analítica (SARA). Universidad Veracruzana. Dr. Luis Castelazo Ayala s/n. Col. Industrial Animas Xalapa 91190, Veracruz.
Recibido mayo 2012,
aceptado agosto 2012
RESUMEN
Este estudio evaluó el establecimiento de la simbiosis entre Rhizobium tropici CIAT899 y Leucaena leucocephala (Lam.) en sistemas contaminados con naftaleno (NAF) y fenantreno (FEN) y la respuesta de la planta con el contenido de compuestos fenólicos totales (CFT), actividad antioxidante total (AAT) y contenido total de clorofilas (Clo-roT) y carotenos (CaT). A los 31 días, el NAF tuvo efectos negativos en la formación de nódulos, retardando su aparición hasta el día 25 en presencia de 100 mg/L. Ante 20 mg FEN/L, las plantas de L. leucocephala no mostraron diferencias significativas en la formación de nódulos con respecto al testigo, mientras que a 60 y 100 mg FEN/L la nodulación disminuyó significativamente en 52 %. La inoculación con R. tropici incrementó el peso seco total (PST) hasta en 150 % comparado con las plantas no inoculadas. El CFT en hoja fue significativamente mayor en los tratamientos no inoculados en comparación con aquellos inoculados con R. tropici y significativamente mayor ante FEN que con NAF. Para ambos contaminantes, la concentración de 100 mg/L produjo mayor CFT y AAT en comparación con 20 y 60 mg/L. Para el caso de raíz, los tratamientos sin contaminantes en ausencia de R. tropici presentaron mayor CFT y AAT. Para los nódulos, la AAT incrementó significativamente ante NAF, mientras que ante FEN disminuyó. El NAF o el FEN redujeron significativamente el contenido de CloroT, el cual fue significativamente mayor en plantas con Rhizobium en comparación con las plantas no inoculadas. El contenido de CaT en plantas no inoculadas incrementó en presencia de NAF y FEN.
Palabras claves: nodulación, HAP, fitotoxicidad, antioxidantes totales, fenólicos, clorofila.
ABSTRACT
This study evaluated the establishment of the symbiosis between Rhizobium tropici CIAT899 and Leucaena leucocephala (Lam.) under contaminated systems with naphtalene (NAF) and phenanthrene (FEN), as well as the physiological plants responses such as total content of phenolic compounds (CFT), total antioxidant activity (AAT) and the content of chlorophylls (CloroT) and carotenoids (CaT). After 31 days, NAF had more significant negative effects on nodulation by delaying the formation of nodules until the day 25 at 100 mg/L. In the presence of 20 mg FEN/L, L. leucocephala plants did not show significant differences on the number of nodules when compared to the control, while nodulation decreased 52 % at 60 and 100 mg FEN/L. Inoculation with R. tropici resulted in significant increases of PST (>150 %) in comparison to non-inoculated plants. The foliar content of CFT was significantly greater at non-inoculated treatments in respect to those with R. tropici, and significantly higher in plants exposed to FEN than NAF. For both hydrocarbons, the concentration of 100 mg/L resulted in greater CFT and AAT when compared to 20 or 60 mg/L. For roots, treatments without contamination and R. tropici had more content of CFT and AAT. The AAT in nodules significantly increased due to NAF, while a significant reduction was observed in FEN treatments. Either NAF or FEN did not significantly affect the content of CloroT, although this content was significantly greater in plants with R. tropici than non-inoculated plants. The CaT content significantly increased at non-inoculated plants exposed to NAF and/or FEN.
Key words: nodulation, PAH, phytoxicity, total antioxidants, phenolics, chloroplyll.
INTRODUCCION
Las leguminosas (familia Fabaceae) son importantes en los agroecosistemas ya que incrementan la fertilidad de los suelos a través de la fijación simbiótica del nitrógeno atmosférico (Almaraz-Suárez y Ferrera-Cerrato 2007), la cual se lleva a cabo en estructuras especializadas denominadas nódulos, que se desarrollan en la raíz de estas plantas (Lloret y Martínez-Romero 2005). Además, la simbiosis Rhizobium-leguminosa favorece la asimilación de N en estas plantas, por lo que son más competitivas en suelos con baja fertilidad. Esta característica de las leguminosas puede ser benéfica en suelos contaminados con hidrocarburos, donde hay limitada disponibilidad de N para el crecimiento de microorganismos que degradan estos compuestos orgánicos (Ferrera-Cerrato et al. 2007).
Los hidrocarburos aromáticos policíclicos (HAP) son encontrados en suelos de sitios industriales a muy altas concentraciones y su acumulación es debida a su baja solubilidad y sus propiedades recalcitrantes (Wilson y Jones 1993). El problema que representan estos compuestos en los sistemas biológicos se relaciona con su alto grado de toxicidad y por sus características carcinogénicas y mutagénicas (Edwards 1983).
La efectividad de algunas plantas en la remediación de suelos contaminados con HAP ha sido descrita (Binet et al. 2000, Muratova et al. 2003), aunque el efecto de las leguminosas arbóreas como Leucaena leucocephala y su simbiosis con rizobios ha recibido poca atención. Por ejemplo, la contaminación del suelo con fenantreno (1000 mg/kg) incrementa el número de nódulos activos en Trifolium pratense (Chiapusio et al. 2007); mientras que en Phaseolus vulgaris, este hidrocarburo reduce significativamente la nodulación (González-Paredes et al. 2007). El estudio de respuestas fisiológicas de leguminosas arbóreas ante HAP es importante desde el punto de vista ecológico, pues estas plantas forman islas de fertilidad, incrementan el contenido de materia orgánica en el suelo y pueden proveer refugio a la flora y a la fauna (NAS 1997).
En las plantas, el efecto tóxico de los HAP puede relacionarse con un incremento en la producción de especies reactivas de oxígeno (ROS, por sus siglas en inglés), que incluyen el H2O2, el O22- y HO-, las cuales pueden servir como moléculas de señalización y como subproductos citotóxicos (Liu et al. 2009). Sin embargo, existe poca información sobre las respuestas fisiológicas de sistemas simbióticos (planta y microorganismo) en presencia de HAP. Por lo anterior, este trabajo evaluó el efecto de dos HAP (naftaleno -NAF- y fenantreno -FEN-) en el establecimiento de la simbiosis Rhizobium tropici-Leucaena leucocephala y la respuesta de parámetros fisiológicos en hojas, raíz y nódulos.
MATERIALES Y MÉTODOS
Semillas de Leucaena leucocephala (Lam.) fueron escarificadas con H2SO4 al 90 % durante 15 minutos y posteriormente, desinfectadas con NaClO por 10 minutos y germinadas en agar-agua al 1 %. A los cinco días después de la germinación, las plántulas fueron transferidas a una bolsa "Growth Pouch" con 40 mL de solución nutritiva de Fahraeus (Fahraeus 1957) contaminada con naftaleno (NAF) o con fenantreno (FEN). Cada hidrocarburo fue disuelto en acetona y aplicado a la solución de Fahraeus en las siguientes concentraciones: 20, 60 y 100 mg/L. Además se establecieron plantas en un sistema no contaminado (0 mg/L) como tratamiento testigo. A los tres días del transplante, las plántulas fueron inoculadas con 1.0 mL de una suspensión con Rhizobium tropici CIAT899 (720 x 108 UFC/mL). Además, se consideraron tratamientos sin inoculación de la bacteria.
El experimento se mantuvo durante 31 días en cámara de ambiente controlado con 12 h de fotoperiodo; la temperatura máxima/mínima y humedad relativa máxima/mínima fueron 26.0/24.0 °C y 70/65 %, respectivamente. Durante este periodo, los nódulos radicales fueron cuantificados cada tercer día, a partir de su aparición hasta el final del experimento. Posteriormente, a los 31 días, las plantas fiieron cosechadas y secadas a 70 °C durante 72 h para determinar el peso seco total (PST).
El contenido de compuestos fenólicos totales (CFT) fue determinado mediante el ensayo con el reactivo Folin-Ciocalteau, utilizando ácido clorogénico como estándar (Singleton y Rossi 1965, Soong y Barlow 2004). Muestras de hoja, raíz y nódulos de las plantas fueron molidas en mortero con 1.5 mL de metanol al 80 %, y centrifugadas durante 15 minutos a 15 000 rpm (~24 000 g). Los extractos fueron conservados a -20 °C hasta su análisis. El análisis consistió en reaccionar alícuotas de 30 (μL de los extractos con 90 (μL de carbonato de sodio (Na2CO3) y 150 (μL de solución de Folin-Ciocalteau en microplacas de 96 pozos. Después de 30 minutos se tomaron lecturas de absorbancia a 725 nm en un espectrofotómetro (Synergy 2, Biotek® Instruments). Los resultados fueron expresados como miligramos equivalentes de ácido clorogénico por masa de tejido fresco (mg ácido clorogénico/g).
Para evaluar la actividad antioxidante total (AAT) se utilizó el ensayo de decoloración del radical 1,1-difenil-2-picrildrazil (DPPH) utilizando Trolox como compuesto antioxidante (Mattháus 2002). A partir de los extractos obtenidos para CFT, se tomaron alícuotas de 15 (μL que fueron transferidas a microplacas de 96 pozos y se hicieron reaccionar con 285 (μL de solución de DPPH. Se tomaron lecturas de absorbancia inicial a 515 nm y las placas fueron incubadas a temperatura ambiente durante 15 minutos, para tomar una lectura de absorbancia final con un espectrofotómetro (Synergy 2, Biotek® Instruments). Los resultados fueron expresados como milimoles de equivalentes de Trolox por masa de tejido fresco (mM Trolox/g).
Para la cuantificación de clorofila total (CloroT) y carotenos (CaT) se usó la metodología de Dere et al. (1998). Muestras de hojas de masa conocida fueron molidas en mortero con 1.5 mL de metanol al 80 % y los extractos fueron mantenidos en refrigeración hasta el momento de tomar lecturas de absorbancia (470, 645 y 662 nm) en un espectrofotómetro (Synergy 2, Biotek® Instruments). Los resultados fueron expresados en miligramos por masa de tejido fresco (mg/g).
El experimento fue un factorial 2 x 4 x 2 con 16 tratamientos y seis repeticiones, distribuidos en un diseño experimental completamente al azar. Los factores fueron tipo de HAP (NAF y FEN) concentración del HAP (0, 20, 60 y 100 mg/L) y la inoculación de R. tropici (con y sin). Los datos obtenidos fueron analizados mediante un análisis de varianza y prueba de comparación de medias (LSD, α=0.05) con el programa estadístico SAS (SAS Institute 2002).
RESULTADOS
A los 31 días, el tipo de HAP, la concentración del contaminante, y la interacción de estos dos factores tuvieron efectos significativos (p ≤ 0.001) en la formación de nódulos en las raíces de L. leucocephala. En el caso del tipo de HAP, las plantas de L. leucocephala ante FEN presentaron una aparición más temprana de nódulos (a los 5 días), en comparación con las plantas expuestas a NAF cuya nodulación apareció a los 12 días (Fig. 1). Con respecto al factor concentración del contaminante, los primeros nódulos aparecieron a los 11 días, ante 20 mg/L. Sin embargo, después de los 14 días se observó que a mayor concentración del contaminante menor número de nódulos (Fig. 1). Las plantas de L. leucocephala ante 20 mg FEN/L mostraron mayor número de nódulos (8.2) hasta el día 28, aunque este valor fue estadísticamente igual al testigo. En contraste, las concentraciones de 60 y 100 mg FEN/L disminuyeron significativamente la formación de nódulos con 6.5 y 4.3, respectivamente (Fig. 1A). Las plantas de L. leucocephala expuestas al NAF retardaron significativamente la aparición de nódulos al incrementar la concentración, especialmente en 60 y 100 mg NAF/L en comparación con el testigo (Fig. 1B). No se observaron nódulos en las plantas de L. leucocephala sin inoculación con R. tropici.
El PST de L. leucocephala mostró diferencias significativas únicamente por el factor inoculación y en la interacción de la inoculación con el tipo de HAP (p ≤ 0.001). La inoculación con R. tropici produjo mayor biomasa (>150 %) con respecto a plantas no inoculadas (Fig. 2). Las plantas inoculadas con R.tropici en presencia de 100 mg FEN/L incrementaron la producción de biomasa (Fig. 2A); mientras que el menor PST correspondió a las plantas no inoculadas ante 60 mg NAF/L (Fig. 2B).
El CFT en hoja presentó diferencias significativas por efecto del tipo de HAP, la inoculación (p ≤ 0.001), la concentración del HAP (p ≤ 0.01) y la interacción de los tres factores (p ≤ 0.001). En el caso del tipo de contaminante, las plantas de L. leucocephala ante FEN presentaron significativamente mayor CFT (>36 %) que las plantas expuestas a NAF (Fig. 3A y C). Con respecto al factor inoculación, las plantas no inoculadas mostraron hasta 167 % más CFT con respecto a las plantas de L. leucocephala inoculadas con R. tropici (Fig. 3A y C). Con relación al factor concentración de HAP, las plantas ante 100 y 60 mg/L manifestaron mayor CFT (17.3 y 15.4 mg/g, respectivamente) en comparación con las plantas testigo sin contaminante, e incluso que plantas ante 20 mg/L (Fig. 3A y C). Las plantas no inoculadas ante 60 mg FEN/L exhibieron mayor CFT, mientras que las plantas inoculadas en presencia de 20 mg FEN/L tuvieron el menor CFT (Fig. 3A y Fig. 3C).
En el caso de raíz, el tipo de contaminante, la inoculación, la concentración del HAP y la interacción de los tres factores presentaron efectos significativos (p ≤ 0.001) en el CFT. En el caso del tipo de HAP, las raíces de L. leucocephala expuestas a NAF tuvieron significativamente mayor CFT que aquellas expuestas a FEN (Fig. 3B y D). Con respecto a la inoculación, las plantas inoculadas con R. tropici evidenciaron significativamente mayor CFT en comparación con las plantas no inoculadas (Fig. 3B y D). Para el factor concentración de HAP, las plantas de L. leucocephala ante 60 mg de HAP/L presentaron significativamente mayor CFT (>35 %) con respecto a las otras concentraciones evaluadas (Fig. 3B y D). Las plantas inoculadas ante 100 mg NAF/L presentaron el mayor CFT en raíz, mientras que el menor CFT se obtuvo en plantas no inoculadas expuestas a 100 mg FEN/L (Fig. 3B y D).
El tipo de HAP (p ≤ 0.001) y la interacción del tipo de HAP con la concentración del contaminante (p ≤ 0.01) presentaron efectos significativos en el CFT en nódulos. Los nódulos de plantas de L. leucocephala expuestos a FEN mostraron mayor CFT que aquellos expuestos a NAF (Fig. 4). En el caso de la respuesta a la concentración del HAP, aunque sin notarse diferencias estadísticas, los nódulos expuestos a concentraciones de 60 mg/L tuvieron mayor CFT, en comparación a los otros tratamientos (Fig. 4). El tratamiento con mayor CFT en nódulos fue el expuesto a 20 mg FEN/L, mientras que el menor CFT se obtuvo en las plantas ante 20 mg NAF/L y 100 mg FEN/L (Fig. 4).

La AAT en hoja reveló diferencias significativas por efecto de la inoculación, la concentración del HAP (P < 0.001) y la interacción de los tres factores evaluados (p ≤ 0.001). Las plantas no inoculadas presentaron hasta 300 % más AAT que las plantas inoculadas con R. tropici (Fig. 5A y C). Para el caso de la concentración de HAP, las plantas expuestas a concentraciones de 100 mg/L exhibieron significativamente mayor AAT con respecto a las otras concentraciones de HAP evaluadas (Fig. 5A y C). Las plantas no inoculadas ante 100 mg FEN/L presentaron mayor AAT, mientras que las plantas inoculadas con R. tropici en presencia de 20 mg FEN/L mostraron la menor AAT (Fig. 5A y C).
El tipo y la concentración del HAP, la inoculación con R. tropici y la interacción de los tres factores (p ≤ 0.001) evidenciaron efectos significativos en la AAT de la raíz. Las raíces de L. leucocephala ante NAF presentaron significativamente mayor AAT en comparación con los valores observados ante FEN (Fig. 5B y D). Para el factor concentración de HAP, las raíces ante 20 mg/L presentaron significativamente mayor AAT en comparación con la concentración de 100 mg/L (Fig. 5 B y D). Para el caso del factor inoculación, las raíces de plantas sin inocular tuvieron significativamente mayor AAT que los tratamientos inoculados. Las plantas no inoculadas ante 20 mg FEN/L exhibieron mayor AAT en la raíz en comparación con las plantas inoculadas en presencia de 20 mg FEN/L (Fig. 5B y D).
La AAT en nódulos fue afectada significativamente por el tipo de HAP y por la interacción del tipo de HAP con la concentración del contaminante (p ≤ 0.001). La AAT en los nódulos de L. leucocephala ante NAF fue mayor comparada con aquellos ante FEN. Para el factor concentración del HAP, como tendencia, las plantas ante 100 mg/L presentaron mayor AAT aunque estadísticamente igual a los otros tratamientos (Fig. 6). Los nódulos ante 60 mg NAF/L tuvieron mayor AAT, en comparación con los nódulos expuestos a 60 mg FEN/L (Fig. 6).
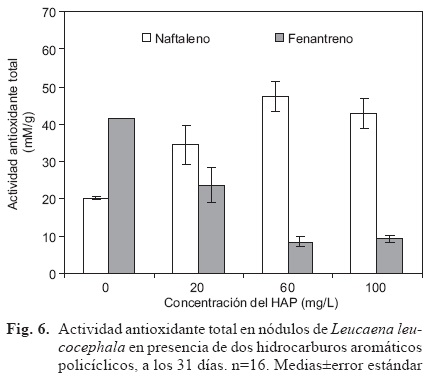
Los factores inoculación y concentración del HAP, así como la interacción de los tres factores evaluados mostraron efectos significativos (p ≤ 0.001) en el contenido de CloroT en hoja. Las plantas de L. leucocephala inoculadas con R. tropici tuvieron mayor cantidad de CloroT que las plantas no inoculadas (Fig. 7A y Fig. 7A). Para el factor concentración del HAP, las plantas sin contaminante exhibieron significativamente mayor cantidad de CloroT que aquellas plantas ante 60 mg/L (Fig. 7A y C). La cantidad de CloroT en las plantas inoculadas sin contaminante fue mayor en comparación con las plantas no inoculadas ante 60 mg FEN/L (Fig. 7A y C).
El tipo y concentración del HAP, la inoculación, y la interacción de los tres factores evaluados tuvieron efectos significativos (p ≤ 0.001) en el contenido de CaT. Las plantas ante FEN presentaron mayor contenido de CaT con respecto a plantas expuestas al NAF (Fig. 7B y D). Para el factor concentración del contaminante, las plantas ante 100 mg/L mostraron mayor contenido de CaT que aquellas ante 20 mg/L (Fig. 7B y D). Para el factor inoculación, las plantas no inoculadas tuvieron significativamente (p ≤ 0.01) mayor cantidad de CaT que las plantas inoculadas con R. tropici (Fig. 7B y D). Las plantas no inoculadas ante 60 mg FEN/L exhibieron mayor contenido de CaT; mientras que las plantas inoculadas con R. tropici ante 20 mg NAF/L tuvieron el menor de CaT (Fig. 7B y D).
DISCUSIÓN
El incremento de las concentraciones de los HAP redujo significativamente la nodulación en las raíces de L. leucocephala. El NAF tuvo mayor efecto negativo en la formación de nódulos en la simbiosis Rhizobium-Leucaena en comparación con el FEN. En el caso de FEN, las plantas expuestas a 20 mg/L no mostraron diferencias significativas en comparación con el testigo. González-Paredes et al. (2007) al evaluar la simbiosis entre Phaseolus vulgaris-Rhizobium tropici CIAT899, observaron la aparición más temprana de nódulos con FEN (20 mg/L) en comparación con la exposición a NAF ó benzo(a)pireno. Aun cuando no se tienen reportes que expliquen dicha estimulación de la nodulación ante bajas concentraciones de FEN, este efecto se puede atribuir a cambios en los patrones de exudación de las raíces expuestas a los HAP. Muratova et al. (2009) indicaron que 10 mg FEN/kg estimularon la producción de carbohidratos en las raíces de Sorghum bicolor. Como parte de los exudados radicales se encuentran los flavonoides (Lundegardh y Stenlid 1944, Ponce et al. 2004), que tienen una función importante como señales que favorecen el establecimiento de la simbiosis Rhizobium-leguminosa (Sundaravarathan y Kannaiyan 2002, Dardanelli et al. 2008). Los resultados experimentales indican que el comportamiento químico del HAP inhibe de manera importante el establecimiento de la simbiosis Rhizobium tropici-Leucaena leucocephala reflejado en la capacidad de formación de nódulos. Lo anterior confirma el efecto negativo de los hidrocarburos del petróleo en la nodulación de leguminosas arbóreas, efecto que puede ser utilizado como indicador de la toxicidad de estos contaminantes en este sistema simbiótico (Rivera-Cruz et al. 2005). En contraste a los resultados del presente trabajo, se ha reportado que la contaminación con 1000 mg FEN/kg incrementa el número de nódulos en Trifolium pratense (Chia-pusio et al. 2007), mientras que Ahmad et al. (1997) encontraron que las cepas de R. meliloti en suelos contaminados con HAP permanecen únicamente en presencia de Medicago sativa.
El efecto tóxico de los HAP en el crecimiento y desarrollo de las plantas ha sido reportado (Henner et al. 1999, Baek et al. 2004, Alkio et al. 2005, Song et al. 2005, Muratova et al. 2009). En el presente estudio, el PST no fue afectado significativamente por el tipo o la concentración del HAP. En contraste, la inoculación de R. tropici estimuló significativamente el crecimiento de las plantas (>150 %). La nula toxicidad de los HAP observada en el crecimiento de L. leuco-cephala, también ha sido reportada para las especies Phaseolus nipponensis, Zea mays, Sorgum bicolor y Festuca arundinacea expuestas a diferentes concentraciones de NAF o de FEN (Baek et al. 2004, Cheema et al. 2009, Muratova et al. 2009). Los efectos tóxicos de los HAP en la planta dependen de factores ambientales, así como de la estructura química, la concentración y el tiempo de exposición al contaminante (Henner et al. 1999, Baek et al. 2004, Song et al. 2005). De manera importante, el presente estudio demuestra la capacidad de L. leucocephala para tolerar concentraciones de NAF y FEN de hasta 100 mg/L, sin afectar su producción de biomasa seca.
El CFT y la AAT fueron significativamente mayores en las plantas sin inocular, lo que sugiere que Rhizobium aminora la toxicidad de los HAP. El efecto fitotóxico de los HAP puede relacionarse con la producción de ROS que incluyen el H2O2, el O22- y radicales HO-, las cuales actúan como moléculas de señalización y como subproductos citotóxicos. Bajo condiciones fotosintéticas y respiratorias normales, estos compuestos se producen en la cadena del transporte de electrones en cloroplastos y mitocondrias y son subproductos de rutas metabólicas en el peroxisoma (Vranova et al. 2002, Liu et al. 2009). Debido a que las ROS atacan químicamente nucleótidos, proteínas, carbohidratos y ácidos grasos, las plantas tienen mecanismos bioquímicos para neutralizarlas (Moller et al. 2007). Por el contrario, las plantas utilizan niveles bajos de ROS ante condiciones de estrés, como señalización para respuestas complejas para la defensa contra patógenos o bien en la desintoxicación de contaminantes (Liu et al. 2009). El estrés inducido por el tipo y la concentración de HAP puede estar contribuyendo al incremento en la producción de ROS que causan efectos negativos en la célula vegetal (Mittler 2002). Ante tal estrés, las plantas activan respuestas metabólicas específicas como son la síntesis y la actividad de compuestos enzimáticos o no enzimáticos con poder antioxidante (Mittler 2002, Lee et al. 2007), así como compuestos fenólicos que participan en la erradicación de ROS (Treutter 2005). En este trabajo, las plantas no inoculadas tuvieron mayor contenido de CFT y AAT, mismos que podrían estar relacionados con la eliminación de ROS inducidas por el estrés causado por NAF o FEN, en donde la presencia de R. tropici puede tener un papel relevante en la tolerancia de L. leucocephala ante ambos HAP. Las respuestas fisiológicas como el CFT, la AAT, la CloroT y los CaT han sido poco descritas para leguminosas arbóreas ante HAP. Liu et al. (2009) encontraron reducción en los niveles de clorofila a, b y total en Arabidopsis thaliana ante diferentes concentraciones de FEN. Lo anterior confirma el efecto del aumento de la concentración del contaminante sobre la reducción del contenido de CloroT en plantas expuestas a FEN en comparación con el testigo no contaminado. Por el contrario, el contenido de CaT incrementó conforme aumentó la concentración de ambos HAP. Aun cuando no se tienen comparaciones del efecto de los HAP en el contenido de CaT, se ha demostrado que el mayor cantidad de estos pigmentos incrementa significativamente al presentarse deficiencias de nitrógeno, lo cual es una respuesta a un daño oxidante en microalgas (Salguero et al. 2003). Lo anterior puede relacionarse con el efecto negativo de los HAP en el contenido de CloroT observado en las plantas de L. leucocephala, mientras que el de CaT fue mayor en presencia de los HAP. En contraste, el contenido de CaT en plantas inoculadas con R. tropici fue menor, mientras que el contenido de CloroT fue mayor con respecto a plantas no inoculadas.
Los resultados indican que L. leucocephala presenta un estrés oxidante ante los HAP evaluados, el cual es atenuado por R. tropici. Debido a que no existen estudios para establecer comparaciones en la simbiosis Rhizobium-leguminosa; análogamente, la simbiosis micorrízica atenúa este tipo de estrés abiótico en sus hospedantes. Por ejemplo, Glomus intraradices reduce notablemente el daño oxidante en Chichorium intybus causado por antraceno y benzo(a) pireno; sin embargo, la presencia de los HAP reduce la densidad de hifas, la intensidad de esporulación del hongo y el tamaño de las raíces de C. intybus (Debiane et al. 2008, 2009).
CONCLUSIONES
La contaminación con NAF y FEN tuvo efectos tóxicos para la formación de nódulos en Leucaena leucocephala, en la que el NAF produjo mayor reducción de la nodulación. La simbiosis entre R. tropici y L. leucocephala incrementó el PST hasta en 150 % comparado con las plantas no inoculadas, demostrándose el efecto benéfico de la simbiosis aún ante los HAP. El CFT y la AAT en las hojas fue significativamente mayores en los tratamientos no inoculados en comparación con los tratamientos con R. tropici, y significativamente más elevados en las plantas ante FEN comparadas con aquellas ante NAF. El tipo de contaminante no tuvo efectos significativos en el contenido de CloroT y CaT; sin embargo, las plantas con R. tropici presentaron mayor contenido de CloroT en comparación con las plantas no inoculadas. Los resultados indican que L. leucocephala experimenta un estrés oxidante inducido por los HAP, y que R. tropici atenúa sus efectos tóxicos en las plantas.
AGRADECIMIENTOS
Trabajo que forma parte del proyecto SEP-CONACyT 79456; CLO, agradece el apoyo del CONACyT durante sus estudios de posgrado.
REFERENCIAS
Ahmad D., Mehmannavaz R. y Damaj M. (1997). Isolation and characterization of symbiotic N2-fixing Rhizobium meliloti from soils contaminated with aromatic and chloroaromatic hydrocarbons: PAHs and PCBs. Int. Biodeterior. Biodegrad. 39, 33-43. [ Links ]
Alkio M., Tabuchi T.M., Wang X. y Colón-Carmona, A. (2005). Stress responses to polycyclic aromatic hydrocarbons in Arabidopsis include growth inhibition and hypersensitive response-like symptoms. J. Exp. Bot. 56, 2983-2994. [ Links ]
Almaraz-Suárez J.J. y Ferrera-Cerrato R. (2007). Fijación simbiótica de nitrógeno en leguminosas. En: Microbiología agrícola (R. Ferrera-Cerrato y A. Alarcón, Eds.). Trillas, México, D.F., pp. 225-238. [ Links ]
Baek K.H., Kim H.S., Oh H.M., Yoon B.D., Kim J. y Lee I.S. (2004). Effects of crude oil, oil components, and bioremediation on plant growth. J. Environ. Sci. Heal. A A39, 2465-2472. [ Links ]
Binet P., Portal J.M. y Leyval C. (2000). Fate of polycyclic aromatic hydrocarbons (PAH) in the rhizosphere and mycorrhizosphere of ryegrass. Plant Soil 227, 207-213. [ Links ]
Cheema S.A., Khan M.I. Tang X., Zhang C., Shen C., Malik Z., Ali S., Yang J., Shen K., Chen X. y Chen Y. (2009). Enhancement of phenanthrene and pyrene degradation in rhizosphere of tall fescue (Festuca arundinacea). J. Hazard. Mater. 166, 1226-1231. [ Links ]
Chiapusio G., Pujol S., Toussaint M., Badot P. y Binet P. (2007). Phenanthrene toxicity and dissipation in rhizosphere of grassland plants (Lolium perenne L. and Trifolium pratense L.) in three spiked soils. Plant Soil 294, 103-112. [ Links ]
Dardanelli M.S., Fernández de Córdoba F.J., Espuny M.R., Rodríguez-Carvajal M.A., Soria-Díaz M.E., Gil-Serrano A.M., Okon Y. y Megías M. (2008). Effect of Azospirillum brasilense coinoculated with Rhizobium on Phaseolus vulgaris flavonoids and Nod factor production under salt stress. Soil Biol. Biochem. 40, 2713-2721. [ Links ]
Debiane D., Garcon G., Verdin A., Fontaine J., Durand R., Grandmougin-Ferjani A., Shirali P. y Lounés-Hadj Sahraoui A. (2008). In vitro evaluation of the oxidative stress and genotoxic potentials of anthracene on mycorrhizal chicory roots. Environ. Exp. Bot. 64, 120-127. [ Links ]
Debiane D., Garcon G., Verdin A., Fontaine J., Durand R., Shirali P., Grandmougin-Ferjani A., y Lounés-Hadj Sahraoui A. (2009). Mycorrhization alleviates benzo[a] pyrene-induced oxidative stress in an in vitro chicory root model. Phytochemistry 70, 1421-1427. [ Links ]
Dere S., Günes T. y Sivaci R. (1998). Spectrophotometric determination of chlorophyll - A, B and total carotenoid contents of some algae species using different solvents. Tr. J. of Botany 22, 13-17. [ Links ]
Edwards N.T. (1983). Polycyclic aromatic hydrocarbons (PAH's) in the terrestrial environment- A review. J. Environ. Qual. 12, 427-441. [ Links ]
Fahraeus, G. (1957). The infection of clover root hairs by nodule bacteria studied by simple glass slide technique. J. Gen. Microbiol. 16, 374-381. [ Links ]
Ferrera-Cerrato R., Alarcón A., Trejo-Aguilar D., Sangabriel W., Mendoza-López M.R., Cruz-Sánchez J.S., López-Ortiz C. y Delgadillo-Martínez J. (2007). Fitorremediación de un suelo contaminado con combustóleo utilizando Phaseolus coccineus y fertilización orgánica e inorgánica. Agrociencia 41, 817-826. [ Links ]
González-Paredes Y., Ferrera-Cerrato R. y Alarcón A. (2007). Effect of three polycyclic aromatic hydrocar-bons on nodulation of Phaseolus vulgaris by Rhizobium tropici. Scientific Program and Abstracts. Annual Meeting Soils in Cold Environments. Canadian Society of Soil Science. 3 al 7 de junio, p. 77. [ Links ]
Henner P., Schiavon M., Druelle V. y Lichtfouse E. (1999). Phytotoxicity of ancient gaswork soils. Effect of polycyclic aromatic hydrocarbons (PAHs) on plant germination. Org. Geochem. 30, 963-969. [ Links ]
Lee S.H., Ahsan N, Lee K.W., Kim D.H., Lee D.G., Kwak S.S., Kwon S.Y., Kim T.H. y Lee B.H. (2007). Simultaneous overexpression of both Cu Zn superoxide dismutase and ascorbate peroxidase in transgenic tall fescue plants confers increased tolerance to a wide range of abiotic stresses. J. Plant Physiol. 164, 1626-1638. [ Links ]
Liu H., Weisman D., Ye Y., Cui B., Huang Y., Colon-Carmona A. y Wang Z. (2009). An oxidative stress response to polycyclic aromatic hydrocarbon exposure is rapid and complex in Arabidopsis thaliana. Plant Sci. 176, 375-382. [ Links ]
Lloret L. y Martínez-Romero E. (2005). Evolución y filogenia de Rhizobium. Rev. Latinoam. Microbiol. 47, 43-60. [ Links ]
Lundegardh H. y Stenlid G. (1944). On the exudation of nucleotides and flavonone from living roots. Arkiv. Bot. 31A, 1-27. [ Links ]
Matthaus M. (2002). Antioxidant activity of extracts obtained from residues of different oilseeds. J. Agric. Food. Chem. 50, 3444-3452. [ Links ]
Mittler R. (2002). Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7, 405-410. [ Links ]
Møller I.M., Jensen P.E., Hansson A. (2007). Oxidative modifications to cellular components in plants. Annu. Rev. Plant Biol. 58, 459. [ Links ]
Muratova A., Hübner Th., Tischer S., Turkovskaya O., Móder M. y Kuschk P. (2003). Plantrhizosphere-microflora association during phytoremediation of PAH contaminated soil. Int. J. Phytorem. 5, 137-151. [ Links ]
Muratova A., Golubev S., Wittenmayer L., Dmitrieva T., Bondarenkova A., Hirche F., Merbach W. y Turkovskaya O. (2009). Effect of the polycyclic aromatic hydrocarbon phenanthrene on root exudation of Sorghum bicolor (L.) Moench. Environ. Exp. Bot. 66, 514-521. [ Links ]
NAS (1997). Leucaena: Promising forage and tree crop for the tropics. National Academy of Sciences. Washington D.C. 115 p. [ Links ]
Ponce M.A., Scervino J.M., Erra-Balsells R., Ocampo J.A. y Godeas A.M. (2004). Flavonoids from shoots, roots and roots exudates of Brassica alba. Phytochemistry 65, 3131-3134 [ Links ]
Rivera-Cruz M.C., Trujillo-Narcía A., Miranda A. y Maldonado E. (2005). Evaluación toxicológica de suelos contaminados con petróleo nuevo e intemperizado mediante ensayos con leguminosas. Interciencia 30, 326-331. [ Links ]
Salguero A., de la Morena B., Vigara J., Vega J.M., Vilchez C. y León R. (2003). Carotenoids as protective response against oxidative damage in Dunaliella bardawil. Biomol. Engineer. 20, 249-253. [ Links ]
SAS Institute Inc. (2002). The SAS system for windows, ver. 9.0. SAS Institute Inc, Cary, North Carolina, EUA. [ Links ]
Singleton VL. y Rossi J.A. (1965). Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. Amer. J. Enol. Viticul. 16, 144-147. [ Links ]
Song Y.F., Gong P., Zhou Q.X. y Sun T.H. (2005). Phytotoxicity assessment of phenanthrene, pyrene and their mixtures by a soil-based seedling emergence test. J. Environ. Sci. Chin. 17, 580-583. [ Links ]
Soong Y.Y. y Barlow P.J. (2004). Antioxidant activity and phenolic content of selected fruit seeds. Food Chem. 88, 411-417. [ Links ]
Sundaravarathan S. y Kannaiyan S. (2002). Role of plant flavonoids as signal molecules to Rhizobium. En: Biotechnology of biofertilizers (S. Kannaiyan Ed.). Narosa Publishing House, Nueva Delhi, India. pp. 144-164. [ Links ]
Treutter D. (2005). Significance of flavanoids in plant resistance and enhancement of their biosynthesis. Plant Biology 7, 581-591. [ Links ]
Vranova E., Inze D. y Van Breusegem F. (2002). Signal transduction during oxidative stress. J. Exp. Bot. 53, 1227-1236. [ Links ]
Wilson S.C. y Jones K.C. (1993). Bioremediation of soil contaminated with polynuclear aromatic hydrocarbons (PAHs): a review. Environ. Pollut. 80, 229-249. [ Links ]














