Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 no.4 Ciudad de México nov. 2012
Tres dosis inoculantes con Proteus sp en la biodegradación de petróleo crudo
Three Proteus sp inoculant dose in crude oil biodegradation
Marcia Eugenia OJEDA-MORALES1, Miguel Ángel HERNÁNDEZ-RIVERA1, José Gabriel MARTÍNEZ-VÁZQUEZ2*, Laura Lorena DÍAZ-FLORES1 y María del Carmen RIVERA-CRUZ3
1 División Académica de Ingeniería y Arquitectura, Universidad Juárez Autónoma de Tabasco, km. 1 Carretera Cunduacán-Jalpa, Colonia Esmeralda, Cunduacán, Tabasco, México, CP: 86040
2 Facultad de Salud y Ciencias A. F., Universidad Internacional SEK, Ismael Valdés 834, Santiago, Chile, CP 8320000. *Autor responsable; gabrielm81@hotmail.com
3 Colegio de Postgraduados Campus Tabasco, Periférico Carlos A. Molina, km 3, Carretera Cárdenas-Huimanguillo, Cárdenas, Tabasco, México, CP. 86570
Recibido marzo 2011,
aceptado agosto 2012
RESUMEN
Desde hace varias décadas existen en México extensas áreas impactadas por derrames petroleros. La mayoría de las tecnologías de biorremediación actuales utilizan microorganismos para descontaminar sitios con hidrocarburos. En este trabajo se prepararon y evaluaron tres dosis inoculantes de Proteus sp. sobre un suelo arcilla-limoso contaminado con hidrocarburos. Las muestras de suelo se colectaron en el municipio Cunduacán, Tabasco, México. Se determinaron la cantidad de hidrocarburos totales de petróleo (HTP) removidos y la magnitud del desarrollo poblacional microbiano durante el estudio, empleando un diseño experimental tipo factorial 3x3x3: tres concentraciones de HTP (tratamientos T1=50 000 ppm, T2=70 000 ppm, T3=90 000 ppm), tres tiempos de desarrollo del inóculo del microorganismo previos al sembrado en el suelo contaminado (D1=48 h D2=72 h D3=96 h) y tres repeticiones. Los datos fueron analizados con el procedimiento ANOVA y prueba de medias mediante el paquete estadístico SAS-6.0. La dosis que presentó la mayor degradación en un lapso de 90 d fue la D1 en todos los tratamientos: 70.99 % (T1), 75.58 % (T2) y 67.56 % (T3) con poblaciones bacterianas finales de 3.506x103, 4.100x103 y 3.867x103 UFC/g de suelo, respectivamente. Se recomienda preparar el inoculante 48 h antes de ser vertido al suelo arcilla-limoso, contaminado con petróleo crudo tipo Istmo y acondicionado con Triple 17, para realizarle biorremediación.
Palabras clave: biodegradación de hidrocarburos, Proteus sp, dosis inoculante, biorremediación.
ABSTRACT
For several decades have existed in Mexico large areas impacted by oil spills. The majority of current bioremediation technologies use microorganisms to clean up oil sites. In this work, were prepared and evaluated three doses of Proteus sp. inoculants on clay-loam soil contaminated with hydrocarbons. The soil samples were collected in the municipality of Cunduacán, Tabasco, México. We determined the amount of total petroleum hydrocarbons (TPH) removed and the magnitude of population development of microorganisms during the study, using a factorial experimental design 3x3x3: three concentrations of HTP (treatments T1=50 000 ppm, T2=70 000 ppm, T3=90 000 ppm), three times seed development of the microorganism pre-planted in the contaminated soil (D1=48 h D2=72 h D3=96 h) and three replications. The data were analyzed using ANOVA procedure and mean test using the statistical software SAS-6. The dose that showed the highest degradation within 90 d was D1 in all treat-ments: 70.99 % (T1), 75.58 % (T2) and 67.56 % (T3) with late bacterial population 3.506x103, 4.100x103 and 3.867x103 CFU/g of soil, respectively. Therefore, it is recommended to prepare the inoculum 48 h before being discharged into the clay-loam soil contamined with Istmo crude petroleum, and conditioning with Triple 17 in order to perform bioremediation.
Key words: biodegradation of hydrocarbons, Proteus sp, inoculum dose, bioremediation.
INTRODUCCIÓN
En México la explotación de los recursos naturales del estado de Tabasco contribuye de manera notable a la economía nacional, contando con una aportación del 5.7 % al Producto Interno Bruto (PIB) por sus actividades industriales (INEGI 2009), correspondiendo un aporte del 3.7 % al PIB total nacional por la extracción de petróleo crudo de los pozos en tierra en este estado del sureste mexicano (Arias 2010). El total de extracción de petróleo crudo en México en el año 2009 fue de 2.6 millones de barriles diarios, de los cuales el 77.5 % se obtuvieron de las regiones marinas del Golfo de México (Cruz-Serrano 2010), y el 17.3 % fueron extraídos de los pozos en tierra de Tabasco (Hernández 2009). Sin embargo, en lo que respecta a la explotación del petróleo, existen muchas consecuencias relacionadas con la contaminación de los ecosistemas de esta región tropical. México produce tres tipos principales de petróleo crudo: el Maya-22 pesado, que constituye casi la mitad del total de la producción; el Istmo-34 ligero (tipo de petróleo crudo empleado en el presente trabajo), bajo en azufre que representa casi un tercio del total de la producción; y el Olmeca-39 extra ligero, aproximadamente la quinta parte del total de la producción (López 2009). Las fuentes de contaminación más comunes debidas a la explotación del petróleo que impactan grandemente al ambiente son los lodos de perforación de tipo inverso y recorte (Vinalay 1998), los ocasionados por derrames de tuberías corroídas (Atlas y Bartha 2002), los producidos por accidentes y los tiraderos de desechos semisólidos. Es por ello que se deben emplear procesos de descomposición de la materia orgánica por medios químicos o biológicos. Dentro de los últimos, los microorganismos pueden oxidar hidrocarburos y utilizarlos como fuente de energía (Castro-Riquelme 2008, Machín-Ramírez et al. 2010), convirtiéndolos en otros productos menos tóxicos y en metabolitos intermediarios dentro de su metabolismo (Fernández 2002, Madigan et al. 2009).
Por lo anterior, resulta conveniente considerar las técnicas de biorremediación para la restauración de sitios contaminados, las cuales se aplican de acuerdo con las necesidades y recursos con que se cuenten en las zonas impactadas por las actividades de la industria petrolera (Watanabe 2001, Fernández 2002). Las estrategias que emplea la biorremediación del suelo contaminado incluyen el estímulo de los microorganismos indígenas, introduciendo nutrientes y oxígeno en el suelo (bioestimulación) o a través de la inoculación de una cepa o consorcio microbiano mixto enriquecido en la tierra, denominado bioaumentación (Barathi y Vasudevan 2001, Seklemova et al. 2001, D'Annibale et al. 2006, Ogbulie et al. 2010), ofreciendo una manera de proporcionar microorganismos específicos en número suficiente para completar la biodegradación. Los microorganismos tolerantes a este ambiente de estrés, dentro de los que se encuentran un gran número de heterótrofos, producen dióxido de carbono, agua, biomasa y otros productos menos tóxicos, como consecuencia de la oxidación de los hidrocarburos por acción de sus monooxigenasas y dioxigenasas (Adams-Schroeder et al. 2002, Leitão 2009).
Las bacterias, de las cuales dependen en su mayoría los proyectos de biorremediación del sitio de interés, son generalmente capaces de trabajar entre un rango de temperatura alrededor de 7 hasta 32 °C, pero se desempeñan mejor en un rango de 15 hasta 30 °C (Hernández-Rivera et al. 2011). La mayoría de ellas tiene buen funcionamiento en un rango de pH de 6.0 a 8.0, pero frecuentemente se encuentran algunas que trabajan en pH alrededor de 8.5 y también en un pH de 4.5 (Rivera-Cruz et al. 2002, Leitão 2009), lo que no descarta que haya algunas que puedan manifestar un adecuado funcionamiento a otras medidas de pH, incluso las ya conocidas. Los microorganismos necesitan condiciones de humedad y oxígeno adecuadas, la acumulación de agua en el suelo no puede ser menor que el 50 % ni debe ser mayor del 80 % de su capacidad de campo (capacidad que tienen los suelos para mantener la humedad) (Trinidade et al. 2002). La adición de demasiada agua al suelo podría reducir el contenido de oxígeno en el suelo. Frecuentemente manteniendo un contenido de humedad apropiado se tiene un buen control de la cantidad de oxígeno disuelto. La oxigenación en la biorremediación se realiza mediante un mezclado realizado con maquinaria adecuada (Trinidade et al. 2002). Los nutrientes complementarios para el desarrollo de los microorganismos hidrocarbonoclastas (N, P, K, etc.), pueden ser proporcionados y ajustados con nutrientes inorgánicos. Si el contenido de nutrientes llega a ser limitado o exagerado, el funcionamiento de la biorremediación declinaría (Fernández 2002, Fuentes 2008). El potencial metabólico de los microorganismos para degradar petróleo encuentra condiciones favorables de temperatura, nutrientes, pH, oxígeno y humedad en suelos tropicales (Rivera-Cruz et al. 2002).
Los géneros de bacterias degradadoras de hidrocarburos en el suelo son: Achromobacter, Acinetobacter, Actinomyces, Alcaligenes, Micrococcus, Mycobac-terium, Nocordis, Proteus y Pseudomonas (López 2009, Hernández-Rivera et al. 2011). De los géneros de bacterias presentes en diferentes suelos contaminados con petróleo crudo, gasolina y queroseno, las más abundantes fueron Acinetobacter, Aeromonas, Bacillus, Corynebacterium, Flavobacterium y Vibrio (López 2009). La biodegradación de diferentes compuestos poliaromáticos de 2 hasta 4 anillos, entre ellos naftaleno, fenantreno, pireno y fluoranteno se ha alcanzado con porcentajes de degradación de 59.5, 50.9, 63.0 y 89.7 % respectivamente, en un tiempo de 10 d (Rivera-Cruz et al. 2002, Thavasi 2007). La inoculación óptima que permite un tratamiento favorable de sitios contaminados por hidrocarburos, sobre todo de suelos, depende del tipo de microorganismo, del suelo y de varios factores adicionales (Castro-Riquelme 2008, Leitão 2009, Machín-Ramírez et al. 2010), algunos de los cuales tal vez aun no hayan sido esclarecidos con la suficiente rigurosidad.
Por lo anterior, resulta necesario, luego de determinar in vitro el efecto de las variables que favorecen el crecimiento de diversos microorganismos degradadores de hidrocarburos en un tipo de suelo dado, continuar con los estudios en campo para encontrar las condiciones óptimas en la recuperación de suelos contaminados por derrames de petroleros en el estado de Tabasco y en cualquier lugar impactado por las actividades de la industria petrolera.
MATERIALES Y MÉTODOS
El presente estudio se llevó a cabo sobre un suelo del estado de Tabasco en México, empleando como contaminante la fracción pesada del petróleo crudo tipo Istmo, cuyo índice API es de 33.74 (escala arbitraria de densidad propuesta por American Petroleum Institute) (Martínez-Vázquez et al. 2011). La bacteria hidrocarbonoclasta utilizada para la degradación del petróleo crudo fue Proteus sp. El estudio se llevó a cabo cumpliendo cada Norma Oficial Mexicana (NOM) y estadounidense (USEPA), donde correspondió, de manera específica.
Ubicación del área y toma de muestra de suelo
El tipo de suelo utilizado en esta investigación fue un arcilla-limoso, ubicado en el estado de Tabasco. La extensión territorial total del estado es de 24 751 km2 (2 475 100 ha) (Rivera-Cruz 2004). Las muestras se tomaron en el municipio de Cunduacán, México. Se colectaron muestras del suelo, seleccionadas según la Norma Oficial Mexicana NOM-021 (SEMARNAT 2002a). El área de muestreo ocupó una superficie de 10 000 m2 (1 ha). El procedimiento utilizado fue el del metro cuadrado, obteniéndose un total de 70 kg de suelo en 6 puntos de muestreo. Las muestras se mezclaron para homogeneizarlas y obtener una muestra compuesta, posteriormente se guardaron en bolsas de polietileno, se sellaron y se dejaron en refrigeración a 4 °C hasta su uso.
Caracterización y procesamiento de la muestra del suelo
La caracterización de las muestras de suelo implicó los análisis físicos: humedad, densidad y temperatura; y los químicos: pH e hidrocarburos totales de petróleo (HTP), y biológicos: conteo de células viables. Posteriormente se procedió a procesar las muestras colectadas.
La medición del pH se hizo empleando la norma NOM-021 (SEMARNAT 2002c). El análisis biológico se realizó con el método de recuento en placas de células viables por diluciones en serie (Madigan et al. 2009). Se utilizaron diluciones seriadas con base 10 en condiciones estériles, las cuales consistieron en diluir 10 g de suelo en 90 mL de agua, y a continuación con una pipeta estéril se continuó la dilución hasta llegar a 10-6 g de suelo. Se prepararon cajas de Petri por triplicado con su respectivo medio de cultivo agar nutriente (AN) (Ramírez 2001), en seguida se agregó al centro de cada una de las cajas 0.1 mL de las diluciones y se dispersó con una varilla de vidrio por la superficie del AN. Posteriormente, las cajas fueron invertidas y se colocaron en bolsas de plástico previamente desinfectadas con alcohol. A continuación, se incubaron a 28 °C hasta el desarrollo de colonias. Para conocer las poblaciones microbianas se realizaron conteos a las 24 h después de haber sembrado. Se efectuó el conteo de células viables de las unidades formadoras de colonias (UFC), para luego transformarlas a unidades formadoras de colonias por gramo de suelo seco (UFC/g ss), según Madigan et al. (2009).
Las muestras de suelo recolectadas, fueron sometidas a los procesos de secado, trituración, molienda y tamizado de acuerdo con el método indicado por la NOM-021 (SEMARNAT 2002b). Se colocaron las muestras en refrigeración a 4 °C para su posterior contaminación con petróleo.
Diseño experimental de inoculación de la muestra
En esta etapa se procedió a obtener la fracción pesada del petróleo crudo tipo Istmo con el cual se contaminaron las muestras de suelo ya tratadas. A continuación, el suelo tratado se contaminó con el hidrocarburo y luego se acondicionó con los nutrientes necesarios. Por otra parte se preparó el inóculo con Proteus sp. y después se sembró en el suelo contaminado y acondicionado. Posteriormente, se dio seguimiento a la degradación del petróleo crudo efectuada por este microorganismo.
Estabilización del petróleo crudo y establecimiento de los tratamientos conforme al diseño experimental. El petróleo crudo tipo Istmo se estabilizó según la norma NOM-138 (SEMARNAT, 2003a), para tener la fracción pesada (que cubre pesos moleculares mayores de C18), y posteriormente se le determinó su densidad real vía picnómetro (SEMARNAT 2002d). De acuerdo con el diseño experimental de arreglo estadístico factorial 3x3x3, se prepararon 27 unidades experimentales (u.e.) de suelo. El arreglo consistió de tres concentraciones de HTP estabilizado (tratamientos T1 T2 y T3), con las que se contaminaron las u.e. de suelo arcilla-limoso; tres tiempos de desarrollo del inóculo de Proteus sp, previos al sembrado en el suelo contaminado con petróleo (D1 D2 y D3), y tres repeticiones. Esto se desarrolló con los tratamientos: T1, 5x104 miligramos de HTP por cada kg de suelo seco libre de hidrocarburos (mg/kg HTP, 50 000 ppm); T2, 7x104 mg/kg HTP (70 000 ppm) y T3, 9x104 mg/kg HTP (90 000 ppm). Los tiempos: D1, 48 h; D2, 72 h; D3, 96 h y las tres repeticiones para cada tiempo de inoculación. Para cada u.e. se emplearon 1.5 kg de muestra de suelo procesado libre de petróleo, contaminándose con la cantidad de petróleo necesaria de acuerdo al valor de su densidad real y al diseño experimental descrito arriba, por mezclado directo y agitación con espátula.
Acondicionamiento del suelo, elaboración y siembra del inóculo. El acondicionamiento del suelo se hizo agregándole fertilizante Triple 17 (0.908 kg Triple17:1 m3 suelo seco estéril), para proveer los nutrientes necesarios a los microorganismos para su desarrollo (López 2009, Hernández-Rivera et al. 2011), porque contiene los nutrimentos (N, P, K) que promueven una mayor multiplicación de cepas después de las sales puras: Na2HPO4, KH2PO4, NH4Cl, y MgSO4•7H2O (Kâstner et al. 1994). La elaboración del inoculo, se llevó a cabo en un medio mineral líquido donde la única fuente de carbono fue el petróleo crudo, empleándose la cepa bacteriana de Proteus sp., la cual se obtuvo de manera similar a un estudio anterior realizado por nuestro equipo de investigación, donde se demostró que tenía un gran potencial para degradar hidrocarburos derivados de petróleo (Hernández-Rivera et al. 2011). Se prepararon dos soluciones (A y B), como se indica a continuación y se esterilizaron a calor húmedo durante 30 min a 137.895 kPa (20 lb/in2) (López, 2009). Solución A: 0.8 g de KH2PO4, 0.2 g de KH2PO4, 0.1 g de NaCl, 0.0125 g de Na2MoO4•2H2O y 0.1372 g de Na2Fe•EDTA disueltos en 900 mL de agua destilada. Solución B: 0.2 g de MgSO4•7H2O y 1.2 g de CaCl•2H2(CaCO3) disueltos en 100 mL de agua destilada (Rivera-Cruz et al. 2002). Las soluciones A y B se mezclaron en condiciones axénicas y a continuación a esta mezcla se le adicionó la cepa de Proteus sp. (5 mL cepa:1 L mezcla), manteniéndose en aireación con compresor de aire durante los tiempos indicados en el diseño del experimento, hasta su sembrado en el suelo contaminado con hidrocarburos: 48 h (D1), 72 h (D2) y 96 h (D3). Finalmente a cada u.e. de suelo contaminado con hidrocarburos y acondicionado con Triple 17, se le agregó la solución del inóculo bacteriano en la proporción 300 mL:1 kg suelo seco, de acuerdo al modelo estadístico, adicionando agua destilada estéril hasta completar el 50 % de humedad de la capacidad de campo requerido. Posteriormente, se le dio seguimiento al estudio.
Seguimiento del experimento en el laboratorio
El experimento se llevó a cabo durante 90 d, tiempo durante el cual el monitoreo estuvo basado en la medición de pH cada 15 d, realizada con el método de la norma NOM-021 (SEMARNAT 2002c); la medición de temperatura, llevada a cabo todos los días durante el tiempo que duró el estudio; la cuantificación de humedad (SEMARNAT 2003b); la determinación de los HTP cada 15 d (SEMARNAT 2003a, USEPA 1996), y el conteo de células viables cada 15 d por el método de recuento en placas por diluciones en serie, como se indicó previamente. Los datos obtenidos fueron analizados con el procedimiento ANOVA y prueba de medias (Tukey, α≤0.05) mediante el paquete estadístico SAS-6.0. Durante el experimento las u.e. se mantuvieron aireadas y el suelo fue mezclado con una espátula. Para mantener la humedad de las u.e., se agregó agua destilada estéril a cada unidad experimental de suelo. Los análisis correspondientes al seguimiento del experimento en el laboratorio se desarrollaron en las fechas indicadas, tomando 100 g de muestra de cada u.e. y manteniéndolos en refrigeración a 4 °C para su posterior procesamiento por las técnicas referidas.
RESULTADOS
El análisis de textura del suelo mostró: 49 % masa arcilla, 41 % masa limo y 10 % masa arena, dando soporte para clasificarlo como suelo arcilla-limoso. Los resultados de los análisis físicos, químicos y biológicos obtenidos para el suelo en estudio libre de hidrocarburos, señalan una T de 25 °C, 1056.8 kg/m3 como valor de densidad real, 4.0 de humedad, pH con un valor de 6.5 y 5.9x10-2 UFC/g de suelo seco. Asimismo, las mediciones realizadas al petróleo tipo Istmo en su fracción pesada (índice API = 33.74), que fue con el que se contaminó el suelo en estudio, presentaron una temperatura de 30 °C y una densidad real de 0.85 g/mL. Las evaluaciones de los parámetros fisicoquímicos y biológicos del suelo contaminado en las u.e. se realizaron durante 90 d.
Medición de propiedades físicas (humedad, temperatura), químicas (pH, HTP) y biológicas (conteo de células viables)
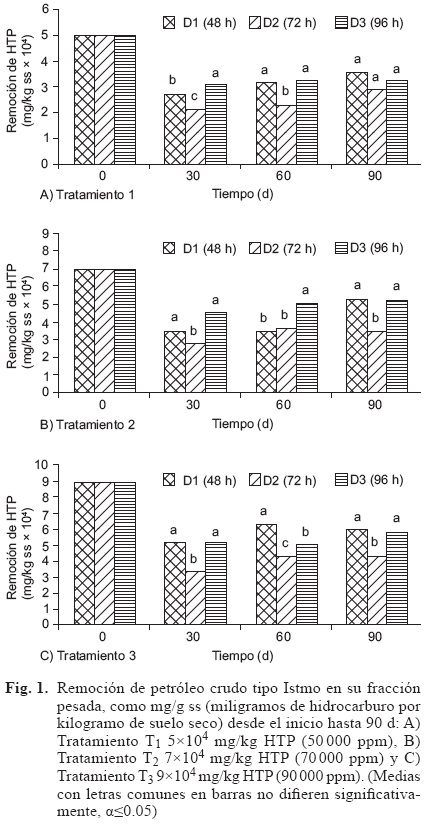
Al inicio del tratamiento, la humedad en las u.e. se ajustó a un valor de 50 % de la capacidad de campo, puesto que los microorganismos requieren condiciones mínimas de humedad para su crecimiento, por lo que se mantuvieron en niveles aceptables recomendados durante todo el tiempo de análisis, es decir, un rango 30-40 % en cada uno de los tratamientos (T1, T2 y T3). En el tiempo que duró el experimento, la temperatura de las u. e. se ubicó en un intervalo de 24 °C a 29 °C en cada uno de los tratamientos. El pH de las se mantuvo en un intervalo entre 6.95 y 7.57 (Madigan et al. 2009), el cual era indispensable para el crecimiento deseado de bacterias. Para controlar el pH en el interior de cada u.e., se agregaron disolución de H2SO4 ó NaOH según se requiriera. En la figura 1 se muestra la remoción de HTP presentes en los tratamientos T, realizada por las diferentes dosis de aplicación de Proteus sp. a los tiempos previos de preparación del inóculo D1 (48 h), D2 (72 h) y D3 (96 h). Mientras que en el cuadro I se indican los porcentajes de remoción de HTP a los 90 días debido a cada inóculo (D), para cada tratamiento.

Las poblaciones bacterianas encontradas a los tiempos t = 0 h de inoculación en cada u.e., como resultado de la siembra de las diferentes dosis de Proteus sp. con tiempos previos de preparación del inoculo D1 (48 h), D2 (72 h) y D3 (96 h), fueron 39 000, 1 210 000 y 350 000 UFC/g ss, respectivamente. La figura 2 indica las poblaciones del microorganismo hidrocarbonoclasta Proteus sp., que se encontraron en los tratamientos T (con las diferentes dosis de aplicación del inóculo), a los tiempos de sembrado de 30, 60 y 90 d.

Así mismo, en el cuadro II se muestra la cuantificación del desarrollo poblacional de Proteus sp como UFC/g ss, a los 90 días debido a cada inóculo (D), para cada tratamiento (T).

DISCUSIÓN
Los estudios realizados al suelo arcilla-limoso previos a su tratamiento, mostraron la presencia de hidrocarburos de tipo vegetal y una baja cantidad de microorganismos, aunque ninguno de los encontrados fue Proteus sp. La información obtenida del suelo tratado junto con las mediciones hechas al petróleo crudo tipo Istmo en su fracción pesada, sirvieron de base para diseñar el experimento de tipo factorial 3x3x3 empleado en la presente investigación.
En el monitoreo de la humedad y la temperatura, la primera es una variable importante que favorece la degradación de contaminantes orgánicos por los microorganismos, por lo cual es importante controlarla (Madigan et al. 2009). Es por ello que durante el desarrollo del presente estudio se mantuvo la humedad en el rango 30-40 % en cada uno de los tratamientos T (T1, T2 y T3), siempre muy cerca de lo señalado por Adams-Schroeder et al. (1999), quien ha reportado que muchas bacterias aerobias trabajan a niveles de humedad entre 40 y 70 % de la capacidad de campo, por lo tanto la humedad mantenida durante los 90 d de monitoreo es aceptable. En el caso de la temperatura, la biorremediación funciona de manera general en un intervalo de aproximadamente 5 a 40 °C, pero el intervalo óptimo para los climas tropicales es aproximadamente de 30 a 35 °C (Rivera-Cruz et al. 2002). La velocidad de degradación aumenta con la temperatura por lo que un incremento de la misma es útil, decreciendo la biodegradación por desnaturalización de las enzimas a temperaturas superiores a 40 °C e inhibiéndose a inferiores 0 °C. En este trabajo se mantuvo la temperatura entre 24 y 29 °C en todas las u.e., intervalo cercano al óptimo en el que crecen la mayoría de los microorganismos (Hernández-Rivera et al. 2011). El pH del suelo puede afectar significativamente la actividad microbiana. El pH de las u.e. se mantuvo en un intervalo de 6.95 a 7.57 es decir, de moderadamente ácido a moderadamente alcalino. El crecimiento de muchos microorganismos normalmente es máximo dentro de un intervalo de pH entre 6.0 y 7.0 (Martínez-Vázquez et al. 2011). En zonas pantanosas, o en algunos suelos ácidos (como los ferrosoles, acrisoles y luvisoles), se puede manejar un pH de 4.0 a 6.0 sin muchos problemas si se utilizan bacterias nativas, pero en la mayoría de los suelos un pH de 6.0 a 8.0 es más adecuado (Fuentes 2008). El efecto del pH en el suelo influye sobre los índices de crecimiento microbiano, como también la solubilidad del fósforo. El pH de las u.e. se mantuvo en condiciones óptimas durante el desarrollo del presente trabajo.
En este estudio se midió la remoción de HTP en el suelo de interés, contaminado con diferentes concentraciones de petróleo crudo (tratamientos T). La remoción fue llevada a cabo por medio del microorganismo hidrocarbonoclasta Proteus sp., a diferentes tiempos de preparación del inóculo de esta bacteria (factor D), previos a su siembra en el suelo contaminado, según el diseño estadístico del experimento. La figura 1A muestra que las concentraciones removidas a los 30 d en T1 (5x104 mg/kg HTP) presentaron diferencias significativas en D3 con respecto a D1 y D2 (r2=0.95, α≤0.05), expresando 3.0992x104, 2.7131x104 y 2.1347x104 mg/kg HTP degradados en el orden que se presentan (30 992, 27 131 y 21 347 ppm respectivamente). A los 60 d, D1 y D3 mostraron diferencias significativas con respecto a D2 (r2=0.97, α≤0.05), encontrando una remoción de 3.1652x104, 3.2117x104 y de 2.2920x104 mg/kg HTP (31 652, 32 117 y 22 920 ppm), correspondientemente. Así mismo, La figura 1A muestra que a los 90 d no se encontró diferencia significativa (r2=0.96, α≤0.05) entre D1, D2 y D3, manifestando concentraciones de 3.5493x104, 2.8901x104 y 3.2097x104 mg/kg HTP degradados (35 493, 28 901 y 32 097 ppm), es decir, un porcentaje de 70.99, 57.80 y 64.19, respectivamente.
De igual forma el análisis de varianza en T2 (7x104 mg/kg de HTP) a los 30 d (Fig. 1B) mostró diferencias significativas (r2=0.80, α≤0.05) en D1 y D3 respecto a D2, siendo la remoción de 3.4803x104, 4.4383x104 y 7.643x104 mg/kg HTP (34 803, 44 383 y 27 643 ppm), en el orden que se presentan. A los 60 d, D3 presentó una diferencia significativa (r2=0.98, α≤0.05) comparado con D1 y D2, encontrando remociones de 5.0507x104, 3.5060x104 y 3.6092x104 mg/ kg HTP (50 507, 35 060 y 36 092 ppm) consecutivamente. Por otro lado, a los 90 d, se encontraron diferencias significativas (r2=0.97, α≤0.05) en D1 y D3 con respecto a D2, obteniendo un valor de remoción de 5.2909x104, 5.2642x104 y 3.4598x104 mg/kg HTP respectivamente (52 909, 52 642 y 34 598 ppm), es decir, del 75.58, 75.20 y 49.43 %.
Por su parte en T3 (9x104 mg/kg de HTP) a los 30 d, los resultados evidenciaron diferencias significativas (r2=0.99, α≤0.05) en D1 y D3 comparado con D2, mostrando una remoción de 5.1222x104, 5.2267x104 y 3.4222x104 mg/kg HTP (51 222, 52 267 y 34 222 ppm) correspondientemente. Posteriormente, a los 60 d D1, D2 y D3 mostraron diferencias significativas en la remoción de HTP (r2=0.98, α≤0.05), encontrándose que fue de 6.3379x104, 4.2953x104 y 5.0437x104 mg/kg HTP (63 379, 42 953 y 50 437 ppm) en el orden que se presentan. Después de 90 d se presentaron diferencias significativas (r2=0.67, α≤0.05) entre D1 y D2 con respecto a D3, con resultados de 6.0808x104, 5.9048x104 y 4.3217x104 mg/kg HTP degradados (60 808, 59 048 y 43 217 ppm), es decir, 67.56, 65.60 y 48.02 % consecutivamente (Fig. 1C).
En cuanto a la eliminación de HTP por Proteus sp. a los 90 d (Cuadro I), los tratamientos T1,2 y 3 ponen de manifiesto que con la aplicación del inoculo a D1 se obtuvieron los mayores porcentajes de remoción, siendo de 70.99, 75.58, y de 67.56 %, respectivamente. Estudios similares al presente, que utilicen el microorganismo hidrocarbonoclasta Proteus sp. como cepa individual, útil para la degradación de hidrocarburos derivados del petróleo en suelos, aun no han aparecido reportados en la literatura. Sólo se ha encontrado una escasa y limitada referencia a su participación en otras condiciones experimentales, formando parte de consorcios microbianos, en biorremediación en efluentes de una planta de fertilizantes adicionados con petróleo (Aldoky y Orugbani 2007). En el mismo contexto, con relación a la especie Proteus, Thavasi et al. (2007), reportaron un 85.15 % de biodegradación de hidrocarburos empleando Proteus aeruginosa, aunque en un medio de sales minerales, no de Triple 17, utilizando agua marina al 75 % como disolvente, con un 0.1 % de petróleo crudo y un tiempo de degradación 7 d, pero no en estudios sobre suelos.
Por otra parte, se determinó la multiplicación de Proteus sp. en el suelo contaminado con la fracción pesada del petróleo tipo Istmo, como UFC/g ss de microorganismo durante todo el tiempo que duraron los tratamientos. El desarrollo poblacional bacteriano a D1, D2 y D3 (empleando los inóculos con tiempos de desarrollo previo de 48 h, 72 h y 96 h, respectivamente), en el tratamiento de suelo contaminado con 5x104 mg/kg HTP (T1), a los 30 d no mostraron diferencias significativas (r2= 0.49, α≤0.05), sin embargo la mayor población fue de 7 127 UFC/g ss (D3). A los 60 d se encontraron diferencias significativas (r2=0.98, α≤0.05) de D2 con respecto a D1 y D3, mostrando que en D2 se obtuvieron 5577 UFC/g ss. Posteriormente a los 90 d no se encontraron diferencias significativas (r2= 0.52, α≤0.05), no obstante la mayor población se presentó al D1 con 3506 UFC/g ss (Fig. 2A). Sin embargo, la figura 2B indica que el T2 manifestó diferencias significativas a los 30, 60 y 90 días en D2 (r230 =0.80, r260=0.85, r290=0.97, 10.05), presentando las poblaciones mayores con valor de 5950, 7276 y 4276 UFC/g ss, respectivamente. Sin embargo para el T3, la figura 2C muestra diferencias significativas a partir de los 30 hasta los 90 d (r230=0.99, r260=0.98, r290=0.67, α≤0.05) en D2, con un crecimiento poblacional de Proteus sp. de 8750, 5863 y 3850 UFC/g ss correspondientemente.
El estudio sobre el crecimiento microbiano muestra que en todos los tratamientos existió un desarrollo poblacional del orden 103 UFC/g ss contaminado con petróleo crudo tipo Istmo, independientemente del factor D, aunque en ningún caso mayor a 9000, y a los 90 d nunca mayor a 4300. Además, en todos los tratamientos a los 90 d hubo una mayor remoción de HTP con D1, resultado que coincide con que para cada tratamiento se generó la mayoría poblacional de Proteus sp. en D1, aunque sólo para T1 y T3 (Cuadro II). Asimismo, la evaluación de la aplicación del inóculo a los 90 d en los tratamientos T1, T2 y T3, aparentemente presentó algunas irregularidades, puesto que comparando el porcentaje de remoción con la cantidad poblacional del microorganismo en D3 para T1 y T2, se observó que con la misma cantidad de microorganismos, se obtuvieron porcentajes distintos de degradación de hidrocarburos (64.19 % en T1 y 75.20 % en T2), siendo menor en T1, y en la comparación de D1 y D2 al T2, a pesar de que existe una mayor población en D2, en D1 hubo un mayor porcentaje de remoción (Cuadro II). Estas observaciones están de acuerdo con lo reportado por Quiñones (2002) y Morales-Guzmán (2007), quienes han mencionado que no necesariamente existe una relación directa entre una población microbiana relativamente numerosa y una mayor degradación debido a que en el sistema existen microorganismos que no son hidrocarbonoclastas. Esto pudo deberse a probabilidad de que en el proceso de preparación del inóculo con Proteus sp., un porcentaje de microorganismos no hayan desarrollado el mismo grado de capacidad hidrocarbonoclasta por no haber tenido la oportunidad de estar en contacto con las cantidades adecuadas de nutrientes con las que se acondicionó el suelo.
CONCLUSIONES
En el presente estudio se evaluó la biodegradación de petróleo crudo sobre un suelo arcilla-limoso contaminado, empleando como criterio la cuantificación de la remoción de hidrocarburos totales de petróleo (HTP) a diferentes períodos de tiempo. Se encontró que en el tratamiento T1(contaminado con 5x104 mg/kg HTP, 50 000 ppm), la dosis con Proteus sp. que presentó la mayor degradación en un lapso de 90 d fue la elaborada D1 (con un tiempo de preparación del inóculo de 48 h, previo a su siembra en las u.e.), puesto que mostró un 70.99 % de remoción de hidrocarburos, con una población bacteriana final de 6100 UFC/g de suelo. A los 90 d el tratamiento 2 (suelo contaminado con 7x104 mg/kg HTP, 70 000 ppm), presentó la remoción más alta (75.58 %), empleando el inóculo elaborado D1, con una producción de 2900 UFC/g de suelo al final del estudio. Asimismo, en el tratamiento 3 (suelo contaminado con 9x104 mg/kg HTP, 90 000 ppm), hubo una mayor eficiencia con D1 a los 90 d, con un 67.56 % de remoción de HTP y un desarrollo poblacional de Proteus sp de 2950 UFC/g de suelo. Es por ello que, a fin de llevar a cabo una biorremediación por bioaumentación sobre un suelo arcilla-limoso contaminado con petróleo crudo tipo Istmo, utilizando un inóculo a base de Proteus sp., se recomienda preparar el inoculante 48 h antes de ser vertido al suelo acondicionado con el fertilizante Triple 17.
AGRADECIMIENTOS
Este estudio forma parte del proyecto POA-2008011, "Determinación de los Parámetro Optimos de Crecimiento para la Producción de Biomasa Bacteriana y Fúngica Hidrocarbonoclasta", desarrollado por la División Académica de Ingeniería y Arquitectura (DAIA) de la Universidad Juárez Autónoma de Tabasco (UJAT), con financiamiento parcial por parte de la empresa Corporativo de Servicios Ambientales S.A. de C.V. (CORSA). Los autores agradecen a la DAIA de la UJAT por el apoyo para llevar a cabo el presente trabajo de investigación, al Ing. Alfredo Castro Betancourt, Gerente General de CORSA S.A de C.V. por la gestión del financiamiento otorgado al proyecto, y al señor Mauricio Kohan Rubio, Decano de la Facultad de Salud y Ciencias A. F. de la Universidad Internacional SEK y a la Dra. Verona Barrella Pécori, por las facilidades otorgadas para la organización y conclusión del presente documento.
REFERENCIAS
Adams-Schroeder R.H., Domínguez-Rodríguez VI. y García-Hernández L. (1999). Potencial de la biorremediación de suelo y agua impactados por petróleo en el trópico mexicano. Terra Latinoam. 17, 159-174. [ Links ]
Adams-Schroeder R.H., Domínguez-Rodríguez V.I. y Vinalay-Carrillo L. (2002). Evaluation of microbial respiration and ecotoxicity in contaminated soils representative of the petroleum producing region of southeastern México. Terra Latinoam. 20, 253-265. [ Links ]
Aldoky A. y Orugbani T. (2007). Removal of crude petroleum hydrocarbons by heterotrophic bacteria in soils amended with nitrogenous fertilizer plant effluents. Afr. J. Biotechnol. 6, 1529-1535. [ Links ]
Arias S. (2010). Desarrollo económico de Tabasco. Tabasco hoy. http://www.tabascohoy.com.mx/noticia.php?id_nota=190648. 07/10/2010. [ Links ]
Atlas R.M. y Bartha R. (2002). Ecología microbiana y microbiología ambiental. 4a ed. Addison Wesley, Madrid, 677 pp. [ Links ]
Barathi S. y Vasudevan N. (2001). Utilization of petroleum hydrocarbons by Pseudomonasfluorescens isolated from a petroleum-contaminated soil. Env. Int. 26, 413-416. [ Links ]
Castro-Riquelme Y. (2008). Estudios de toxicidad y bio-degradación de hidrocarburos modelo en H. F. Tesis de Maestría en Biotecnología. Universidad Autónoma Metropolitana, México, D.F., 90 pp. [ Links ]
Cruz-Serrano N. (2010). Pemex, tercera petrolera en el mundo en 2009. El Universal. http://www.eluniversal.com.mx/finanzas/80420.html. 07/10/2010. [ Links ]
D'Annibale A., Rosetto F., Leonardi V., Federici F. y Petruccioli M. (2006). Role of autochthonous filamentous fungi in bioremediation of a soil historically contaminated with aromatic hydrocarbons. Appl. and Environmental Microbiol. 72, 28-36. [ Links ]
Fernández L.L. (2002). Tecnologías de biorremediación en suelos. En: La edafología y sus perspectivas al siglo XXI. Tomo II (R. Quintero-Lizaola, T. Reyna-Trujillo, L. Corlay-Chee, A. Ibáñez-Huerta, N. E. García-Calderón, Eds.). Colegio de Postgraduados, Universidad Nacional Autónoma de México-Universidad Autónoma Chapingo, Montecillo, Estado de México, pp: 700-705. [ Links ]
Fuentes D.I. (2008). Evaluación de la velocidad de degradación del petróleo en un suelo utilizando microorganismos y vermicomposta. Tesis de Ingeniería Química. División Académica de Ingeniería y Arquitectura, Universidad Juárez Autónoma de Tabasco. Tabasco, México, 67 pp. [ Links ]
Hernández E.C. (2009). Innovación tecnológica base para extracción de petróleo. Milenio Tabasco. http://www.skyscrapercity.com/showthread.php?t=634607&page=18 07/10/2010 [ Links ]
Hernández-Rivera M.A., Ojeda-Morales M E., Martínez-Vázquez J.G., Villegas-Cornelio V y Córdova-Bautista Y. (2011). Optimal parameters for the develop of the hydrocarbonoclastic microorganism Proteus sp. J. Soil Sci. Plant Nutr. 11, 29-43. [ Links ]
INEGI (2009). Comunicado Núm. 203/09. Instituto Nacional de Estadística y Geografía Aguascalientes, México, 10 pp. [ Links ]
Kâstner M., Breuer-Jammali M. y Mhro B. (1994). Enumeation and characterization of the soil sites to mineralize polycyclie aromatic hidrocarbons. Appl. Microbiol. Biot. 41, 267-273. [ Links ]
Leitão A.L. (2009). Potential of Penicillium Species in the Bioremediation Field. Int. J. Environ. Res. Public Health. 6, 1393-1417. [ Links ]
López H.L.L. (2009). Optimización de los parámetros de Temperatura, pH y nutrientes para la producción de biomasa bacteriana y fúngica degradadora de petróleo. Tesis de Ingeniería Química. División Académica de Ingeniería y Arquitectura, Universidad Juárez Autónoma de Tabasco, Tabasco, México, 75 pp. [ Links ]
Machín-Ramírez C., Morales D., Martínez-Morales F., Okoh A.I. y Trejo-Hernández M.R. (2010). Benzo[a] pyrene removal by axenic- and co-cultures of some bacterial and fungal strains. Inter. Biodeter. Biodegr. 64, 538-544. [ Links ]
Madigan M.T., Martinko J.M., Dunlap P.V. y Clark D.P. (2009). Broca. Biología de los microorganismos. 12a ed. rev. y aum. Pearson, Addison Wesley, Madrid, Cap. 5, 117-173. [ Links ]
Martínez-Vázquez J.G., Hernández-Rivera M.A., Ojeda-Morales M.E. y García-Marín M.J. (2011). Condiciones ambientales y de nutrientes óptimos para el desarrollo del microorganismo hidrocarbonoclasta Penicillium sp. in vitro. Akadémeia 9, 97-112. [ Links ]
Morales-Guzmán G. (2007). La fitorremediación de suelos contaminados con petróleo mediante la utilización de la planta de arroz (Oriza Sativa L.). Tesis de Maestría en Ciencias. Colegio de Postgraduados en Ciencias Agrícolas, H. Cárdenas, Tabasco, México, 204 pp. [ Links ]
Ogbulie T.E., Nwigwe H.C., Iwuala M.O.E. y Okpokwasili G.C. (2010). Study on the use of monoculture and multispecies on bioaugumentation of crude oil contaminated agricultural soil. Nigerian J. Microbiol. 24, 2160-2167. [ Links ]
Quiñones A.E.E. (2002). El sistema rizosférico del maíz (Zea mayz L.) en la biorremediación de suelos contaminados con petróleo. Tesis Maestría en Ciencias. Colegio de postgraduados, Montecillos, Texcoco, Edo. de México, 268 pp. [ Links ]
Ramírez G.R. (2001). Manual de Prácticas de Microbiología General. Facultad de Química, UNAM, México 257 pp. [ Links ]
Rivera-Cruz M.C., Ferrera-Cerrato R., Rodríguez-Vásquez R. y Fernández-Linares L. (2002). Adaptación y selección de microorganismos autóctonos en medios de cultivo enriquecidos con petróleo crudo. Terra Latinoamer. 20, 423-444. [ Links ]
Rivera-Cruz M.C. (2004). Clasificación de suelos tropicales influenciados por derrames de petróleo en Tabasco. Tecnociencia Universitaria 3, 7-25. [ Links ]
Seklemova E., Pavlova A. y Kovacheva K. (2001). Biostimulation based bioremediation of diesel fuel: Field demonstration Biodegradation 12, 311-316. [ Links ]
SEMARNAT (2002a). Norma Oficial Mexicana NOM-021-RECNAT-2000. Apartado 6.1. Evaluación de la conformidad para muestreo de suelos. Muestreo para determinar fertilidad de suelos. Diario Oficial de la Federación, Segunda Sección. Diciembre de 2002. [ Links ]
SEMARNAT (2002b). Norma Oficial Mexicana NOM-021-RECNACT-2000. Apartado 7.1.1. Método AS-01. Preparación de la muestra de suelo. Diario Oficial de la Federación, Segunda Sección. Diciembre de 2002. [ Links ]
SEMARNAT (2002c). Norma Oficial Mexicana NOM-021-RECNACT-2000 Apartado 7.1.2. Método AS-02. Determinación del pH del suelo medido en agua. Diario Oficial de la Federación, Segunda Sección. Diciembre de 2002. [ Links ]
SEMARNAT (2002d). Norma Oficial Mexicana NOM-021-RECNACT-2000. Apartado 7.1.4. Método AS-04. Determinación de la densidad real con el picnómetro. Diario Oficial de la Federación, Segunda Sección Diciembre de 2002. [ Links ]
SEMARNAT (2003a). Norma Oficial Mexicana NOM-138-SEMARNAT-2003. Apartado A.3. Determinación de hidrocarburos de la fracción pesada. Diario Oficial de la Federación, Primera Sección. Noviembre de 2004. [ Links ]
SEMARNAT (2003b). Norma Oficial Mexicana NOM-138-SEMARNAT-2003. Método: NMX-AA-052. Determinación de la humedad del suelo. Diario Oficial de la Federación, Primera Sección. Marzo de 2005. [ Links ]
Thavasi R., Jayalakshmi S., Radhakrishnan R. y Balasubramanian T. (2007). Plasmid incidence in four species of hydrocarbonoclastic bacteria isolated fron oil pollued marine environment. Biotechnology 6, 349-352. [ Links ]
Trinidade P., Sobral L. G., Rizzo A. C., Leite S. G. F., Lemons J. L. S., Milloili V.S. y Soriano A.U. (2002). Evaluation of the biostimulation and bioaugmentation techniques in the bioremediation process of petroleum hydrocarbon contaminated soils. 9th International Petroleum Environmental Conference, IPEC (Integrated Petroleum Environmental Consortium), Alburqueque, NM, 15 pp. [ Links ]
USEPA (1996). EPA-Method-3540C. Soxhlet Extraction. Hidrocarburos totales del petróleo (fracción pesada). United States Environmental Protection Agency. Manual. Washington, DC, 3 pp. [ Links ]
Vinalay C.L. (1998). Diagnóstico sobre el manejo y disposición de lodos de perforación en la zona lacustre Julivá-Santa Anita, Tabasco, México. Tesis Ingeniería Ambiental. Universidad Juárez Autónoma de Tabasco, Tabasco, México, 73 pp. [ Links ]
Watanabe K. (2001). Microorganisms relevant to bioremediation. Curr. Opin. Biotech. 12, 237-241. [ Links ]














