Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 n.3 Ciudad de México Aug. 2012
Artículos
Metabolismo del azufre de aislados bacterianos provenientes de un humedal artificial empleado para el tratamiento de efluentes de la industria curtidora
Sulfur metabolism in bacterial isolates from a constructed wetland used for treating tannery industrial wastewater
Juan Ramiro PACHECO AGUILAR1*, María MALDONADO VEGA2 y Juan José PEÑA CABRIALES1
1 Laboratorio de Microbiología Ambiental. Departamento de Biotecnología y Bioquímica. Centro de Investigación y Estudios Avanzados del Instituto Politécnico Nacional (CINVESTAV-IPN). Km. 9.6. Libramiento Norte, carretera Irapuato-León. Apdo. Postal 629, C.P. 36500. Irapuato, Gto. México *Autor responsable; juanramiro29@yahoo.com.mx
2 Laboratorio de Investigación Ambiental. Centro de Innovación en Tecnologías Competitivas, CIATEC A.C. Omega 201, Fracc. Industrial Delta. C.P. 37545, León Gto. México
Recibido marzo 2011,
aceptado abril 2012
RESUMEN
Los humedales artificiales constituyen una alternativa para el tratamiento de efluentes, donde los procesos biológicos de oxidación originados por la rizósfera de las plantas y los microorganismos presentes in situ, contribuyen para la remoción de contaminantes. En el presente trabajo se caracterizó el metabolismo del azufre (S) de diez bacterias pertenecientes a los géneros Acinetobacter, Alcaligenes, Ochrobactrum y Pseudomonas, las cuales fueron aisladas de un humedal construido para el tratamiento de efluentes con alto contenido de materia orgánica (demanda bioquímica de oxígeno: DBO5 1320 mg/L) y sulfuros (54 mg/L) provenientes de la industria del curtido de piel. Los ensayos bioquímicos indican que todos los aislados pueden emplear alguna especie de S como azufre elemental (S0), tiosulfato (S2O62-) o sulfuro (S2-) como única fuente de S. También se encontró que las cepas del género Pseudomonas fueron las más versátiles, ya que oxidan el S2- (2 mM) y S2O62- (4 mM) transformándolos a S0 y tetrationato (S4O62-), respectivamente, mientras que las cepas de Acinetobacter sólo oxidan el S0 a S2O62-. También se observó que las cepas de los géneros Alcaligenes y Ochrobactrum oxidan el S2O62- (4 mM) a S4O62-. La actividad de estos microorganismos a través del sistema de tratamiento y la integración de sus metabolismos podrían participar activamente en la remoción de sulfuros.
Palabras clave: oxidación, sulfuro (S2-), azufre elemental (S0), tiosulfato (S2O62), tetrationato (S4O62-), Acinetobacter, Alcaligenes, Ochrobactrum, Pseudomonas.
ABSTRACT
Constructed wetlands are an alternative for the treatment of effluents where biological oxidation processes caused by the rhizosphere of plants and microorganisms present in situ, contribute to the removal of contaminants. In the present work, we characterized the sulfur (S) metabolism of ten bacteria belonging to the genera Acinetobacter,Alcaligenes, Ochrobactrum and Pseudomonas, which were isolated from a wetland constructed for the treatment of effluents with high organic matter content (biochemical oxygen demand: BOD5 1320 mg/L) and sulfides (54 mg/L) from the leather tanning industry. Biochemical assays indicate that all the isolates can use some sulfur species such as elemental sulfur (S0), thiosulfate (S2O62-) or sulfide (S2-) as the sole source of S. We also found that strains of Pseudomonas genus were the most versatile base on the fact that they oxidize S2- (2 mM) and S2O62- (4 mM) transforming them to S0 and tetrathionate (S4O62-), respectively, whereas Acinetobacter strains only oxidize S0 to S2O62-. We also found that the strains of the genera Alcaligenes and Ochrobactrum oxidize S2O62- (4 mM) to S4O62-. The activity of these microorganisms through the treatment system and the integration of their metabolism might actively participate in the removal of sulfur compounds.
Key words: Oxidation, sulfide (S2-), elemental sulfur (S0), thiosulfate (S2O62-), tetrathionate (S4O62-), Acinetobacter, Alcaligenes, Ochrobactrum, Pseudomonas.
INTRODUCCIÓN
Los humedales artificiales son sistemas construidos con base en el principio de los humedales naturales, donde el agua y el suelo proveen las características principales para el desarrollo de las plantas y microorganismos, actuando como biofiltros, removiendo sedimentos y contaminantes de los efluentes a través de esta tecnología (Stottmeister et al. 2003). Estos sistemas biológicos son considerados versátiles debido a su alta eficiencia para tratar efluentes de la industria eléctrica y minera contaminados con metales como el selenio (Se), arsénico (As), boro (B), zinc (Zn), plomo (Pb) y fierro (Fe) (O'sullivan et al. 1999, Ye et al. 2003). También se ha reportado su empleo para la degradación de contaminantes orgánicos provenientes de efluentes domésticos, de la industria química y de los alimentos (Rivera et al. 1997, Philippi et al. 1999, Da Motta et al. 2001, Kao et al. 2001, Larsen et al. 2001, Haberl et al. 2003). Pacheco et al. (2008) reportan la construcción de un sistema de humedales para tratar los efluentes generados por la industria del curtido, observando que la demanda química de oxígeno (DQO: 17 520 mg/L), demanda bioquímica de oxígeno (DBO5: 1320 mg/L), cromo total (Cr: 31 mg/L), nitrógeno total (NTK: 267 mg/L), sulfatos (SO42-: 2518 mg/L) y sulfuros (HS-: 54 mg/L), fueron reducidos en un 98, 95, 99, 94, 92 y 99 %, respectivamente, en el efluente final.
La actividad de las poblaciones microbianas es determinante durante el tratamiento por humedales. Algunos procesos microbianos que han sido identificados incluyen la desnitrificación, sulfato-reducción, sulfoxidación y la oxido-reducción de metales (Da Motta et al. 2001, Stottmeister et al. 2003, Lloyd et al. 2004, Whitmire y Hamilton 2005). Particularmente la degradación anaerobia de la materia orgánica y la sulfato-reducción aunado a los sulfuros provenientes del proceso del curtido, generan efluentes con alto contenido de sulfuros de hasta 54 mg/L, los cuales resultan tóxicos para la vida acuática (Bagarinao y Vetter 1989). Sin embargo, dentro de la ecología microbiana también han sido identificadas poblaciones bacterianas sulfoxidantes (BSO), las cuales reoxidan el sulfuro formado. Algunas reacciones de oxidación del S identificadas en microorganismos, indican la transición de las siguientes especies químicas: S2-(sulfuro) → S0 (S elemental) → SO32- (sulfito) → SO42- (sulfato), aunque los intermediarios pueden interaccionar químicamente, haciendo la ruta más compleja, tal es el caso de la formación del tiosulfato (S2O32-), el cual se forma por la combinación química del S0 y el SO32-, este compuesto también puede ser oxidado por microorganismos a tetrationato (S4O62-) a través de la siguiente reacción general: S0 + SO32-→ S2O32- → S4O62- (Suzuki 1999).
Los géneros microbianos sulfoxidantes más estudiados incluyen especies de los géneros de Thio-bacillus, Thiomicrospira, Thermothrix, Thiothrix y Beggiatoa (Greene et al. 2003, Beller et al. 2006, Syed et al. 2006). En el humedal construido para el tratamiento de efluentes provenientes de la industria del curtido, fueron obtenidos diez aislados bacterianos creciendo en el medio de cultivo Thiobacillus B para microorganismos sulfoxidantes, los cuales fueron identificados por análisis del gen 16S ribosomal, pertenecientes a los géneros Acinetobacter, Alcaligenes, Ochrobactrum y Pseudomonas. El objetivo del presente estudio fue determinar las capacidades de estos aislados bacterianos para metabolizar especies reducidas del S.
MATERIALES Y MÉTODOS
Aislados bacterianos
Los aislados de estudio (depositados en el cepario del Laboratorio de Microbiología Ambiental en el Departamento de Bioquímica y Biotecnología del CINVESTAV campus Guanajuato) fueron obtenidos del humedal construido en la tenería "La Europea" en León, Gto., e identificados por el análisis del gen ribosomal 16S. Cuatro aislados pertenecen al género Pseudomonas (A11, A12, A14 y B12), tres aislados al género Alcaligenes (C11, C14 y C15), dos al género Acinetobacter (E1 y E2) y uno al género Ochrobactrum (D11) (Pacheco et al. 2008).
Oxidación de compuestos reducidos de S
Para la caracterización bioquímica de oxidación de fuentes reducidas de S, se empleó el medio líquido de cultivo modificado Thiobacillus B reportado por Leduc (1999), el cual contiene (g/L): 2.9 citrato de sodio, 3.0 KH2PO4, 2.0 KNO3, 0.1 NH4Cl, 0.1 MgCl2, 0.1 CaCl2, 0.2 Fe(NH4)(SO4)2.6H20 y 0.05 MgSO4.7H2O, ajustado a pH 7.0. Como fuente reducida de S se utilizó tiosulfato de sodio 20 mM, S elemental 1 % o sulfuro de sodio 2 mM. Todos los ensayos fueron inoculados a una densidad de 1 x 106 células/mL (densidad óptica 0.01) e incubados en agitación a 150 rpm por 72 h, a 28 °C. Al término de la incubación, la densidad óptica fue medida y el S0, SO32-, S2O32- y S4O62- fueron analizados. El ensayo de oxidación de S2- fue llevado a cabo bajo condiciones anaerobias, cuantificando en el medio, la disminución del S2- y la reducción de nitratos (NO3–) a nitritos (NO2–).
Fuentes reducidas de S
Para determinar la capacidad de los aislados para utilizar S0 o S2O32- como única fuente de S, se empleó el medio modificado Thiobacillus B, sustituyendo el MgSO4 por MgCl2, y utilizando S elemental (1 %) o tiosulfato de sodio (20 mM) (Rosseti et al. 2003).
TÉCNICAS DE ANÁLISIS
Sulfuros
La cuantificación de S2- se llevó a cabo mediante la formación del complejo de azul de metileno con sulfato de N', N dimetil -p-fenilendiamina, en presencia de FeCl3, el cual fue medido a 665 nm (Rodier 1981).
Tiosulfato y tetrationato
El S2O32- y S4O62- fueron cuantificados como tiocianato (SCN-) por medio de la reacción de cia-nólisis con KCN en presencia de CuCl2, el producto formado fue medido a 460 nm. Para discriminar el SCN- formado a partir del S4O62-, la muestra fue incubada por 30 minutos con KCN y NH4OH previo a la adición de CuCl2 (Masau 1999).
Azufre elemental
El S0 fue extraído del medio de cultivo con éter de petróleo y posteriormente llevado a cianólisis con NaCN en acetona, el producto final fue medido a 460 nm (Masau 1999).
Sulfito
Este método está basado en la formación de un complejo colorido generado por la p-rosanilina y el formaldehído, en presencia de tetracloromercurato (II), el producto fue medido a 554 nm (Masau 1999).
RESULTADOS
Los resultados de los ensayos de oxidación se presentan en el cuadro I. La mayoría de los aislados mostraron crecimiento en el medio Thiobacillus B con S0. Sólo en el medio donde crecieron los aislados pertenecientes al género de Acinetobacter (E11 y E12) se encontró S2O32- como especie oxidada. La formación de SO32- y la combinación con S0 probablemente formaron S2O32-, el cual no fue oxidado, acumulándose en el medio de cultivo como ha sido reportado por Suzuki (1999). De la misma manera, todos los aislados crecieron en medio Thiobacillus B con tiosulfato de sodio (20 mM), detectándose en los medios de cultivo S4O62- como producto de oxidación, con excepción donde crecieron los aislados del género Acinetobacter. En ninguno de los ensayos de oxidación de especies reducidas de S se encontró SO42-, ni hubo acidificación del medio. El pH final fluctuó entre 7.2 - 8.8, siempre más alcalino que el pH inicial, debido probablemente a la formación de hidróxido (OH-) durante las reacciones de oxidación del tiosulfato: 4Na2S2O3 + 2H2O + O2 → 2Na2S4O6 + 4NaOH (Mason y Kelly 1988, Suzuki 1999).
En relación a la oxidación de S2-, sólo fue detectada la disminución en la concentración en el medio de cultivo donde se inocularon los aislados A11, A12, A14 y B12 pertenecientes al género Pseudomonas (Cuadro II). No se detectó alguna especie oxidada del S, por lo que pudieron haber utilizado el S2- como fuente de S (Okada et al. 1982) o haberlo oxidado a S0 intracelular (Chung et al. 1997). Este ensayo fue llevado en condiciones anaerobias por lo que se empleó NO3- como aceptor alterno de electrones durante el consumo de S2-. La cinética de la disminución en la concentración de S2- y NO3-, así como la producción de NO2- se muestra en la figura 1. Los resultados muestran que alrededor de las 70 h el sulfuro había sido completamente metabolizado por los aislados A11, A12 y A14.

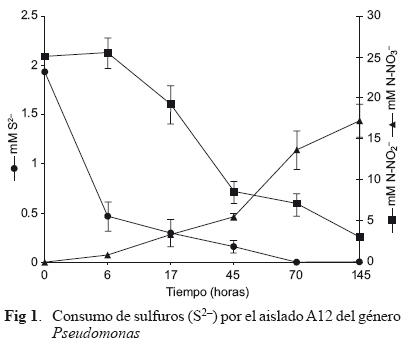
El S0 y S2O32- fueron metabolizados como única fuente de S por todos los aislados, en términos de crecimiento bacteriano determinado por un aumento en la densidad óptica. Sin embargo, este aumento no estuvo correlacionado con el consumo de S2O32-, también pudo detectarse la acumulación de S4O62-como especie oxidada del S2O32- (Cuadro III). La diferencia en la producción de S4O62- entre los aislados pudo deberse a la presencia de SO32-, producto de la acción enzimática de la rodanasa sobre el S2O32-, el SO32- actúa como inhibidor del sistema enzimático (S-oxidante dependiente del citocromo c) que lleva a cabo la oxidación de S2O32- a S4O62- (Suzuki 1999, Sekowska et al. 2000). En los ensayos realizados con Acinetobacter (E11 y E12) creciendo en tiosulfato de sodio, no se detectó S4O62-, el crecimiento mínimo observado en el aislado E12 probablemente se debió por el consumo de S2O32- en cantidades no detectables por el método analítico.
DISCUSIÓN
La presencia de plantas en humedales construidos promueve procesos químicos y biológicos en la zona de la rizósfera que participan en la mejora de la calidad de los efluentes, mediante la oxidación de compuestos orgánicos e inorgánicos (Stubner et al. 1998, Baptista et al. 2003). La actividad microbiana aerobia sulfoxidante es dependiente de la rizósfera o de aceptores alternos de electrones como NO3-, Fe3+ o Mn4+ cuando ocurre en sedimentos bajo condiciones anaerobias (Stubner et al. 1998, Eckord etal. 2002, Leduc 1999).
La participación de los géneros bacterianos de los aislados de estudio en el ciclo del S ha sido previamente reportada, tal es el caso de Pseudomonas, género cosmopolita, el cual ha sido aislado de suelos, de reactores empleados en tratamiento de efluentes y hasta de respiraderos marinos. Su metabolismo incluye la oxidación de S2- a S0 y de S2O32- a S4O62-, además del uso de dimetil sulfuro (DMS) como fuente de S al igual que Acinetobacter (Ruby et al. 1981, Chung et al. 1996, Fuse et al. 2000, Okabe et al. 2005).
La degradación de compuestos organosulfurados como los bencensulfonatos, ha sido ampliamente estudiada en bacterias del género Alcaligenes, debido a que pueden emplearlos como fuente de C y S (Cook et al. 1999). Ochrobactrum es un género que se ha encontrado presente en la ecología microbiana de lodos activados de reactores anaerobios sulfoxidantes, con capacidades de oxidación de S2- a S0 o a SO42- (Mahmood et al. 2009).
Todos los aislados de este estudio pueden utilizar S2-, S0 o S2O32- como fuente de S y como producto de la oxidación de S2O32-, acumulan S4O62- sin la producción de SO42-. Las poblaciones sulfoxidantes formadoras de S4O62- están presentes en diversos ambientes como suelos, lagos sódicos, biorreactores y sedimentos marinos (Podgorsek e Imhoff 1999, Sorokin 2003).
El papel del S4O62- dentro del ciclo del S ha sido descrito por Sorokin et al. (1996) en la cepa Catenococcus thiocyclus LMD 92.12. Ensayos en medios de cultivo muestran que el S4O62- producido por la oxidación biológica del S2O32-, promueve la oxidación química de S2- hacia S0 cuando se adiciona S2- al medio. La cepa reoxida el S2O32 a S4O62-, y de esta manera se oxida más S2-. Este mecanismo acopla reacciones químicas y biológicas que pudieran ocurrir también en el humedal en estudio. De esta manera, los géneros de Pseudomonas, Alcaligenes y Ochrobactrum pudieran estar llevando a cabo la oxidación indirecta de S2- de la misma manera que Catenococcus thiocyclus, mientras que el S0 producido pudiera ser oxidado a S2O32- por Acinetobacter (Podgorsek et al. 2004). La figura 2 muestra el ciclo del S propuesto por Sorokin et al. (1996) adaptado con los aislados microbianos del presente estudio.
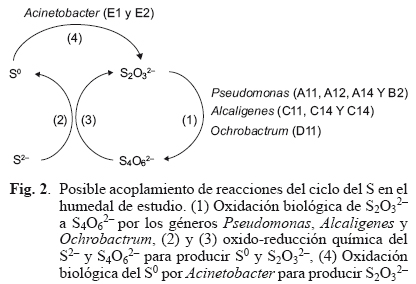
CONCLUSIONES
Los resultados en el presente trabajo indican que las poblaciones microbianas sulfoxidantes presentes en el humedal poseen capacidades diversas para metabolizar compuestos reducidos de azufre por asimilación y oxidación pudiendo participar en la mejora de la calidad de los efluentes. El conocimiento y mantenimiento de estas poblaciones es necesario para el adecuado funcionamiento del humedal.
REFERENCIAS
Bagarinao T. y Vetter R.D. (1989). Sulfide tolerance and detoxification in shallow-water marine fishes. Mar. Biol. 103, 291-302. [ Links ]
Baptista J. D.C., Donnelly T., Rayne D. y Davenport R.J. (2003). Microbial mechanisms of carbon removal in subsurface flow wetlands. Wat. Sci. Tech. 48, 127-134. [ Links ]
Beller H.R., Letain T.E., Chakicherla A., Kane S. R., Legler T. C. y Coleman M. A. (2006). Whole-genome transcriptional analysis of chemolithoautotrophic thio-sulfate oxidation by Thiobacillus denitrificans under aerobic versus denitrifying conditions. J. Bacteriol. 188, 7005-7015. [ Links ]
Chung Y.C., Huang C. y Tseng C.P. (1996). Biodegradation of hydrogen sulfide by a laboratory-scale immobilized Pseudomonas putida CH11 biofilter. Biotechnol. Prog.12, 773-778. [ Links ]
Chung Y.C., Huang C. y Tseng C.P. (1997). Removal of hydrogen sulphide by immobilized Thiobacillus sp. strain CH11 in a biofilter. J. Chem. Tech. Biotechnol. 69, 58-62. [ Links ]
Cook A. M., Laue H. y Junker F. (1999). Microbial desul-fonation. FEMS Microbiol. Rev. 22, 399-419. [ Links ]
Da Motta M.D.M.L., Leite G.R. y Giovannini S. G.T. (2001). Performance of two macrophyte especies in experimental wetlands receiving variable loads of anaerobically treated municipal wastewater. Wat. Sci. Tech. 44, 311-316. [ Links ]
Eckford R.E. y Fedorak P.M. (2002). Planktonic nitrate-reducing bacteria and sulfate-reducing bacteria in some western Canadian oil field waters. J. Ind. Microbiol. Biotechnol. 29, 83-92. [ Links ]
Fuse H., Takimura O., Murakami K., Yamaoka Y. y Omori T. (2000). Utilization of dimethyl sulfide as a sulfur source with the aid of light by Marinobacterium sp. strain DMS-S1. Appl. Environ. Microbiol. 66, 5527-5532. [ Links ]
Greene E.A., Hubert C., Nemati M., Jenneman G.E. y Voordouw G. (2003). Nitrite reductase activity of sulphate-reducing bacteria prevents their inhibition by nitrate-reducing, sulphide-oxidizing bacteria. Environ. Microbiol. 5, 607-617. [ Links ]
Habelr R., Grego S., Langergraber G., Kadlec R.H., Cicalini A. R., Dias S. M., Novais J. M., Aubert S., Gerth A., Hartmurt T. y Hebner A. (2003). Constructed wetlands for the treatment of organic pollutants. J. Soils Sed. 3, 109-124. [ Links ]
Kao C.M., Wang J.Y. y Wu M.J. (2001). Evaluation of atrazine removal processes in a wetland. Wat. Sci. Tech. 44, 539-544. [ Links ]
Larsen L., Jergensen C. y Aamand J. (2001). Potential mineralization of four herbicides in a ground water-fed wetland area. J. Environ. Qual. 30, 24-30. [ Links ]
Leduc D. (1999). Quantification of bacterial populations indigenous to acidic drainage streams. Master of Science Thesis. School of Graduate Studies. Laurentian University of Sudbury. Ontario, Canadá, pp126. [ Links ]
Lloyd J.R., Klessa D.A., Parry D.L., Buck P. y Brown N.L. (2004). Stimulation of microbial sulphate reduction in a constructed wetland: microbiological and geochemical analysis. Wat. Res. 38, 1822-1830. [ Links ]
Mahmood Q., Hu B., Cai J., Zheng P., Azim M.R., Jilani G. e Islam E. (2009). Isolation of Ochrobactrum sp. QZ2 form sulfide and nitrite treatment system. J. Hazard. Mater. 165, 558-565. [ Links ]
Masau R.J.Y. (1999). The mechanism of thiosulfate oxidation by Thiobacillus thiooxidans 8085. Master of Science Thesis. Department of Microbiology. University of Manitoba. Winnipeg, Canadá. 158 pp. [ Links ]
Mason J. y Kelly D.P. (1988). Thiosulfate oxidation by obligately heterotrophic bacteria. Microb. Ecol. 15, 123-134. [ Links ]
Okabe S., Ito T., Sugita K. y Satoh H. (2005). Succession of internal sulfur cycles and sulfur-oxidizing bacterial communities in microaerophilic wastewater biofilms. Appl. Environ. Microbiol. 71, 2520-2529. [ Links ]
Okada J., Murata K. y Kimura A. (1982). Assimilation of elemental sulfur by a mutant of Escherichia coli B. Agr. Biol. Chem. 46, 1915-1916. [ Links ]
O'sullivan A.D., McCabe O.M., Murray D.A. y Otte M.L. (1999). Wetlands for rehabilitation of metal mine wastes. Biol. Environ. 99B, 11-17. [ Links ]
Pacheco A.J. R., Peña C.J.J. y Madonado V.M. (2008). Identification and characterization of sulfur-oxidizing bacteria in an artificial wetland that treats wastewater from a tannery. Int. J. Phytoremed. 10, 359-370. [ Links ]
Philippi L.S., Da Costa R.H.R. y Sezerino P.H. (1999). Domestic effluent treatment through integrated system of septic tank and root zone. Wat. Sci. Tech. 40, 125-131. [ Links ]
Podgorsek L. e Imhoff J.F. (1999). Tetrathionate production by sulfur oxidizing bacteria and the role of the tetrathionate in the sulfur cycle of Baltic Sea sediments. Aquat. Microb. Ecol. 17, 255-265. [ Links ]
Podgorsek L., Petri R. e Imhoff J.F. (2004). Cultured and genetic diversity, and activities of sulfur-oxidizing bacteria in low-temperature hydrothermal fluids of the North Fiji Basin. Mar. Ecol. Prog. Ser. 266, 65-76. [ Links ]
Rivera F., Warren A., Curds C.R., Robles E., Gutiérrez A., Gallegos E. y Calderón A. (1997). The application of the root zone method for the treatment and reuse of high-strength abattoir waste in México. Wat. Sci. Tech. 35, 271-278. [ Links ]
Rodier J. (1981). Análisis de las aguas. 1a ed. Omega, Barcelona, 1080 pp. [ Links ]
Rossetti S., Blackall L.L., Levantesi C., Uccelletti D. y Tandoi V (2003). Phylogenetic and physiological characterization of a heterotrophic, chemolithoautotrophic Thiothrix strain isolated from activated sludge. Int. J. Syst. Evol. Microbiol. 53, 1271-1276. [ Links ]
Ruby E.G., Wirsen C.O. y Jannasch H.W. (1981). Chemo-lithotrophic sulfur-oxidizing bacteria from the Galapagos Rift hydrothermal vents. Appl. Environ. Microbiol 42, 317-324. [ Links ]
Sekowska A., Kung H.F. y Danchin A. (2000). Sulfur metabolism in Escherichia coli and related bacteria: Facts and fiction. J. Mol. Microbiol. Biotechnol. 2, 145-177. [ Links ]
Sorokin D.Y., Robertson L.A. y Kuenen J.G. (1996). Sulfur cycling in Catenococcus thiocyclus. FEMS Microbiol. Ecol. 19, 117-125. [ Links ]
Sorokin D.Y. (2003). Oxidation of inorganic sulfur compounds by obligately organotrophic bacteria. Microbiology. 72, 725-739. [ Links ]
Stottmeister U., Wiebner A., Kuschk P., Kappelmeyer U., Kästner M., Bederski O., Müller R.A. y Moormann H. (2003). Effects of plants and microorganisms in constructed wetlands for wastewater treatment. Biotechnol. Adv. 22, 93-117. [ Links ]
Stubner S., Wind T. y Conrad R. (1998). Sulfur oxidation in rice field soil: activity, enumeration, isolation and characterization of thiosulfate-oxidizing bacteria. Syst. Appl. Microbiol. 21, 569-578. [ Links ]
Suzuki I. (1999). Oxidation of inorganic sulfur compounds: chemical and enzymatic reactions. Can. J. Microbiol. 45, 97-105. [ Links ]
Syed M., Soreanu G., Falletta P. y Béland M. (2006). Removal of hydrogen sulfide from gas streams using biological processes - A review. Can. Biosyst. Eng. 48, 1-14. [ Links ]
Whitmire S.L. y Hamilton S.K. (2005). Rapid removal of nitrate and sulfate in freshwater wetland sediments. J. Environ. Qual. 34, 2062-2071. [ Links ]
Ye Z.H., Lin Z.Q., Whiting S.N., De Souza M.P. y Terry N. (2003). Possible use of constructed wetland to remove selenocyanate, arsenic, and boron from electric utility wastewater. Chemosphere 52, 1571-1579. [ Links ]














