Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista internacional de contaminación ambiental
versão impressa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 no.3 Ciudad de México Ago. 2012
Artículos
Sobrevivencia de bacteriófagos en una presa recreativa del noreste de México
Bacteriophage survival in a recreation dam of the northeast of México
Luis SAMANIEGO-MORENO1, Juan A. VIDALES-CONTRERAS2*, Rodolfo A. GARCÍA-ZAMBRANO2, Humberto RODRÍGUEZ-FUENTES2, Emilio OLIVARES-SÁENZ2, Rigoberto VÁZQUEZ-ALVARADO2, Ernesto J. SÁNCHEZ-ALEJO2 y Pablo GORTARES-MOROYOQUI2
1 Universidad Autónoma Agraria Antonio Narro, Departamento de Riego y Drenaje. Calzada Antonio Narro No. 1923, C.P. 25315, Saltillo, Coahuila, México *Autor responsable; javidalesc@hotmail.com
2 Universidad Autónoma de Nuevo León, UANL, Facultad de Agronomía, Av. Universidad s/n Ciudad Universitaria, San Nicolás de los Garza, Nuevo León, C.P. 66451, México
Recibido noviembre 2010,
aceptado mayo 2012
RESUMEN
La tasa de decaimiento (k) de los colifagos PRD1 y MS2, modelos de virus entéricos, fue evaluada in situ en el agua de la presa recreativa "La Juventud" ubicada en Marín, N.L., México. Su relación con la temperatura (T), pH, conductividad eléctrica (CE), sólidos suspendidos totales (SST), oxígeno disuelto (OD) y coliformes totales (CT) y fecales (CF) fue también analizada. Los resultados mostraron que para ambos colifagos la menor sobrevivencia fue en verano y la mayor en invierno. Comparado con PRD1, MS2 presentó mayor tasa de decaimiento. Sin embargo, PRD1 sobrevivió por más tiempo en el fondo de la columna de agua de la presa que en su superficie. La tasa de decaimiento no estuvo relacionada con la CE ó la concentración de OD medida en cada uno de los sitios de muestreo. La concentración de SST fluctuó entre 45 y 80 mg/L, CT entre 75 y 335 unidades formadoras de colonias (UFC)/100 mL, mientras que la densidad de Cf se ubicó entre 25 y 125 UFC/100 mL de muestra. Estos valores están muy por debajo de los máximos permisibles para descargas de aguas residuales a aguas y bienes nacionales, cumpliendo con las normas mexicanas para aguas de recreación en SST y CF.
Palabras clave: inactivación, colifagos, PRD1, MS2, patógenos.
ABSTRACT
The decay rate (k) of PRD1 and MS2 was evaluated in situ at "La Juventud" recreational dam. Its relation with temperature (T), pH, electrical conductivity (EC), total suspended solids (TSS), dissolved oxygen (DO), and the amount of total (TC) and fecal coliform (FC) was also analyzed. For both coliphages, the lowest survival was in summer and the highest one during the winter, probably as a result of water temperature. The k for MS2 was higher than for PRD1, which survive longer on the bottom of the column than on the surface. There was not a relationship between EC or DO concentration and k at the sampling sites. The TSS ranged from 45 to 80 mg/L, TC from 75 to 335 colony forming units (cfu)/100 mL, and FC between 25 and 125 cfu per 100 mL of sample. These values are well below the maximum permissible levels for wastewater discharges to national waters complying with the Mexican standards for recreational waters in TSS and FC.
Key words: inactivation, coliphages, PRD1, MS2, pathogen.
INTRODUCCIÓN
Una de las formas más comunes de contaminación de los cuerpos de agua superficiales es por patógenos entéricos asociados a las heces fecales de individuos infectados. Entre estos patógenos, los virus entéricos han sido considerados la causa más común de muerte entre la niñez a nivel mundial, especialmente en países subdesarrollados (Walsh y Warren 1979, Butler 1984, Clark y McKendrick 2004). Al ser evacuados al ambiente ellos pueden alcanzar los cuerpos de agua superficiales, que abastecen a las poblaciones o que se utilizan como sitios de recreación, poniendo en riesgo la salud pública al ser capaces de causar diversas enfermedades entre la población (Bosch et al. 2006); por ejemplo, gastroenteritis, hepatitis A, hepatitis E, meningitis y miocarditis, entre otras.
La presencia de virus entéricos en cuerpos de agua superficiales o subterráneos es un riesgo importante que puede afectar la salud pública, ya que ellos pueden sobrevivir por largos periodos manteniendo la posibilidad de brotes de enfermedades entéricas o en casos más graves epidemias. Para determinar la tasa de decaimiento en el ambiente se puede recurrir a virus no patogénicos; por ejemplo, colifagos, incapaces de reproducirse en el ambiente (Campos 1993, Grabow 2001), con una morfología similar a la que presentan los virus entéricos y con la ventaja de que su análisis es relativamente sencillo, económico y rápido (Vidales-Contreras et al. 2006). Los más comúnmente utilizados como modelos de virus entéricos son PRD1 y MS2. Entre otras características, PRD1 infecta bacterias gram negativas como Escherichia coli y Salmonella typhimurium, posee una membrana lípido-protéica bajo su cápside similar al adenovirus y al rotavirus (McNulty 1978, Balakireva el at. 2003). El virus es de forma icosaédrica, con un tamaño de 62 nm y 24 x 106 daltones de peso molecular (Olsen et al. 1974). MS2 es un virus desnudo, similar a los enterovirus, coxsackievirus, polivirus y enterovirus. Infecta a Escherichia coli ATCC15597, es de forma icosaédrica, con un tamaño de 27 nm y tiene un peso molecular de 3.5 x 106 daltones (Kuzmanovic et al. 2003, Harvey y Ryan 1993).
Los factores que pueden afectar a la sobrevivencia del virus en agua incluyen a la temperatura, materia orgánica, microorganismos aeróbicos y luz solar, entre otros (Bosch et al. 2006). Sin embargo, el factor más importante es la temperatura, ya que su incremento favorece el decaimiento del virus principalmente por la actividad de enzimas extracelulares (Gundy et al. 2009) y en casos extremos la desnaturalización de proteínas (Hurst et al. 1980). Yahya et al. (1993) evaluaron la sobrevivencia de PRD1 y MS2 en agua subterránea de diferentes sitios de Estados Unidos de América a diferentes temperaturas. Las tasas de decaimiento observadas fueron 0.05 y 0.55 log10/día para PRD1 y MS2, respectivamente, a 23 °C en agua colectada de Tucson AZ, EUA. A 7 °C la diferencia en decaimiento para ambos colifagos fue despreciable. Por otra parte, John y Rose (2005) realizaron una revisión de factores que afectan la sobrevivencia de microorganismos en agua subterránea. En este estudio el valor de la media geométrica para las tasas de inactivación para colifagos, poliovirus, echovirus, bacterias coliformes, enterococos y Salmonella spp., fue aproximadamente de 0.07-0.1 log10/día, mientras que las tasas de inactivación para el virus de hepatitis A, coxsackievirus y PRD1 fueron de 0.02-0.04 log10/día. Los estudios anteriores sugieren que la tasa de decaimiento de colifagos y virus entéricos es dependiente de la temperatura, mayor decaimiento a mayores temperaturas.
La presa "La Juventud" ubicada al noreste de México, recibe anualmente 32 000 visitantes con fines de recreación y pesca deportiva. A esta presa llegan principalmente los escurrimientos superficiales producidos por las precipitaciones que ocurren en su cuenca, sin embargo, en ella se ubican pequeños desarrollos urbanos y explotaciones de cerdos y ganado vacuno, además del predio donde se confinan los desechos de la cabecera municipal de Marín N. L. México. La presa se encuentra aproximadamente a 1.5 km de un sistema de lagunas de oxidación donde se tratan las aguas residuales de la cabecera municipal, lo que sugiere que en temporada de precipitaciones existe el riesgo que efluentes contaminados lleguen a ella. Es importante mencionar que al noreste de la presa se establecen cultivos irrigados con agua residual tratada. Los objetivos de la presente investigación fueron: (i) evaluar in situ la tasa de decaimiento de los colifagos PRD1 y MS2; (ii) analizar su relación con T, pH, CE, OD y SST, y (iii) cuantificar CT y CF en las aguas de la presa para compararla con las normas oficiales mexicanas.
MATERIALES Y MÉTODOS
La presa "La Juventud" (Fig. 1) pertenece a la Facultad de Agronomía de la Universidad Autónoma de Nuevo León (FAUANL), está ubicada en el kilómetro 15.5 de la carretera Zuazua-Marín, su extensión es de 54.47 ha. El clima de la región es extremoso, la precipitación anual fluctúa entre 250 y 500 mm; de los cuales, la mayor parte ocurre en agosto y septiembre. Las mayores temperaturas se presentan en julio y agosto con una máxima de 40 °C. La mínima es de 4 °C y la media anual 22 °C, la dirección predominante de los vientos es de norte a sur (Marín 2008).

El sitio para la prueba de sobrevivencia (Fig. 1) de MS2 y PRD1 se localizó a los 25° 52' 29'' N, 100° 04' 07'' O, con una profundidad de 4 m al inicio del estudio y de aproximadamente 3 m durante la época de estiaje. Los colifagos PRD1 y MS2 se obtuvieron del Laboratorio de Remediación Ambiental y Análisis de Aguas, Suelos y Plantas de la FAUANL. Ambos virus fueron replicados por el método de doble capa (Adams, 1959) usando como hospedero Salmonella typhimurium LT2 y Escherichia coli 15597, respectivamente, en agar de soya tripticaseina (BDBioxon, México) a concentración de 40 g/L. Una alícuota de 0.1 mL de una suspensión del virus se mezcló con 0.5 mL de su hospedero en 30 g/L de caldo de soya tripticaseina (BDBioxon, México) preparado con agar bacteriológico al 1.0 % (BDBioxon, México). Esta suspensión se añadió a la placa de agar de soya y posterior a su solidificación se incubó a 37 °C por 24 h. Inmediatamente después de este periodo se añadieron 6 mL de agua destilada estéril incubándose por 3 h a temperatura ambiente (25 °C). La suspensión se recuperó en una botella de polipropileno de 250 mL y se centrifugó a 15 000 x g (Centrifuge 5804 R Eppendorf) por 15 min. El sobrenadante se filtró a través de una membrana de nitrocelulosa de 47 mm de diámetro y 0.45 μm de tamaño de poro (Millipore, Billerica, MA, EUA). La sobrevivencia se realizó in situ utilizando membranas de diálisis (Spectra/Por Spectrum) con un umbral de permeabilidad de 12 000 a 14 000 daltones de peso molecular, lo que permite que los iones solubles del agua pasen la membrana e impidiendo el paso de MS2 y PRD1 (3.5 y 24 x 106 daltones, respectivamente). Se colocaron bolsas de aproximadamente 100 mm de largo y 25 mm de ancho en agua destilada para suavizarlas y atarlas en uno de sus extremos. Las bolsas se llenaron con 3 mL de una mezcla de 300 mL de agua de la presa y 0.3 mL de solución concentrada de cada colifago, atando su extremo superior. La concentración de PRD1 y MS2 (Co) en esta suspensión fue cuantificada, cuadro I, al inicio de cada experimento.
Inicialmente los ensayos se llevaron a cabo colocando grupos de 12 bolsas con la suspensión viral previamente preparada a 0, 1, 2, 3 y 4 m de profundidad en la primavera del 2007 (17-24 de abril). Posteriormente, los periodos de monitoreo fueron: primavera (23 de abril-02 de mayo) y verano del 2008 (01-11 de julio), a profundidades de 0, 1, 2, y 3 m. Sin embargo, esta condición cambio en otoño del 2008 (12-21 de diciembre), debido a las precipitaciones ocurridas en julio de ese año e invierno del 2009 (23-28 de enero) cuando la altura de la columna del agua fue de 4 m. Diariamente una bolsa de diálisis colectada de cada profundidad de muestreo se colocó en un recipiente con hielo y se llevó al Laboratorio de Remediación Ambiental Análisis de Suelos Aguas y Plantas de la FAUANL para su análisis por el método de doble capa (Adams 1959). Una alícuota de 0.5 mL de S. tiphymuruim LT2 o E. coli 15597 para los colifagos PRD1 y MS2, respectivamente, y 0.1 mL de la suspensión de la bolsa de diálisis diluida mediante diluciones decimales sucesivas, se mezclaron en 4.5 mL de caldo de soya tripticaseina (30 g/L), conteniendo 1.0 % de agar bacteriológico, mantenido en baño María a una temperatura de 47 °C. Esta mezcla se vació en una placa de agar de soya tripticaseina (40 g/L); una vez solidificada, se incubó por 24 h a 37 °C. La concentración (C) se determinó mediante el promedio de la enumeración de las unidades formadoras de placa (UFP) por placas Petri, preparadas por duplicado, multiplicado por el factor de dilución (F), el cual es expresado como:

Donde v es el volumen ensayado, 0.1 mL, y d es la dilución usada para el análisis, 10-1, 10-2, 10-3, y así sucesivamente, que permitió la cuantificación de los colifagos. Al momento del muestreo y a las profundidades mencionadas anteriormente fueron medidos pH, CE y T, con un medidor multiparámetros de campo (YSI Mod. 63150, EUA), lo mismo para OD (Hanna Instruments, HI 9143 EUA). Sin embargo, las observaciones de pH fueron realizadas sólo en primavera, verano y otoño de 2008.
Para la determinación de SST se utilizó la técnica de diferencias de peso (APHA 1992), tomándose solamente muestras de la superficie del sitio de muestreo. Brevemente, una muestra bien mezclada se filtró a través de un filtro de fibra de vidrio de 47 mm de diámetro (Whatman EUA) y el residuo retenido se secó hasta peso constante a 103-105 °C. El incremento en el peso del filtro representa el total de sólidos suspendidos. Los volúmenes de muestra, por triplicado, que se usaron fueron de 20 mL. La medición de turbidez (Hanna Instruments, HI 93703, EUA) se realizó in situ. Para CT y CF se tomaron muestras de agua de la superficie de los sitios de muestreo, conservadas en hielo y llevadas al laboratorio para su análisis por la técnica de filtración por membrana (APHA 1992) utilizando M-Endo para CT y MFc (Difco, EUA) para CF. Las membranas de filtración fueron de nitrocelulosa de 47 mm de diámetro y 0.45 μm de tamaño de poro (Millipore, Billerica, MA, EUA). Alícuotas de 1 y 10 mL fueron los volúmenes ensayados, por duplicado, para determinar la concentración de ambos grupos bacterianos.
Con la concentración relativa (C/Co) de los colifagos expresada en unidades logarítmicas base 10 en el eje de las ordenadas y el día de muestreo como pareja ordenada en el eje de las abscisas, se trazó un modelo de regresión lineal para determinar k mediante la pendiente del modelo. Los valores de k reportados como negativos indican inactivación, mientras más negativo más alta la tasa de decaimiento (Yates et al. 1985, McLaughlin y Brooks 2008).
Los datos de precipitación y la temperatura ambiente y del agua que se registraron durante los experimentos se muestran en la figura 2 y en todos ellos el mayor valor se encontró en verano (INIFAP 2009).

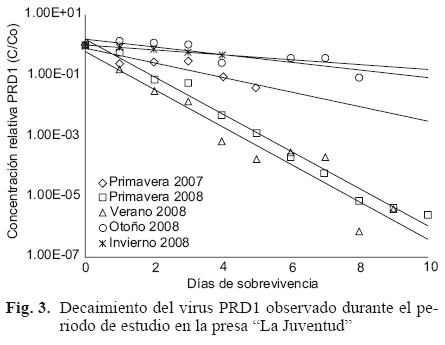
La sobrevivencia de PRD1 y MS2, representada como el promedio de las concentraciones relativas de los colifagos, a lo largo de toda la columna de agua, se muestran en las Figs. 3 y 4, respectivamente. Las tasas de decaimiento se ilustran en el cuadro II. Para ambos virus la menor sobrevivencia fue en verano y la mayor en invierno. En comparación con PRD1, MS2 exhibió una mayor tasa de decaimiento a excepción de la primavera de 2008. Es importante señalar que en este periodo solo se consideraron los datos obtenidos en el punto ubicado a 3 m de profundidad para MS2, debido a las pocas observaciones realizadas en los puntos superficiales (Fig. 5). Comparando los resultados entre profundidades de muestreo, la tendencia general, a excepción del verano 2008, fue que el PRD1 sobrevivió por periodos más largos en el fondo de la columna de agua (Fig. 6) que en la superficie. Con respecto a MS2, este comportamiento también se observó, sin embargo, los dos sitios intermedios no siempre mostraron menor sobrevivencia comparado con el fondo de la columna. La mayor sobrevivencia de PRD1 en relación con MS2 ha sido observada en diversos estudios (Yates et al. 1985, Yahya et al. 1993, Blanc y Nasser 1996, Schijven et al. 2000, Enriquez et al. 2003, Brion et al. 2004). Por ejemplo, Yahya et al. (1993) observaron que PRD1 sobrevivió periodos 7 a 10 veces más prolongados que MS2 en muestras de agua subterránea. En comparación con MS2, Enriquez et al. (2003) encontraron una mayor sobrevivencia de PRD1 en suelos; mientras que Blanc y Nasser (1996) sugieren que PRD1 es un indicador más adecuado que MS2 para predecir la sobrevivencia de virus patogénicos a temperatura ambiente.




Los resultados para pH, T, CE y OD se presentan en las Figs. 7, 8, 9 y 10, respectivamente. Para pH, su tendencia fue a incrementarse hacia la superficie del agua probablemente a consecuencia de una mayor actividad fotosintética de las algas presentes que consumieron el CO2 modificando su equilibrio (Jenkis 1999) e incrementando el pH. Durante los estudios no se observó alguna relación entre la tasa de decaimiento con la CE u OD en cada uno de los sitios de muestreo. Sin embargo, comparado con los valores en la superficie, la concentración de oxígeno y temperatura fueron menores en el fondo de la columna, probablemente, como consecuencia del efecto del viento, la estratificación por temperatura, la baja capacidad de difusión del oxígeno en el agua, la capacidad fotosintética de las algas presentes y la actividad microbiológica en el fondo de la presa. Algo similar se observó con la CE, aunque es valioso señalar que las curvas A y B (Fig. 9) corresponden al mismo periodo de monitoreo en el verano 2008, durante el cual se presentaron fuertes precipitaciones en la cuenca, resultando en una reducción de la CE, curva B. La mayor CE en el fondo de la presa puede atribuirse a una renovación más rápida del agua en la superficie de la columna debido al vertido del volumen almacenado por el vertedor de demasías. Para los muestreos mensuales, los SST fluctuaron entre 45 y 80 mg/L ligeramente superior a los 75 mg/L de promedio mensual señalados como límite máximo para aguas recreativas, aunque inferior a los 125 mg/L de promedio diario, establecidos por la Norma Oficial Mexicana NOM-001-ECOL-1996 (SEMARNAT 1996). Los niveles de turbidez se ubicaron entre 15 y 33 unidades nefelométricas durante los meses de muestreo del presente estudio.
Por otra parte, las concentraciones de CT fluctuaron entre 75 y 335 UFC/100 mL mientras que las CF se ubicaron entre 25 y 125 UFC/100 mL de muestra. Estos valores están muy por debajo de los máximos permisibles, NOM-003-ECOL-1997 (SEMARNAT 1997), para descargas de aguas residuales a aguas y bienes nacionales (1000 UFC/100 mL de promedio mensual para coliformes fecales ó 2000 UFC/100 mL de promedio diario). Por lo que hasta el momento de llevar a cabo esta investigación, la calidad microbio-lógica, con base en CT y CF, así como física, SST, de las aguas de la presa se encuentran en los niveles recomendados por la normatividad mexicana.




CONCLUSIONES
En comparación con MS2, los resultados del presente estudio sugieren que PRD1, al sobrevivir por más tiempo en el ambiente, es un indicador más adecuado para evaluar la sobrevivencia de virus entéricos en el agua de la presa "La Juventud". En comparación con PRD1, MS2 podría indicar una tasa de decaimiento más alta que virus entéricos similares a PRD1 como adenovirus o rotavirus. Aparentemente, los patógenos de efluentes residuales municipales podrían sobrevivir por mayor tiempo durante el invierno que en otra época del año, lo que significa un mayor riesgo para las personas que visitan la presa durante ese tiempo, en caso de una descarga de agua residual. Actualmente, el embalse cumple con las normas mexicanas para aguas de recreación en SST y CF, sin embargo, el crecimiento urbano de la cabecera municipal de Marín, N.L., puede cambiar estas condiciones.
REFERENCIAS
Adams M.H. (1959). Bacteriophage. Interscience Publishers, Nueva York, EUA. 592 p. [ Links ]
Balakireva L., Schoehn G., Thouvenin E. y Chroboczek J. (2003). Binding of adenoviruses capsid to dopalmitoyl phosphatidylcholine provides a novel pathway for virus entry. J. Virol. 77, 4858-4866. [ Links ]
Blanc R. y Nasser A. (1996). Effect of effluent quality and temperature on the persistence of viruses in soils. Water Sci. Technol. 33, 237-242. [ Links ]
Bosch A., Pintó R.M. y Abad F.X. (2006) Survival and transport of enteric viruses in the environment. En: Food Microbiology and Food Safety (S.M. Goyal, Ed.). Springer, EUA, pp.151-187. [ Links ]
Brion G.M., O`Banion N.B. y Marchin G.L. (2004). Comparison of bacteriophages for use in iodine inactivation: batch and continuous flow studies. J. Water Health 2, 261-266. [ Links ]
Butler T. (1984). Diarrheal diseases caused by viruses: A review of mechanisms and prospects for prophylactic intervention. PJMID, 13, 65-73. [En línea]: http://psmid.org.ph/vol13/vol13num2topipic1.pdf (revisado: 15/01/2012). [ Links ]
Campos P.C. (1993). Indicadores de contaminación fecal en aguas. (En línea): http://tierra.rediris.es/hidrored/ebooks/ripda/contenido/capitulo20.html (revisado: 06/02/09). [ Links ]
Clark B. y McKendrick M. (2004). A review of viral gastroenteritis. Curr. Opin. Infect. Dis. 17, 461-469. [ Links ]
Enriquez C., Alum A., Suarez-Rey E.M., Choi C.Y., Oron G. y Gerba C.P. (2003). Bacteriophages MS2 and PRD1 in turfgrass by subsurface drip irrigation. J. Environ. Eng. 129, 852-857. [ Links ]
Grabow W. (2001). Bacteriophages: update on application as models for viruses in water. Water S.A. 27, 251-267 [ Links ]
Gundy P.M., Gerba C.P. y Pepper I.L. (2009). Survival of coronaviruses in water and wastewater. Food Environ. Virol. 1, 10-14. [ Links ]
Harvey R.W. y Ryan J.N. (2004). Use of PRD1 bacteriophage in groundwater viral transport, inactivation, and attachment studies. Microb. Ecol. 49, 3-16. [ Links ]
Hurs C.J., Gerba C.P. y Cech I. (1980). Effects of environmental variables and soil characteristics on virus survival in soil. Appl. Environ. Microbiol. 40, 1067-1079 [ Links ]
INIFAP (2009). Red Nacional de Estaciones Estatales Agroclimatológicas Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, México. [En línea]: http://clima.inifap.gob.mx (Revisado: 06/02/09). [ Links ]
Jenkis D. (1999). Química del agua. Limusa. México. [ Links ]
John D.E. y Rose J.B. (2005). Review of factors affecting microbial survival in groundwater. Environ. Sci. Technol. 39, 7345-7356. [ Links ]
Kuzmanovic D.A., Elashvili I., Wick Ch., O'Conell C. y Krueger S. (2003). Bacteriophage MS2: molecular weight and spatial distribution of the protein and RNA components by small-angle neutron scattering and virus counting. Structure 11, 1339-1348. [ Links ]
Marín (2008). (En línea): www.marin.gob.mx (Revisado: 06/02/09). [ Links ]
Mclaughlin M.R. y Brooks J.P. (2008). EPA worst case water microcosm for testing phage biocontrol of Salmonella. J. Environ. Qual. 37, 266-271. [ Links ]
McNulty M.S. (1978) Rotaviruses. J. Gen. Virol. 40, 1-18. [ Links ]
Olsen R.H., Siak J. y Gray R. (1974) Characteristics of PRD1, a plasmid-dependent broad host range DNA bacteriophage. J. Virol. 14, 689-699. [ Links ]
Schijven J.F., Medema G., Vogelaar A.J. y Hassanizadeh S.M. (2000). Removal of microorganisms by deep well injection. J. Cont. Hydrol. 44, 301-327. [ Links ]
SEMARNAT (1997). Norma Oficial Mexicana NOM-003-ECOL-1997. Límites máximos permisibles de contaminantes para las aguas residuales tratadas que se reusen en servicios al público. Secretaria de Medio Ambiente, Recursos Naturales y Pesca. Diario Oficial de la Federación. 21 de Septiembre de 1998. [ Links ]
SEMARNAT (1996). Norma Oficial Mexicana NOM-001-ECOL-1996. Límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. Secretaria de Medio Ambiente, Recursos Naturales y Pesca. Diario Oficial de la Federación. 24 de Diciembre de 1996. [ Links ]
Vidales-Contreras J.A., Gerba C.P., Karpiscak M.M., Acuna-Askar K. y Chaidez-Quiroz C. (2006). Transport of coliphage PRD1 in a surface flow constructed wetland. Water Environ. Res. 78, 2253-2260. [ Links ]
Walsh J. y Warren K. (1979). Selective PHC-an interim strategy for diseases control in developing countries. N. Engl. J. Med. 30, 967-974. [ Links ]
Yahya M.T., Galsomies L., Gerba C.P. y Bales R. C. (1993). Survival of bacteriophages MS-2 y PRD-1 in ground water. Water Sci. Technol. 27, 409-412. [ Links ]
Yates M.V., Gerba C.P. y Kelley L.M. (1985). Virus persistence in groundwater. Appl. Environ. Micro. 49,778-781. [ Links ]














