Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista internacional de contaminación ambiental
versão impressa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 no.2 Ciudad de México Mai. 2012
Artículos
Evidencia de la biodegradación de resinas fenólicas con hongos ligninolíticos por microscopía electrónica de barrido
Scanning electronic microscopy evidence of phenol–formaldehyde resins biodegradation with ligninolitic fungi
Graciela Ibeth PONCE ANDRADE1, Rafael VÁZQUEZ DUHALT2, Refugio RODRÍGUEZ VÁZQUEZ3, Iliana Ernestina MEDINA RAMÍREZ1, Juan Antonio LOZANO ÁLVAREZ1 y Juan JÁUREGUI RINCÓN1*
1 Departamento de Ingeniería Bioquímica, Universidad Autónoma de Aguascalientes. *Autor responsable; jjaureg@correo.uaa.mx.
2 Departamento de Ingeniería Celular y Biocatálisis, Instituto de Biotecnología, Universidad Nacional Autónoma de México.
3 Departamento de Biotecnología, CINVESTAV, IPN
Recibido agosto 2011,
aceptado febrero 2012
RESUMEN
Los polímeros sintéticos están generando problemas ambientales debido a que generalmente son resistentes a la degradación, sin embargo, investigaciones recientes se han enfocado en métodos biológicos para tratar estos residuos y el desarrollo de plásticos degradables. Los plásticos están clasificados en dos grandes tipos: termoplásticos y termoestables. Las resinas fenólicas están incluidas dentro de los termoestables, las cuales no pueden ser fundidas por lo tanto no son susceptibles al reciclado y causan un problema ambiental. A través de los estudios acerca de los hongos ligninolíticos se ha determinado que estos organismos producen enzimas extracelulares con alta inespecificidad química e intensa actividad oxidante, lo que les otorga una considerable capacidad para degradar diferentes compuestos orgánicos con estructura similar a la lignina. El objetivo de este trabajo fue demostrar, utilizando microscopía electrónica de barrido que los hongos ligninolíticos tienen la capacidad de degradar las resinas fenólicas. Los resultados demostraron que los hongos Bjerkandera adusta, Pleurotus ostreatus, Phanerochaete chrysosporium y Sporotrichum pulverulentum pueden degradar las resinas fenólicas.
Palabras clave: resina fenólica, biodegradación, white–rot fungi, Bjerkandera adusta.
ABSTRACT
Synthetic polymers are growing environmental concern because they are generally nondegradable and recent research has been focused on the biological treatment of plastic wastes and the development of biodegradable plastics. Plastics are classified into two broad types: thermoplastics and thermosetting plastics. Phenol–formaldehyde resins (PF resins) are included in the thermosetting plastic category. They are products that once formed cannot be soften, therefore the process for recycling cannot be applied and they cause an environmental problem. Through intensive study of white–rot fungi it has been determined that these organisms produce extracellular enzymes with very low substrate specificity and intense oxidative activity. This makes them suitable for degradation of many different compounds notably organopollutants with structural similarities to lignin. The object of this work was to demonstrate, using scanning electron microscopy, that ligninolitic fungi have the capacity to degrade PF resins. The results showed that the fungi Bjerkandera adusta, Pleurotus ostreatus, Phanerochaete chrysosporium and Sporotrichum pulverulentum can degrade the PF resins.
Key words: Phenolic resins, biodegradation, White–rot fungi, Bjerkandera adusta.
INTRODUCCIÓN
Los tiempos modernos se han caracterizado por la gran producción de materiales sintéticos que son difíciles de degradar y son tóxicos para el ambiente. Con el fin de mejorar su rendimiento, los compuestos han sido diseñados específicamente para tener una larga vida útil y no reaccionar con los productos químicos comunes (Levin y Gealt 1997). Ellos son extremadamente estables y no fácilmente entran a los ciclos de degradación de la biosfera. La contaminación ambiental por desechos de polímeros sintéticos ha sido reconocida como un problema grave. Con el fin de apoyar el desarrollo sustentable en el mundo, este problema debe ser atendido (Ikada 1999, Shimao 2001) de aquí surge la necesidad de estudiar la degradación de polímeros ya que ahora se necesita reducir la cantidad de desechos que se generan por el uso de los materiales poliméricos y su poca compatibilidad con el ambiente (Cristán et al. 2003).
Dentro de la gran variedad de polímeros sintéticos existente, a todos ellos se les puede clasificar en dos grandes grupos con base a su comportamiento ante el calor: los termoplásticos o termodeformables y los duroplásticos o termoestables (Sodhi 2000). Los termoplásticos son los que experimentan cambios reversibles ya que se ablandan en presencia del calor y se endurecen cuando se enfrían por lo que son susceptibles de ser reciclados; por otro lado, los duroplásticos son aquellos que se solidifican en forma definitiva cuando se les aplica calor y presión durante el moldeado, el recalentamiento no ablanda estos materiales y si la aplicación de calor continúa la pieza llega a carbonizarse directamente (Montalvo 2007). Las resinas consisten inicialmente de moléculas lineales pero por calentamiento forman irreversiblemente una red de enlaces entrecruzados, produciendo una estructura reticular tridimensional que no se funde, proporcionando un producto final generalmente más duro, fuerte y resistente al calor que un termoplástico (Cristán et al. 2003) y que después de enfriarse no pueden recuperarse para transformaciones posteriores, por lo cual no son susceptibles para el reciclado.
A este grupo pertenecen las resinas fenólicas (RF) las cuales se forman por policondensación del fenol y del formaldehído. Están conformadas por anillos aromáticos, unidos por el grupo metileno. Las uniones del producto ocurren principalmente en la posición orto ó para con los hidroxilos fenólicos. Poseen una amplia variedad de aplicaciones. Su mercado más importante se centra en polvos de moldeo, materiales de aislamiento térmico y adhesivos en la fabricación de tableros aglomerados y contrachapados. Esto supone un consumo del 75 % del total de las resinas fenólicas producidas. El resto se destina exclusivamente a la fabricación de adhesivos para la industria de tableros (Gardziella et al. 2000).
La descomposición de los desechos de RF únicamente es posible realizando la incineración del material, ya que es muy resistente a la temperatura, pH extremos, alta humedad, radiación, corrosión y tiene excelentes propiedades aislantes. Desafortunadamente el proceso de incineración también contamina por lo que una alternativa es la biodegradación, que consiste en la capacidad de los microorganismos de convertir los compuestos complejos a sustancias elementales y los contaminantes a compuestos no tóxicos, sin embargo hasta hace poco más de cuatro años no se tenía evidencia de su biodegradabilidad (Gusse et al. 2006). Debido a la importancia de estos plásticos en el mercado y la acumulación de sus desechos es imperativo encontrar sistemas biológicos capaces de reciclar al ambiente estos compuestos contaminantes.
Los hongos ligninolíticos (HL), también llamados hongos de la pudrición blanca de la madera tienen la capacidad de degradar la lignina. La peculiar irregularidad estructural del polímero de lignina hace que estas enzimas se caractericen por tener mecanismos de acción poco específicos que oxidan los anillos aromáticos constitutivos de dicho polímero. Las enzimas que participan en este proceso son la lignina peroxidasa, la peroxidasa dependiente de manganeso y la lacasa, una fenoloxidasa que contiene principalmente cobre en su sitio activo. El patrón de expresión de esas actividades enzimáticas depende de los diferentes organismos y del medio en donde se desarrollen.
La inespecificidad química y la intensa actividad oxidante de estas enzimas les confieren una considerable capacidad de degradar diferentes compuestos orgánicos con estructura similar a la de las unidades monoméricas que constituyen la lignina. Entre los diferentes xenobióticos que pueden ser transformados por hongos basidiomicetos se encuentran fundamentalmente plaguicidas, hidrocarburos aromáticos (benzo(α)pireno, fenantreno, pireno, etc.) compuestos orgánicos clorados (pentaclorofenoles, cloroanilinas, bifenilos policlorados) azocolorantes, etc. Este sistema ligninolítico, ha demostrado ser muy versátil y atractivo para fines ambientales, porque puede servir para eliminar diversos contaminantes difíciles de degradar (Solís 2005).
Existen escasos reportes referentes a la biodegradación de la RF empleando microorganismos (bacterias y hongos). Kaplan et al. (1979) ensayaron 17 especies de hongos. La biodegradación de las RF fue muy escasa obteniendo porcentajes de 0 a 0.17 % en un periodo de 35 días. También ensayaron consorcios microbianos y los porcentajes de biodegradación fueron similares a pesar de que los tiempos de degradación se llevaron hasta 11 semanas, por lo que ellos concluyeron que estas resinas son recalcitrantes. Gusse et al. (2006) fueron los primeros en reportar la biodegradación de estas resinas por medio de HL que estaban consideradas como no biodegradables. El organismo que ha sido reportado como degradador de estas resinas fenólicas es Phanerochaete chrysosporium. Sundarapandiyan et al. (2010) reportaron a Trametes versicolor como un hongo capaz de biodegradar las RF, pero ellos utilizaron un producto comercial llamado Basyntan DI que es un condensado de fenol y naftol, el cual es soluble en agua y en este trabajo lograron reducir la demanda química de oxígeno, la demanda bioquímica de oxígeno y el carbono orgánico total en 76.66, 65.11 y 72.94 % respectivamente en un periodo de ocho días.
El objetivo de este trabajo fue demostrar utilizando microscopía electrónica de barrido que los HL tienen la capacidad de degradar las resinas fenólicas.
MATERIALES Y MÉTODOS
I Cepas fúngicas
Se trabajó con las siguientes cepas de HL: Bjerkandera adusta 7308, Pleurotus ostreatus 7992, Phanerochaete chrysosporium 4521, Sporotrichum pulverulentum 4521, Trametes versicolor 8272, Ganoderma applanty 8168, Trametes hispida 8260, Trametes zonatus 8158, Trametes hirsuta 8165, obtenidas de la Universidad de Alberta, del Mold Herbarium (Edmonton, Canadá). Todos los hongos fueron mantenidos en cajas Petri con PDA de 4–7 °C y resembrados cada 60 días.
II Síntesis de la resina
Para la síntesis de la RF se usó la formulación reportada por Saechtling (1995), la cual es representativa de los productos comerciales pero sin aditivos. Se hizo reaccionar formaldehído y fenol en proporción 1.25:1 respectivamente en medio alcalino con agitación constante en baño de agua a 70 °C por una hora. Se curó la resina a 100 °C por 24 horas; se enfrió y se fragmentó en trozos pequeños y se lavó varias veces con agua destilada hasta eliminar residuos de los reactivos. Los trozos obtenidos se secaron a 110 °C por 24 horas. Se registró el peso de cada uno de ellos y se esterilizaron por 20 minutos a 121 °C con calor húmedo.
III Ensayo de biodegradación
La biodegradación se realizó en cajas Petri con agar–malta al 3 %. En cada caja se colocó un trozo de RF previamente pesado y esterilizado y se inoculó con 1 cm2 de micelio crecido en PDA de cada una de las cepas. El experimento se realizó por triplicado y todas las cajas se incubaron a 28°C durante 200 días, haciendo observaciones cada 30 días. Como testigos se usaron cultivos de cada una de las cepas fúngicas sin resina y además la RF en PDA sin hongo. Al final del periodo se recuperó cada uno de los trozos de RF, se lavaron y se secaron a 110 °C durante 24 horas.
IV Pérdida de peso
Las muestras de RF se sometieron a un lavado con ácido clorhídrico 6 N por 12 horas con el objetivo de remover el micelio del hongo que creció dentro de la RF, posteriormente se determinó el peso seco para calcular el porcentaje de pérdida de peso. Se incluyó un testigo (RF sin exponer al proceso de biodegradación y lavada con ácido).
V Microscopía electrónica de barrido
Se realizó la observación de los trozos de RF (como testigo se usó RF sin exponer al proceso de biodegradación) en el microscopio electrónico de barrido (MEB), empleando un microscopio modelo JEOL JSM–5900 LV. En todos los casos se emplearon los mismos aumentos (20–310).
RESULTADOS
El ensayo de biodegradación se realizó durante 200 días durante los cuales se observó la tendencia al crecimiento del micelio sobre la resina y cambios de color en el medio de cultivo en la zona circundante a la RF y se compararon con los testigos. Después de 10 días de incubación, las cepas Bjerkandera adusta 7308, Pleurotus ostreatus 7992, Phanerochaete chrysosporium 4521, Sporotrichum pulverulentum 4521 y Trametes versicolor 8272, cubrieron toda la superficie de la RF y la caja. Se evaluó la velocidad de crecimiento midiendo el diámetro del halo de crecimiento del hongo tanto en las cajas con y sin RF, sin embargo las cajas que contenían la resina presentaron cambios en la coloración del medio de cultivo como se observa en la figura 1, por lo que fueron seleccionadas para continuar con el experimento. En cambio en Ganoderma applanty 8168, Trametes hispida 8260, Trametes zonatus 8158 y Trametes hirsuta 8165 el crecimiento del micelio se detuvo en los bordes de la RF. El trozo de RF testigo que estuvo en contacto con el medio de cultivo sin hongo no produjo coloración ni sufrió cambios (Fig. 2).


Después de transcurrir el tiempo establecido para el proceso de biodegradación de RF con HL, los fragmentos se sacaron del medio de cultivo y se les realizó un lavado donde se observaron cambios evidentes en su textura (Fig. 3) y en las propiedades mecánicas del material ocasionado por el contacto con el micelio ya que al agitar algunos trozos vigorosamente se fragmentaron por completo (Fig. 4).


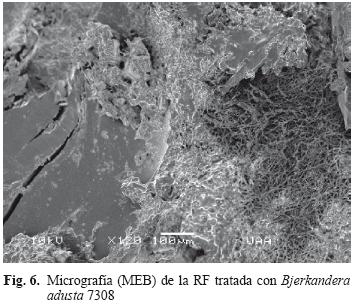
Posteriormente las muestras seleccionadas fueron observadas con el MEB y se compararon con el testigo que presentó una superficie lisa y compacta (Fig. 5). La figura 6 muestra la acción de B. adusta 7308 sobre la RF donde se identifican zonas de degradación evidentes, con regiones moteadas, reducción gradual del espesor, invasión del micelio sobre la superficie y algunas fracturas. Las figuras 7 y 8 revelan como P. ostreatus 7992 también afectó la estructura de la RF modificando la superficie lisa de la RF, invasión del micelio y formación de fracturas.



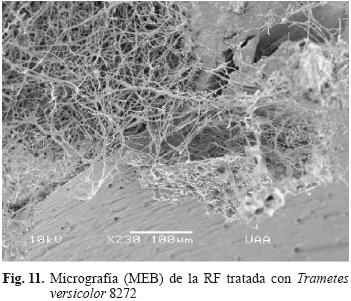
Las figuras 9 y 10 presentan la superficie de la RF tratada con P. chrysosporium 4521. Estas micrografías claramente muestran un residuo claro en la superficie, penetración del micelio en la resina y formación de poros en la superficie que demuestran el proceso de biodegradación. Trametes versicolor 8272 formó surcos en la superficie de la resina, invasión del micelio y zonas de degradación evidentes como se muestra en la figura 11.


La figura 12 muestra la superficie de la RF tratada con Sporotrichum pulverulentum 4521 bastante afectada por la acción del hongo donde se puede apreciar la formación de poros y la fractura del material ocasionada por la biodegradación.

El cuadro I presenta el porcentaje promedio de pérdida de peso donde se puede apreciar que después del tiempo transcurrido el material de RF sometido a biodegradación por medio de los HL sufre una disminución en todos los casos.

DISCUSIÓN
Entre los polímeros sintéticos más antiguos y aún extremadamente importantes se encuentran las RF que son insolubles y no pueden ser fundidas. Estas propiedades han generado gran demanda por estos polímeros tan resistentes pero también los hacen extremadamente difíciles de degradar (Gusse et al. 2006). Cuando termina su vida útil se convierten en un desecho que se acumula porque no se puede reciclar y contamina el ambiente. Debido a la importancia comercial y al problema ambiental que generan estos compuestos surge la necesidad de buscar alternativas para su degradación.
Debido a que un indicador inicial de la biodegradación de un material es el cambio en su apariencia y la microscopía se usa frecuentemente para observar la colonización microbiana y los cambios físicos en los materiales (Fedorak 2005), se desarrolló un ensayo para demostrar la capacidad de los HL de degradar RF usando microscopía electrónica de barrido y se encontró que el crecimiento de las cepas Bjerkandera adusta 7308, Pleurotus ostreatus 7992, Phanerochaete chrysosporium 4521, Sporotrichum pulverulentum 4521 y Trametes versicolor 8272 en medio agar–malta con trozos de RF dio resultados positivos.
Como testigo se colocaron trozos de resina en el medio de cultivo únicamente y se incubaron en las mismas condiciones que las muestras sometidas a biodegradación observándose que la RF no generó cambios en la coloración del medio de cultivo (Fig. 2). En cambio, en las cajas que contenían RF y las cepas de Bjerkandera adusta 7308, Pleurotus ostreatus 7992, Phanerochaete chysosporium 4521, Sporotrichum pulverulentum 4521 y Trametes versicolor 8272 hubo crecimiento uniforme de micelio sobre la superficie de la resina y se presentó una coloración en el medio de cultivo por debajo de la región donde se colocó el trozo de RF (Fig. 1). Un segundo control fue el cultivo de las cepas en el mismo medio de cultivo pero sin RF y no hubo cambio de coloración lo que implica que los hongos ligninolíticos están relacionados con la transformación de este material. Estas cepas fueron seleccionadas para ser observadas en el MEB.
Al realizar la separación de las RF sometidas a biodegradación se observó un cambio en su apariencia física, especialmente en cuanto a la rugosidad y fragilidad del material ya que al ser sometido a agitación vigorosa algunos de los trozos se fragmentaron totalmente (Fig. 4), lo que puede ser considerado como un indicador del ataque fungal, aunque esto no demuestre que se trata de un proceso de degradación en términos del metabolismo (Shah et al. 2008).
A través del microscopio electrónico de barrido fue posible observar que las hifas producen zonas moteadas, surcos y zonas de evidente degradación en la superficie de la RF que gradualmente van reduciendo su espesor, formando poros o bien ocasionan que los fragmentos colapsen y presenten fracturas (Figs. 6–12). El crecimiento y la permanencia del micelio sobre la superficie y la penetración en cualquier irregularidad encontrada o generada en la RF permite considerar que las hifas juegan un papel importante en el proceso. En cambio, en la muestra testigo se observa una superficie lisa, tersa y compacta. (Fig. 5) Este mismo comportamiento se reporta como mecanismo de degradación de la lignina (Jennings et al. 1999) por lo que debido a las similitudes en la composición de ambos polímeros puede presentarse un proceso de degradación semejante.
Gusse et al. (2006) reportaron la primera evidencia de biodegradación de RF con hongos de la podredumbre blanca presentando una micrografía de MEB después de 28 días de incubación con Phanerochaete chrysosporium donde se aprecia la degradación del material (principalmente debido al número de aumentos). Sin embargo, no es tan clara como las imágenes que se presentan en este trabajo donde se muestra tanto el crecimiento del micelio como el daño que éste le causa a la RF.
Debido a la insolubilidad y el tamaño de este tipo de polímeros, los microorganismos son incapaces de transportar el material directamente al interior de sus células donde la mayoría de los procesos bioquímicos tienen lugar, por lo que primero excretan enzimas extracelulares las cuales rompen los polímeros fuera de las células. Estas enzimas son demasiado grandes para penetrar profundamente en el polímero, por lo que actúan sólo en la superficie; por consiguiente la biodegradación de estos materiales es usualmente un proceso superficial (Muller 2003) como se observa en las figuras 6–12.
La biodegradación superficial puede ser explicada por la acción de las enzimas ligninolíticas que poseen los hongos de la podredumbre blanca que tienen la capacidad de catalizar la degradación de contaminantes usando un mecanismo de radicales libres inespecífico. Cuando un electrón es agregado o removido de su estado fundamental se vuelve muy reactivo permitiéndole dar o tomar electrones de otros compuestos. Esto provee la base de la inespecificidad de las enzimas y la capacidad de degradar xenobióticos (Hamman 2004).
Sundarapandiyan et al. (2010) encontraron que Trametes versicolor logra degradar una resina fenólica (condensado lineal) soluble en agua, el hongo produjo principalmente dos enzimas la lacasa y una polifenol oxidasa, que son las responsables de la biodegradación de ese polímero. Aunque la estructura de este compuesto es similar a la RF utilizada en este trabajo, el grado de entrecruzamiento es menor al observado en el polímero (RF) obtenido en nuestro laboratorio, lo anterior sugiere que los hongos de la pudrición blanca de la madera son capaces de biodegradar estos compuestos.
En la cuadro I se presenta el porcentaje de pérdida de peso de las RF. Según los resultados obtenidos Phanerochaete chrysosporium es el hongo que presentó la mayor perdida de peso. Esta información confirma que la presencia del micelio sobre la RF y su metabolismo colaboran en su biotransformación. Kaplan et al. (1979) reportaron que la velocidad de descomposición de la lignina en suelo es de 2 a 15 % durante un mes y en cultivos axénicos con hongos basidiomicetos de la podredumbre blanca de hasta el 7 %; por lo que la pérdida de peso de estos polímeros sintéticos es más lenta pero no despreciable.
CONCLUSIONES
Las RF son polímeros que presentan entrecruzamiento de sus unidades poliméricas lo que las hace muy resistentes y estables, sin embargo la acción de los hongos ligninolíticos sobre la superficie observada a través de MEB demuestra que estos microorganismos tienen la capacidad de biodegradar este tipo de materiales recalcitrantes debido a que poseen un sistema enzimático extracelular muy inespecífico capaz de actuar sobre este tipo de estructuras.
Se han identificado otras cepas de HL que pueden biodegradar a las RF además de los hongos ya reportados: Phanerochaete chrysosporium (Gusse et al. 2006), Trametes versicolor (Sundarapandiyan et al. 2010).
La comprensión del proceso contribuirá al desarrollo de algún proceso biotecnológico para el tratamiento de polímeros de desecho como las resinas fenólicas.
AGRADECIMIENTOS
Se agradece al CONACyT por la beca brindada (204771) al estudiante y a la Universidad Autónoma de Aguascalientes por el financiamiento para la realización del proyecto PIBT08–8.
REFERENCIAS
Cristán F.A., Ize L. I. y Gavilán G. A. (2003). La situación de los envases en México. Gaceta ecológica. INE. SEMARNAT. México. Oct.–Dic. 069: 67–82. [ Links ]
Fedorak P. M. (2005). Microbial processes in the degradation of fibers. En: Biodegradable and sustainable fibres. (Blackburn R. S. Ed.). Woodhead Publishing. Cambridge, GBR. pp. 1–30. [ Links ]
Gardziella A., Pilato L.A. y Knop A. (2000). Phenolic Resins. Springer. Berlín 560 p. [ Links ]
Gautam R., Bassi A.S. y Yanful E.K. (2007). A review of biodegradation of synthetic plastic and foams. Appl. Biochem. Biotechnol. 141, 85–108. [ Links ]
Gusse A.C., Millar P.D. y Volk T.J. (2006). White–rot demonstrate first biodegradation of phenolic resin. Environ. Sci. Technol. 40, 4196–4199. [ Links ]
Hamman S. (2004). Bioremediation capabilities of white rot fungi. BI570–review article. [en línea]: http://es.scribd.com/doc/35575106/Bio–Remediation–Capabilities–of–White–Rot–Fungi. [ Links ]
Ikada E. (1999). Electron microscope observation of biodegradation of polymers. J. Environ. Polym. Degr. 7, 197–201. [ Links ]
Jennings D.H. y Lysek G. (1999). Fungal Biology: Understanding the fungal lifestyle. 2a. ed. Bios Scientific Publishers Ltd. Nueva York, 166 p. [ Links ]
Kaplan D.L., Hartenstein R. y Sutter J. (1979). Biodegradation of polystyrene, poly(methyl methacrylate), and phenol formaldehyde. Appl. Environ. Microbiol. 38, 551–553. [ Links ]
Levin M. y Gealt M.A. (1997). Biotratamiento de residuos tóxicos y peligrosos. Mc Graw Hill, México, 352 p. [ Links ]
Montalvo L.A. (2007). Plásticos industriales y su procesamiento. Monografías. Argentina. pp 8–42. [ Links ]
Müller R. (2003). Biodegradability of polymers: regulations and methods for testing. En: Biopolymers, general aspects and special applications, biology, chemistry biothecnology, applications. (A. Steinbüchel. Ed.) Weinheim: Wiley–VCH. 10, 365–388. [ Links ]
Saechtling H. (1995) Saechling international plastics handbook for the technologist engineer and user. 3a. ed. Hanser Publisher. 644 p. [ Links ]
Shah A.A., Hasan F., Hameed A. y Ahmed S. (2008) Biological degradation of plastics: A comprehensive review. Biotechnol. Advan. 26, 246–265. [ Links ]
Shimao M. (2001). Biodegradation of plastics. Curr. Opin. Biotechnol. 12, 242–247. [ Links ]
Sodhi G.S. (2000). Fundamental concepts of environmental chemistry. Alpha Science International, Oxford. 581 p. [ Links ]
Solís S. (2005). Hongos que eliminan contaminantes. Rev. Instituto Tecnológico de Mérida 22, 10–11. [ Links ]
Sundarapandiyan S., Ramanaiah B., Chandrasekar R. y Saravanan P. (2010). Degradation of Phenolic Resin by Tremetes versicolor. J. Polym. Environ. 18, 674–678. [ Links ]














