Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 no.2 Ciudad de México may. 2012
Artículos
Acumulación de arsénico y metales pesados en maíz en suelos cercanos a jales o residuos mineros
Accumulation of arsenic and heavy metals in maize near mine tailings
Esther Aurora RUIZ HUERTA1 y María Aurora ARMIENTA HERNÁNDEZ2*
1 Posgrado en Ciencias de la Tierra, Universidad Nacional Autónoma de México.
2 Instituto de Geofísica, Universidad Nacional Autónoma de México, Recursos Naturales, Laboratorio de Química Analítica. *Autora responsable; victoria@geofisica.unam.mx.
Recibido abril 2011,
aceptado febrero 2012
RESUMEN
Se determinaron las concentraciones de As y metales pesados Pb, Zn, Cu, Fe, Cd, en cuatro sustratos bajo la influencia de los jales mineros de "El Fraile" y se evaluó su acumulación y efectos en el desarrollo de plantas de maíz (Zea mays L.) variedad H–515, crecidas en invernadero bajo condiciones controladas (temperatura, humedad relativa y radiación solar) por 70 días; también se evaluaron las concentraciones de metales para plantas de 30 días. Las plantas de maíz sembradas en los sustratos (S3 y S4) con mayores concentraciones de As y metales (metales y metaloides tóxicos, MMTOX), mostraron síntomas visibles de afectación como: necrosis, clorosis, adelgazamiento de las hojas e inhibición del crecimiento. El Zn y el Pb fueron los elementos con mayor concentración en los sustratos y en las plantas. En los sustratos, las concentraciones de Zn variaron de 175.2 a 16193 mg/kg y las de Pb de 66.5 a 6166 mg/kg. A los 70 días de crecimiento el Zn presentó concentraciones de 54.7 a 3555.4 mg/kg y el Pb de 11.1 a 320.3 mg/kg en las raíces. En la parte aérea se determinaron contenidos de 30.8 a 519.8 mg/kg para el Zn y de 3.7 a 38.5 mg/kg para el Pb. A los 30 días los contenidos de Zn en raíz variaron entre 88.9 y 504.8 mg/kg y los de Pb entre 25.2 y 300.9 mg/kg; en la parte aérea se determinaron concentraciones para el Zn de 15.5 a 555.6 mg/kg y para el Pb de 2.2 a 10.8 mg/kg. Los factores de translocación (FT) y de bioconcentración (FBC) fueron generalmente bajos para todos los elementos. Sin embargo, en las plantas de 30 y 70 días los FT fueron ligeramente mayores con valores de 0.86 y 0.85 para Cd y de 0.82 para Zn en los suelos de uso agrícola; el As presentó el mayor FT en todos los suelos para plantas de 70 días. También se observaron diferencias en el desarrollo del maíz; las plantas crecidas en la unidad experimental de suelos agrícolas lejanos a los jales mostraron un mejor crecimiento (46 cm en promedio) respecto a las crecidas en los residuos de jal (24 cm en promedio). Este mismo comportamiento fue observado al evaluar las características anatómicas, pesos fresco y seco, biomasa y número de hojas, con diferencias significativas (p<0.05) entre las unidades experimentales, y mayores valores para S1 seguidos de S2, S3 y S4. Estos resultados sugieren que la contaminación por MMTOX en las áreas cercanas a los jales afecta el desarrollo de las plantas de maíz al acumularlos y altera su crecimiento y desarrollo causando efectos fitotóxicos que se reflejan en su apariencia.
Palabras Clave: suelo agrícola, factor de translocación, factor de bioconcentración, invernadero, efectos fitotóxicos.
ABSTRACT
Arsenic and metals Pb, Zn, Cu, Fe, Cd concentrations were determined in four substrates near mine tailings. After 70 days growth, accumulation of those elements and effects in the development of young maize (Zea mays L.) H–515, raised in greenhouse under controlled conditions (temperature, relative humidity and solar radiation) were also evaluated. Maize planted in substrates (S3 and S4) with higher concentrations of As and metals (Toxic metals and metalloids TMM) showed visible affectations such as: chlorosis, thinner leaves and growth inhibition. Zinc and Pb reached the highest contents among the studied elements in substrates and plants. In substrates, Zn concentrations ranged from 175.2 to 16193 mg/kg, and Pb from 66.5 to 6166 mg/kg. After 70 days growth, Zn concentrations in roots ranged from 54.7 to 3555.4 mg/kg, and Pb from 11.1 to 320.3 mg/kg. In the aerial part Zn contents varied from 30.8 to 519.8 mg/kg and Pb ranged from 3.7 to 38.5 mg/kg. Metal concentrations were also evaluated in 30 days growth maize plants. Zinc contents in roots ranged from 88.9 to 504.8 mg/kg, and Pb from 25.2 to 300.9 mg/kg; in the aerial part concentration ranges were 15.5 to 555.6 mg/kg for Zn, and 2.2 to 10.8 mg/kg for Pb. Generally low translocation (TF) and bioconcentration factors (BF) were determined for all elements. However, TF for Zn and Cd were slightly higher in plants after 30 and 70 days growth, with 0.86 and 0.85 for Cd and 0.82 for Zn in agricultural soils; arsenic had higher TF in all substrates for 70 days growth plants. Differences were also observed in maize development; plants grown in agricultural soils far from tailings showed better growth (46 cm on average) while those grown in tailings had lower growth (24 cm on average). Anatomic characteristics, fresh and dry weight, biomass and number of leaves also presented a similar behavior showing significant differences (p<0.05) among experimental units with S1 presenting the highest values, followed by S2, S3 and S4. Results suggest that TMM in zones close to tailings accumulate and affect young maize plants development, disturb their growth and cause phytotoxic effects that are shown in their appearance.
Keywords: farm soil, translocation factors, bioconcentration factors, greenhouse, phytotoxic effects.
INTRODUCCIÓN
La industria minera es una de las actividades económicas de mayor tradición en México. Actualmente comprende la explotación de metales preciosos, metales industriales, minerales metálicos y no metálicos y metales obtenidos como subproductos. En 2009 los porcentajes de los principales productos del sector minero nacional fueron oro (18.1), plata (14.5), cobre (13.1), arena (7.4), zinc (7.2), grava (5.4) y fierro (4.9), que en conjunto representaron 71.1% del valor del mismo (INEGI 2005, SGM 2010). Desafortunadamente, esta actividad puede afectar el ambiente y es común que en sitios cercanos a minas y fundiciones de metales se encuentren áreas extensas con presencia de cobre, cadmio, arsénico, plomo entre otros, los cuales en altas concentraciones tienen efectos tóxicos fuertes y son considerados contaminantes ambientales capaces de alterar a los ecosistemas (Nedelkoska y Doran 2003, Chehregani et al. 2005, Wei et al. 2007, Yadav et al. 2009). Además, estos elementos, no son biodegradables y pueden bioacumularse (Boularbah et al. 2006). Las plantas han desarrollado mecanismos muy específicos para absorber, translocar y acumular nutrientes (Lasat 2000); sin embargo, algunos metales y metaloides aunque no son esenciales para los vegetales son absorbidos, translocados y acumulados debido a que presentan un comportamiento electroquímico similar a los elementos nutritivos esenciales (Souza et al. 2005). La fitoxicidad ocasionada por las altas concentraciones de metales pesados da como resultado clorosis, crecimiento débil de las plantas y puede incluso ocasionar reducción en la captación de los nutrientes así como desórdenes en el metabolismo (Chaudri et al. 2000, Broos et al. 2005, Dan et al. 2008). Así, los metales pesados causan estrés oxidante en las plantas (Fayiga et al. 2004). Además se ha reportado que el estrés por metales afecta a la fotosíntesis, a la fluorescencia de la clorofila y a la resistencia estomatal (Monni et al. 2001). Por ejemplo, el cobre inhibe la fotosíntesis y los procesos reproductores, el plomo reduce la producción de clorofila mientras que el arsénico interfiere con el proceso metabólico y disminuye la germinación de las semillas (Franco–Hernández et al. 2010, Smith et al. 2010). Consecuentemente, el crecimiento de las plantas se reduce o es total (Gardea–Torresdey et al. 2005). Todas las plantas absorben metales del suelo donde se encuentran, pero en distinto grado dependiendo de la especie vegetal y de las características y contenido de metales en el suelo. Las plantas pueden adoptar diversas estrategias frente a la presencia de metales en su entorno (Baker 1981, Barceló et al. 2003). Flores–Tavison et al. (2003) reportaron algunas especies que crecen en suelos contaminados por arsénico en Chihuahua, México. Carrillo y González–Chávez (2006) reportaron a Polygonum aviculare L. y a Jatropha dioica Sessé como acumuladoras de zinc. Armienta et al. (2008) registró a Prosopis leavigata L. y Acacia farnesiana (L.) Willd., en suelos ricos con arsénico en Zimapán, Hidalgo.
La acumulación de metales pesados en tejidos vegetales por absorción u otras formas de asociación natural, da la posibilidad de ser biodisponibles a los seres humanos y animales a través del consumo de estos productos (Brun et al. 2001, Gincchio et al. 2002, Prieto García et al. 2005, Friesl et al. 2006). Esta posible vía de exposición es particularmente relevante en el caso del maíz (Zea mays L.) ya que es un alimento básico de la dieta de los mexicanos, y su cultivo constituye una actividad importante para la sobrevivencia de la familia campesina, por lo que el impacto generado por los residuos mineros representa un problema de salud, ambiental y social. En trabajos previos, Kabata–Pendias y Pendias (2001) reportaron valores de concentraciones de metales para granos de maíz dulce en el intervalo de Cu 1.4 a 2.1, Zn 25 a 36, As 0.03 a 0.4 y Pb 0.3 a 3.0 mg/kg.
El desarrollo del maíz es afectado por algunos elementos metálicos que se refleja en los diferentes órganos y tejidos que pueden presentar algunos cambios estructurales (Malkowski et al. 2002, Souza et al. 2005, Pál et al. 2006; Shen et al. 2006) lo que altera también su rendimiento. Aunado a esto, en la región minera de Taxco no existen muchos estudios relacionados con la transferencia de metales entre el suelo y las plantas. Los trabajos más representativos son los generados por Talavera et al. (2002) y Torre–Martínez (2001) quienes determinaron el impacto de los residuos mineros sobre suelos de cultivo y urbanos de la zona, mientras que Díaz–Villaseñor (2006), evaluó la transferencia de metales entre suelo y plantas de maíz que crecieron en terrenos afectados por jales mineros. Cabe señalar que esas plantas, además de estar expuestas a suelos contaminados pueden haber recibido metales y metaloides directamente en las partes aéreas (debido al transporte de partículas de jales) y en las raíces por absorción directa de agua de riego contaminada.
En este trabajo se presentan los resultados de la acumulación de As y metales pesados en plantas de maíz (Zea mays L.) crecidas en sustratos con influencia minera bajo condiciones controladas de invernadero. Se evalúan también las diferencias en el desarrollo de las plantas provocadas por las concentraciones de metales y metaloides tóxicos en los suelos y jales. La importancia de este trabajo radica en el uso de suelos impactados con residuos mineros de la zona para estudiar el desarrollo del maíz en condiciones controladas, lo que permitió evaluar la transferencia y los efectos de los metales pesados y metaloides tóxicos procedentes únicamente del suelo. Este tipo de investigación no ha sido realizado en la zona, ni se encontraron referencias de artículos publicados similares para el maíz en otras áreas mineras.
MATERIALES Y MÉTODOS
El área de estudio (Fig. 1) se ubica en Taxco, Guerrero, en la parte suroeste de México, donde existe una importante actividad minera. El área de muestreo está ubicada en el municipio 55, a 10 km al SO de la ciudad de Taxco de Alarcón, en la localidad de Santa Rosa. En esa zona se localiza el jale "El Fraile", en las coordenadas 18°31' 28.23" latitud norte y 99°37' 55.92" longitud oeste, a una altitud de 1664 msnm. Los suelos de la región pertenecen a la unidad edafológica feozem háplico (FAO 1977, INEGI 2005), son de clase textural media. El clima es cálido con lluvias veraniegas y con un régimen de humedad que va desde ligeramente húmedo hasta seco (SEMARNAP 2000, INEGI 2005).
Muestreo de suelos, residuos y semillas
Se colectaron muestras de suelo y semillas de maíz (Zea mays L.) de la variedad H–515 (obtenidas de lugareños, información personal) a partir de las plantas crecidas en suelos de la región, también se tomaron muestras de suelo contaminado en zonas cercanas a los jales "El Fraile". Los sitios de muestreo se seleccionaron de acuerdo con su distancia a la zona contaminada y al uso de suelo, en este caso de siembra de maíz. La zona contaminada fue elegida a partir de estudios previos, que se orientaron principalmente hacia el conocimiento del comportamiento geoquímico de As y metales tóxicos en la zona (Armienta et al. 2004, Talavera et al. 2006, Díaz–Villaseñor 2006, Romero et al. 2007). Las condiciones utilizadas, que se establecieron con base en distancias respecto a los residuos del jale y por lo tanto sujetos a distinta influencia de los mismos, fueron suelo agrícola lejano a los jales o testigo (S1), suelo agrícola cercano a los jales (S2), suelo muy cercano a jales (S3) y jales (S4). Estos sustratos fueron seleccionados para evaluar la acumulación de metales en las plantas de maíz; cabe mencionar que los sustratos S1 y S2 son empleados para la siembra de esta gramínea.
Se tomaron tres muestras de jale y suelo por condición, para formar muestras compuestas de cada sustrato a partir de 20 cm de profundidad. La colecta de dos muestras de suelo agrícola donde se cultiva maíz, S2 (que corresponde al más cercano a los jales de la zona) y el suelo testigo (S1) tuvo por objeto determinar las posibles variaciones en el desarrollo de las plantas en suelos de labranza con distinta influencia de los residuos mineros. Los sitios de estudio se establecieron de acuerdo con los antecedentes del lugar así como a las distancias y el uso de suelo, para determinar diferencias en el impacto de los metales pesados en el desarrollo de las plantas de maíz.
Diseño experimental. Se utilizó un arreglo por bloques al azar con plantas de maíz. Los bloques fueron las condiciones establecidas (S1, S2, S3 y S4), las muestras de plantas se evaluaron a los 30 y 70 días de estudio. Las unidades experimentales fueron macetas de 750 g de capacidad, las cuales se llenaron con 500 g del jale ó 500 g de suelo.
Experimento en invernadero. Las semillas colectadas se esterilizaron con NaOCl al 2.5 % y se lavaron con agua destilada, se embebieron en agua desionizada por 24 h, se sembraron en macetas con los suelos o el jale establecidos anteriormente y se dejaron crecer durante 70 días en invernadero automatizado, perteneciente al Instituto de Geología, UNAM. En el invernadero se controlaron las condiciones de temperatura, humedad relativa y radiación solar, con régimen natural de luz (día–noche) y riego con agua desionizada sin permitir el lixiviado de la maceta. Se extrajeron a los 30 días 12 plantas (cuatro por condición) para evaluar diferencias entre etapas de crecimiento. Se monitorearon las condiciones ambientales controladas semanalmente y se tomaron datos de crecimiento y características anatómicas en las diferentes condiciones durante el periodo experimental.
Las condiciones ambientales en promedio para los 70 días del experimento fueron las siguientes: temperatura de 19.11 °C, humedad relativa de 54.39 % y radiación solar de 13.90 W/m2, que son condiciones óptimas para el desarrollo de las plantas de maíz de la variedad H–515 (Méndez et al. 2005, SIAP 2007).
Análisis de las muestras. Las muestras de suelos y jales fueron secadas al aire, homogeneizadas y tamizadas a través de malla 230 de 0.063 mm. Después fueron digeridas con HCl–HNO3 en horno de microondas (CEM, MARSX press) y las concentraciones de Pb, Zn, Cu, Fe, y Cd se determinaron mediante espectrofotometría de absorción atómica por llama (AAnalist 100, Perkin Elmer) empleados por Wang et al. (2008) y Maldonado et al. (2011) y de As por generación de hidruros (Nuñez–Montoya et al. 2011). Los análisis de suelo se hicieron en seis réplicas y la calidad de los resultados se evaluó mediante el análisis del material de referencia Montana Soil 2711 NIST por triplicado, obteniendo 83–100 % de recuperación.
Las plantas cosechadas después de 30 y 70 días de crecimiento se dividieron en raíz y parte aérea, se lavaron vigorosamente con agua desionizada y enseguida en un baño ultrasónico durante 20 minutos. Posteriormente se secaron a 60 °C hasta peso constante, se tomaron 0.5 g de muestra y se fragmentaron en pedazos pequeños y por último se digirieron con HNO3 concentrado y HClO4 concentrado en digestión abierta. Las concentraciones de los metales se determinaron por absorción atómica con llama (Perkin Elmer AAnalyst 100), horno de grafito para Pb y FIAS para As. Estos procedimientos han sido propuestos por Azcue et al. (1995) y reportados por otros autores (Pratas et al. 2005, Armienta et al. 2008).
Factor de translocación y bioconcentración
Las concentraciones obtenidas fueron usadas para estimar los factores de translocación (FT) y bioconcentración (FBC). El factor de translocación para los metales en las plantas se calculó como la concentración en la parte aérea dividida entre la concentración en la raíz. El factor de bioconcentración fue expresado por la proporción de la concentración del metal en la raíz sobre la concentración total en el suelo (Tu et al. 2003, Rizzi et al. 2004, Maldonado et al. 2011):

Análisis estadístico
Los tratamientos fueron replicados de 3 a 9 muestras. Los resultados se analizaron usando el paquete estadístico SPSS Versión 18. Los datos fueron tratados por el método de ANOVA y la prueba de Duncan para comparar las medias (p< 0.05). Los datos de crecimiento para la obtención de la gráfica se procesaron por medio del software GraphPad (Versión 5).
RESULTADOS Y DISCUSIÓN
Concentración de metales en suelo
Las concentraciones de los metales y metaloides tóxicos analizadas en los sustratos (suelos y jale) que alcanzaron mayores valores, en mg/kg, fueron Pb de 127 a 6166, Zn de 311.7 a 16193 y As de 28.9 a 3744.3 (Cuadro I). Se observó un incremento de estos elementos de acuerdo con la cercanía a los jales "El Fraile", con diferencias estadísticamente significativas (p<0.05) entre las medias.
El porcentaje de hierro fue elevado en todos los sitios destacando la mayor concentración en el S4 174 000 mg/kg con niveles menores y similares (sin diferencias estadísticas significativas p<0.05) entre los sitios S1 y S2 (37 000 y 34 000 mg/kg), respectivamente. Las concentraciones de metales y metaloides tóxicos en las unidades experimentales variaron de la siguiente forma, para S1 y S2, Fe> Zn> Pb> Cu>As>Cd y para S3 y S4 Fe> Zn> Pb> As>Cu> Cd y con respecto a los sitios presentaron el siguiente orden de acuerdo con las concentraciones obtenidas S4>S3>S1>S2, a excepción del Zn y Cd que mostraron otra secuencia. Los elementos con concentraciones más elevadas(mg/kg) fueron Fe 174 000, Zn con 16 193 en S3, Pb con 6166 en S4, As con 37 44.3 en S4 y Cd con 152.2 en S3 (p<0.05). Estos resultados revelan la influencia de los residuos en los suelos más cercanos, en este caso S3, y se encuentran en rangos similares o mayores a los determinados por otros autores en la misma zona minera. Talavera et al. (2008) reporta altas concentraciones en jales de Taxco (mg/kg): Cd (1.0–780), Cu (71.8–1320), Fe (2.49–25.1 %), Pb (780–43 700), Zn (380–10 000); Romero (2008) encontró valores de Pb (1479), Zn (469), Cu (72), Fe (9.4 %) y As (585) en jales de las misma zona, mientras que Díaz–Villaseñor (2006) reporta valores en suelos de siembra en la zona de "El Fraile" de Pb (1334.83), Zn (2620.0), Cu (122.78), Fe (3.8 %) y As (89.02). Sin embargo, las concentraciones determinadas en las cuatro unidades experimentales en estudio rebasan los valores de fondo regionales calculados para suelos (sin incluir los residuos mineros) de la región de Taxco según Talavera et al. (2001), que reportan valores (en ppm) de: Fe=20.8, Cu= 24.8, Cd= 1.0, Pb= 25.5 y As= 29.5. Por otro lado, las concentraciones de Pb en S3 y S4, Cd en S3 y As en todos los sustratos rebasan los valores máximos permitidos según la NOM–147–SEMARNAT/SSA1–2004 (Cd= 37ppm, Pb= 400 ppm y As= 22 ppm), por lo que posiblemente el patrón de los contaminantes metálicos en los suelos influye significativamente en el crecimiento de las plantas de maíz.
Concentraciones de metales en plantas
Las concentraciones de metales y metaloides tóxicos en las raíces de las plantas de maíz fueron superiores a las medidas en la parte aérea en los periodos de 30 y 70 días (Cuadros II y III). Se determinó también que las mayores concentraciones se presentaron en las condiciones S3 y S4 para los seis elementos analizados, As y metales Pb, Zn, Cu, Fe, Cd, mientras que las condiciones S1 y S2 presentan valores similares en un intervalo moderado comparado con las otras dos condiciones S3 y S4 (p<0.05). Estas variaciones responden a la distancia en torno al jale "El Fraile" de cada sustrato. Se ha reportado que a medida que las plantas están más alejadas a jales los niveles de concentración de metales y metaloides tóxicos disminuyen al igual que los del suelo, así mismo, la vegetación puede ser empleada como indicador útil de metales o metaloides en un medio (Kabata–Pendias 2001, Puga et al. 2006).
Sin embargo, al analizar las concentraciones de arsénico en la raíz y parte aérea (tallo y hojas) de las plantas de 70 días se encontraron casi en los mismos niveles, con intervalos bajos entre 0.1 a 0.8 mg/kg pero con diferencias significativas entre los sitios; por otro lado, aún en concentraciones bajas se ha observado que el As puede reducir el rendimiento de los cultivos (Peterson 1980). Armienta et al. (2008) determinaron en Prosopis laevigata y Acacia farnesiana elevados contenidos de As, 78.2 y 67.0 mg/kg respectivamente, en una área minera en Zimapán México; estos valores son muy contrastantes con los obtenidos para el maíz en este trabajo. Una de las causas de estas diferencias podría atribuirse a la distinta capacidad de las especies para captar el contaminante.
Los valores medidos en las raíces para los sitios estudiados estuvieron en los siguientes intervalos (mg/kg): para Fe fueron de 1437.9 a 8666.5, Zn de 54.7 a 3555.4, Cu de 10.4 a 90.1, Cd de 1.3 a 55.0, Pb de 11.1 a 320.3 y As de 0.10 a 0.40 (p<0.05). Se encontró que el sitio S4 presentó las concentraciones más elevadas que en las otras tres localidades. El elemento que se acumula en mayor cantidad en las raíces de acuerdo con los resultados obtenidos es el Zn. Las mayores concentraciones medidas en S4 implican una relación entre el sustrato en que crece la planta con la cantidad de metal absorbida por el maíz lo cual ha sido reportado para Cu por Ait et al. (2002) quienes evaluaron la bioacumulación y la tolerancia de Cu en un medio hidropónico y observaron que a mayor concentración de Cu en la solución nutritiva se incrementa la concentración en las raíces y partes aéreas del vegetal. Así mismo Kabata–Pendias y Pendias (2001) describen que la captación de metales pesados por raíces puede ser un proceso tanto pasivo (no metabólico) como activo (metabólico), estos mecanismos de captación difieren dependiendo del metal. El Pb y el Ni son absorbidos pasivamente mientras que el Cu, Mo y Zn son absorbidos activamente, esta diferencia podría asociarse al comportamiento observado en las raíces de maíz.
En la parte aérea de las plantas de maíz el Fe se encontró en el intervalo de 34.3 a 160.9 mg/kg resaltando que el sitio con mayor concentración de Fe fue el S4 (Cuadro II). El Zn presentó concentraciones de 30.8 y 44.7 mg/kg en los sitios S1 y S2, respectivamente, mientras que los sitios S3 y S4 tuvieron los mayores contenidos; 519.8 y 427.6 mg/kg respectivamente. Carrillo–González (2005) encontró valores semejantes en Tagetes lunulata (500 mg/kg) crecidas en sitios cercanos a zonas mineras de Zacatecas. Estas concentraciones de Zn relativamente altas en la planta se deben a su carácter esencial (Alloway 1995). El Cu en la parte aérea sólo fue detectado para el sitio S4 con 25.2 mg/kg en promedio. El Cu tiene una movilidad relativamente baja respecto a otros elementos en las plantas, permaneciendo en los tejidos de las raíces y hojas hasta su senescencia (Alloway 1995). Por otro lado el Cd fue detectable y variable entre los diferentes sitios en un rango de 1.1 a 41.1 mg/kg, en el siguiente orden: S3 >S4 > S2> S1. Para el Pb las concentraciones fueron parecidas en los tres primeros sitios S1, S2, S3 y muy elevada en S4, con 4.0, 3.7, 5.9 y 38.5 mg/kg, respectivamente. Finalmente, el As fue similar en los sitios S1, S2 y S4 (0.2 mg/kg) y mayor en S3 (0.8 mg/kg). Estos resultados mostraron que en la parte aérea del maíz el As presenta una baja respuesta a las concentraciones en el suelo; Pb, Fe y Cu aumentan solamente en suelos muy contaminados, mientras que Zn y Cd se incrementan con relativamente menores contenidos de los mismos en los sustratos.
Díaz– Villaseñor (2006), reporta para plantas de maíz adultas en la zona de Taxco concentraciones de metales y metaloides tóxicos (mg/kg): Pb (0.93 y 0.88), Zn (21.50 y 21.25), Cu (4.92 y 6.08), Fe (36.58 y 36.50), Cd (0.33 y 5.65) y As (0.42 y 4.62) en tallos y hojas, respectivamente. Yun–sheng et al. (2007) determinaron 246 mg/kg para Fe, 2.7 para Cu y 15.1 para Zn en plantas de maíz de 7 semanas de crecimiento. Las concentraciones medidas en la parte aérea de las plantas cultivadas en el experimento que aquí se reportan, Pb (4 a 38.5 mg/kg), Zn (30.8 a 519.8), Cu (25.2) y Fe (34.3 a 160.9), fueron mayores a las reportadas por Díaz Villaseñor (2006) y Yun–sheng et al. (2007); mientras que las de Cd (1.1 a 4.1 mg/kg) y As (0.2 a 0.8) fueron menores a las medidas por Díaz–Villaseñor (2006); esto podría deberse a diferencias en las concentraciones de los suelos utilizados en los respectivos trabajos. Por otro lado, se han efectuado estudios en plantas que crecen en torno a sitios mineros y se han reportado contenidos de metales y metaloides tóxicos que varían de acuerdo con las especies estudiadas (Wang et al. 2008, Franco–Hernández et al. 2010, Gómez– Bernal et al. 2011).
Las concentraciones de metales y metaloides tóxicos en las plantas presentaron el siguiente orden: Zn> Pb> Cu> Cd> As en raíz y parte aérea. La acumulación de MMTOX en los diferentes órganos de las plantas de maíz se presentó en el siguiente orden: raíz > parte aérea que ha sido también observado en otros trabajos (Díaz–Villaseñor 2006, Yun–sheng et al. 2007, Wang et al. 2008, Franco–Hernández et al. 2010). Este comportamiento se debe a que algunas especies basan su resistencia a los metales en la estrategia de una eficiente exclusión del metal, restringiendo su transporte hacia la parte aérea (Memon et al. 2001).
Por otro lado, se determinaron contenidos de MMTOX en las plantas de maíz a los 30 días de desarrollo superiores a los medidos a los 70 días con excepción del As (Cuadro III). Esto puede estar relacionado al efecto planta–biomasa, debido a que la biomasa en las plantas de 70 días es mayor de dos a tres veces en relación con las de 30 días de desarrollo; de acuerdo con la condición se encontraron las siguientes diferencias: para S1 es de 3 y S2, S3 y S4 es de dos veces.
Las concentraciones en las raíces y parte aérea a los 30 días presentaron el siguiente orden: Zn> Fe> Pb> Cd> As. Las concentraciones de arsénico absorbidas por las plantas fueron bajas en ambas partes analizadas a excepción de las raíces en la condición S3 y S4 con 2.5 y 2.6 mg/kg, en el caso del Pb los contenidos en la raíz a los 30 días fueron aproximadamente el doble en relación a los observados a los 70 días. Estos resultados indican que las concentraciones de metales y metaloides tóxicos acumulados en las plantas, en este caso de maíz, pueden variar de acuerdo con la etapa fisiológica de desarrollo en la que se encuentren (Souza et al. 2005, Díaz–Villaseñor 2006).
Factores de translocación y bioconcentración
Para evaluar la habilidad de las plantas para translocar los metales desde la raíz hacia la parte aérea fue calculado el FT (Cuadro IV). Para las plantas de maíz a los 70 días de desarrollo se observa que el FT más elevado correspondió al arsénico con valores entre 1.08 y 2.29, seguido por Cd de 0.07 y 0.86 y Zn de 0.12 y 0.82. El resto de los elementos analizados presentaron FT muy bajos. Las plantas acumuladoras de metales se caracterizan por FT>1 (Raskin y Ensley 2000, Tu et al. 2003). Los valores de FT mayores a 1 para el As en todos los sitios indican que es un elemento transferible en las plantas de maíz, mientras que para el resto de los metales analizados el FT fue menor a 1. Sin embargo, aunque los FT del Cd y Zn no son superiores a 1 están muy cercanos a este valor en el sitio S2, por lo que los resultados de este estudio indican que estos elementos podrían ser considerados como los más transferibles en el maíz. En el caso de las plantas de 30 días, los valores del FT más elevados se encontraron en el Zn seguidos por As y Cd.
Los factores de bioconcentración para las plantas de maíz a los 70 días de desarrollo estuvieron entre 0.03 y 0.06 para el Fe, entre 0.21 y 2.05 para el Zn, entre 0.08 y 0.22 para el Cu, entre 0.36 y 0.73 para el Cd, entre 0.04 y 0.17 para el Pb y entre 0.0001 y 0.003 para el As. Estos valores son bajos para la mayoría de los elementos analizados e indican que en esta especie no hay una hiperacumulación. Sin embargo, en el caso del Zn y del Cd se observaron valores elevados para la condición S4 con 2.05 y 0.73. Para las plantas de 30 días de desarrollo se encontró que el FBC en general es bajo, y los valores más altos se presentaron para el Zn y Cd con 0.53 y 1.05 respectivamente en la condición S2 (Cuadro IV). Por lo tanto, aunque los FT indican una traslocación hacia las partes superiores del maíz para algunos de los elementos estudiados, los valores de FBC indican que hay bajo riesgo de que los metales se transfieran significativamente a la planta. Wang et al. (2008) encontraron valores muy bajos de bioconcentración para Mn, Cd, Cu y Zn, todos inferiores a 1 y valores mayores en la translocación principalmente para Cd (Cynodon dactylon con 6.72) y Cu (Humuluas scandens con 2.20) en plantas que crecen en torno a minas. Maldonado et al. (2011), en un estudio in vitro con Acasia farnesiana reportaron valores elevados de bioconcentración (8.5 a 53.5) y valores muy bajos de translocación (0.028 a 0.032) para el Pb, lo que indica que la bioacumulación y la translocación dependen más de la eficiencia de cada especie; en el caso de Zea mays la eficiencia es baja, esto también ha sido observado por Díaz–Villaseñor (2006) en plantas de maíz adultas en "El Fraile" con valores bajos de translocación para As, Ni, Pb, Zn (0.28, 0.02, 0.01, 0.03, respectivamente) y los más elevados para Cd (2.95), sin detectar grandes diferencias entre plantas de maíz jóvenes en 30 y 70 días y las adultas. Estos estudios indican que hay especies de plantas que toleran las concentraciones elevadas de metales en el suelo porque restringen su absorción y translocación hacia las hojas. Sin embargo, otras los absorben y acumulan activamente en su biomasa, lo que requiere una fisiología muy especializada (Baker y Walter 1990). Por otro lado, algunos elementos pueden tener efectos sinérgicos o antagónicos. Para el caso de los MMTOX analizados en este trabajo, de acuerdo con Kabata–Pendias y Pendias (2001) el Fe puede tener efectos antagónicos o sinérgicos con el Cd y antagónicos con Zn y Cu; el Zn y el Pb presentan efectos sinérgicos con el Cd; el Pb y As posiblemente son antagónicos con el Zn; y el Cu puede presentar efectos antagónicos o sinérgicos con el Cd. Debido a la semejanza química del Cd y Zn, su interacción ha sido la más estudiada (Sikora y Wolt 1986). Se han descrito efectos tanto antagónicos como sinérgicos entre estos elementos (Williams y David 1976, Welch et al. 1999). Sin embargo, los efectos conjuntos de MMTOX son complejos y dependen entre otros factores de las concentraciones y de la disponibilidad de los elementos en el suelo así como de propiedades de las raíces, por lo que requieren un estudio específico que se encuentra fuera de los alcances de este trabajo.
Desarrollo
Se observó una tasa de germinación del 93.18 % de un total de 44 semillas de maíz. El brote de las plántulas se inició en el cuarto día.
Durante los primeros 10 días de crecimiento de las plantas no se observaron diferencias en el crecimiento entre las condiciones, la medida total de las plántulas fue de 3 a 5 cm para todos los individuos. Sin embargo, en los siguientes días se observó que las que tuvieron mejor desarrollo fueron las que crecieron en las condiciones S1, las más alejadas de los jales, seguidas de S2 para las cuales las hojas eran totalmente verdes, mientras que en S3 y S4 los síntomas visuales de toxicidad fueron un menor desarrollo en crecimiento, además de que sus hojas delgadas presentaron necrosis, clorosis y tonalidades pardas. Estas afectaciones se deben posiblemente a las altas concentraciones de Zn y Cd encontradas en los suelos que se sabe producen efectos fitotóxicos (Lagriffoul et al. 1998, Sousa y Rauser 2003, Sousa et al. 2005).
Así mismo, Pál (2006) investigó los efectos provocados por el Cd en maíz y reportó que este elemento induce cambios fisiológicos tales como inhibición del crecimiento, cambios en el metabolismo del agua y de los iones, inhibición de fotosíntesis, cambios en la actividad enzimática y formación de radicales libres. La síntesis y compartamentalización de las fitoquelatinas son inducidas poco tiempo después de iniciar el estrés por Cd, mientras que otros mecanismos de defensa también juegan un papel importante.
Por otro lado, el tamaño de las hojas a 30 días de crecimiento de la planta fue distinto entre las plantas de los diversos sustratos, así, S1 tuvo un máximo de 28 cm mientras que S4 no rebasó los 13 cm. En el cuadro V se muestran las diferencias encontradas a partir del análisis estadístico (p<0.05) para los pesos frescos y secos así como la biomasa estimada correspondiente a cada condición. La pérdida de biomasa o humedad fue de 58 a 69 % para las condiciones S3 y S4 respectivamente, y la biomasa osciló en un rango de 27 a 42 % para S3 y S4 con diferencias significativas (p<0.05). En la relación del peso total (fresco y seco) de la planta considerando raíz–parte aérea, se observaron en esta etapa de 30 días diferencias de hasta tres veces entre el peso de S1 (3.31 g) con respecto a S4 (1.10 g). Estadísticamente no se observaron diferencias significativas en el número de hojas vegetativas (3) a un nivel de p<0.05.
A los 70 días las plantas que mayor biomasa y desarrollo en crecimiento presentaron fueron las correspondientes a S1 con 10.9 g y 45.6 cm y a S2 con 5 g y 33.6 cm, mientras que las plantas de las condiciones S3 y S4 pesaron 3 g y midieron 24.2 cm y 2.3 g y 19.0 cm, respectivamente, y mostraron una disminución en el crecimiento a partir del día 15 (Fig. 2); el número de hojas en promedio encontradas fue de seis para las primeras dos unidades experimentales S1 y S2, y de cinco para S3 y S4. Esto muestra que los tratamientos S1 y S2 no presentaron diferencias entre ellos, de igual forma para S3 y S4 (p=0.05).
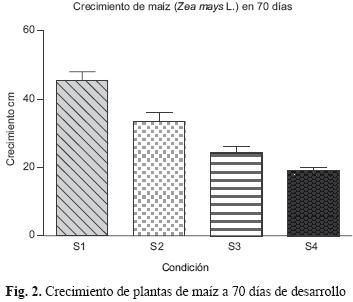
Se encontró que existe una relación de crecimiento en función a la distancia del jale con tallas menores en las plantas crecidas en el jale S4 y un mejor desarrollo en las plantas del sitio más alejado a los residuos mineros (S1). Este comportamiento puede obedecer a la exposición a Cu y Pb, ya que de acuerdo con Godbold y Kettner (1991), Gzyl et al. (1997), Ait et al. (2002) y Malkowsi (2002), las altas exposiciones de las plantas de maíz a elementos como Cu y Pb, reducen significativamente su crecimiento y ocasionan una rápida inhibición en el desarrollo de las raíces.
La tolerancia a los metales pesados es muy dependiente de varias adaptaciones biológicas, químicas y fisiológicas en los sitios contaminados con metales pesados (Leung et al. 2007). En este caso el maíz muestra diferencias en su desarrollo que responden a las distintas concentraciones de metales en el suelo.
CONCLUSIONES
Se encontró que Zn y Pb fueron los elementos con mayor concentración para los sustratos y acumulación en las plantas. Los elementos críticos que deben ser vigilados son el Pb, Cd y As, debido a su toxicidad. El As se presentó en concentraciones altas en todas las unidades experimentales. Se encontraron similitudes entre las concentraciones de los elementos evaluados en las unidades S1 y S2, a diferencia de las medidas en las unidades experimentales S3 y S4 con valores más altos en S4 para la mayoría de los metaloides y metales pesados analizados. En las plantas se observó la mayor acumulación en raíces de 30 días en la unidad experimental S3. Las concentraciones de metales y metaloides tóxicos en las plantas presentaron el siguiente orden: Zn> Pb> Cu> Cd> As en raíz y parte aérea. La acumulación de metales y metaloides tóxicos en los diferentes órganos de las plantas de maíz se presentó en el siguiente orden: raíz> parte aérea.
Los factores de translocación y de bioconcentración fueron generalmente bajos para todos los elementos. Sin embargo, en las plantas de 30 y 70 días los FT de Cd y Zn se encontraron ligeramente elevados para los suelos de siembra y el As presentó un mayor FT en todos los sustratos para plantas de 70 días, lo que indica su acumulación y transferencia de la raíz a la parte aérea.
El patrón de comportamiento en el desarrollo de las plantas de maíz respondió a las diferentes distancias en relación a los residuos mineros y las concentraciones de los contaminantes en los suelos. Las plantas crecidas en los tratamientos: suelo muy cercano a los jales (S3) y jales (S4) presentaron mayor acumulación de metales en raíz y en parte aérea y sufrieron afectaciones en su desarrollo normal en altura y biomasa. La disminución en el desarrollo del maíz que se reflejará en su productividad constituye un impacto significativo para los pequeños agricultores del área.
Los resultados señalan la relevancia de realizar evaluaciones epidemiológicas en la zona que considere al maíz entre las fuentes de exposición a metales pesados (principalmente plomo). Otra recomendación sería evaluar la parte comestible de esta planta (granos).
Por otro lado, a pesar de que ya existen normas para proteger el ambiente de este tipo de residuos, particularmente la NOM–141–SEMARNAT–2003, es importante efectuar estudios como el que aquí se presenta pues se genera información específica de lugares impactados durante muchos años (previos a la entrada en vigor de las normas pertinentes) como lo es el jal "El fraile" en Taxco, Gro. Entre las alternativas que pueden investigarse para sanear estos sitios sería el control del drenaje ácido así como la introducción de especies de plantas acumuladoras y tolerantes endémicas en zonas consideradas de alto riesgo ecológico.
La información generada por esta investigación debería ser considerada por las autoridades para promover que se realicen pruebas similares en otras zonas mineras, evitar los cultivos que pudieran afectar a los animales y al hombre, así como fomentar el desarrollo de otro tipo de actividades económicas en dichas zonas.
AGRADECIMIENTOS
Los autores agradecen el apoyo otorgado por el laboratorio de Química Analítica del Instituto de Geofísica de la UNAM y a N. Ceniceros, A. Aguayo y O. Cruz por su asistencia en el procesamiento de las muestras, así como a la responsable del invernadero Mónica Rangel, por el uso de las instalaciones.
REFERENCIAS
Ait A.A., Pilar B.M. y Ater M. (2002). Tolerance and bioaccumulation of copper in Phragmites australis and Zea mays. Plant and Soil. 239, 103–111. [ Links ]
Alloway, B. J. (1995). Heavy metals in soil. Blackie A & P. London, UK, 403 pp. [ Links ]
Armienta M.A., Ongley L.K., Rodríguez R., Cruz O., Mango H., y Villaseñor G. (2008). Arsenic distribution in mesquite (Prosopis laevigata) and huizache (Acacia farnesiana) in the Zimapán mining area, México. Geochem.: Explo., Environ., Anal. 8, 1–7. [ Links ]
Armienta M.A., Talavera O., Villaseñor G., Espinosa E., Pérez–Martínez I., Cruz O., Ceniceros N. y Aguayo A. (2004). Environmental behavior of metals from tailings in shallow rivers: Taxco, central Mexico, Transactions of the Institution of Mining and Metallurgy Section B–Applied Earth Science, 113: 76–82. [ Links ]
Azcue J.M., Mudroch A., Rosa F., Hall G.E.M., Jackson T.A. y Reynoldson T. (1995). Trace elements in water, sediments, porewater and biota polluted by tailings from and abandoned gold mine in British Columbia, Canada. J. Geochem. Explor. 52, 25–34. [ Links ]
Baker, A. J. M. y Walter, P. L. (1990). Ecophysiology of metal uptake by tolerant plants. En: Heavy metal tolerance in plants: Evolutionary aspects (A. J. Shaw, Ed.). CRC Press Inc., Boca Raton, FL, pp. 155–157. [ Links ]
Baker, A. J. M. (1981). Accumulators and excluders – strategies in the response of plants to heavy metals. Journal of Plant Nutrition. 3: 643–654. [ Links ]
Barceló, J. y Poschenrieder, C. (2003). Phytoremediation: principles and perspectives. Contrib Sci. 2: 333–344. [ Links ]
Boularbah A., Schwartz C., Bitton G., Aboudrar W., Ouhammou A. y Louis Morel J. (2006). Heavy metal contamination from mining sites in South Morocco; 2. Assessment of metal accumulation and toxicity in plants. Chemosphere, 63, 811–817. [ Links ]
Broos K., Beyens H. y Smolders E. (2005). Survival of rhizobia in soil is sensitive to elevated zinc in the absence of the host plant. Soil Biol. Biochem. 37, 573–579. [ Links ]
Brun L.A., Maillet J., Hinsinger P. y Pepin M. (2001). Evaluation of copper availability to plants in copper–contaminated vineyard soils. Environ. Pollut. 111, 293–302. [ Links ]
Carrillo–González R., y González–Chávez M.C.A. (2006). Metal accumulation in wild plants surrounding mining wastes. Environ. Pollut. 144, 84–92. [ Links ]
Carrillo–González R. (2005). Niveles de contaminación de los suelos y las plantas. En: El sistema planta–microorganismo–suelo en áreas contaminadas con residuos de minas (M. C. González–Chávez, J. Pérez–Moreno, y R. Carrillo–González, Ed.). Colegio de postgraduados. Montecillo, Estado de México. pp. 34–60. [ Links ]
Chaudri A.M., Allain C.M., Barbosa–Jefferson V.L., Nicholson F.A., Chambers B.J. y McGrath S.P. (2000). A study of the impacts of Zn and Cu on two rhizobial species in soils of a long term field experiment. Plant Soil. 22, 167–179. [ Links ]
Chehregani A., Malayeri B. y Golmohammadi R. (2005). Effect of heavy metals on the developmental stages of ovules and embryonic sac in: Euphorbia cheirandenia. Pakistan J. Biol. Sci. 8, 622–625. [ Links ]
Dan T., Hale B., Johnson D., Conard B., Stiebel B. y Veska E. (2008). Toxicity thresholds for oat (Avena sativa L.) grown in Ni–impacted agricultural soils near Port Colborne, Ontario, Canada. Can. J. Soil Sci. 88, 389–398. [ Links ]
Díaz–Villaseñor E. (2006). Transferencia de metales entresuelo y plantas de Maíz (Zea mays L.), sembradas en terrenos impactados por jales mineros en la región de Taxco, Guerrero. Tesis maestría. UAG. [ Links ]
FAO (1977). Guía para la descripción de perfiles de suelos. Food and Agriculture Organization of the United Nations. Guía. Roma. 70 pp. [ Links ]
Fayiga A.O., Ma L.Q., Cao X., y Rathinasabapathi B. (2004). Effects of heavy metals on growth and arsenic accumulation in the arsenic hyperaccumulator Pteris vittata L. Environ. Pollut, 132, 289–296. [ Links ]
Flores–Tavison E., Alarcón–Herrera M.T., González E.S., y Olguín E.J. (2003). Arsenic tolerating plants from mine sites and hot springs in the semi Arid region of Chihuahua, México. Acta biotechnol 23, 113–119. [ Links ]
Franco–Hernández M.O., Vásquez–Murrieta M.S., Patiño–Siciliano A., y Dendooven L. (2010). Heavy metals concentration in plants growing on mine tailings in Central Mexico. Biores. Techn. 101, 3864–3869. [ Links ]
Friesl W., Friedl J., Platzer K., Horak O. y Gerzabek M.H. (2006). Remediation of contaminated agricultural soils near a former Pb/Zn smelter in Austria: batch, pot and field experiments. Environ. Pollut. 144, 40–50. [ Links ]
Gardea–Torresdey J.L., Peralta–Videa J.R., de la Rosa G. y Parsons J.G. (2005). Phytoremediation of heavy metals and study of the metal coordination by X–ray absorption spectroscopy. Coor. Chem. Revs. 249, 1797–1810. [ Links ]
Gincchio R., Rodriguez P.H., Badilla–Ohlbaum R., Allen H.E. y Lagos G.E. (2002). Effect of soil copper content and pH on copper uptake of selected vegetables grown under controlled conditions. Environ. Toxicol. Chem. 21, 1736–1744. [ Links ]
Godbold D.L. y Kettner C. (1991). Use of root elongation studies to determine aluminium and lead toxicity in Picea abies seedlings. J. Plant Physiol. 138, 231–235. [ Links ]
Gómez–Bernal J.M., Santana–Carrillo J., Romero–Martin F., Armienta–Hernández M.A., Morton–Bermea O. y Ruiz–Huerta E.A. (2010). Plantas de sitios contaminados con desechos mineros en Taxco, Guerrero, México. Bol. Soc. Bot. Méx. 87, 131–133. [ Links ]
Gzyl J., Przymusinsk R. y Wozny A. (1997). Organospecific reaction of yellow lupin seedlings to lead. Acta Soc. Bot. Pol. 66, 61–66. [ Links ]
INEGI (2005). Prontuario de información geográfica municipal de los Estados Unidos Mexicanos. Taxco de Alarcón, Guerrero. Instituto Nacional de Estadística y Geografía de México. Clave geoestadística 12055. [ Links ]
Kabata–Pendias, A. y Pendias H (2001). Trace elements in soils and plants. Third edition. CRC Press– Boca Raton. USA. 413 pp. [ Links ]
Lagriffoul A., Mocquot B., Mench M. y Vangronsveld J. 1998. Cadmium toxicity effects on growth, mineral and chlorophyll contents, and activities of stress related enzymes in young maize plants (Zea mays L.). Plant and Soil. 200, 241–250. [ Links ]
Lasat M. (2000). Phytoextraction of metals from contaminated soil: a review of plant/soil/metal interaction and assessment of pertinent agronomic issues. J. Hazard Subst Res 2, 1–25. [ Links ]
Leung H.M., Ye Z.H. y Wong M.H. (2007). Survival strategies of plants associated with arbuscular mycorrhizal fungi on toxic mine tailings. Chemosphere 66, 905–915. [ Links ]
Maldonado M.A., Favela T.E., Rivera C.F. y Volke S.T.L. (2011). Lead bioaccumulation in Acacia farnesiana and its effect on lipid peroxidation and glutathione production. Plant and Soil. 339, 377–389. [ Links ]
Malkowsi E., Kita A., Galas W., Karcz W. y Kuperberg J.M. (2002). Lead distribution in corn seedlings (Zea mays L.) and its effect on growth and the concentrations of potassium and calcium. Plant Growth Regul. 37, 69–76. [ Links ]
Memon A.R., Aktoprakligíl D., Özdemír A. y Vertii A. (2001). Heavy metal accumulation and detoxification mechanisms in plants. Turk J Bot. 25, 111–121. [ Links ]
Méndez G.M., Solorza J.F., Velázquez del Valle M., Gómez N.M., Paredes O.L. y Bello–Pérez L.A. (2005). Composición química y caracterización calorimétrica de híbridos y variedades de maíz cultivadas en México. Agrociencia. 39, 267–274. [ Links ]
Monni S., Uhlig C., Hansen E., y Magel E. (2001). Ecophysiological responses of Empetrum nigrum to heavy metal pollution. Environ. Pollut. 112, 121–129. [ Links ]
Nedelkoska T.V. y Doran P.M. (2000). Characteristics of heavy metal uptake by plant species with potential for phytoremediation and phytomining. Miner. Eng. 13, 549–561. [ Links ]
Norma Oficial Mexicana NOM–147–SEMARNAT/SSA1–2004 Que establece criterios para determinar las concentraciones de remediación de suelos contaminados por arsénico, berilio, cadmio, cromo hexavalente, mercurio, níquel, plomo, selenio, talio y vanadio. Diario Oficial de la Federación, 2 de marzo de 2007. México. [ Links ]
Nuñez–Montoya G.O., Alarcón–Herrera M.T., Melgoza–Castillo A., Rodríguez–Almeida F.A. y Royo–Márquez M.H. (2011). Evaluación de tres especies nativas del desierto chihuahuense para uso en fitoremediación. Terra Latinoamericana 1, 35–41. [ Links ]
Pál M., Horváth E., Janda T., Páldi E. y Szalai G. (2006). Physiological changes and defense mechanisms induced by cadmium stress in maize. J. Plant Nutr. Soil Sci. 169, 239–246. [ Links ]
Peterson P. y Girling C. (1980). Other Trace Metals. Impact of Heavy Metal Pollution on Plants. Vol.1. Effects of trace metals on plant function. N. Lepp, Ed. London: Applied Science Publishers. [ Links ]
Pratas J., Prasad M.N.V., Freitas H. y Conde L. (2005). Plants growing in abandoned mines of Portugal are useful for biogeochemical exploration of arsenic, antimony, tungsten and mine reclamation. J. Geochem. Explor. 85, 99–107. [ Links ]
Prieto–García F., Callejas H.J., Lechuga M.A., Gaytán J.C., y Barrado E.E. (2005). Acumulación en tejidos vegetales de Arsénico provenientes de aguas y suelos de Zimapán estado de Hidalgo, México. Bioagro 17, 129–135. [ Links ]
Puga, S., Sosa, M., Lebgue, T., Quintana, C., y Campos, A. (2006). Contaminación por metales pesados en el suelo provocado por la industria minera. Ecología Aplicada 5: 149–155. [ Links ]
Raskin I. y Ensley B.D. (2000). Phytoremediation of toxic metals: Using plants to clean up the environment. John Wiley & Sons, New York. 304 pp. [ Links ]
Rizzi L., Petruzzelli G., Poggio G. y Vigna Guidi G. (2004). Soil physical changes and plant availability of Zn and Pb in a treatability test of phytostabilization. Chemosphere. 57, 1039–1046. [ Links ]
Romero F.M., Armienta M.A. y González–Hernández G. (2007). Solid–phase control on the mobility of potentially toxic elements in an abandoned lead/zinc mine tailings impoundment, Taxco, México. Appl. Geochem. 22, 109–127. [ Links ]
Romero F.M., Armienta Ma.A., Gutiérrez M.E., y Villaseñor G. (2008). Factores geológicos y climáticos que determinan la peligrosidad y el impacto ambiental de jales mineros. Revista Internacional de Contaminación Ambiental. 24, 43–54. [ Links ]
SEMARNAP (2000). Evaluación de la degradación del suelo causada por el Hombre en la República Mexicana, Escala 1:250,000. Secretaría de Medio Ambiente y Recursos Naturales. Memoria Nacional. México. 58 pp. [ Links ]
Servicio Geologico Mexicano (SGM) (2010). Resumen de indicadores Básicos de la Minería. En: Anuario Estadistico de la Minería Mexicana. Ampliada 2009. (Secretaria de Economia, Ed). Coordinación General de Minería, pp. 10–48. [ Links ]
Shen H., Christie P. y Li X. (2006). Uptake of zinc, cadmium and phosphorus by arbuscular mycorrhizal maize (Zea mays L.) from a low available phosphorus calcareous soil spiked with zinc and cadmium. Environ. Geoche. And Healt. 28, 111–119. [ Links ]
SIAP (2007). Situación actual y perspectivas del maíz en México 1996–2012. Servicio de Información Agroalimentaria y Pesquera. 208 pp. [ Links ]
Sikora, F.J. y Wolt, J. (1986). Effect of cadmium and zinc treated sludge on yield and cadmium–zinc uptake of corn. J. Environ. Qual. 15, 340–345. [ Links ]
Smith E.S., Christophersen M.H., Pope S., y Andrew S.F. (2010). Arsenic uptake and toxicity in plants: integrating mycorrhizal influences. Plant Soil. 327, 1–21. [ Links ]
Souza F.J., Dolder H. y Cortelazzo A.L. (2005). Effect of excess cadmium and zinc ion son roots and shoots of maize seedlings. J. Plant Nutr. 28, 1923–1931. [ Links ]
Souza J.F. y Rauser W. (2003). Maize and radish sequester excess cadmium and zinc in different ways. Plant Sci. 165, 1009–1022. [ Links ]
Talavera O., Armienta M.A., Dótor A., y García J. (2002). Metales pesados relacionados con actividades mineras en la región de Taxco, Guerrero, III Reunión Nacional de Ciencias de la Tierra. Puerto Vallarta, México. [ Links ]
Talavera O., Armienta M.A., García A. J. y Flores M.N. (2006). Geochemistry of leachates from the El Fraile sulfide tailings piles in Taxco, Guerrero, Southern Mexico. Environ. Geoch. Health. 28, 243–255 [ Links ]
Talavera O., Díaz V.E. y Ramírez G.A.H. (2008). Impacto de los jales mineros en los recursos naturales en la región de Taxco, Guerrero. Boletín de Mineralogía. 18, 65–66. [ Links ]
Torre–Martínez J. (2001). Caracterización físico–ambiental y distribución de metales pesados en suelos de la cuenca del Río Taxco. Tesis de licenciatura UAG. [ Links ]
Tu C., Ma l.Q. y Bondada B. (2003). Arsenic accumulation in the hyperaccumulator Chinese brake and its utilization potential for phytoremediation. J. Environ. Qual. 31, 1671–1675. [ Links ]
Wang X., Liu Y., Zeng G., Chai L., Xiao X., Song X. y Min Z. (2008). Pedological characteristic of Mn tailings and metal accumulation by native plants. Chemosphere. 72, 1260–1266. [ Links ]
Wei Z., Xi B., Zhao Y., Wang S., Liu H. y Jiang Y. (2007). Effect of inoculating microbes in municipal solid waste composting on characteristics of humic acid. Chemosphere 68, 368–374. [ Links ]
Welch R.M., Hart J.J., Norvell W.A., Sullivan L.A. y Kochian L.V. (1999). Effects of nutrient solution zinc activity on net uptake, translocation, and root export of cadmium and zinc by separated sections of intact durum wheat (Triticum turgidum L. var durum) seeding roots. Plant soil. 208, 243–250. [ Links ]
Williams C.H. y David D.J. (1976). The accumulation in soil of cadmium residues from phosphate fertilizers and their effect on the cadmium content of plants. Soil Sci. 121, 86–93. [ Links ]
Yadav S.K., Juwarkar A.A., Kumar G.P., Thawale P.R., Singh S.K. y Chakrabarti T. (2009). Bioaccumulation and phyto–translocation of arsenic, chromium and zinc by Jatropha curcas L.: impact of dairy sludge and biofertilizer. Bioresour. Technol. 100, 4616–4622. [ Links ]
Yun–sheng X., Bao–dong C., Peter C., Andrew S.F., You–shan W. y Xiao–lin L. (2007). Arsenic uptake by arbuscular mycorrhizal maize (Zea mays L.) grown in an arsenic–contaminated soil with added phosphorus. J. Environ. Sci. 19, 1245–1251. [ Links ]














