Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.28 n.1 Ciudad de México Feb. 2012
Artículos
Respuesta de crecimiento y tolerancia a metales pesados de Cyperus elegans y Echinochloa polystachya inoculadas con una rizobacteria aislada de un suelo contaminado con hidrocarburos derivados del petróleo
Growth response and tolerance to heavy metals of Cyperus elegans and Echinochloa polystachya inoculated with a rhizobacteria isolated from soil polluted with petroleum derived hydrocarbons
Daniela LABRA–CARDÓN1, Leonor Angélica GUERRERO–ZÚÑIGA3, Aída Verónica RODRÍGUEZ–TOVAR2, Silvano MONTES–VILLAFÁN1, Sandra PÉREZ–JIMÉNEZ1 y Angélica RODRÍGUEZ–DORANTES1*
1 Laboratorio Fisiología Vegetal, Departamento de Botánica, Escuela Nacional de Ciencias Biológicas, IPN, Prol. Carpio y Plan de Ayala s/n. C.P.11340, México, D.F. *Correo electrónico: rodorantes@yahoo.com.mx.
2 Laboratorio Micología Médica, Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, I.P.N., Prol. Carpio y Plan de Ayala s/n. C.P.11340, México, D.F.
3 Dirección de Seguridad y Medio Ambiente, Instituto Mexicano del Petróleo, Eje Central Lázaro Cárdenas 152, C.P. 07730, México, D.F.
Recibido agosto 2010
Aceptado septiembre 2011
RESUMEN
Se ha demostrado que las interacciones benéficas entre cultivos de plantas y bacterias son útiles en la disminución de la toxicidad producida por metales, así como en el aporte de nutrientes esenciales; por ello, las comunidades microbianas han sido empleadas para la biorremediación, en particular las rizobacterias promotoras del crecimiento (PGPR's por sus siglas en inglés). Este estudio evaluó la respuesta del crecimiento y la tolerancia a metales pesados de dos especies de plantas de pantano: Cyperus elegans y Echinochloa polystachya, inoculadas con una rizobacteria solubilizadora de fosfatos identificada como Bacillus sp. y expuestas a cadmio (Cd) y zinc (Zn). El crecimiento de ambas especies se favoreció en presencia de la rizobacteria; sin embargo, las plántulas crecidas con los metales e inoculadas con la rizobacteria, no mostraron diferencias significativas en las variables de crecimiento, lo que sugiere que su respuesta ante los metales está relacionada tanto con la dosis como con el tiempo de exposición, así como con la tolerancia intrínseca de estas especies. No obstante esto, la presencia de la rizobacteria mantuvo el crecimiento de las plántulas de C. elegans ante los metales pesados, lo que podría estar asociado con un efecto protector a las plántulas con la disminución de la toxicidad de ambos metales. Es importante enfatizar la importancia de la investigación sobre la colonización de las rizobacterias, no solamente en la espermosfera, sino también en las raíces de las plántulas inoculadas con el incremento de la superficie radical para la absorción de metales, así como con el papel protector de las rizobacterias contra la toxicidad de metales en el suelo, lo que permitirá establecer un mejor crecimiento y desarrollo de especies vegetales para la estabilización, la revegetación y la remediación de suelos contaminados con metales pesados.
Palabras clave: metales pesados, rizobacterias promotoras del crecimiento vegetal, Cyperus, Echinochloa.
ABSTRACT
The benefic interactions between cultures of plants and bacteria have been demonstrated to be useful for the decrease of toxicity produced by heavy metals and nutritional deficiency. With this, the microbial communities have been applied as tools for bioremediation, particularly the plant growth promoting rhizobacteria (PGPR's). This study evaluated the growth response and tolerance to heavy metals of two swamp plant species: Cyperus elegans and Echinochloa polystachya, both inoculated with phosphate solubilizing rhizobacteria Bacillus sp. exposed to cadmium (Cd) and zinc (Zn). The growth response of both species was favored by the presence of the rhizobacteria without metals; although, the grown with both metals and inoculated with the rhizobactera metal tolerant did not show a significant promotion of their growth; this suggests that their response to the metals are related with the doses and the exposition time and to the intrinsic tolerance of the plant species to these metals. Even these results, the presence of the rhizobacteria maintained the growth of C. elegans seedlings exposed to the heavy metals assessment; this could be associated with a plant protecting effect that diminishes the metal toxicity. It is relevant to emphasize the research importance about the colonization by rhizobacteria not only at the spermosphere but also at the roots of the inoculated seedlings with the increase of the radical surface for the metals absorption and the protecting role of the rhizobacteria against the toxicity of metals, that allows the establishment of a better growth and development of plant species to the stabilization, vegetation recover and the remediation of contaminated soils with heavy metals.
Key words: heavy metals, plant growth promoting rhizobacteria, Cyperus, Echinochloa.
INTRODUCCIÓN
El suelo, el agua superficial y el agua subterránea pueden ser contaminados con compuestos peligrosos como consecuencia de actividades naturales (e.g. la erosión y filtraciones salinas) y de actividades humanas (e.g. industria, agricultura, tratamiento de aguas residuales, construcciones y la minería) (Arthur et al. 2005). Dentro de los compuestos peligrosos que son considerados como contaminantes de naturaleza inorgánica se tiene a los metales pesados, nitratos, fosfatos y ácidos.
Los metales pesados como plomo (Pb), arsénico (As), cadmio (Cd), cobre (Cu), zinc (Zn), níquel (Ni) y mercurio (Hg), se adicionan en forma continua a los suelos a través de actividades agrícolas, actividades industriales, incineración y emisiones de los vehículos (Khan 2005). Tanto el Cd como el Zn son elementos que poseen propiedades ambientales y geoquímicas similares; donde el procesamiento y la liberación subsecuente de Zn al ambiente se acompaña normalmente por Cd (Kabata–Pendias y Pendias 1992). El Cd es considerado un metal pesado que se libera al ambiente como resultado de una gran variedad de actividades antrópicas. No obstante que no es un elemento esencial para las plantas, este metal se absorbe por las raíces y se transporta hacia las hojas en muchas especies. Por lo que altas concentraciones de éste ocasionan toxicidad en las plantas por su alta movilidad (Arduini et al. 2006, Singh et al. 2006, Matusik et al. 2008, Li et al. 2009). Generalmente, causa daños en las hojas produciendo clorosis y enrollamiento de las mismas; así como también la disminución del crecimiento de las raíces y el brote (Milone et al. 2003, Xu et al. 2008, Tang et al. 2009).
El Zn es considerado como un micronutriente esencial para el crecimiento de las plantas; ya que es un constituyente vital de varias enzimas metabólicas (Saravan et al. 2007), sin embargo también puede ser muy tóxico cuando éste se presenta a una concentración excesiva (Küpper et al. 2000, Clemens, 2006, Broadley et al. 2007). El Zn se adiciona a las plantas a través de fertilizantes como ZnSO4 que, en los suelos, puede transformarse a formas insolubles dependiendo de las condiciones edáficas de los mismos. Se menciona que la solubilización del Zn por microorganismos es un proceso de suma importancia para el aporte a las plantas de este micronutriente (Di Simine et al. 1998, Fasim et al. 2002).
Un método alternativo para la recuperación de suelos contaminados es la biorremediación que se define como la acción de microorganismos o de otros sistemas biológicos para la degradación de agentes contaminantes del ambiente, con el uso de métodos in situ y ex situ para eliminar la contaminación de suelos (Kuiper et al. 2004). La rizósfera se considera como una interfase importante entre el suelo y la planta, ya que desempeña un papel fundamental en el establecimiento de la biorremediación de suelos contaminados. Entre los microorganismos rizosféricos que están involucrados en las interacciones con suelos contaminados con metales pesados, las bacterias rizosféricas promotoras del crecimiento vegetal denominadas PGPR (por sus siglas en inglés, Plant Growth Promoting Rhizobacteria, término establecido por Kloepper (1989)), tienen una atención especial (Ma et al. 2011). Se consideran microorganismos que migran del suelo a la rizosfera de las plantas y colonizan sus raíces (Kloepper y Schroth 1978); actúan como agentes protectores contra diversos patógenos, son consideradas como fertilizadores del suelo por su capacidad para movilizar nutrientes, producen fitohormonas que modifican la fisiología de las plantas y también participan en el establecimiento de procesos simbióticos que son de extrema importancia ecológica. Dentro de las PGPR´s existen bacterias pertenecientes a un gran número de géneros bacterianos como Azotobacter, Acetobacter, Azospirillum, Burkholderia, Pseudomonas y Bacillus (Tenuta 2003). El manejo biológico que implica el uso de plantas y de su microbiota rizosférica asociada, ha generado mucho interés para remediar y secuestrar sustancias peligrosas del ambiente (Zaidi et al. 2006) y se ha utilizado como una herramienta más para tratar sitios contaminados, en particular, con metales pesados (Kuiper et al. 2004, Wu et al. 2006) al favorecer el desarrollo de las plantas crecidas en presencia de metales como Ni, Pb y Zn, al generar un crecimiento radical mayor durante las primeras etapas de su crecimiento (Glick et al. 1998).
La promoción del crecimiento radical es uno de los marcadores principales para medir los efectos benéficos de las PGPR (Glick et al. 1995); ya que las fitohormonas que estimulan el crecimiento de las plantas y que se producen por estas rizobacterias dentro de la zona radical, incrementan la densidad y la longitud de los pelos radicales. El establecimiento rápido de las raíces, sea por elongación de las raíces primarias o por la proliferación de raíces laterales y adventicias, es ventajoso para las plántulas conforme incrementan su habilidad de anclaje al suelo, así como el incremento en la superficie de absorción de agua y nutrientes de su ambiente, lo que potencia su capacidad de sobrevivencia (Volkmar y Bremer 1998, Hariprasad et al. 2009). Las asociaciones entre plantas y microorganismos tolerantes a metales pesados merecen una atención particular; ya que éstos poseen el potencial para bioacumular metales de ambientes contaminados o favorecen su movilización e inmovilización, que en consecuencia incrementan la absorción de éstos y favorecen el crecimiento de las plantas, lo que ayuda a la limpieza de suelos con metales pesados (Singh et al. 2007, Glick 2010, Ma et al. 2011). Este estudio evaluó la respuesta del crecimiento y de la tolerancia a metales pesados de dos especies vegetales de pantano: Cyperus elegans L. y Echinochloa polystachya H.B.K. inoculadas con una rizobacteria solubilizadora de fosfato identificada como Bacillus sp., las plántulas estuvieron expuestas a Cd y Zn en sistemas hidropónicos.
MATERIALES Y MÉTODOS
Manejo e identificación de la rizobacteria solubilizadora de fosfatos de un suelo contaminado con hidrocarburos derivados del petróleo
La cepa bacteriana empleada fue aislada de una zona de un suelo contaminado con hidrocarburos derivados del petróleo, cuya concentración de hidrocarburos de fracción ligera (HCFL) es de 90 ppm, de hidrocarburos de fracción media (HCFM) de 100 ppm y de hidrocarburos de fracción pesada (HCFP) de 450 ppm. La rizobacteria aislada presentó la propiedad de solubilizar fosfatos in vitro (datos no mostrados) y su identificación por morfología macroscópica de los aislados bacterianos se realizó considerando aspectos convencionales como: morfología bacteriana, afinidad tintorial y arreglo celular, para lo cual se usó la técnica de tinción de Gram.
Para la identificación molecular de la rizobacteria seleccionada, se llevó a cabo la amplificación del gen completo que codifica para el fragmento 16S rDNA, cuya característica principal es el alto nivel de conservación, por lo que se ha utilizado como un marcador molecular efectivo para la identificación y clasificación microbiana usando herramientas moleculares y bioinformáticas. En este caso, se emplearon los iniciadores universales fD1 y rD1, que fueron diseñados por Weisburg et al. (1991) para la amplificación completa del gen de aproximadamente 1500 pb. Se obtuvo ADN genómico de cada aislado bacteriano usando el método descrito por Allers y Lichten (2000) y la amplificación del marcador molecular 16S rDNA con la siguiente mezcla de reacción: 50 ng de ADN genómico, 200 mM de dNTPs, 3 mM de Mg++, 50 pmol de cada iniciador y 2.5 U de la enzima Taq polimerasa (Invitrogene, CA) en un volumen final de 100 µL. Dicha mezcla de reacción se sometió a las siguientes condiciones de amplificación: una desnaturalización inicial de 5 minutos a 95 ºC, seguido de 30 ciclos a 95 ºC por 2 minutos, 42 ºC por 40 segundos y 72 ºC por 4 minutos; finalmente, un ciclo de polimerización de 72 ºC por 20 minutos. Los productos de PCR fueron separados por electroforesis en geles de agarosa al 1 % y teñidos con bromuro de etidio; estos productos se purificaron y se obtuvo la secuencia de nucleótidos (FES–Iztacala, UNAM). Las secuencias resultantes, se compararon con las secuencias reportadas en el banco de genes disponible de la NCBI (National Center for Biotechnology Information), utilizando la herramienta BLAST con la finalidad de conocer la similitud con otras secuencias ya reportadas y tener, entonces, una identificación de la cepa bacteriana.
Evaluación de la promoción del crecimiento vegetal y la determinación de la tolerancia a metales pesados de Cyperus elegans y Echinochloa polystachya
El material vegetal se obtuvo a partir de la limpieza y selección de semillas de Cyperus elegans L. (Cyperaceae) y Echinochloa polystachya H.B.K. (Poaceae), provenientes de una de las zonas contaminadas del Pantano Santa Alejandrina situado en las inmediaciones de la refinería Lázaro Cárdenas del Río, en Minatitlán, Veracruz, ubicada dentro de la planicie costera del sureste de México (N 17º 58′ 12.7" y W 94º 30′ 52.2") y colectadas en época de verano y ambas especies en etapa de floración. Para la evaluación de la promoción del crecimiento vegetal de estas especies se establecieron los cultivos hidropónicos en frascos de vidrio con tapas magenta (Sigma, Aldrich) usando 25 mL de medio mineral que contenían las siguientes sales: 0.20M NH4H2PO4, 0.50M NH4NO3, 1.15M Ca(NO3)2, 0.26M CaCl2, 0.20M MgCl2·6H2O, 0.20M Mg(NO3)2·6H2O, 0.40M MgSO4 7H2O, 0.20M KH2PO4, 1.20M KNO3, 0.50M K2SO4, 0.040M FeCl3·6H2O, 1.2 × 10–2M H3BO3, 1.2 × 10–4M CuCl2·H2O, 2.3 × 10–3M ZnCl2, 4.4 × 10–4M MnCl2·4H2O, 6 × 10–6M Na2MoO4·H2O, EDTA y FeSO4·7H2O, con un pH= 6, con la adición de agar bacteriológico al 6 % (medio mineral blando).
Una colonia del aislado bacteriano (rizobacteria XIII) se resuspendió en 5 mL de agua destilada estéril para obtener un inóculo de 3.5 × 107 UFC/mL, con esta suspensión se inocularon semillas por separado de C. elegans y de E. polystachya, previamente desinfectadas con 10 mL de alcohol al 70 % durante 3 minutos y con 10 mL de hipoclorito de sodio al 10 % durante 5 minutos, enjuagando cinco veces con agua destilada estéril. Las semillas de ambas especies se dejaron embebidas por 30 minutos en la suspensión bacteriana preparada. También se embebieron semillas de ambas especies (previamente desinfectadas) en agua destilada estéril por 30 minutos, antes de colocarlas sobre la superficie del medio mineral blando.
Se evaluó tanto la promoción del crecimiento vegetal por Bacillus sp. en los experimentos como también el indicio de la tolerancia que confirió este aislado al incrementar el crecimiento vegetal bajo la presencia de los metales pesados seleccionados: Cd (3CdSO4•8H2O: 0.01, 0.05 y 0.1 mM) y Zn (ZnCl2: 3, 4 y 5 mM), con experimentos con y sin la adición de los contaminantes. La siembra de las semillas en el medio mineral blando y con los tratamientos, se realizó bajo condiciones de esterilidad; los cultivos con el material seminal se mantuvieron en un cuarto de incubación bajo condiciones controladas de temperatura (+/–36 ºC) y fotoperíodo (12:12), por 45 días. El número de semillas por experimento fue de 60 y los ensayos se realizaron por triplicado.
Una vez concluido el tiempo de incubación de los cultivos, se extrajeron las plántulas obtenidas de cada experimento para la medición de la longitud foliar y radical tanto de las plantas inoculadas como las plantas sin inocular y con metales pesados. Los resultados obtenidos se consideraron para la determinación del índice de tolerancia (IT) (Wilkins 1978, Burd et al. 1998), por la expresión: IT = LRm / LRc, donde: LRm es la longitud radical de las plántulas que crecieron en presencia del metal específico adicionado y LRc es la longitud radical de las plántulas crecidas en ausencia del metal, lo mismo con la longitud foliar. Se consideraron también los experimentos de ambas especies con y sin el inóculo bacteriano. Todos los valores de IT se multiplicaron por 100 para obtener los porcentajes de crecimiento. A todos los resultados obtenidos se les aplicó el análisis de varianza (ANOVA) y laprueba de Tukey–Kramer de comparación múltiple, empleando el paquete estadístico GraphPad InStat, V2.03 (Aceves 1993).
RESULTADOS Y DISCUSIÓN
Caracterización e identificación de la rizobacteria solubilizadora de fosfato aislada de un suelo contaminado con hidrocarburos derivados del petróleo
De 23 aislados bacterianos que se obtuvieron del suelo rizosférico contaminado con hidrocarburos derivados del petróleo se seleccionó a la rizobacteria XIII que es una bacteria solubilizadora de fosfato. La morfología microscópica de la rizobacteria fue la de un bacilo corto Gram positivo esporulado. De los resultados de su análisis molecular, la búsqueda y alineamiento de las secuencias amplificadas del gen 16S rDNA con las secuencias incluidas en el banco de genes, se obtuvo como resultado un alto porcentaje de similitud (89 %) con el género Bacillus sp. Para la asignación taxonómica al nivel de especie, con base en la comparación de secuencias de este gen, se debe guardar una similitud mayor al 97.5 %; mientras que para la identificación a nivel de género se requiere del 85 hasta el 95 % con la mejor secuencia relacionada (Rossello–Mora y Amman 2001). En este caso, las características de la morfología microscópica y el comportamiento Gram, también lo corroboraron.
Promoción del crecimiento de Cyperus elegans y Echinochloa polystachya con la inoculación de la rizobacteria
El análisis de las interacciones entre plantas y microorganismos rizosféricos benéficos ha mostrado que éstos incrementan la producción de biomasa y la tolerancia de las plantas a metales pesados, dando lugar a considerarlos como componentes importantes de las tecnologías de fitorremediación (Wenzel et al. 1999, Glick 2003). Las rizobacterias promotoras del crecimiento de vida libre, así como las simbiontes pueden mejorar la nutrición de las plantas y el crecimiento, la competitividad vegetal y las respuestas a los factores de estrés externos (Burd et al. 2000, Egamberdiyeva y Hoflish 2004, Mantelin y Touraine 2004).
La rizobacteria XIII, identificada como Bacillus sp. que se empleó para la inoculación de semillas de C. elegans y E. polystachya promovió el crecimiento tanto radical como foliar de las plantas. En particular, la promoción del crecimiento radical en C. elegans (633 % ± 628.8) comparada con la promoción radical de E. polystachya (95.4 % ± 89.6) y la promoción del crecimiento foliar en las plántulas de C. elegans (166.2 % ± 115.3 ) y de E. polystachya (116 % ± 100.4), en ambos casos, comparando con el crecimiento de las plántulas testigo sin inocular. Esta respuesta evidenció la relación sinérgica entre esta bacteria y las especies vegetales consideradas en estos bioensayos. Es importante mencionar que dentro de los mecanismos involucrados en la interacción de plantas y microorganismos, la colonización exitosa de una PGPR como inoculante es un requerimiento para promover el crecimiento vegetal (Compant et al. 2010). Esta colonización puede ocurrir sobre la superficie completa de algunas células rizodérmicas y las bacterias pueden establecerse como microcolonias o biopelículas (Benizri et al. 2001). En este caso, la colonización en la espermosfera de las semillas de estas dos especies resultó un primer evento importante en la promoción del crecimiento de las plántulas.
Efecto causado por la rizobacteria Bacillus sp. sobre el crecimiento de las plántulas de Cyperus elegans y Echinochloa polystachya expuestas a Cd
La respuesta de ambas especies ante la presencia de Cd, en general mostró que son poco tolerantes a las concentraciones de Cd empleadas; el efecto fue inhibitorio a medida que se incrementó la concentración del metal con respecto a las plántulas testigo (Figs. 1a y 1b) y, en particular, la respuesta de las plántulas de E. polystachya presentó un efecto inhibitorio total en la concentración más alta de Cd por lo que, no se reporta respuesta en este ensayo. Sin embargo, para las plántulas de C. elegans, la concentración de 0.01 mM de Cd promovió el crecimiento radical en un 289 % (± 254) más que las plántulas testigo, lo que sugiere que este metal pudiera promover el crecimiento de las plántulas, comportamiento muy similar al obtenido por Yang et al. (2004) con plantas de Sedum alfredii Hance (Crassulaceae) y Arabis paniculata Franchet (Brassicaceae) (Tang et al. 2009), donde se observó un efecto estimulante al incrementar la biomasa de estas especies expuestas a Cd. Estos hechos sugieren que ciertos metales sin importar si son benéficos o tóxicos, pueden en cierta medida ser estimuladores del crecimiento.
Se han desarrollado algunos estudios que implican el análisis del efecto de las PGPR tolerantes a metales sobre el crecimiento de plántulas en presencia de metales pesados; dentro de ellos, la aplicación del bioensayo de la medición de la promoción de la elongación radical, conocido como PREP (Plant Root Elongation Promotion), basado en la evaluación de la actividad promotora del crecimiento radical de las plántulas como indicador del efecto de acción sinérgica entre la rizobacteria y la plántula (Dell' Amico et al. 2008).
La actividad PREP de Bacillus sp. sobre el crecimiento de las plántulas de C. elegans en presencia de Cd, mostró que este aislado es tolerante a las concentraciones de Cd probadas y favoreció su crecimiento comparado con las plántulas de E. polystachya (Figs. 1a y 1b). No se mostró una diferencia significativa para el crecimiento radical (ns, p>0.05) pero sí con el crecimiento foliar de las plantas inoculadas con y sin Cd (*** = p< 0.001, ** = p< 0.01, * = p< 0.05); caso que podría ser comparable con el reportado en la literatura donde algunas bacterias promueven el crecimiento de Brassica juncea (L.) Coss y Brassica napus L. (Brassicaceae) ante la presencia de este metal (Belimov et al. 2005, Sheng y Xia 2006). Una alta concentración elevada de Cd para las plantas puede producir un efecto severo sobre el crecimiento radical y como consecuencia, dar como resultado el daño en la raíz, la reducción de los pesos fresco y seco de la planta; así como también la reducción en la absorción de agua y nutrientes (Singh y Tewari 2003). Para estas especies, la concentración empleada de Cd resultó tóxica, no obstante que es tolerable para la rizobacteria empleada (resultados no mostrados aquí).
Efecto causado por la rizobacteria Bacillus sp. sobre el crecimiento de las plántulas de Cyperus elegans y Echinochloa polystachya expuestas a Zn
La respuesta general de C. elegans y de E. polystachya, ante la presencia de Zn, mostró que también en este caso, al igual que con el Cd, el crecimiento tanto radical como foliar, en ambas especies, disminuyó a medida que se incrementó la concentración de Zn en los bioensayos (Figs. 2a y 2b). Es decir, estas especies vegetales tampoco toleran estas concentraciones de Zn en el medio, lo que evidencia que un exceso del micronutriente ocasiona daños en el desarrollo de éstas; como la apariencia de clorosis y marchitamiento. Aquí, el efecto de la presencia de Zn en el cultivo hidropónico a la concentración de 3 mM, potenció ligeramente el desarrollo de las plántulas de C. elegans comparadas con las plántulas testigo, al igual que en el caso del Cd. Esta respuesta, aunque a la concentración más baja de exposición, resultó muy similar en su conjunto a la que presentaron plantas de A. paniculata Franchet expuestas a los dos metales (Tang et al. 2009). Se menciona que este fenómeno es similar al proceso denominado hormesis que es un término comúnmente utilizado en la toxicología para referirse a los efectos estimulantes a bajos niveles de exposición ante agentes tóxicos (Forbs 2000, Roosens et al. 2003). Tang et al. (2009) sugieren que la línea de unión y diferencia entre la hormesis y el efecto estimulador del crecimiento inducido por la presencia de Cd y Zn en su estudio con A. paniculata Franchet, al igual que la presente investigación, no está del todo completamente claro, este es el mismo caso observado de la respuesta positiva de exposición a estos dos metales en las raíces de Thlaspi caerulescens L. (Brassicaceae) en un suelo heterogéneo (Schwartz et al. 1999, Whiting et al. 2000, Schwartz et al. 2003), donde la concentración de Cd dio una respuesta similar a la exposición con Zn.
La presencia de la rizobacteria Bacillus sp. no causó incremento en el desarrollo particular de las plántulas de C. elegans expuestas a Zn, ya que el crecimiento radical y foliar, en general, no es diferente al obtenido por las plántulas expuestas a Zn a las concentraciones probadas de 3, 4 y 5 mM, concentraciones a las que la rizobacteria es tolerante; sin embargo, se presentó una diferencia significativa al compararla con las plántulas inoculadas y los tratamientos con los metales (* = p< 0.05, ** =p< 0.01). Al igual que con la presencia de Cd, el Zn mantuvo el crecimiento de las plántulas de C. elegans, atenuando el efecto de las concentraciones de ambos metales a las cuales fueron expuestas (Figs. 2a y 2b). Al igual que para las plántulas de E. polystachya inoculadas con esta rizobacteria, su efecto de la promoción del crecimiento en estas dos especies vegetales en las concentraciones más bajas de los metales pesados probados, pudo estar relacionado con la síntesis de fitohormonas y la biodisponibilidad de minerales en el medio de cultivo en interacción con las plantas (Jacobson et al. 1994, Glick et al. 1998, Gupta et al. 2002).
Evaluación de la promoción del crecimiento vegetal y la determinación de la tolerancia a metales pesados de Cyperus elegans y Echinochloa polystachya en presencia de la rizobacteria Bacillus sp. XIII
Finalmente, el efecto medido de la presencia de ambos metales sobre el crecimiento de estas dos especies con referencia a las plántulas testigo sin metales y sin inocular, se evaluó en términos del porcentaje del crecimiento obtenido, donde un crecimiento mayor del 100 % hace referencia al incremento de ellas en más del 100 % del testigo comparado. En ambas especies, la tolerancia a la presencia de los metales, también fue determinada en función de su crecimiento, donde para el caso del Cd, las plántulas de C. elegans presentaron un incremento en el desarrollo radical (con 289 y 175 %, respectivamente) a las concentraciones de 0.01 y 0.05 mM (Cuadro I).

La inoculación con la rizobacteria promovió el crecimiento radical de C. elegans en 139 % más que el testigo, con la exposición a la concentración de Cd de 0.01 mM; disminuyendo éste a las otras dos concentraciones del metal. En las plántulas inoculadas el crecimiento foliar fue menor al testigo, lo mismo para E. polystachya (menor al 60 %).
En la exposición de las plántulas al Zn, también se obtuvo un porcentaje de desarrollo radical mayor al testigo a la concentración de 3 mM, para C. elegans de 154 % manteniendo su crecimiento a las concentraciones de 4 y 5 mM en un 23 % en promedio, tanto foliar como radical. Lo que no ocurrió con E. polystachya, que tuvo porcentajes muy bajos de crecimiento de las plántulas (menores al 17 %) (Cuadros I y II).
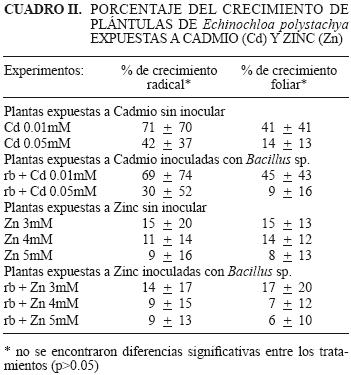
En ambos casos, la inoculación con la rizobacteria Bacillus sp. promovió una respuesta del crecimiento en ambas especies, en particular notable en las plántulas de C. elegans sin la adición del metal, con la misma respuesta de promoción en la concentración mas baja de Cd y Zn. Así mismo, las plántulas mantuvieron su crecimiento en las otras dos concentraciones de ambos metales, con lo que esta especie resultó más tolerante al efecto tóxico de estos metales que E. polystachya con un crecimiento menor.
Dell' Amico et al. (2008) mencionan que entre más propiedades posee una PGPR (producción de sideróforos, solubilización de fosfato y producción de fitohormonas), éstas la harán un inoculante recomendable; no obstante que no todas sus propiedades se expresen en un tiempo o etapa determinada del crecimiento vegetal, lo que varía también dependiendo de la cepa bacteriana y del patrón de crecimiento a evaluar (Belimov et al. 2001, 2005). En este estudio, el manejo del bioensayo de la promoción de la elongación radical (PRP) evidenció que en la germinación y el establecimiento de las plántulas, la relación sinérgica entre la rizobacteria y las plántulas fué exitosa dado su efecto colonizador y promontorio del crecimiento vegetal.
CONCLUSIONES
Las plantas de Cyperus elegans y de Echinochloa polystachya crecidas en presencia de los metales Cd y Zn e inoculadas con la rizobacteria Bacillus sp. XIII y tolerante a estos metales, no mostraron una promoción significativa de su crecimiento. Esto sugiere que la respuesta ante la presencia de los metales está relacionada estrechamente tanto con la dosis como con el tiempo de exposición de las plantas a los contaminantes, no obstante que la presencia de las rizobacteria mantuvo el crecimiento de las plantas de C. elegans ante los metales pesados probados. Esto podría estar asociado con un efecto protector a la planta con la disminución de la toxicidad de ambos metales. Es importante enfatizar la importancia de la investigación sobre la colonización de las rizobacterias, no solamente en la espermosfera, sino también en las raíces de las plantas inoculadas con el incremento de la superficie radical para la absorción de metales, así como en el papel protector de las rizsobacterias contra la toxicidad de metales, lo que permite establecer un mejor crecimiento y desarrollo de especies vegetales para la estabilización, la revegetación y la remediación de suelos contaminados con metales pesados.
AGRADECIMIENTOS
Se agradece a la Secretaría de Investigación y Posgrado del IPN, el apoyo financiero otorgado al Proyecto SIP: 20080061, para la realización de este trabajo.
REFERENCIAS
Aceves J. (1993). GraphPad Software. GraphPad InStat, V2.03. [ Links ]
Allers T. y Linchen M. (2000). A method for preparing genomic DNA that restrains branch migration of Holiday junctions. Nucleic Acids Res. 15, 28–36. [ Links ]
Arduini I., Ercoli I., Mariotti M. y Masoni A. (2006). Response of Miscanthus to toxic cadmium applications during the period of maximum growth. Environ. Exp. Bot. 55, 29–40. [ Links ]
Arthur E.L., Rice P.J., Rice P.J., Anderson T.A., Baladi S.M., Henderson K.L.D. y Coats J.R. (2005). Phytoremediation–An Overview. Crit. Rev. Plant Sci. 24, 109–122. [ Links ]
Belimov A.A., Safronova V.I., Sergeyeva T.A., Egorova T.N., Matveyeva V.A., Tsyganov V.E., Borisov A.Y. y Tikhonovich I.A. (2001). Characterization of plant growth–promoting rhizobacteria isolated from polluted soils and containing 1–aminocyclopropane–1– carboxylate deaminase. Can. J. Microbiol. 47, 642–652. [ Links ]
Belimov A.A., Hontzeas N., Safronova V.I., Demchinskaya S.V., Piluzza G., Bullitta S. y Glick B.R. (2005). Cadmium–tolerant plant growth–promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.). Soil Biol. Biochem. 37, 241–250. [ Links ]
Benizri E., Baudoin E. y Guckert A. (2001). Root colonization by inoculated plant growth rhizobacteria. Biocontrol Sci. Techn. 11, 557–574. [ Links ]
Broadley M.R., White P.J., Hammond J.P., Zelko I. y Lux A. (2007). Zinc in plants. New Phytol. 173, 677–702. [ Links ]
Burd G.I., Dixon D.G. y Glick B.R. (1998). A plant growth–promoting bacterium that decreases nickel toxicity in seedlings. Appl. Environ. Microbiol. 64, 3663–3668. [ Links ]
Burd G.I., Dixon G.D. y Glick B.R. (2000). Plant growth promoting bacteria that decrease heavy metal toxicity in plants. Can. J. Microbiol. 46, 237–245. [ Links ]
Clemens S. (2006). Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants. Biochimie 88, 1707–1719. [ Links ]
Compant S., Clément C. y Sessitsch A. (2010). Plant growth–promoting bacteria in the rhizo– and endosphere of plants: Their role, colonization, mechanisms involved and prospects for utilization. Soil Biol. Biochem. 42, 669–678 [ Links ]
Dell'Amico E., Cavalca L. y Andreoni V. (2008). Improvement of Brassica napus growth under cadmium stress by cadmium–resistant rhizobacteria. Soil Biol. Biochem. 40, 74–84. [ Links ]
Di Simine C.D., Sayer J.A. y Gadd G.M. (1998). Solubilization of zinc phosphate by a strain of Pseudomonas fluorescens isolated from a forest soil. Biol. Fertil. Soils. 28, 87–94. [ Links ]
Egamberdiyeva D. y Hoflich G. (2004). Effect of plant growth–promoting bacteria on growth and nutrient uptake of cotton and pea in a semi–arid region of Uzbekistan. J. Arid Environ. 56, 293–301. [ Links ]
Fasim F., Ahmed H., Parsons R. y Gadd G.M. (2002). Solubilization of zinc salts by a bacterium isolated from the air environment of a tannery. FEMS Microbiol. Lett. 213, 1–6. [ Links ]
Forbs V.E. (2000). Is hormesis an evolutionary expectation? Funct. Ecol. 14, 12–24. [ Links ]
Glick B.R., Karaturovic D.M. y Newell P.C. (1995). A novel procedure for rapid isolation of plant growth promoting pseudomonads. Can. J. Microbiol. 41, 533–536. [ Links ]
Glick B.R., Penrose D.M. y Li J. (1998). A model for the lowering of plant ethylene concentrations by plant growth–promoting bacteria. J. Theor. Biol. 190, 63–68. [ Links ]
Glick B.R. (2003). Phytoremediation: synergistic use of plants and bacteria to clean up the environment. Biotechnol. Adv. 21, 383–393. [ Links ]
Glick B.R. (2010). Using soil bacteria to facilitate phytoremediation. Biotechnol. Adv. 28, 367–74. [ Links ]
Gupta C.P., Dubey R.C. y Maheshwari D.K. (2002). Plant growth enhancement and suppression of Macrophomina phaseolina causing charcoal rot of peanut by fluorescent Pseudomonas. Biol. Fert. Soils 35, 399–405. [ Links ]
Hariprasad P., Navya H.M.,Chandranayaka M. y Niranjana S.R. (2009). Advantage of using PSIRB over PSRB and IRB to improve plant health of tomato. Biol. Control. 50, 307–316. [ Links ]
Jacobson C.B., Pasternak J.J. y Glick B.R. (1994). Partial purification and characterization of ACC deaminase from the plant growth–promoting rhizobacterium Pseudomonas putida GR12–2. Can. J. Microbiol. 40, 1019–1025. [ Links ]
Kabata–Pendias A. y Pendias H, (1992). Trace elements in soils and plants. 3a. CRC. Press, Boca Raton, pp. 131–154. [ Links ]
Khan A.G. (2005). Role of soil microbes in the rhizospheres of plants growing on trace metal contaminated soils in phytoremediation. J. Trace Elem. Med. Bio. 18, 355–364. [ Links ]
Kloepper J.W. y Schroth M.N. (1978). Plant growth–promoting rhizobacteria on radishes. Proceedings of the 4th International Conference on Plant Pathogen Bacteria, 2. p. 879–82. [ Links ]
Kloepper J.W., Lifshitz R. y Zablotowicz R.M. (1989). Free–living bacterial inocula for enhancing crop productivity. Trends Biotechnol. 7, 39–43. [ Links ]
Kuiper I., Lagendijk E.L., Bloemberg G.V. y Lugtenberg B.J.J. (2004). Rhizoremediation: a beneficial plant–microbe interaction. Mol. Plant Microbe In. 17, 6–15. [ Links ]
Küpper H., Lombi E., Zhao F.J. y McGrath S.P. (2000). Cellular compartmentation of cadmium and zinc in relation to other elements in the hyperaccumulator Arabidopsis halleri. Planta 212, 75–84. [ Links ]
Li T., Yang X., Lu L., Islam E. y He Z. (2009). Effects of zinc and cadmium interactions on root morphology and metal translocation in hyperaccumulating species under hydroponic conditions. J. Hazard. Mater. 169, 734–741. [ Links ]
Ma Y., Prasad M.N.V., Rajkumar M. y Freitas H. (2011). Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils. Biotechnol. Adv. 29, 248–258. [ Links ]
Mantelin S. y Touraine B. (2004). Plant growth–promoting bacteria and nitrate availability: impacts on root development and nitrate uptake. J. Exp. Bot. 55, 27–34. [ Links ]
Matusik J., Bajda T. y Manecki M. (2008). Immobilization of aqueous cadmium by addition of phosphates. J. Hazard. Mater. 152, 1332–1339. [ Links ]
Milone M.T., Sgherri C., Clijsters H. y Navari–Izzo F. (2003). Antioxidative responses of wheat treated with realistic concentration of cadmium. Environ. Exp. Bot. 50, 265–276. [ Links ]
Roosens N., Verbruggen N., Meerts P., Ximenez–Embun P. y Smith J.A.C. (2003). Natural variation in cadmium tolerance and its relationship to metal hyperaccumulation for seven populations of Thlaspi caerulescens from western Europe. Plant Cell Environ. 26, 1657–1672. [ Links ]
Rossello–Mora R. y Amann R. (2001). The species concept for prokaryotes. FEMS Microbiol. Rev. 25, 39–67. [ Links ]
Saravan V.S., Madhaiyan M. y Thangaraju, M. (2007). Solubilization of zinc compounds by the diazotrophic, plant growth promoting bacterium Gluconacetobacter diazotrophicus. Chemosphere. 66, 1794–1798. [ Links ]
Schwartz C., Morel J.L., Saumier S., Whiting S.N. y Baker A.J.M. (1999). Root development of the zinc–hyperaccumulator plant Thlaspi caerulescens as affected by metal origin, content and localization in soil. Plant Soil. 208, 103–115. [ Links ]
Schwartz C., Echevarria G. y Morel J.L. (2003). Phytoextraction of cadmium with Thlaspi caerulescens. Plant Soil 249, 27–35. [ Links ]
Sheng X.F. y Xia J.J. (2006). Improvement of rape (Brassica napus) plant growth and cadmium uptake by cadmium–resistant bacteria. Chemosphere 64, 1036–1042. [ Links ]
Singh P.K. y Tewari R.K. (2003). Cadmium toxicity induced changes in plant water relations and oxidative metabolism of Brassica juncea L. plants. J. Environ. Biol. 24, 107–112. [ Links ]
Singh S., Eapen S. y D'Souza S.F. (2006). Cadmium accumulation and its influence on lipid peroxidation and antioxidative system in an aquatic plant, Bacopa monnieri L. Chemosphere. 62, 233–246. [ Links ]
Singh J.S., Pandey V.Ch. y Singh D.P. (2011). Efficient soil microorganisms: A new dimension for sustainable agriculture and environmental development. Agr. Ecosyst. Environ.140, 339–353. [ Links ]
Tang Y., Qiua R., Zenga X., Yinga R. Yua F. y Zhoua X. (2009). Lead, zinc, cadmium hyperaccumulation and growth stimulation in Arabis paniculata Franch. Environ. Exp. Bot. 66, 126–134 [ Links ]
Tenuta M. (2003). Plant growth promoting rhizobacteria: prospects for increasing nutrient acquisition and disease control. (en línea). http://www.umanitoba.ca/afs/agronomists_conf/2003/pdf/tenuta_rhizobacteria.pdf. [ Links ]
Volkmar K.M. y Bremer E. (1998). Effects of seed inoculation with a strain of Pseudomonas fluorescens on root growth and activity of wheat in well–watered and drought–stressed glass–fronted rhizotrons. Can. J. Plant Sci. 78, 545–551. [ Links ]
Weisburg W.G., Barns S.M., Pelletier D.A. y Lane D.J. (1991). 16 Ribosomal DNA amplification for phylogenetic study. J. Bacteriol. 131, 697–703. [ Links ]
Wenzel W.W., Lombi E. y Adriano D.C. (1999). Biogeochemical processes in the rhizosphere: role in phytoremediation of metal–polluted sites. En: Heavy metal stress in plants– from molecules to ecosystems. (M.N.V. Prasad y J. Hagemeyer Eds.), Springer, Heidelberg, Berlín, Nueva York, pp. 273–303. [ Links ]
Whiting S.N., Leake J.R., McGrath S.P. y Baker A.J.M. (2000). Positive responses to Zn and Cd by roots of the Zn and Cd hyperaccumulator Thlaspi caerulescens. New Phytol. 145, 199–210. [ Links ]
Wilkins D.A. 1978. The measurement of tolerance to edaphic factors by means of root growth. New Phytol. 80, 623–633. [ Links ]
Wu S.C., Cheung K.C., Luo Y.M. y Wong M.H. (2006). Effects of inoculation of plant growth–promoting rhizobacteria on metal uptake by Brassica juncea. Environ. Pollut. 140, 124–135. [ Links ]
Xu P., Zou J., Meng Q., Zou J., Jiang W. y Liu D. (2008). Effects of Cd2+ on seedling growth of garlic (Allium sativum L.) and selected physiological and biochemical characters. Biores. Technol. 99, 6372–6378. [ Links ]
Yang X.E., Long X.X., Ye H.B. He Z.L., Calvert D.V. y Stoffella P.J. (2004). Cadmium tolerance and hyperaccumulation in a new Zn–hyperaccumulating plant species (Sedum alfredii Hance). Plant Soil 259, 181–189. [ Links ]
Zaidi S., Usmami S., Singh B.R. y Musarrat J. (2006). Significance of Bacillus subtilis strain SJ–101 as a bioinoculant for concurrent plant grown promotion and nickel accumulation in Brassica juncea. Chemosphere 64, 991–997. [ Links ]














