Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista internacional de contaminación ambiental
versão impressa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.27 no.1 Ciudad de México Fev. 2011
Distribución, comportamiento y toxicidad de metales y azufre en el agua de poro de los sedimentos superficiales del saco del Golfo de Cariaco, estado Sucre, Venezuela
Distribution, behavior and toxicity of metals and sulfur in pore water from the surface sediments of Gulf of Cariaco, Sucre state, Venezuela
María Valentina FUENTES H.1, Blanca ROJAS DE GASCUE 2, Luisa ROJAS DE ASTUDILLO 1,2, José BUCARITO1 y José L. PRIN2
1 Escuela de Ciencias, Núcleo de Sucre, UDO, Cerro Colorado, Cumaná, Venezuela. mariavalentinaf_1@hotmail.com
2 Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas, Núcleo de Sucre, UDO, Cerro del Medio, Cumaná, Venezuela.
Recibido agosto 2009
Aceptado noviembre 2010
RESUMEN
Debido a que el criterio de calidad de los sedimentos, derivado del modelo de equilibrio de partición, sostiene que el agua de poro es una fuente principal de acumulación y toxicidad de especies químicas en los tejidos de los organismos bentónicos, y tratando de reproducir los procesos de difusión en ellos, fue considerado interesante estudiar el comportamiento de metales y azufre en el agua de poro de los sedimentos superficiales del saco del Golfo de Cariaco y su absorción en hidrogeles de poliacrilamida, entrecruzada con N,N–metilenbisacrilamida. Las concentraciones totales en el agua de poro (μg/L, excepto S en mg/L) medidas por ICP–OES fueron: Al (173–530), Cd (<LD–206), Cu (102–387), Cr (139–210), Fe (152–1299), Mn (33–362), Ni (93–266), Pb (66–238), Zn (90–258) y S (584–975). Los xerogeles, previamente impregnados con agua de poro, fueron analizados por MEB–EDX y no evidenciaron la presencia de metales tóxicos, excepto en dos localidades de muestreo. Las pruebas de supervivencia de Artemia sp. y de actividad hemolítica resultaron negativas. El análisis de componentes principales indicó la asociación del primer componente (60 %) con Ni, Cd, Pb, Cu, Zn, Al, Mn y S, mientras que con el segundo (24 %), positivamente para Fe y Al, y negativamente para Cr. Estos resultados sugieren un enlace mecánico entre Mn y Ni, Cu, Pb, Cd y Zn y su remineralización simultánea. Al comparar las concentraciones totales con los resultados reportados por Man et al. (2004), en el humedal costero Mai Po (China), sólo fueron superadas en un sitio de muestreo. La mayoría de los metales no lograron difundirse a través del gel, probablemente por formar coloides grandes o enlazarse con la materia orgánica en disolución. Los resultados indicaron que los sedimentos no son tóxicos y son de calidad alta a media.
Palabras claves: biodisponibilidad, calidad sedimentaria, hidrogel de poliacrilamida, difusión.
ABSTRACT
Because the criterion of sediment quality, derived from the partition equilibrium model, argues that the pore water is a major source of accumulation and toxicity of chemical species in the tissues of benthic organisms, and trying to reproduce the diffusion processes in them, it was considered interesting to study the behavior of metals and sulfur in the pore water of surface sediments of saco Gulf of Cariaco and its absorption into polyacrylamide hydrogels, crosslinked with N,N metilenbisacrylamide. Total concentrations in pore water (μg/L, except S in mg/L) measured by ICP were: Al (173 – 530), Cd (<LD–206), Cu (102–387), Cr (139–210), Fe (152–1299), Mn (33–362), Ni (93–266), Pb (66–238), Zn (90–258) and S (584—975). The xerogel, previously impregnated with pore water, were analyzed by EDX – SEM and did not show the presence of toxic metals, except for two sampling locations. The test of survival of Artemia sp. and the hemolytic activity were negative. Principal component analysis associated Ni, Cd, Pb, Cu, Zn, Mn and S to the first component (60 %), whereas the second was (24 %) positively associated to Fe and Al, and to Cr negatively. These results suggest a mechanical bonding between Mn and Ni, Cu, Pb, Cd and Zn, and their simultaneous remineralization. The total concentrations found in this study were exceeded only in one sampling site when compared to the results reported by Man et al. (2004), in the coastal wetland Mai Po (China). Most metals were unable to diffuse through gel, probably due to formation of colloids or linkage to dissolved organic matter. The results indicated that the sediments are not toxic and are medium to high quality.
Key words: bioavailability, sediment quality, polyacrylamide hidrogel, diffusion.
INTRODUCCIÓN
La fauna béntica está expuesta a metales en fase disuelta (agua de poro y agua subyacente) y en fase particulada (sedimento). El criterio de calidad de los sedimentos, derivado del modelo de equilibrio de partición, sostiene que el agua de poro es la fuente principal de especies químicas acumulables y tóxicas para dichos organismos, debido a que allí los contaminantes están muy disponibles, química y biológicamente (Wang et al. 1999, Man et al. 2004).
Tratando de reproducir los procesos de difusión de las especies químicas por las membranas de los organismos pequeños se han desarrollados microsensores genéricos dinámicos que utilizan hidrogeles, los cuales pueden ser penetrados por metales iónicos y complejos metálicos dinámicos (van Leeuwen et al. 2005). De tal manera, los hidrogeles pueden usarse como herramientas útiles para determinar la concentración y especiación de iones metálicos lábiles (Alfaro et al. 2000, Yesek y van Leeuwen 2004).
Zhang y Davidson (1995) señalaron que los hidrogeles de poliacrilamida entrecruzada con N,N–metilenbisacrilamida permiten el paso de una gran cantidad de especies dinámicas. En principio, estos hidrogeles dejan pasar metales disueltos (lábiles) y formas coloidales con un tamaño suficientemente pequeño para difundirse en el gel. Los complejos inorgánicos formados por un metal y los aniones OH—, CO32— y SO42— pueden penetrar el gel, debido a que sus movilidades son similares a las de los iones metálicos libres, situación contraria exhiben los complejos metálicos de ligandos húmicos y fúlvicos, naturales o antrópicos.
Para establecer la calidad de un sedimento no es suficiente conocer las concentraciones de los metales, deben incluirse pruebas de toxicidad. Una de las principales razones para realizar estas pruebas, en agua de poro, es que ellas proveen mayor información que la suministrada por pruebas en fase sólida, eludida o en extractos de sedimentos. De hecho, existen muchas pruebas para medir efectos subletales y crónicos de especies epi e infaunales, equivalentes a las de la fase sólida del sedimento (SETAC 2001), entre dichas pruebas se destacan la prueba de supervivencia del microcrustáceo Artemia sp. y la prueba de actividad hemolítica.
La prueba de toxicidad usando Artemia sp., aunque no simula exactamente las condiciones naturales, es una prueba rápida y sencilla. En general consiste en exponer una población de nauplios libres, de 24 horas de vida, a diferentes concentraciones del agua de poro extraída de los sedimentos (Bartolomé y Sánchez 2007) y el ensayo de actividad hemolítica consiste en medir la oxihemoglobina liberada por los eritrocitos dañados, la cual es directamente proporcional al grado de lisis de los hematíes (Mottu et al. 2001).
En este estudio se realizan, por primera vez, en el agua de poro del saco del Golfo de Cariaco (Venezuela), determinaciones de Al, Fe, Mn, Zn, Ni, Cu, Cd, Cr, Pb y S, así como de las especies metálicas bioaccesibles difundidas a través de hidrogeles de poliacrilamida, y se emplearon el criterio de calidad para los metales potencialmente tóxicos, la relación [Fe]/[S] y el grado de toxicidad con el fin de establecer la calidad del agua de poro. De tal manera, esta investigación es una herramienta útil para el seguimiento histórico de estas especies químicas en la zona.
MATERIALES Y MÉTODOS
Área de estudio
Entre las áreas pesqueras más productivas de la región nororiental de Venezuela se encuentra el Golfo de Cariaco. Su sector más oriental conocido como el saco es una zona geomorfológicamente resguardada, con una gran fertilidad biológica e intensa actividad biótica, donde desovan especies de importancia comercial y se refugia la fauna silvestre (Fig. 1). Además, en sus sedimentos se acumula y renueva gran cantidad de carbono orgánico (0.2–6 %), fundamentalmente, procedente de los manglares que bordean su costa. El carbono orgánico se distribuye heterogéneamente; los menores porcentajes se ubican en la región occidental, mientras que los mayores hacia el este y norte (Martínez 2002).

El clima de la región es semidesértico y de influencia marina, con precipitaciones ligeramente superiores a los 250 mm. La evaporación es bastante alta durante todo el año (>2000 mm/año). Las temperaturas oscilan entre 26 y 29ºC, debido al efecto suavizador de los vientos Alisios, los cuales soplan en dirección NNE–ENE. Estos vientos tienen baja velocidad (2–3 m/s) y actúan en periodos cortos de tiempo; por lo tanto, las corrientes marinas y las olas son débiles. La salinidad media del agua es 35 ups (Quintero y Lodeiros 1996, Quintero et al. 2006)
Quintero et al. (2006) han señalado que los sedimentos marinos del saco del golfo contienen granos de tamaño medio y poca cantidad de granos finos, con proporciones de arenas medias y finas muy parecidas, y porcentajes de limos y arcillas entre 15 y 53 %, excepto en Chiguana y La Peña, donde los contenidos de esta última fracción están entre 3.57 y 3.77 %. La distribución de las fracciones sedimentarias determina texturas desde arena media fina hasta limo–arcilla. En algunos casos existe gran influencia bioclástica e inclusive arenas gruesas bioclásticas gravosas.
Predominantemente, el mecanismo de transporte de las partículas del sedimento del saco es la suspensión, debido a la presencia de corrientes débiles y suave oleaje. Además, la topografía de la zona no permite el desarrollo significativo de estos procesos hidrodinámicos y los bosques de mangle, el cual bordea sus riberas absorbe energía, y amortigua el movimiento de las aguas y el oleaje. Una excepción a la regla la constituyen los sedimentos de Chiguana y Punta Guacarapo, sitios donde prevalece el mecanismo de tracción, probablemente debido a corrientes locales (Quintero et al. 2006).
Estas características le confieren un gran interés científico y socioeconómico, ya que las poblaciones circundantes dependen de los recursos que allí se generan. Sin embargo, recibe especies químicas, potencialmente nocivas para el ecosistema, desde núcleos poblados, criaderos de camarones, escorrentías límnicas, Río Cariaco y tráfico automotor y marítimo (Márquez et al. 2005). Estos aportes podrían modificar su calidad natural y disminuir notablemente los recursos vivos.
Las muestras de sedimentos superficiales se colectaron en siete estaciones (Ests) de muestreo (Fig.1), en junio del año 2007, con una draga Diez Laffont de 0.02 m2 de área. Se tomaron siete réplicas de sedimento, en cada punto de muestreo, las cuales fueron homogeneizadas rápidamente. Inmediatamente después de la toma de muestras, los sedimentos se mantuvieron en posición vertical dentro bolsas de polietileno selladas, cubiertos por bolsas plásticas negras, y congelados hasta su análisis.
Metales y azufre totales
El agua de poro del sedimento, extraída por centrifugación refrigerada (20 ºC) a 2330 rpm, se filtró por papel Whatman 42. En ella se cuantificó directamente la concentración total de Al, Fe, Mn, Cd, Cu, Cr, Ni, Pb, Zn y S, en un espectrómetro de emisión óptica con un plasma acoplado inductivamente (ICP–OES), Perkin Elmer Optima 5300 DV. El instrumento se calibró bajo las siguientes condiciones: flujo argón al plasma de 15 L/min, flujo argón auxiliar 0.2 L/min, flujo del nebulizador 0.8 L/min, generación de frecuencia 1300 W, caudal de flujo a la bomba peristáltica 1.5 mL/min, temperatura 30 ºC. A fin de minimizar el efecto matriz, las soluciones estándares se prepararon con agua de mar artificial, filtrada a través de acetato de celulosa (0.45 μm). Por separado, se preparó una curva de adición de analito para verificar el efecto matriz, el cual fue despreciable. Además, se obtuvieron los límites de detección (μg/L) para cada una de las especies químicas medidas, de la curva de calibración: Al (5), Cd (9), Cu (4), Cr(4), Fe (5), Mn (5) Ni (8 ), Pb (7), Zn (2) y S (600).
Síntesis de los hidrogeles
Se sintetizaron los hidrogeles de poliacrilamida, a partir de monómeros de acrilamida entrecruzada con N, N'–metilenbisacrilamida. El agente iniciador de la reacción fue persulfato de amonio (Zhang y Davison 1995, Yesek y van Leeuwen 2004, Rojas et al. 2007). Las proporciones de reactivos utilizadas fueron las siguientes: 2.0000 g de acrilamida, 0.0400 g de agente entrecruzante y 0.0100 g de iniciador. Las cantidades apropiadas del monómero y del agente entrecruzante se disolvieron en agua destilada dentro de un tubo de ensayo. A continuación, el iniciador fue agregado, la mezcla agitada hasta total disolución y sumergida en un baño de aceite a 60 ºC, durante 6 horas, tiempo en el cual se formaron los hidrogeles (Rojas et al. 2007). Al terminar la polimerización, el hidrogel fue extraído del tubo de ensayo, cortado en forma de pastilla y dializado en agua desionizada. El agua fue cambiada, tantas veces como fue necesario, para remover cualquier residuo de reactante, lo cual fue verificado al obtenerse pH 7. Posteriormente, fueron secados los trozos de hidrogel, al ambiente, hasta alcanzar una masa constante (Yesek y van Leeuwen 2004, Rojas et al. 2007).
Estos hidrogeles fueron caracterizados por espectroscopía de infrarrojos con transformada de Fourier (IR–FT), después de 24 barridos con una resolución de 2 cm—1, para constatar su estructura.
Tamaño de los poros del xerogel de poliacrilamida:
Dos mm (129 μg) de xerogel fracturado se colocaron en agua destilada hasta alcanzar su equilibrio fisicoquímico (8 horas). Posteriormente, el xerogel se colocó en soluciones de etanol entre 10 y 100 % v/v, en forma sucesiva, durante 25 minutos en cada una. Una vez culminado este proceso, el hidrogel se secó en un secador de punto crítico, marca Hitachi, modelo HCP–2. Posteriormente, se adhirió a un portamuestra de aluminio mediante una cinta conductora de doble adhesión y se pintó con pintura de carbón. A continuación se cubrió con cromo y se llevó a un evaporador de alto vacío, marca Hitachi, modelo HUS–5GB. Finalmente, la muestra preparada se analizó en un microscopio electrónico de barrido de emisión de campo (MEB–EC), marca Hitachi, modelo S–800 operado a 11 kv. Todo el proceso se realizó por triplicado (Rojas et al. 2007).
Metales biodisponibles
Un xerogel de 100.0 mg se sumergió en el agua de poro, durante doce horas. Transcurrido ese tiempo, la pastilla hidratada fue protegida de la luz y dejada secar. Una vez recuperado su estado xerogel se fracturó, se fijó en un portamuestra de aluminio con una cinta conductora y se cubrió con una capa fina de carbón activado, en un evaporador de alto vacío Hitachi, modelo HUS–5GB. La muestra preparada se analizó en un equipo de dispersión de energía de rayos X (EDX) acoplado a un microscopio electrónico de barrido (MEB), marca Phillips, modelo XL 30. Lo anterior con la finalidad de observar y semicuantificar los metales absorbidos por el hidrogel (Rojas et al. 2007).
Análisis de conglomerados
Mediante el método de la varianza mínima de Ward se obtuvo un árbol jerárquico de modo Q, el cual agrupa las estaciones de muestreo con características comunes (Guisande et al. 2006).
Análisis de componentes principales
Con este método descriptivo se generó una representación dimensional de nuevas variables, las cuales son combinaciones lineales de las variables originales, y analiza la variabilidad total (Guisande et al. 2006).
Criterio de calidad del agua de poro
Ankley et al. (1996) propusieron que la biodisponibilidad de los metales presentes en los sedimentos podría predecirse siguiendo criterios de calidad de sedimentos (SQC, por sus siglas en inglés) basados en unidades tóxicas (IWCTU). Debido a que los metales actúan competitivamente respecto a sus posibles interacciones tóxicas deben ser considerados de manera conjunta. Para ello, la concentración de los metales disueltos en el agua de poro es convertida en unidades tóxicas y se suman. Si el agua de poro no muestra efecto tóxico o impacto sobre los organismos es debido a que se cumple la siguiente condición:
Para un metal:
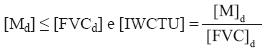
Para varios metales:

Donde [Md] es la concentración micromolar de un metal disuelto en el agua de poro, [FCVd] es el valor de toxicidad crónica aplicado al metal disuelto respectivo e [IWCTU] es el criterio de unidades tóxicas para agua de poro. El cálculo de [FVCd] para los criterios de concentración crónica (CCC) recomendado por la tabla de referencias para el examen de aguas marinas superficiales de la Administración Oceánica y Atmosférica (NOAA) de los EUA, está basada en los criterios de calidad para el agua ambiental (AWQC, por sus siglas en inglés) (Ankley et al. 1996, Campana et al. 2005).
Supervivencia de Artemia sp.
En este ensayo se evaluó la toxicidad aguda con Artemia franciscana (SCFI 1995). Las soluciones de prueba fueron las diluciones 100, 50 y 25 % de agua de poro, en agua de mar artificial filtrada (0.45 μm) y de salinidad ajustada (34–36 ups), la cual fue usada como testigo negativo, y donde fue realizada la eclosión. Para ello se colocaron 10 organismos en 2 mL de cada solución de prueba, por quintuplicado, durante un tiempo de exposición de 24 horas con luz artificial y a una temperatura de 27 ºC. Simultáneamente, fueron realizados ensayos con cinco soluciones de dodecil sulfato de sodio (DSS) y sulfato de zinc, como testigos positivos.
Prueba de actividad hemolítica
Con muestras de sangre humana (ORh+) se evaluó la actividad hemolítica del agua de poro de los sedimentos, siguiendo la metodología descrita en Mottu et al. (2001). El agua de poro se mezcló con sangre en las relaciones 1:99, 5:95 y 10:90, hasta un volumen final de 10 mL. Las mezclas se incubaron durante 90 minutos en un baño de agua a 37 ºC. Luego, se centrifugaron durante 10 minutos a 1000 rpm para separar las células corpusculares. La liberación de la oxihemoglobina, debido a los daños producidos por el agua de poro en los glóbulos rojos, se determinó por espectrometría de absorción molecular (UV/VIS Jenway 6300) a 415 nm. Todos los análisis se realizaron por triplicado.
RESULTADOS
Metales totales
Los valores máximos de Cd, Cu, Ni, Pb, Zn y S se registraron en la zona oriental (Est 1), región más interna y resguardada del ecosistema, cuyos sedimentos son arenolimosos; mientras que en las otras localidades de muestreo, de sedimentos arenosos y limoarenosos, las concentraciones fueron muy similares entre sí (Cuadro I). Las correlaciones entre los metales fueron positivamente significativas (r > 0.99). El Cr se distribuyó en forma homogénea en todo el ecosistema y sus mayores concentraciones se alcanzaron en Muelle de Cariaco (Est 2) y La Peña (Est 3). Aunque las distribuciones de Fe y el Mn fueron parecidas, el Fe alcanzó su máxima concentración en Guacarapo (Est 6) y Mn en San Rafael (Est 4). Estas concentraciones superaron con creces los contenidos de dichos metales en los sedimentos de las demás estaciones (Cuadro I). En el área, la textura granulométrica arena covarió con Fe (r = 0.93), Al (r = 0.67) y Cr (r = —0.83).
El metal que mejor correlacionó con S fue Mn (r = 0.74) y sus máximos valores se encontraron en la zona más oriental (Est 1) y en San Rafael (Est. 4). Además, este parámetro correlacionó con la fracción granulométrica limo (r = 0.62), Zn (r = 0.62), Cu (r = 0.58) y Ni (r = 0.54).
Las concentraciones de los metales y azufre no mostraron relación estadística significativa con el pH registrado en el agua de poro, el cual estuvo comprendido entre 7.40 (Est. 1, zona más oriental) y 8.07 (Est. 4, San Rafael).
El análisis de conglomerados, obtenido con las concentraciones totales, agrupó las estaciones en dos conglomerados principales (Fig. 2). Uno de ellos solo incluyó la zona oriental (Est 1), de sedimentos arenolimosos y muy resguardada geomorfológicamente. Único sitio donde se detectó Cd, y las concentraciones de los metales, excepto Cr, duplicaron o triplicaron los contenidos de los metales, de las demás localidades.

Las restantes estaciones formaron un grupo aparte por la similitud de las concentraciones de Ni, Cu, Zn, Pb y S. Su distinción posterior se debió a los contenidos de Fe y Al, es decir, los sedimentos arenosos de Guacarapo (Est 6) y Pericantar (Est 7) mostraron las concentraciones más altas de estos elementos, y los sedimentos de Muelle de Cariaco (Est 2), La Peña (Est 3) y Centro (Est 5), con contenidos comparables de arena y limo, presentaron concentraciones inferiores de Fe y Al. San Rafael (Est 4) se distinguió de las anteriores localidades, por contener mucho S y Mn. El Cr mostró escasísima relación con este componente (r = 0.06) y con los demás metales (Cuadro I, Fig. 2).
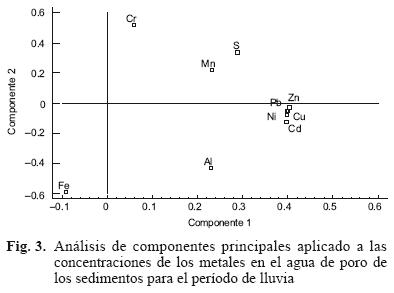
Mediante el análisis de componentes principales (Fig. 3) se extrajeron dos componentes que explicaron 84 % de la varianza de los datos. De esta cifra, 60 % se relacionó con la varianza del primer componente y 24 % con la varianza del segundo componente. Con el primer componente se asociaron mejor Ni, Cd, Pb, Cu y Zn (r = 0.40) que Al, Mn y S (0.23 < r < 0.29), mientras que con el segundo componente se relacionaron Al (r = —0.43) y Fe (r = —0.59); sin embargo, la asociación Cr (r = 0.52), Mn (r = 0.22) y S (r = 0.34) con el segundo componente fue opuesta a la de Al y Fe (Fig. 3).
Caracterización del xerogel por IR–TF
En la figura 4 se observan los espectros de un monómero de acrilamida teórica a), un monómero de la acrilamida utilizada b) y del polímero de la acrilamida sintetizada c). En el espectro del polímero preparado pueden observarse bandas más amplias y ligeramente desplazadas por el aumento de los grupos funcionales; sin embargo, su ubicación en el espectro confirma la exitosa polimerización por radicales libres, en la cual el monómero de acrilamida (AAM) fue entrecruzado con N,N–metilenbisacrilamida (NNMBA) en un proceso iniciado con persulfato de amonio (PSA).
Elementos retenidos en el xerogel
El tamaño de los poros del xerogel de poliacrilamida varió entre 50 y 514 nm. En general, el 86 % de los poros mostraron diámetros entre 50 y 243 nm, con predominio de los tamaños 50 (37 %), 114 (10 %), 149 (7 %) y 186 nm (10 %). El porcentaje de los demás tamaños varió entre 2 y 4 %.
Una micrografía MEB y un espectro EDX típicos del análisis de uno de los xerogeles impregnados previamente con agua de poro de la zona oriental (Est 1) se muestra en la figura 5. Este resultado indica el porcentaje de especies químicas en función del total de especies retenidas en el xerogel y resalta la ausencia de metales tóxicos Cd, Cr, Cu, Ni, Pb y Zn. De manera similar, los resultados de las demás estaciones se enlistan en el cuadro II, en el cual puede notarse que sólo en Muelle de Cariaco (Est 2) y La Peña (Est 3) el hidrogel absorbió Ni. Azufre y calcio estuvieron presentes en todas las muestras de xerogel analizadas, y Fe, Si y Mg solamente en algunas de ellas.
La relación molar [Fe]/[S] calculada con la información de este análisis varió entre 0.01 (Est 1) y 0.62 (Est 4), valores comparativamente altos fueron obtenidos en Muelle de Cariaco (Est 2, 0.37) y La Peña (Est 3, 0.56).
Criterio de unidades tóxicas crónicas de los metales (IWCTU) y relación [Fe]/[S]
En el cuadro III se muestran los criterios de unidades tóxicas para el agua de poro del ecosistema (IWCTU). En el agua de poro de todas las estaciones, fue superado el valor de toxicidad crónica aplicado al conjunto de metales totales disueltos.
Al calcular las relaciones molares [Fe]/[S], a partir de las concentraciones totales, los valores variaron entre 0.11 y 0.17, excepto en Guacarapo (Est 6, 0.98) y Pericantar (Est 7, 0.89).
Supervivencia de Artemia sp.
No fue observada mortandad de organismos en las diluciones del agua de poro (100, 50 y 25 %), excepto en Muelle de Cariaco (Est 2) y en el centro (Est 5). En Muelle de Cariaco, la mortalidad registrada fue 40 % en agua de poro pura, 30 % en agua de poro diluida a la mitad y 10 % en agua de poro diluida a la cuarta parte; y en el centro fue 100 % en agua de poro pura, 10 % en agua de poro diluida a la mitad y 10 % en agua de poro diluida a la cuarta parte. Cabe resaltar que sólo en estas localidades el agua de poro mostró una ligera coloración amarillenta.
Las concentraciones letales medias (LC50) de los controles positivos de DSS y ZnSO4 fueron respectivamente 28 mg/L y 35 mg/L, y en el agua de mar artificial, usada como testigo negativo, no hubo mortandad de organismos.
Actividad hemolítica
La actividad hemolítica en el agua de poro, de todas las estaciones, para todas las proporciones agua de poro: sangre, contempladas en la metodología fueron menores de 0.60 %, similar a la obtenida en la lisis intrínseca de los glóbulos rojos.
DISCUSIÓN
El resguardo geomorfológico, el carácter fino de los sedimentos y la acumulación de materia orgánica, procedente de los manglares y de los aportes del Río Carinicuao, probablemente justifiquen la mayor acumulación de metales en la zona más oriental, área donde el transporte por suspensión es más pronunciado que en otras localidades del saco (Quintero et al. 2006). Fuentes (2010) señala que las concentraciones totales de los metales presentes en los sedimentos del saco están por debajo de las referencias geoquímicas de la fracción fina (limo y arcilla), por lo tanto son fundamentalmente detritos de suelos y rocas meteorizadas, los cuales pueden haber sufrido cambios diagenéticos y contener poca cantidad de metales antrópicos. Es factible que las diferencias de concentraciones en el agua de poro puedan estar condicionadas por la granulometría y el contenido de material orgánico. Por ello, los metales carbonofílicos (Cu, Pb y Zn) puede ser liberados del sedimento al agua de poro durante la oxidación de la materia orgánica y las concentraciones de Fe, Mn, Cr y Al dependen de la calidad de los minerales provenientes del continente. Respecto a estas consideraciones, Ponce et al. (2000) señalaron que el metabolismo alto y eficiente de los microorganismos es el factor responsable de la degradación de la materia orgánica, la cual provoca la liberación de metales al agua de poro y afecta, fundamentalmente, a los metales Cu, Pb y Zn que forman especies relativamente estables con la materia orgánica. De esta manera, la presencia de quelatos orgánicos aumenta la tendencia de los metales a presentarse en la fase acuosa (Man et al. 2004). Por otro lado, Caraballo (1982) reportó la presencia de rocas metamórficas y sedimentarias, ricas en Fe, Al, Cr y Mn, en la Península de Araya, costa norte del saco. Otro factor importante es la movilización de las fases geoquímicas por la acción de organismos horadadores u otros organismos capaces de penetrar en los sedimentos (Tessier et al. 1979).
Es difícil establecer si las concentraciones en el agua de poro ejercen o no posible contaminación, sin haber criterios específicos para este tipo de muestra. Estos contenidos solamente pueden contrastarse contra valores reportados por otros investigadores en zonas distintas, incluso con características diferentes. Así, las concentraciones de Pb y Zn obtenidas en el agua de poro de los sedimentos del saco fueron más altas que los valores máximos reportados por Ponce et al. (2000) para la Bahía de Cádiz (España); sin embargo, las concentraciones de Cu y Cd fueron similares. Dicha bahía recibe vertidos de efluentes residuales urbanos y desechos de la industria naviera, y fue catalogada como un sistema poco contaminado respecto a los metales Cd, Cu, Pb y Zn. Las concentraciones de Pb y Cd, en la zona más oriental del área estudiada, y las de Cr, en todas las estaciones, superaron el intervalo de contenidos informado por Man et al. (2004) en los sedimentos del humedal tropical costero Mai Po (China). Además, en todas las localidades de muestreo, las concentraciones de Cd, Zn y Cu fueron menores que las encontradas en el agua de poro del estuario del Río Guadalete (Campana et al. 2005), consideradas como no tóxicas.
El análisis de componentes principales que muestra la asociación Fe–Al con el segundo componente sugiere que estos dos metales están en forma coloidal, probablemente coloides de hidróxidos y sulfatos básicos de Al y Fe. Este mismo análisis resalta la afinidad existente entre los metales Cd, Cu, Ni, Pb y Zn y entre los pares Ni–Mn, Cu–Mn, Pb–Mn, Cd–Mn y Zn–Mn, sugiriendo que el Mn está enlazado mecánicamente con estos metales y se removilizan simultáneamente. A este respecto, Fones et al. (2001) informaron sobre la existencia de enlaces metal – Mn, en la vecindad de la frontera óxica/subóxica del agua de poro. Estos investigadores atribuyen la oxidación a un mecanismo moderado similar al microbiano, el cual requiere condiciones similares a las necesarias para la removilización reductiva del Mn. Alternativamente, los metales pueden ser incorporados a oxihidróxidos de Mn, porque forman una estructura de intercapa y pueden ser liberados concomitantemente con el Mn. Además, añaden que metales como el Cd pueden enlazarse indirectamente al Mn, vía la materia orgánica oxidada, más que ser incorporados a la red cristalina. Durante este proceso, los electrones liberados en la descomposición de la materia orgánica causan la reducción del Mn. Al ocurrir dicho mecanismo, el Cd se libera de la materia orgánica asociada a la matriz sedimentaria. Además, Fuentes (2010) informa que la relación molar C/S en los sedimentos superficiales del saco del Golfo de Cariaco es menor de 7.5 (equivalente a 2.8 %), lo cual confirma la condición reductora (anóxica – sulfídica) de los sedimentos.
Man et al. (2004) estudiando la distribución de los metales pesados en el sedimento y en el agua de poro de un humedal costero tropical de Hong Kong, encontraron esta situación y la explicaron como el resultado de la reducción y removilización de Fe y Mn en la fase geoquímica del sedimento. Sin embargo, la removilización del Cr pudo ocurrir vía la formación de complejos orgánicos de Cr (III) y la subsecuente liberación al agua de poro.
Las especies químicas metálicas, potencialmente tóxicas, presentes en el agua de poro del saco del Golfo de Cariaco no lograron penetrar por difusión el hidrogel de poliacrilamida entrecruzada con N, N´–metilenbisacrilamida, probablemente, tampoco las membranas celulares de los organismos bentónicos, quizás por formar complejos orgánicos húmicos o grandes complejos metal – ligando (Zhang y Davidson 1995). Los ligandos naturales enlazados con metales, en la materia orgánica particulada y disuelta son poliaminocarboxilatos que contienen muchos grupos carboxílicos, tales como ácido dietilentrinitrilopentacético y ácido etilendiamintetracético (Hirose 2006). Puede suceder que las cargas estructurales negativas de los hidrogeles de poliacrilamida atraigan más los iones metálicos libres que a los complejos con cargas similares, como los poliaminocarboxilatos. Así, el hidrogel excluye metales no lábiles, de gran tamaño y estabilidad/labilidad inadecuada (van Leeuwen et al. 2005). Respecto a esto, gran número de experimentos sugieren que los efectos biológicos están correlacionados con la actividad del ión divalente, la única forma biodisponible (Ankley et al. 1996). Aunque la ingesta es una de las vías de incorporación, donde los sistemas digestivos se encargan de separar metales, en esta experiencia sólo se consideran los metales lábiles, penetrables por difusión.
Otro factor influyente podría ser la baja concentración de los metales tóxicos, en comparación con los iones característicos del agua de mar, pudiendo estos últimos ocupar más sitios o difundirse más rápidamente. Respecto a esto, Bernal y Raisbalck (2008) señalan que todos los electrones de la capa de valencia de los cationes duros (tipo A), como: Na+, K+, Mg2+, Ca2+, Al3+, Si4+ (en SiO44—), S6+(en sulfatos), poseen configuración de gas noble. Esto hace posible que se coordinen fácilmente con el oxígeno de los grupos carbonilos de los ligandos orgánicos, como los del hidrogel de poliacrilamida. Los cationes intermedios como Fe3+, Cu2+, Ni2+ y Pb2+ poseen electrones en su capa de valencia y pueden coordinarse con S.
La presencia de Fe, Al, S y Si en los xerogeles indica que puede haber coloides de hidróxidos y sulfatos básicos de Al y Fe asociados, así como silicatos hidratados de aluminio, amorfos. Además, la presencia del azufre corrobora la existencia de una gran proporción de metales enlazados a especies de azufre (SO42—, S2—). Respecto a esto último, Grout et al. (1999) encontraron, en aguas de escorrentías urbanas que caen en el ecosistema costero de la ciudad de Houston, fases disueltas y coloidales de C, Si, Al, Fe, Cr y Zn, mientras que coloides de Ca, K, Mg, Ba y Cu sólo en fase disuelta. Estas fases coloidales incluían fases cristalizadas (arcillas y oxihidróxidos) y fases amorfas (agregados, glóbulos aislados y geles). Tanto en la época lluviosa como en la seca, los coloides estaban predominantemente compuestos de sílice, y variaban desde agregados orgánicos hasta geles ricos en Si, Al, y Fe.
Como la relación [Fe]/[S] resultó muy cercana a la unidad en el agua de poro de los sedimentos de Guacarapo y Pericantar, es factible la presencia de complejos de FeS en estas localidades. Adicionalmente, el intervalo entre 0.37 y 0.62 de la relación [Fe]/[S], calculada de los datos del análisis de dispersión por rayos X, posiblemente demuestra la formación de dos especies sulfurosas de hierro, FeS2 y otra especie no identificada, en los xerogeles, contentivos del material presente en el agua de poro de los sedimentos de Muelle de Cariaco, La Peña y San Rafael. Jézéquel et al. (2007) usaron esta misma relación para evidenciar la presencia de FeS2 y otra especie de azufre no identificada, producto de la relación [Fe]/[S] igual a 0.40, cuando analizaron por EDX, Fe y S retenido en el hidrogel con agua de poro de la laguna de Thau (Francia). Ellos proponen que las especies disueltas del agua de poro como Fe2+, HS–, H2S o los complejos de FeS, más que los coloides pueden reaccionar en esas condiciones en el hidrogel de poliacrilamida. El contacto entre ellos es muy probable por la alta porosidad del hidrogel.
Aunque el criterio de unidades tóxicas para el agua de poro superó importantemente la unidad, la prueba de supervivencia de Artemia sp. indicó que el agua de poro no es tóxica para dicha especie, respecto a la concentración de los metales analizados. En el agua de poro de los sedimentos aledaños a las poblaciones de Muelle de Cariaco y La Peña, un factor o especie química no identificada provocó la mortalidad. En cuanto a la liberación de oxihemoglobina, los resultados indican que no existía alguna especie química capaz de romper la membrana de los glóbulos rojos.
CONCLUSIONES
A pesar de soportar presión antrópica, el saco del Golfo de Cariaco puede considerarse un sistema muy poco contaminado y no tóxico, respecto a los metales Cu, Ni, Pb, Cr, Cd y Mn. En el agua de poro de los sedimentos fue evidente un enlace metal – Mn, dichos metales se removilizan al mismo tiempo. Además, existe gran cantidad de S disuelto. Los elementos disueltos fueron retenidos por el hidrogel de poliacrilamida, sin evidencia de metales tóxicos, excepto Ni en dos localidades. Cerca de Muelle de Cariaco y en el centro del ecosistema actuó un factor diferente a la concentración de los metales potencialmente tóxicos que provocó mortalidad de Artemia sp.
AGRADECIMIENTOS
Los autores agradecen al Instituto de Investigaciones en Ciencias Aplicadas y Biomedicina (IIBCA) y al Departamento de Química de la Universidad de Oriente por el apoyo brindado para la realización de este estudio.
REFERENCIAS
Alfaro M.C., Beaulieu P. y Tessier A. (2000). In situ measurement of trace metals in lake water using the dialysis and DGT techniques. Anal. Chem. Acta. 418, 53–58. [ Links ]
Ankley G.T., Di Toro D.J., Hansen D. y Berry W.J. (1996). Technical basis and proposal for deriving sediment quality criteria for metals. Environ. Toxicol. Chem. 15, 2056–2066. [ Links ]
Bartolomé M.C. y Sánchez S. (2007). Valoración de la toxicidad aguda de biocidas utilizados en ambientes de la vida privada y la salud pública sobre Artemia franciscana. Rev. Latinoam. Rec. Nat. 3, 90–97. [ Links ]
Bernal J.P. y Railsback L.B. (2008). Introducción a la tabla periódica de los elementos y sus iones para ciencias de la tierra. Rev. Mex. Cienc. Geol. 25, 236–246. [ Links ]
Campana O., Rodríguez A. y Blasco J. (2005). Bioavailability of heavy metals in the Guadalete river estuary (SW Iberian Peninsula). Cienc. Mar. 31, 135–147. [ Links ]
Caraballo L.F. (1982). El Golfo de Cariaco. Parte II. Los sedimentos superficiales y su distribución por el fondo. Fuente de sedimentos. Análisis mineralógico. Bol. Inst. Oceanogr. Venezuela 21, 37–65. [ Links ]
Fones G., Davidson W., Lobby O., Barker B. y Thamdrup B. (2001). High–resolution metal gradients measured in situ DGT/DET deployment in Black Sea sediments using an autonomous benthic lander. Limnol. Oceanogr. 46, 982–988. [ Links ]
Fuentes M. V. (2010). Evaluación de la calidad de los sedimentos superficiales del saco del Golfo de Cariaco, Estado Sucre, Venezuela. Tesis de Doctorado. Instituto Oceanográfico de Venezuela. Universidad de Oriente. Cumaná, Venezuela, 172 pp. [ Links ]
Grout H., Wiesner M.R. y Bottero J. (1999). Analysis of colloidal phases in urban stormwater runoff. Environ. Sci. Technol. 33, 831–839. [ Links ]
Guisande C., Barreira A., Maneiro I., Riveiro A., Vergara A. y Vaamonde A. (2006).Tratamiento de datos. Ediciones Diaz de Santos. Vigo, España. 365 pp. [ Links ]
Hirose K. (2006). Chemical speciation of trace metals in seawater: a review. Anal. Sci. 22, 1055–1063. [ Links ]
Jézéquel D., Brayner R., Metzger E., Viollier E., Prévot F. y Fiévet F. (2007). Two–dimensional determination of disolved iron and sulfur species in marine sediment pore waters by thin–film bases imaging. Thau lagoon (France). Estuar. Coast. Shelf Sci. 72, 420–431. [ Links ]
Man K., Zheng J., Leung A., Lam P.H., Lam M.H. y Yu Y. (2004). Distribution and behavior of trace metals in the sediment and porewater of a tropical coastal wetland. Sci. Tot. Environ. 327, 295–314. [ Links ]
Márquez A., Bonilla J., Martínez G., Senior W., Aguilera D. y González A. (2005). Estudio geoquímico de los sedimentos superficiales del litoral nororiental del Golfo de Cariaco, Estado Sucre, Venezuela. Bol. Inst. Oceanogr. Venezuela. 44, 89—103. [ Links ]
Martínez G. (2002). Metales pesados en sedimentos superficiales del Golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venezuela 41, 83–96. [ Links ]
Mottu F., Stelling M., Rüfenacht D. y Doelker E. (2001). Comparative hemolytic activity of undiluted organic water–miscible solvents for intravenous and intra–arterial injection. J. Pharm. Sci. Tech. 55, 16–23. [ Links ]
Ponce R., Forja J. y Gómez–Parra A. (2000). Influencia de la actividad antropogénica en la distribución vertical del Zn, Cd, Pb y Cu en agua intersticial y sedimentos marinos costeros (Bahía de Cádiz, SW de España). Cienc. Mar. 26, 479–502. [ Links ]
Quintero A. y Lodeiros C. (1996). Variaciones térmicas del agua de Turpialito, Golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venezuela 35, 27–40. [ Links ]
Quintero A., Caraballo L., Bonilla J., Terejova G. y Rivadula R. (2006). Sedimentos marino–costeros del Golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venezuela 45, 127–139. [ Links ]
Rojas B., Ramírez M., Aguilera R., García A., Prin J.L., Lias J., Torres C. y Kattime I. (2007). Hidrogeles obtenidos a partir de acrilamida, ácido maleico, ácido acrílico y monitaconato de octilo: síntesis, capacidad absorbente y variaciones de pH en soluciones de sulfato de sodio. Rev. Téc. Ing. Univ. Zulia 30, 74–84. [ Links ]
SCFI (1995). Norma Oficial Mexicana NMX–AA–110–SCFI–1995. Que establece el método biológico para la evaluación de la calidad del agua mediante pruebas de toxicidad aguda utilizando Artemia franciscana. Requisitos a que deben sujetarse los terceros autorizados que realicen la prueba. Secretaría de Comercio y Fomento Industrial. Diario Oficial de la Federación, México, 6 de marzo de 1996. [ Links ]
SETAC (1995). Porewater toxicity testing: biological, chemical and ecological considerations. Society of Environmental Toxicology and Chemistry. Resumen de un informe técnico, Pensacola. 26pp. [ Links ]
Tessier A., Campbell P. y Bisson M. (1979). Sequential extraction procedure for the speciation of particulate trace metal. Anal. Chem. 51, 844–851. [ Links ]
van Leeuwen H., Town R., Buffle J., Cleven R., Davidson W., Puy J., van Riemsdijk W. y Sigg L. (2005). Dynamic speciation analysis and biaoavailability of metals in aquatic systems. Environ. Sci. Technol. 39, 8545–8556. [ Links ]
Wang W., Stupakoff I. y Fisher N. (1999). Bioavailability of dissolved and sediment–bound metals and marine deposit–feeding polychaeta. Mar. Ecol. Prog. Ser. 178, 281–293. [ Links ]
Yezek L.P. y van Leeuwen H.P. (2004). An electrokinetics characterization of low charge density cross–linked polyacrilamide gels. J. Colloid. Interf. Sci. 278, 243–250. [ Links ]
Zhang H. y Davison W. (1995). Performance characteristic of diffusion gradients in thin films in situ measurement of trace metals in aqueos solution. Anal. Chem. 67, 3391—3400. [ Links ]














