Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.26 no.2 Ciudad de México may. 2010
Artículos
Bioadsorción de cobre utilizando lodo anaerobio acidogénico
Copper bioadsorption using acidogenic anaerobic sludge
María Teresa CERTUCHA–BARRAGÁN1,2, Glenda DUARTE–RODRÍGUEZ 2, Evelia ACEDO–FÉLIX3, F. Javier ALMENDARIZ–TAPIA2, Onofre MONGE–AMAYA2 Jesús L. VALENZUELA–GARCÍA2 y A.L. LEAL–CRUZ4
1 Instituto de Ingeniería, Universidad Autónoma de Baja California, Mexicali, Baja California, México.
2 Departamento de Ingeniería Química y Metalurgia, Universidad de Sonora, Hermosillo, Sonora, México. Correo electrónico: mtcertucha@iq.uson.mx
3 Centro de Investigación en Alimentación y Desarrollo, A.C., Hermosillo, Sonora, México.
4 CINVESTAV–Saltillo, Saltillo, Coahuila, México.
Recibido diciembre 2008
Aceptado diciembre 2009
RESUMEN
En este trabajo se presenta un estudio de la bioadsorción de cobre utilizando lodo anaerobio acidogénico viable y no viable, con las siguientes características: ST 60.57 g/L, SSV 30.95, IVL 43 mLlodo/gSSV, tamaño de partícula de 0.25 a 0.6 mm, µmax de 0.375 gDQO–CH4/gSSV.d y Ksacetato de 27.11 mM. Las pruebas de bioadsorción utilizando medio acuoso sintético y concentraciones de 50 a 300 mgCu(II)/L, muestran que la remoción de cobre es más evidente en los primeros 15 minutos. La capacidad de bioadsorción de cobre para el lodo viable y no viable presentó comportamientos similares que se ajustan al modelo de Langmuir, con valores de qmax de 25.4 y 27.67 mgCu(II)/ gSSV, con un valor de la constante b igual a 0.00739 y 0.00699, respectivamente. El estudio cinético indica que es factible el uso de lodo acidogénico viable y no viable para remover cobre empleando reactores anaerobios acidogénicos. Los resultados de la caracterización de los lodos por MEB, EDS y DRX revelaron la presencia de bacterias, diatomeas (sílice amorfa) y una matriz de sílice (cristobalita) en los lodos empleados en esta investigación. El análisis cualitativo y cuantitativo por EDS de los lodos muestra la presencia de cobre bioacumulado en las diatomeas y adsorbido en la biopelícula.
Palabras claves: Bioadsorción, cobre, isotermas, lodo–anaerobio–acidogénico, remoción.
ABSTRACT
In this paper a study of biosorption of copper was carried out using living and nonliving acidogenic anaerobic sludge. Characterization results of sludge are as follows: TS 60.57 g/L, VSS 30.95, SVI 43 mLsludge/gVSS, particle size from 0.25 to 0.6 mm, µmax of 0.375 gCOD–CH4/gVSS d, and Ksacetate of 27.11 mM. Bioadsorption trails using copper concentration from 50 to 300 mgCu(II)/L show that copper removal is more evidently during the first 15 minutes. Bioadsorption capacity of copper in living and non–living sludge has the same behavior and there is a well fitting with Langmuir model in both systems, where qmax is 25.4 and 27.67 mgCu(II)/gVSS, and b corresponds to 0.00739 y 0.00699, respectively. In addition, living and non–living sludge can be used to remove copper using acidogenic anaerobic reactors. SEM, EDS and XRD results for sludge reveal the presence of bacteria, diatoms (amorphous silica) and silica (cristobalite) matrix. Qualitative and quantitative analysis by EDS showed the presence of copper bioaccumulated into diatoms and on the biofilms.
Key words: Bioadsorption, copper, isotherm, anaerobic–acidogenic–sludge, removal.
INTRODUCCIÓN
Varios factores son importantes en la retención de metales pesados usando biomasa anaerobia. Estos factores incluyen las propiedades químicas de la superficie celular, el tamaño de partícula, la actividad metabólicade la biomasa, entre otros. Diversos microorganismos, tales como levaduras, hongos y bacterias han sido reportados para la remoción de metales pesados (Cd, Hg, Cr, Zn, Co, Sn, Fe y Cu) de efluentes contaminados (Vieira y Volezky 2000, Wang y Chen 2006). Específicamente para la remoción de cobre se han empleado algas (Scenedesmus incrassatulus, Ecklonia maxima, Lessoniaflavicans, Durvillea patatorum, algaverde–phaeophyta, algaverde–chlorophyta y alga roja–rhodophyta); bacterias (Bacillus subtilis, Bacillus sp., Escherichia coli, Bacillus cereus, Pseudomona aeruginosa, Pseudomonas sp., Micrococus sp., Pseudomonas ambigua, Desulfovibrio vulgaris, Enterobacter cloacae, Alcaligenes eutrophus, Dinococcus radiodurans) y levaduras (Sacaromices cerevisiae) (Mullen et al. 1989, Vieira y Volesky 2000, Wang 2002, Mack etal. 2004, Peña–Castro etal. 2004). Estos microorganismos tienen la habilidad de remover cobre mediante labioadsorción. El proceso de bioadsorción puede ser definido como la captación de contaminantes desde una solución acuosa por un material biológico a través de mecanismos fisicoquímicos o metabólicos. Los dos mecanismos diferenciados para la captación de los metales pesados por parte de la biomasa son la bioacumulación y la bioadsorción (Volesky 2004, Reyes et al. 2006). El primer mecanismo se basa en la capacidad de absorción de las especies metálicas hacia el interior de las células que componen la biomasa, mientras que el segundo, se basa en la adsorción de los iones en la superficie de la célula, este fenómeno puede ocurrir por intercambio iónico, precipitación, complej ación o atracción electrostática (Alexander 1999, Vieira y Volesky 2000, Reyes et al. 2006). La remoción de metales pesados como el cobre mediante bioadsorción ha sido estudiada desde los años setenta. El cobre es un metal esencial que regula algunas funciones celulares y está involucrado en la producción de proteínas. Sin embargo, el cobre en altas concentraciones puede provocar efectos tóxicos y cambios fisiológicos en organismos heterotróficos y fototróficos (BoWmetal. 2005). Por otra parte, debido a la diversidad de materiales biológicos que se pueden emplear para la remoción de éste, existe la necesidad de estudiar la bioadsorción de cobre utilizando microorganismos específicos, identificar los mecanismos y entender las interacciones microorganismo–metal. Con base en lo anterior, se planteó como objetivo evaluar la cinética de bioadsorción de cobre en lodo anaerobio acidogénico viable y no viable en reactores por lotes.
MATERIALES Y MÉTODOS
Reactivos
Todos los reactivos empleados en esta investigación fueron de grado analítico de la marca Sigma–Aldrich y las soluciones de cobre (Cu (II)) se prepararon a partir de sulfato de cobre (CuSO4) disuelto en agua desionizada.
Lodos anaerobios
a) Obtención y caracterización fisicoquímica
Los lodos se obtuvieron de una planta de tratamiento de agua de la industria cervecera y fueron analizados para determinar sólidos totales (ST), sólidos suspendidos volátiles (SSV), cenizas, índice volumétrico de lodo (IVL) (APHA 1995) y distribución de tamaño de partícula (Laguna et al. 1999). Para realizar las pruebas de bioadsorción con lodos no viables, estos se esterilizaron en una autoclave a 16 psi durante 15 minutos. Mientras que, las pruebas con lodo viable, se realizaron con los lodos previamente acondicionados en un medio acidogénico.
b) Activación y acondicionamiento de lodos
Para llevar a cabo esta etapa, se transfirieron 300 mL de lodo a matraces de 1 L y se activaron con medio mineral (g/L): 1.045 NH4Cl, 0.27 KCl, 0.17 KH2PO4, 0.185 MgSO4•7H2O, 0.05 CaCl2•H2O, 0.5 dextrosa, 0.02 extracto de levadura, 0.5 CH3COONa, 0.125 NaHCO3 y 1 mL de solución de elementos traza (Visser 1995). El período de incubación fue de 12 a 20 días en una incubadora con agitación (New Brunswick Scientific modelo C76) a una temperatura de 35 °C y a 50 rpm. Posteriormente, se hizo la conversión del lodo metanogénico a acidogénico, sobrealimentando el lodo metanogénico con 5 gDQOacetato/L para tener una mayor producción de ácidos grasos y de esta forma, disminuir la actividad metanogénica y estabilizar el pH entre 4–4.5.
c) Cinética de actividad metanogénica
Este estudio se llevó a cabo en botellas serológicas de 150 mL con un volumen de operación de 100 mL, las cuales se alimentaron con acetato de sodio a concentraciones de 0.25, 0.5, 1, 2, 3 y 5 gDQO/L y se inocularon con 10 mL de lodo en el medio mineral de Visser (1995). Posteriormente, fueron incubadas durante 24 h en un cuarto con temperatura controlada a 35 °C. Se determinó la demanda química de oxígeno (DQO), de acuerdo con los métodos estándar(APHA 1995) y el metano por desplazamiento de una solución de hidróxido de sodio (NaOH) al 3 %. Las muestras para la determinación de DQO y metano se tomaron cada tres horas.
Bioadsorción
a) Cinética
Las pruebas de bioadsorción se hicieron en matraces de 250 mL, con 200 mL de medio mineral ajustado a un pH de 4.5 para evitar la precipitación de iones de cobre. En estas pruebas, se utilizaron las siguientes concentraciones de cobre en mgCu(II)/L: 50, 100, 150, 200y300.Acada una de las soluciones, se les adicionaron 12 mL de lodo (0.37g SSV) y se incubaron a 37 °C durante 75 minutos en una incubadora con agitación a 50 rpm. Se tomaron muestras cada 15 minutos para cuantificar el ion metálico en el sobrenadante con un espectrofotómetro de absorción atómica (Perkin Elmer 3100).
b) Isotermas de bioacumulación y bioadsorción
La capacidad de retención de cobre (q) de la biomasa se calculó mediante la siguiente ecuación (Gutiérrez–Cerón et al. 1997, Mesquita etal. 2007):

donde q corresponde a la capacidad de biosorción de cobre (g de cobre/g de bioadsorbente), Q es la concentración inicial de Cu(II) en solución (g/L), Cf es la concentración final de Cu(II) en solución (g/L) y X0 es la concentración de sólidos volátiles suspendidos (bioadsorbente) (g/L).
Las isotermas de bioadsorción se obtuvieron graneando la capacidad de retención del metal (g de cobre/ g de biomasa) contra la concentración residual del metal en solución (g/L). En el presente trabajo, los datos experimentales se ajustaron al modelo de adsorción de Langmuir. De acuerdo a este modelo, las isotermas se pueden definir como se muestra en la siguiente ecuación:

donde, qmáx es la capacidad máxima que presentó el lodo, para bioadsorber cobre (gCu(II)/gSSV), Ce es la concentración de Cu (II) remanente en la solución bajo condiciones de equilibrio y b es una constante relacionada con la energía de adsorción. Este modelo considera que las isotermas de bioadsorción tienen un comportamiento parabólico y permiten obtener parámetros (qmax y b) útiles descritos anteriormente y que representan características importantes del sistema.
Caracterización de lodos por MEB, EDS y DRX
Con el propósito de establecer los mecanismos de bioadsorción de cobre en los lodos anaerobios, se realizó un estudio sistemático que involucró la observación de los microorganismos presentes en los lodos, mediante microscopia electrónica de barrido (MEB) y microanálisis general y puntual por espectroscopia por dispersión de energía de rayos X (EDS), sobre la matriz que componen los lodos y los microorganismos presentes en este. El microscopio electrónico de barrido (MEB, Philips, modelo XL30 ESEM) utilizado en este estudio está provisto de un dispositivo (EDAX, modelo Falcon) para realizar microanálisis mediante espectroscopia por dispersión de energía de rayos X (EDS). El análisis por MEB de los lodos se realizó en condiciones de bajo vacío y ambiental a diferentes magnificaciones de 200 a 2000X. Para cada magnificación, se hizo microanálisis puntual sobre los microorganismos, así como un análisis general de los lodos para la determinación de Cu por EDS. Las señales empleadas fueron electrones secundarios de baja energía (SE, secondary electrons) para la adquisición de las imágenes y rayos X característicos para el análisis elemental cualitativo y cuantitativo de Cu. Previo al análisis, las muestras se prepararon colocándolas sobre substratos conductores de aluminio y recubiertos con cinta de grafito. Después, las muestras se recubrieron con oro para hacer conductora la muestra y obtener las imágenes. La identificación de las fases presentes en los lodos se llevó a cabo mediante la técnica de difracción de rayos X. Las muestras fueron preparadas previamente con el propósito de homogeneizarlas. Esta preparación consistió en la pulverización de las muestras hasta obtener un tamaño de partícula menor a 100 mallas. Posteriormente, los polvos fueron colocados sobre portamuestras para su análisis en un difractómetro de rayos X (Philips 3040). Las condiciones de análisis fueron las siguientes: radiación K a de cobre, λ= 1.5418 Å, el ángulo de barrido se varió en el rango de 10 a 80° y la velocidad de barrido fue de 0.02°/s. El voltaje de excitación del ánodo fue de 30 kV y la corriente aplicada fue 97000 nA (Leal 2007).
RESULTADOS Y DISCUSIÓN
Caracterización de lodos
En el cuadro I se muestran los resultados de la caracterización del lodo anaerobio empleado para la remoción de cobre.

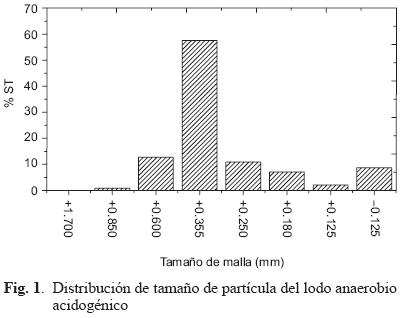
La cuantificación de los SSV es una manera indirecta para determinar la biomasa y se obtienen al restar las cenizas (SF) a los ST, de este modo la biomasa contenida en el lodo fue la mitad del total de sólidos. El IVL indica que el lodo presentó una velocidad de sedimentación rápida. Los valores superiores a un IVL de 150, se asocian en general con el crecimiento de bacterias filamentosas y una baja sedimentación (Crites y Tchobanoglous, 2000). Los resultados del análisis granulométrico (Fig. 1) muestra que los sólidos totales y volátiles presentes en los lodos están constituidos en su mayoría por gránulos con tamaño de partícula de 0.355 mm.
Determinación de la constante de saturación (Ks) La figura 2 muestra los resultados de la actividad metanogénica específica (AME (µDQO–CH4) evaluada a diferentes concentraciones de acetato del lodo anaerobio previamente activado.

Para determinar la constante de saturación (Ks) y la máxima AME (µmax) se empleó una herramienta de cálculo de Excel denominada Solver. Esta herramienta permite una optimización a partir de datos experimentales (Fig. 2) para la determinación de los valores Ks y µimax, que posteriormente son empleados para hacer un ajuste al modelo de Monod [(µDQO–CH4(Cacet.)= µmax Cacet./ (Ks+Cacet.)] (Olguin–Lora et al. 2003). De acuerdo con este análisis, los valores de parámetros Ksacetato y µmax corresponden a 27.11 mM y 0.375 gDQO–CH4/gSSV·d, respectivamente.
Cinética de bioadsorción
Los resultados experimentales de la cinética de bioadsorción de cobre utilizando lodo anaerobio viable se muestran en la figura 3. De acuerdo con los resultados, la remoción del cobre es más marcada en los primeros 15 minutos y se observó que el incremento en la capacidad de adsorción de cobre es directamente proporcional a la concentración de cobre presente en las soluciones acuosas y al tiempo de contacto, lográndose una adsorción máxima de 19.39 mgCu(II)/gSSV. Por otro lado, la remoción de cobre aumenta al disminuir la concentración de cobre en las soluciones. La máxima remoción (24 %) se obtuvo en las pruebas de bioadsorción empleando soluciones acuosas con 50 mg Cu (II)/L y tiempos de contacto de 75 minutos. Los resultados correspondientes al blanco sin biomasa y empleado como control, mostraron que la precipitación del cobre fue menor a 5 %. Con base en lo anterior, se considera que la bioadsorción de cobre bajo las condiciones experimentales es más eficiente si se trabaja con soluciones acuosas con baja concentración de cobre.

En la figura 4 se presentan las curvas de bioadsorción de cobre, en las cuales se utilizó lodo anaerobio no viable variando el tiempo y la concentración de cobre de las soluciones acuosas (50, 100, 150, 200 y 300 mg Cu(II)/L). En esta gráfica se puede observar que a la concentración de 50 mg/L de cobre, la remoción máxima es del 27.5 % a los 75 minutos y al aumentar la concentración a 300 mg/L de cobre se observa una reducción en la remoción hasta el 12 % para el mismo tiempo.
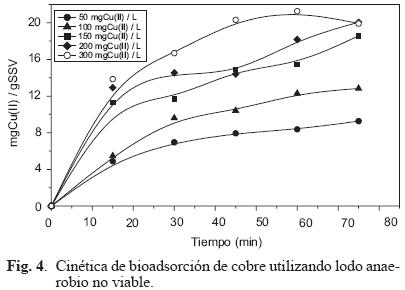
Los resultados de la cinética de bioadsorción de cobre utilizando lodo viable y no viable revelaron que existe una mayor remoción de cobre en el lodo no viable bajo condiciones similares. Dicho comportamiento es atribuido a un incremento de la capacidad de retención de la biomasa durante la esterilización en autoclave, que se debe a un aumento del área superficial generado por el rompimiento de las células y de los gránulos (Haytoglu et al. 2001).
Isotermas de bioadsorción
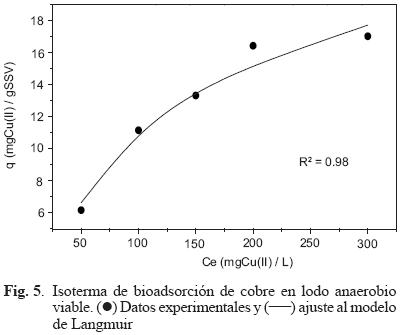
En las figuras 5 y 6 se presentan los resultados correspondientes a las isotermas de bioadsorción de cobre utilizando lodo viable y no viable. Después de hacer el ajuste de los datos experimentales al modelo de Langmuir mediante la herramienta de cálculo de Excel Solver, se determinaron los siguientes parámetros: el límite máximo de retención (qmax) que corresponde a la capacidad del material para retener iones metálicos en soluciones concentradas y la ordenada al origen b que es la capacidad del material de retener metales en soluciones diluidas (Gutiérrez–Cerón et al. 1997). De acuerdo con estos resultados, los valores de qmax para los lodos viable y no viable fueron de 25.4 y 27.67 mgCu(II)/gSSV, respectivamente. Mientras que, los valores de la constante b fueron 0.00739 para el lodo viable y 0.00699 para el lodo no viable. El ajuste de los datos experimentales al modelo Langmuir indica que existe una interacción soluto–adsorbente de segundo orden bajo las condiciones experimentales utilizadas, que toda la superficie tiene la misma actividad para la bioadsorción del cobre y que no existe interacción de las especies adsorbidas. Por otra parte, se considera que la bioadsorción del cobre se lleva a cabo mediante el mismo mecanismo y el grado de bioadsorción es inferior a una monocapa molecular completa en la superficie del lodo acidogénico. Dado que, los resultados anteriores no muestran diferencias significativas en el comportamiento de la capacidad de bioadsorción de cobre para los dos tipos de lodo, es posible considerar como una alternativa el uso de biomasa viable y no viable para remover cobre utilizando reactores anaerobios.

Caracterización de lodos por DRX, MEB y EDS Las figuras 7a y b muestran los resultados de las características microestructurales de los lodos. Los resultados de DRX revelaron que los lodos están constituidos por fases amorfa y cristalina. La figura 7a muestra un difractograma de DRX correspondiente a los lodos, en el cual se observa un patrón representativo de materiales amorfos (señal de baja intensidad extendida en una amplia región 2θ: 10–50 grados) que se atribuyen a la sílice amorfa y algunas reflexiones que pertenecen a la fase cristobalita de la sílice (JCPDS 77–1316; 21.990, 36.109, 31.453; tetragonal; a=4.9709Å y c=6.9278 Å; cristobalita–SiO2). La sílice cristalina está asociada a la matriz que compone los lodos y la sílice amorfa a las diatomeas que se encuentran embebidas en la matriz de sílice, como se muestra en la fotomicrografía de MEB (Fig. 7b).
En las figuras 8a y 8b se muestra la morfología típica de los microorganismos observados en los lodos, así como las formas del material exopolimérico que compone la biopelícula, que consiste básicamente de bacterias y sustancias poliméricas extracelulares (EPS por sus siglas en inglés) (Donlan 2002).
Los resultados de la caracterización por MEB y EDS revelan que el cobre no se encuentra en la matriz (cristobalita) que compone a los lodos, sino en las diatomeas y en la biopelícula en cantidades promedio de 2.66 % en peso (Fig. 9).
Además, considerando que las diatomeas se encuentran recubiertas por una biopelícula, se asume que el cobre se encuentra bioacumulado en las diatomeas y adsorbido en la biopelícula, ya que los rayos X característicos empleados para el análisis por EDS, son generados cuando el haz de electrones penetra en la muestra a profundidades de 300–1000 nm (0.3 a 1µm) (Pantano y Kelso 1984).
CONCLUSIONES
El uso de biomasa viable y no viable constituye una alternativa apropiada para remover cobre utilizando reactores anaerobios. La bioadsorción de cobre utilizando reactores con lodos acidogénicos anaerobios viable y no viable, presenta una interacción soluto–adsorbente de segundo orden bajo las condiciones experimentales, ya que se ajusta al modelo de Langmuir. Este proceso es más eficiente al trabajar con soluciones acuosas con baja concentración de cobre. Sin embargo, se obtienen valores de remoción ligeramente superiores cuando se trabaja con lodo no viable. De acuerdo con los resultados de la caracterización microestructural, los lodos empleados en la remoción de cobre están compuestos por diatomeas (sílice amorfa) y una matriz de sílice (cristobalita). La formación de la biopelícula y la presencia de cobre en los lodos empleados en la bioadsorción, permiten establecer que el cobre se encuentra bioacumulado en las diatomeas y adsorbido en la biopelícula.
AGRADECIMIENTOS
El presente estudio forma parte del proyecto de investigación científica básica 2007 No. 82561 Apoyado por CONACyT. Los autores expresan su agradecimiento al Centro de Investigación y Estudios Avanzados (CINVESTAV) Unidad Saltillo y a su auxiliar de investigación Felipe de Jesús Márquez Torres por su apoyo y asesoría en la caracterización por microscopía electrónica de barrido, espectroscopia de energía dispersa y difracción de Rayos X, como parte del convenio de cooperación CINVESTAV Unidad Saltillo/ Universidad de Sonora 2006. Al Departamento de Ingeniería Química y Metalurgia, en forma muy especial a la Q.B. María Elena Ochoa, Ángel Antonio Romero y Jesús Cervantes por su apoyo en los análisis realizados.
REFERENCIAS
Alexander M. (1999). Biodegradation and Bioremediation. 2a ed. Academic Press. Maryland Heights, EUA, pp. 377–390. [ Links ]
APHA (1995). Standard Methods for the Examination of Water and Wastewater 19th ed. American Public Health Association/American Water Works Association/Water Environment Federation, Washington DC, USA. [ Links ]
Boivin M.Y., Breure A. M., Vanden Ende F.P., Greve G.D., Rutgers M. y Admiral W. (2005). Effects of copper and temperature on aquatic bacterial communities. Aquatic. Toxicol. 71, 345–356. [ Links ]
Crites R. y Tchobanoglous G. (2000). Tratamiento de aguas residuales en pequeñas poblaciones. McGraw–Hill. Colombia, 344–473 pp. [ Links ]
Donlan R.M. (2002). Biofilms: Microbial life on surfaces, (en línea). http://www.cdc.gov/ncidod/EID/vol.8no9/02–0063.html. 06/05/08. [ Links ]
Gutiérrez–Cerón M. A., González González L.R., Sánchez Mora E. y Mellado Peralta D. (1997). Biosorción de Pb (II) porbiomasa de Saccharomyces cerevisiae. Memorias. XI Congreso Nacional de Ingeniería Sanitara y Ambiental. Zacatecas, Zacatecas, México, del 4 al 7 de noviembre, 2002. [ Links ]
Haytoglu B., Demier G.N. y Yetis U. (2001). Effectiveness of anaerobic biomass in adsorbing heavy metals. Water Sci. Technol. 44, 245–252. [ Links ]
Laguna A., Ouattara A., González R.O., Barón O., Fama G., El Mamouni R., Guiot S., Monroy O. y Macarie H. (1999). A simple and low cost technique for determining the granulometry of upflow anaerobic sludge blanket reactor. Water Sci. Technol. 40, 1–8. [ Links ]
Leal C.A.L. (2007). Estudio termodinámico, cinético y microestructural de la descomposición de Na2SiF6–formación de nitruros de silicio en sistemas Na2SiF6–precursor de nitrógeno–diluyente. Tesis Doctoral. CINVESTAV, Unidad Saltillo. México, 55, 133 pp. [ Links ]
Mack C., Burgess J.E. y Ducan J.R. (2004). Membrane bioreactors for metal recovery from wastewater: A review. Water S.A. 30, 521–532. [ Links ]
Mesquita V.D., Augusto C.A.C., Assumpação H.C., Luiz C.V. y Pessôa F.F. (2007) Biosorption of lead by the brown seaweed Sargassumfilipendula–batch and continuous pilot studies. Electron J. Biotechnol. 10, 368–375. [ Links ]
Mullen M.D., Wolf D.C., Ferris F.G., Beveridge T.J., Flemming C.A. y Bailey G.W. (1989). Bacterial sorption of heavy metals. Appl. Environ. Microbiol. 55, 3143–3149. [ Links ]
Olguin–Lora P., Puig–Grajales L. y Razo–Flores E. (2003). Inhibition of the acetoclastic methanogenic activity by phenol and alkyl phenols. Environ. Technol. 24, 999–1006. [ Links ]
Pantano C.G. y Kelso J. C. (1984). Chemical analysis of fracture surface, fractography of ceramic and metal failures. American Society for Testing and Materials. West Conshohocken, EUA, pp. 139–156. [ Links ]
Peña–Castro J.M., Martínez Jerónimo F., Esparza García F. y Cañizares Villanueva R.O. (2004). Heavy metals removal by the microalgae Scenedesmus incrassatulus in continuos cultures. Bioresource Technol. 94, 219–222. [ Links ]
Reyes E.D., Cerino C.F. y Suárez H.M.A. (2006). Remoción de metales pesados con carbón activado como soporte de biomasa. Ing. IX, pp. 59–64. [ Links ]
Vieira R.H. y Volesky B. (2000) Biosorption: a solution to pollution? Int. Microbiol. 3, 17–24 [ Links ]
Visser A. (1995). The anaerobic treatment of sulfate containing wastewater. Ph. D. Thesis. Wageningen Agricultural University, Wageningen, Holanda, pp. 33–47. [ Links ]
Volesky B. (2004). Biosorption of heavy metals. ed. CRC Press, Boca Raton, Florida. 408 p. [ Links ]
Wang J. (2002). Biosoption of copper (II) by chemically modified biomass of Saccharomyces cerivisiae. Process Bioch. 37, 847–850. [ Links ]
Wang J. y Chen C. (2006). Biosorption of heavy metals by Saccharomyces cerevisiae: A review. Biotech. Adv. 24,427–451. [ Links ]














