Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.25 no.4 Ciudad de México nov. 2009
Artículos
Calidad microbiológica del acuífero de Zacatepec, Morelos, México
Microbiological quality of the Zacatepec aquifer, Morelos, Mexico
Elizabeth RAMÍREZ, Esperanza ROBLES, Ma. Guadalupe SAINZ, Reynaldo AYALA y Emelia CAMPOY
Facultad de Estudios Superiores, Iztacala, Universidad Nacional Autónoma de México, Av. de los Barrios 1, Los Reyes Iztacala, Tlalnepantla 54090, Estado de México, México. Correo electrónico: erf@servidor.unam.mx
Recibido enero 2008
Aceptado febrero 2009
RESUMEN
Los mantos subterráneos constituyen una de las principales fuentes de abastecimiento de agua potable en México. Por lo general, albergan sólo a ciertos organismos debido a su bajo contenido en materias nutritivas. Sin embargo, las actividades humanas y el crecimiento urbano son los principales factores para la contaminación de los acuíferos. De esta forma, el agua puede contener contaminantes químicos o biológicos que causan diversas enfermedades, entre los que están algunas amibas de vida libre (AVL). El objetivo de este estudio es determinar la calidad microbiológica (coliformes totales, coliformes fecales y amibas de vida libre) del acuífero de Zacatepec, Morelos. Para ello se realizaron muestreos mensuales durante un año en trece pozos del acuífero; se midieron en el lugar los siguientes parámetros fisicoquímicos: pH, oxígeno disuelto y temperatura. Se determinaron los coliformes totales y fecales utilizando la técnica de filtro de membrana; para las amibas se utilizó el medio selectivo agar no nutritivo con Enterobacter aerogenes (NNE) y la identificación se realizó tomando en cuenta sus características morfológicas. Todos los pozos presentaron contaminación por coliformes totales, uno de ellos con una media geométrica de 107 UFC/100 mL. En cambio, los coliformes fecales estuvieron ausentes en cuatro de los pozos, pero en uno se presentó contaminación alta con una media geométrica de 107 UFC/100 mL. El pozo más contaminado con bacterias fue el número 3 y la contaminación de coliformes totales y fecales más alta se presentó en los meses de abril y julio. Se detectaron amibas de vida libre en todos los pozos; en el 2 se encontró el mayor número de aislamientos amibianos, en tanto que en los pozos 4, 5 y 10 se presentaron los más bajos. Se observaron los números más altos en diciembre y enero y el más bajo en abril. Se aislaron 22 especies pertenecientes a 16 géneros; el más frecuente fue Hartmannella con 38 %, el cual no ha sido reportado como patógeno, pero se ha encontrado asociado a infecciones oculares y cerebrales en humanos. De las amibas patógenas, se detectó Acanthamoeba, pero con baja frecuencia (6.7 %). Los parámetros fisicoquímicos tuvieron muy poca variación temporal: el pH se mantuvo cercano a la neutralidad en un intervalo promedio de 6.7 a 7.3, la temperatura fue de 25.1 a 28.0 °C y el oxígeno disuelto de 2.9 a 4.8 mg/L. Los valores promedio de estos parámetros entre los pozos fueron muy semejantes. La presencia de las bacterias coliformes indica que existe una contaminación de origen antrópico en el acuífero y junto con la presencia de las amibas de vida libre patógenas, resalta la importancia de desinfectar el agua antes de su consumo como agua potable.
Palabras clave: coliformes, amibas de vida libre, agua subterránea, acuífero.
ABSTRACT
Groundwater is one of the main supply sources of drinking water in Mexico, as they support a poor biological community, because of their low contain of nutrients. However in the recent years, human activities and urban growth are the main factors of aquifer contamination. Therefore, water may contain chemical contaminants and microorganisms that can cause several diseases; such is the case of free–living amoebae (FLA). The objective of this research is to determine the microbiological quality (total coliforms, fecal coliforms and free–living amoebae) of Zacatepec aquifer, in the state of Morelos. Monthly samplings of thirteen wells of the aquifer were carried out during one year. The following physicochemical parameters were measure in situ: pH, dissolved oxygen (DO) and temperature. Total and fecal coliforms were determined by the membrane filter technique. Free–living amoebae were cultured on non–nutritive agar medium (NNE); the identification was carried out taking in account their morphological features. All the wells were polluted with total coliforms, one with a geometric mean of 107 CFU/100 mL. Fecal coliforms were absent in four wells; nevertheless, one presented a geometric mean of 107 CFU/100 mL. The most polluted well was number 3, and the months with more bacteria were April and July. Free–living amoebae were isolated in all the wells, the highest isolation number was found in well number 2, while the lowest were found in wells 4, 5, and 10. December and January were the months with the highest number of amoebae, and April with the lowest. Twenty two species belonging to 16 genera were isolated; the most frequent was Hartmannella with 38 %; this amoeba has not been reported as pathogenic, but it has been associated to ocular and brain infections in humans. Of the pathogenic amoebae, Acanthamoeba was isolated, but with a low frequency (6.7 %). Physicochemical parameters had low seasonal variation, pH was close to neutrality in a range of 6.4 to 7.3, temperature was in a range of 25.1 to 28 °C, and dissolved oxygen of 2.9 to 4.8 mg/L. The average values of the physicochemical parameters among the wells were very similar. The presence of coliforms indicates human pollution in the aquifer, and together with the presence of pathogenic free–living amoebae, stand out the significance of water disinfection before it being used as drinking water.
Key words: coliforms, free–living amoebae, groundwater, aquifer.
INTRODUCCIÓN
Entre las fuentes principales que suministran agua para consumo humano se encuentran los acuíferos, los cuales son formaciones geológicas que almacenan agua y actúan como depósito y reserva. La mayoría conforman grandes extensiones y generalmente se recargan por el aporte de aguas pluviales, corrientes superficiales y lagos que se infiltran en el suelo. Dentro de un acuífero, el agua escurre debido a la gravedad desde las zonas de recarga hacia las de descarga, las cuales pueden ser ríos, lagos o manantiales. La explotación se efectúa mediante el bombeo en pozos (Price 2007).
De todos los ambientes acuáticos, la biología del agua subterránea es una de las menos estudiadas; específicamente se conoce poco de los aspectos microbiológicos de la contaminación que ocurre en este ambiente –en comparación con las aguas superficiales–, principalmente debido a la creencia de que este tipo de agua es esencialmente limpia por la acción filtrante del medio poroso por el cual pasa el agua. Debido a lo anterior, la determinación del número de bacterias en el agua subterránea no se consideraba necesaria (Gerba y Bitton 1984, Zoller 1994).
Generalmente, la calidad del agua subterránea es superior a la del agua superficial con respecto al contenido bacteriológico, turbiedad y diversos parámetros físicos y químicos. La calidad del agua subterránea puede variar de un sitio a otro debido a los cambios de las condiciones hidrológicas y geológicas de cada lugar; puede tener alto contenido de metales (en general de hierro y manganeso) por disolución de componentes del suelo en el que se encuentran contenidos. Por otra parte, hay que tomar en cuenta que el acuífero no es renovable: si se explota con una tasa mayor a la de recarga, puede agotarse o deteriorar su calidad (Price 2007).
En la década de los setenta se observó en los Estados Unidos de América que el uso de agua subterránea no tratada provocó brotes de enfermedades transmitidas por el agua, lo que confirmó la posibilidad de su contaminación por microorganismos patógenos (Bitton y Harvey 1992).
En México, el interés en las investigaciones de la microbiología del agua subterránea se ha incrementado por la creciente demanda de esta fuente, ya que es indispensable que no exista riesgo a la salud por su uso.
De acuerdo con la Comisión Nacional del Agua, hasta ahora se han identificado en el país 459 acuiferos, de los cuales más de 20 % se encuentran en sobreexplotación: su extracción promedio anual se calcula en 24 km3 a través de 140 mil aprovechamientos subterráneos. El mayor número se encuentra en el noroeste del país, sin embargo los que reciben una recarga significativa se localizan en el sureste; de hecho, a excepción de esta zona, en México existen problemas de disponibilidad debido a que las recargas son menores a las extracciones.
Tanto la baja disponibilidad como los niveles de contaminación que presentan las cuencas hidrológicas y los acuíferos son alarmantes. Esto ha propiciado que se limiten los usos del agua y se impacte la salud pública y el entorno ambiental de muchas comunidades (Pacheco et al. 2004).
Las actividades humanas, el crecimiento urbano, la falta de decisión de las instituciones e indolencia cultural son los principales factores de riesgo para que un acuífero se contamine. Las principales fuentes de organismos patógenos son los efluentes de agua residual, lodos residuales de tratamientos de desechos y efluentes de tanques sépticos (Gerba y Bitton 1984, Keswick 1984, Eitan 1994, Wallach 1994).
De esta forma, el agua puede contener microorganismos que causan enfermedades diarreicas. Estos padecimientos son causados por bacterias, virus y protozoarios que se dispersan a través de la ruta fecal–oral y que potencialmente puede ser transmitidos por el agua de consumo utilizada para diversas actividades en el hogar, incluyendo la higiene personal o a través del contacto primario con aguas para uso recreativo contaminadas. Las amibas de vida libre (AVL), presentes en estos casos de contaminación, pueden causar daño al sistema nervioso central en el humano y otros animales (Craun 1984, Gerba y Bitton 1984, Bitton y Harvey 1992, Chapalle 1993, Zelikson 1994, Visvesvara et al. 2007, Bonilla y Ramírez 2008).
Según la Organización Mundial de la Salud, 80 % de las enfermedades infecciosas y parasitarias gastrointestinales se asocian con una tercera parte de las defunciones causadas por el uso y consumo de agua insalubre. La Organización también reconoce que sólo 41% de la población mundial consume agua purificada y desinfectada para ser considerada "segura" (Higuera et al. 2000).
En congruencia con lo anterior, en los países donde las enfermedades microbianas y parasitarias muestran elevados índices de prevalencia, la importancia primaria de la calidad del agua para uso y consumo humano está centrada en las características microbiológicas y se considera que la contaminación química, al no estar asociada con efectos inmediatos y agudos, tiene importancia secundaria (Higuera et al. 2000). Por lo tanto, el objetivo de este estudio fue determinar la calidad microbiológica (coliformes totales y fecales y amibas de vida libre patógenas) del acuífero de Zacatepec, Morelos.
MATERIALES Y MÉTODOS
El acuífero Zacatepec se localiza en la porción suroeste del estado de Morelos, donde las coordenadas para enmarcar el área del polígono del acuífero son: longitud Oeste de 99°14"20' y latitud Norte de 18°35"22'. Colinda al norte con el acuífero de Cuer–navaca, al este con el acuífero de Cuautla–Yautepec, y al poniente con los ríos Chontalcuatlán y San Jerónimo, ambos en el Estado de México (CNA2000). Los pozos de muestreo se ubicaron en los municipios de Coatlán del Río, Mazatepec, Miacatlán, Puente de Ixtla, Tlalquitenango, Tlaltizapan y Xochitepec (Fig. 1).

Este acuífero se ubica en dos diferentes unidades de rocas; la primera consiste en rocas ígneas basálticas fracturadas que presentan alta permeabilidad y distribución irregular. La segunda la constituyen rocas que presentan permeabilidad media y una distribución irregular.
Las muestras de agua se tomaron antes del proceso de cloración con el objeto de evaluar la calidad microbiológica del acuífero y no la efectividad del proceso de la cloración de los pozos.
Se tomaron muestras mensuales, durante un año, de trece pozos del acuífero de Zacatepec, haciendo un total de 312 muestras. Para las determinaciones bacteriológicas se tomaron las muestras en bolsas estériles de 250 mL, que se trasladaron en hielo al laboratorio para su análisis inmediato (con un tiempo de transportación de aproximadamente 2 a 3 horas). Para el análisis de las amibas de vida libre potencialmente patógenas, se tomaron las muestras de agua en envases estériles de 1000 mL y se transportaron al laboratorio a temperatura ambiente. En cada pozo se determinó in situ la temperatura y el oxígeno disuelto (OD) con un medidor de oxígeno YSI, modelo 5 1b, y el pH con un potenciómetro Conductronic modelo pH10.
En el laboratorio se determinaron dos parámetros bacteriológicos: coliformes totales y fecales utilizando la técnica de filtro de membrana; los resultados se expresaron en unidades formadoras de colonias (UFC) (APHA–AWWA–WEF 1998).
Para las amibas se filtraron 1000 mL de la muestra a través de membranas de 5 mm de poro en condiciones estériles. Las membranas se colocaron hacia abajo en placas de medio agar no nutritivo con la bacteria Enterobacter aerogenes (NNE). Las placas se incubaron a 30 °C y se revisaron después de ocho días para detectar el crecimiento amibiano, usando un microscopio invertido.
La identificación de las amibas se realizó tomando en cuenta las características morfológicas tanto de la forma trófica como quística; se observaron preparaciones frescas al microscopio de contraste de fases a 400 y 1000 aumentos, siguiendo las claves taxonómicas de Page (1988).
RESULTADOS
Con los resultados obtenidos se calculó la media geométrica, valor mínimo y valor máximo de los coliformes totales y fecales (Cuadro I).

En relación a las medias geométricas de los coliformes totales, todos los pozos presentaron contaminación, aunque sólo uno de ellos con 107 UFC/100 mL, tres con 12, 14 y 16 y el resto osciló entre 1 y 5 UFC/100 mL. Las medias geométricas de coliformes fecales fueron de 0 en 4 pozos; uno presentó contaminación alta (107 UFC/100 mL), dos con 10 y 16 y el resto osciló entre 1 y 3 UFC/100 mL. Los coliformes totales y fecales mostraron una amplia correlación entre ellos (0.9).
En relación a la variación espacial, se observó con las medias geométricas (Fig. 2) que el pozo más contaminado fue el número 3, seguido por los pozos 1, 2, 7 y 12. Los menos contaminados fueron 4, 5, 8, 9 y 10.
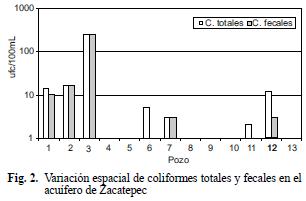
De acuerdo a la variación temporal, se notó que la contaminación por coliformes totales y fecales más alta se presentó en los meses de abril y julio (Fig. 3). Esos meses coinciden con las épocas de periodos vacacionales, en los cuales probablemente se incremente la población ambulante (visitantes) y con ello las descargas residuales y su infiltración al suelo.

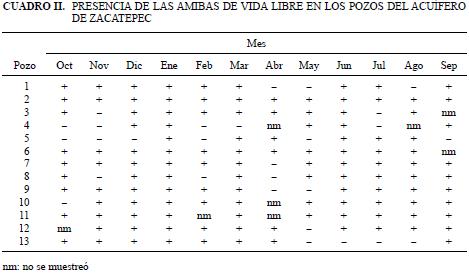
Con respecto a las amibas de vida libre, solamente en 18.9 % del total de muestras analizadas no se detectaron estos microorganismos. Se observó que en 10 de los pozos se presentaron amibas en todos o casi todos los meses, y solamente en los pozos 4 y 5 se detectaron amibas en 5 y 6 meses respectivamente (Cuadro II).
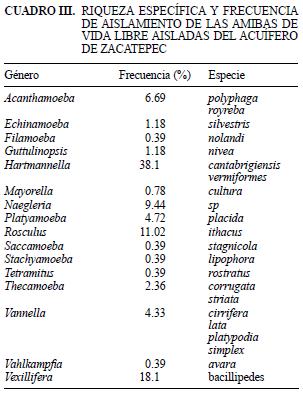
Se aislaron 22 especies pertenecientes a 16 géneros; el género amibiano que más se presento fue Hartmannella con 38 % de frecuencia (Cuadro III). De las amibas que se han reportado como patógenas, se detectó Acanthamoeba con baja frecuencia (6.7 %) y con dos especies: A. polyphaga y A. royreba. La amiba aislada del género Naegleria, por las características de su quiste, probablemente pertenezca a la especie N. gruberi, que no se ha reportado como patógena (Page 1988, Bonilla y Ramírez 2008).
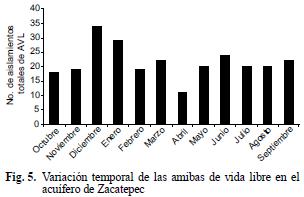
En el pozo 2 se encontró el mayor número de aislamientos amibianos, en tanto que en los pozos 4, 5 y 10 se presentaron los más bajos (Fig. 4). Con respecto a la variación temporal de las AVL, se observaron los números más altos en diciembre y enero y el más bajo en abril (Fig. 5).

Los parámetros fisicoquímicos tuvieron muy poca variación durante el período de estudio. El pH se mantuvo cercano a la neutralidad en un intervalo promedio de 6.7 a 7.3, la temperatura fue de 25.1 a 28.0 °C y el oxígeno disuelto de 2.9 a 4.8 mg/L (Cuadro IV). No se encontró ninguna correlación significativa entre las AVL con los coliformes totales y fecales y los parámetros fisicoquímicos. Tampoco se observó diferencia en la frecuencia o riqueza específica de las amibas en los pozos por la presencia de las bacterias coliformes.

DISCUSIÓN
En general, el agua de los pozos presentó contaminación bacteriológica: en todos los pozos se encontraron coliformes totales y en 9 de ellos se detectaron coliformes fecales. En consecuencia, de los trece pozos analizados, cinco presentaron medias geométricas bajas (de 0.56 a 1.04 UFC/100 mL para coliformes totales y de 0.31 a 0.79 UFC/100 mL para coliformes fecales), mientras que un pozo tuvo una media geométrica muy alta (107 UFC/100 mL) para ambos grupos de indicadores. El hecho de que en uno o más meses se presentara contaminación por coliformes totales en los pozos sugiere que el acuífero ya está siendo afectado por la contaminación urbana.
Una de las características principales de la zona es la falta de drenaje y aunque gran parte del uso del agua es agrícola, otra parte significativa es para uso doméstico; de ahí la importancia de que no se deteriore su calidad.
De acuerdo con los Criterios Ecológicos de Calidad del Agua (SEDUE 1989), aquellos cuerpos de agua que pueden ser utilizados para proveer agua para consumo humano, desde el punto de vista bacteriológico, deben presentar un máximo de 1000 UFC de coliformes fecales/100 mL para considerarse como fuente de abastecimiento de agua potable o riego agrícola. Los valores de coliformes fecales presentados en los pozos se encuentran por debajo de dicho límite, por lo que el agua es adecuada como fuente de suministro. Si consideramos que el agua pasa por un dosificador de cloro antes de llegar al público usuario, cumple conlaNOM–127–SSA1–1994 (SSA 1994), en la cual tanto los coliformes totales como los fecales deben estar ausentes.
La presencia de coliformes y amibas de vida libre en el acuífero, aunque sea en bajo número, indica que los microorganismos pueden estar presentes en el agua subterránea profunda y que estos sistemas acuáticos pueden soportar una comunidad micro–biológica. Lo anterior es importante porque hasta hace relativamente poco tiempo se consideraba que la posibilidad de que ocurrieran procesos biológicos en el agua subterránea era poca y no significativa (Gerba y Bitton 1984).
El hallazgo de amibas en el acuífero contribuye al conocimiento de la biología del agua subterránea: aunque se han realizado algunos estudios acerca del transporte y sobrevivencia de las bacterias y virus en el suelo y agua subterránea (Craun 1984, Gerba y Bitton 1984, Bitton y Harvey 1992, Chapelle 1993, Zelikson 1994, Price 2007), los estudios sobre otros grupos biológicos como los protozoos son escasos (Novarino etal. 1997, Ramírez et al. 2001).
El número de aislamientos amibianos relativamente alto que se obtuvo en el pozo 2 puede deberse a que se encuentra localizado dentro de una empresa avícola. Es posible que ésta aporte una importante contaminación tanto biológica como orgánica al agua subterránea a través de la disposición de sus efluentes de agua de desecho en el suelo, la cual es una de las principales fuentes de contaminación microbiológica del agua subterránea (Gerba y Bitton 1984, Keswick 1984, Field y Barber 1994, Wallach 1994).
De las amibas detectadas, Hartmannella –el género más frecuente (38.1 %)–, Vannella (4.33 %) y Vahlkampfia (6.39 %) se han encontrado asociadas a casos de encefalitis y queratitis en humanos, pero no se ha comprobado su papel como agentes causantes de dichas enfermedades (Aitken et al. 1996, Centeno et al. 1996, Dua et al. 1998, Inoue et al. 1998, Michel et al. 2000, Lorenzo et al. 2007, Scheid 2007).
La baja frecuencia con que se encontró el género Acanthamoeba, y el número de aislamientos amibianos encontrados, contrasta con lo reportado en acuíferos con mayor contaminación orgánica, en los que este género se ha encontrado hasta en 67.3 % y el número de aislamientos ha sido mayor (Ramírez et al. 2001). Esto concuerda con lo observado por Bitton y Gerba (1984), en el sentido de que en acuíferos de aguas limpias, el número de protozoarios podía ser bajo o aún cero, mientras que en acuíferos contaminados orgánicamente su abundancia era generalmente más alta.
No se observaron variaciones temporales importantes de temperatura, pH y oxígeno disuelto en el acuífero, lo que señala la mayor estabilidad de las condiciones ambientales de estos sistemas con respecto a los superficiales (Zoller 1994). Tampoco se observó una variación espacial importante de los parámetros fisicoquímicos.
Los valores de pH y oxígeno disuelto estuvieron dentro de los reportados para la presencia tanto de las amibas de vida libre no patógenas como patógenas, con un pH cercano a la neutralidad y concentraciones mínimas de oxígeno disuelto de 2 mg/L. Sin embargo, la temperatura del agua no favoreció una presencia mayor de las amibas patógenas, especialmente de Naegleria fowleri, debido a que prefieren temperaturas por encima de los 30 °C (Visvesvara et al. 2007, Bonilla y Ramírez 2008).
A pesar de que la mayoría de las amibas aisladas del acuífero no han sido reportadas como patógenas, hay que tener precaución con aquéllas en que existe duda acerca de su papel como patógenos, como es el caso de Hartmannella, Vahlkampfia y Vannella, por lo que no se debe de descuidar la desinfección que se aplica al agua antes de ser distribuida a los usuarios. Una concentración de cloro libre residual de 1.5 mg/L es suficiente para inhibir la presencia de estos géneros amibianos, la cual es la concentración máxima que debe de tener el agua para consumo humano. Sin embargo, otras amibas –como las del género Acanthamoeba–, son más resistentes al cloro y se requiere de una concentración mínima de 2 mg/L (SSA 1994, Bonilla et al. 2004).
También se debe tomar en cuenta que, aunque la vía de entrada principal al organismo humano de este grupo de amibas es por las fosas nasales durante la natación, se han reportados algunos casos de meningoencefalitis amibiana en los que el paciente contrajo la enfermedad por el contacto con agua potable contaminada, al enjuagarse enérgicamente durante el lavado de la cara y al estar jugando con el agua de una manguera; en ambos casos, la inoculación también fue por las fosas nasales (Visvesvara et al. 2007, Bonilla y Ramírez 2008).
La presente investigación contribuyó al conocimiento de la microbiología del agua subterránea, especialmente del grupo de las amibas, que ha sido poco estudiado.
Es probable que la presencia de asentamientos humanos, carentes de servicios sanitarios y drenajes adecuados, esté influyendo en el deterioro que se empieza a observar en la calidad del agua del acuífero. Esto también se puede deber en parte al incumplimiento de las especificaciones en la construcción de los pozos (SEMARNAT 1996a) y a la deficiente protección de los mismos (SEMARNAT 1996b).
A pesar del tipo de roca con alta y media permeabilidad que presenta el acuífero, se puede concluir que la capacidad del suelo para retener los contaminantes provenientes de las descargas de las aguas residuales, como es el caso de las bacterias que tienen carga negativa y pueden interactuar con las partículas de suelo cargadas positivamente, permite que el acuífero mantenga todavía una buena calidad microbiológica.
AGRADECIMIENTOS
Al Programa PAPCA 2006–2007 de la FES Iztacala, UNAM, por el apoyo económico otorgado para la realización de esta investigación.
A la Comisión Nacional del Agua, Gerencia de Aguas Subterráneas, Subgerencia de Explotación y Monitoreo Geohidrológico y a la Subdirección de Aguas Subterráneas, de la Dirección Técnica del Organismo de la Cuenca Balsas, por el apoyo y facilidades brindadas para la realización de este estudio.
REFERENCIAS
Aitken D., Hay J., Kinnear F.B., Kirkness C.M., Lee W.R. y Seal D.V. (1996). Amebic keratitis in a wearer of disposable contact lenses due to a mixed Vahlkampfia and Hartmannella infection. Ophthalmology. 103, 485–494. [ Links ]
APHA–AWWA–WEF (1998). Standard methods for the examination of water andwastewate. American Public Health Association, American Water Works Association, Water Environment Federation, Washington D.C. [ Links ]
Bitton G. y Harvey R.W. (1992). Transport of pathogens through soils and aquifers. En: Environmental Microbiology (R. Mitchell, Ed.). Wiley–Liss, Inc., Nueva York, pp. 103–124. [ Links ]
Bonilla P., Ramírez E., Ortíz R. y Eslava C. (2004). La ecología de las amibas de vida libre en ambientes acuáticos. En: Microbiología Ambiental (I. Rosas, A. Cravioto, E. Ezcurra, Eds.). SEMARNAT, INE, PUMA–UNAM, Ciudad de México, pp. 67–81. [ Links ]
Bonilla P. y Ramírez E. (2008). Amebas de vida libre asociadas a patologías en seres humanos. En: Parasitología Médica (M.A. Becerril, Ed.). McGraw–Hill Interamericana, Ciudad de México, pp. 22–30. [ Links ]
Centeno M., Rivera F., Cerva L., Tsutsumi V., Gallegos E., Calderón A., Ortiz R., Bonilla P., Ramírez E. y Suárez G. (1996). Hartmannella vermiformis isolated from the cerebrospinal fluid of a young male patient with meningoencephalitis and bronchopneumonia. Arch. Med. Res. 27, 579–586. [ Links ]
Chapelle H.F. (1993). Groundwater Microbiology and Geochemistry. John Wiley & Sons, Inc., Nueva York, 448 p. [ Links ]
CONAGUA (2000). Determinación de la disponibilidad del agua en el acuífero de Zacatepec, Estado de Morelos. Comisión Nacional del Agua, Gerencia de Aguas Subterráneas, Subgerencia Regional Técnica, México, 83 pp. [ Links ]
Craun G. F. (1984). Health aspect of groundwater pollution. En: Groundwater pollution microbiology (G. Bitton y Ch. P. Gerba, Eds.). John Wiley & Sons, Nueva York, pp. 135–180. [ Links ]
Dua H.S., Azuara–Blanco A., Hossain M. y Lloyd J. (1998). Non–Acanthamoeba amebic keratitis. Cornea 17, 675–677. [ Links ]
Eitan G. (1994). Groundwater contamination by septic tanks. En: Groundwater contamination and control (U. Zoller, Ed.). Marcel Dekker Inc., Nueva York, pp. 203–208. [ Links ]
Field J.A. y Barber L.B. (1994). Wastewater treatment and groundwater contamination. En: Groundwater Contamination and Control (U. Zoller, Ed.). Marcel Dekker Inc., Nueva York, pp. 377–390. [ Links ]
Gerba P. y Bitton G. (1984). Microbial pollutants: their survival and transport pattern to groundwater. En: Groundwater pollution microbiology (G. Bitton y Ch. P. Gerba, Eds.). John Wiley & Sons, Nueva York, pp. 65–88. [ Links ]
Higuera I.A., Castillo E.I., Eslava C.C., Cifuentes E., Cortés M.J., Murillo R.M. y Yalaupari M.J.P. (2000). Contaminación del Agua y efectos en la salud. http://cofepris.salud.gob.mx/bv/libros/Cap02.pdf 22/11/2007 [ Links ]
Inoue T., Asari S., Tahara K., Hayashi K, Kiritoshi A. y Shimomura Y. (1998). Acanthamoeba keratitis with simbiosis of Hartmannella ameba. Am. J. Ophthalmol. 125, 721–723. [ Links ]
Keswick B.H. (1984). Sources of groundwater pollution. En: Groundwater pollution microbiology (G. Bitton y Ch.B. Gerba, Eds.). John Willy & Sons, Nueva York, pp. 39–64. [ Links ]
Lorenzo–Morales J., Martínez–Carretero E., Batista N., Álvarez–Marín J., Bahaya Y., Walochnik J. y Valladares B. (2007). Early diagnosis of amoebic keratitis due to a mixed infection with Acanthamoeba and Hartmannella. Parasitol. Res. 102, 167–169. [ Links ]
Michel R., Schmid E.N., Böker T., Hager D.G., Müller K.D., Hoffmann R. y Seitz H.M.(2000). Vannella sp. harboring Microsporidia–like organisms isolated from the contact lens and inflamed eye of a female keratitis patient. Parasitol. Res. 86, 514–520. [ Links ]
Novarino G., Warren A., Butler H., Lambourne G., Boxshall A., Bateman J., Kinner N.E., Harvey R.W., Mosse R.A. y Teltsch B. (1997). Protistan communities in aquifers: a review. FEMS Microbiol. Rev. 20, 261–275. [ Links ]
Pacheco A. J., Cabrera S. A. y Pérez C. R. (2004). Diagnóstico de la calidad del agua subterránea en los sistemas municipales de abastecimiento en el estado de Yucatán, México. Ingeniería 8, 165–179. [ Links ]
Page F.C. (1988). A new key to freshwater and soil gymnamoebae. Fresh Water Biological Association. Cumbria, Inglaterra, 112 pp. [ Links ]
Price M. (2007). Agua subterránea. Limusa, Ciudad de México, 330 pp. [ Links ]
Ramírez E., Campoy E., Matus D., Robles E., Bonilla P., Warren A. y Ortiz R. (2001). Free–living amoebae in organically–contaminated aquifer in Mexico. En: Proceedings of IXth International Meeting of the Biology and Pathogenicity of Free–Living Amoebae (S. Billot–Bonet, P.A. Cabanes, F. Marciano–Cabral, P. Pernil, y E. Pringuez, Eds.). John Libbey. Eurotex, París, pp. 109–116. [ Links ]
Scheid P. (2007). Mechanism of intrusion of a microspordian–like organism into the nucleus of host amoebae (Vannella sp.) isolated from a keratitis patient. Parasitol. Res. 101, 1097–1102. [ Links ]
SEDUE (1989). Criterios Ecológicos de Calidad del Agua. CE–CCA–001/89. Secretaría de Desarrollo Urbano y Ecología. 1 de Diciembre de 1989. [ Links ]
SEMARNAT (1996a). Norma Oficial Mexicana NOM–003–CNA–1996. Requisitos durante la construcción de pozos de extracción de agua para prevenir la contaminación de acuíferos. Secretaría de Medio Ambiente, Recursos Naturales y Pesca. Diario Oficial de la Federación. 6 de Enero de 1997. [ Links ]
SEMARNAT (1996b). Norma Oficial Mexicana NOM–004–CNA–1996. Requisitos para la protección de acuíferos durante el mantenimiento y rehabilitación de pozos de extracción de agua y para el cierre de pozos en general. Secretaría de Medio Ambiente, Recursos Naturales y Pesca. Diario Oficial de la Federación. 24 de Julio de 1997. [ Links ]
SSA (1994). Norma Oficial Mexicana NOM–127–SSA1–1994, Salud ambiental. Agua para uso y consumo humano (Modificación). Límites permisibles de calidad y tratamiento a que debe someterse el agua para su potabilización. Secretaría de Salud. Diario Oficial de la Federación. 16 de Diciembre de 1999. [ Links ]
Visvesvara G.S., Moura H. y Schuster F.L. (2007). Pathogenic and opportunistic free–living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol. Med. Mic. 50, 1–26. [ Links ]
Wallach R. (1994). Groundwater contamination by sewage irrigation. En: Groundwater contamination and control (U. Zoller, Ed.). Marcel Dekker Inc., Nueva York, pp. 189–202. [ Links ]
Zelikson R. (1994). Microorganisms and viruses in groundwater. En: Groundwater contamination and control (U. Zoller, Ed.). Marcel Dekker Inc., Nueva York, pp. 425–436. [ Links ]
Zoller U. (1994). Fundamentals, scope, and issues. En: Groundwater Contamination and Control (U. Zoller, Ed.). Marcel Dekker Inc., Nueva York, pp. 1–4. [ Links ]














