Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.25 no.4 Ciudad de México nov. 2009
Artículos
Adsorción de arsénico en zeolita natural pretratada con óxidos de magnesio
Arsenic adsorption in natural pre–treated zeolite with magnesium oxide
Flérida MEJÍA–ZAMUDIO1,3, Jesús L. VALENZUELA–GARCÍA1, Salvador AGUAYO–SALINAS1 y Diana MEZA–FIGUEROA2
1 Departamento de Ingeniería Química y Metalurgia, Universidad de Sonora, Blvd. Luis Encinas y Rosales s/n, Col. Centro, Hermosillo, Sonora, México. 83000. Correo electrónico: fleridam@iq.uson.mx
2 Departamento de Geología, Universidad de Sonora, Blvd. Luis Encinas y Rosales s/n, Col. Centro, Hermosillo, Sonora, México. 83000.
3 Instituto de Ingeniería, Universidad Autónoma de Baja California, Blvd. Benito Juárez s/n, Mexicali, Baja California, México. 21900.
Recibido noviembre 2008
Aceptado abril 2009
RESUMEN
Se desarrolló una metodología para pretratar una zeolita natural (chabazita) con óxido de magnesio para remover arsénico (As+5) en agua de consumo humano. Se propone un tratamiento con óxido de magnesio por considerarse un adsorbente eficiente para remoción de metales en agua. El análisis de difracción de rayos X muestra cambios significativos en la chabazita debido a la presencia de óxidos e hidróxidos amorfos incorporados durante el pretratamiento. Los resultados del diseño experimental muestran una eficiencia superior a 90 % de As+5 adsorbido en un tiempo de cinco minutos. Los resultados indican que las variables más significativas que afectan la adsorción de As+5 son la concentración inicial de As y la relación sólido/líquido (S/L). Los datos experimentales se ajustan de mejor forma a la isoterma de Freundlich, con lo que se obtiene una capacidad de adsorción de 20.17 mg/g.
Palabras clave: chabazita, adsorción, arsénico, zeolita natural.
ABSTRACT
A methodology was developed to modify a natural zeolite (chabazite) with magnesium oxide in order to remove arsenic (As+5) from water for human consumption. It is proposed a magnesium oxide while regarded as an efficient adsorbent for removing metals in water. X–ray diffraction analyses show significant changes in the chabazite due to the presence of oxides and amorphous hydroxides incorporated during the pretreatment. Experimental design results show an efficiency greater than 90 % of As+5 adsorbed in five minutes. The results indicate that the most significant variables affecting the adsorption of As+5 are the initial concentration of As and the solid/liquid (S/L) ratio. Experimental data fitted better to Freundlich isotherm with a 20.17 mg/g adsorption capability.
Key words: chabazite, adsorption, arsenic, natural zeolite.
INTRODUCCIÓN
El arsénico, tanto en su forma orgánica como inorgánica, es un elemento tóxico a la salud humana que persiste en el ambiente como resultado de contaminación natural y antrópica (Söros et al. 2003). La exposición crónica a arsénico, aún en bajas concentraciones, puede ocasionar diversos problemas a la salud (Rivera y Piña 2005). Las fuentes antrópicas comunes incluyen incineradores de basura, combustión, refinerías y gasolinas (Ozaki et al. 2004). Las emisiones a la atmósfera pueden incorporarse a suelos y aguas superficiales a través de procesos de depósito por vía seca o húmeda (Carbonell et al. 1995). Las fuentes naturales incluyen la lixiviación de minerales que contienen arsénico, que afecta principalmente a las aguas subterráneas (Thirunavukkarasu et al. 2002).
La reducción de los niveles de arsénico en aguas de consumo humano representa uno de los retos ambientales prioritarios a nivel mundial (Thirunavukkarasu et al. 2002). En México se han reportado problemas de contaminación de arsénico en agua en las siguientes regiones: Comarca Lagunera (Rosas et al. 1999), Zimapán, Hidalgo (Romero et al. 2008), Guanajuato (Mahlknecht et al. 2004), Zacatecas, Zacatecas (Castro et al. 2003) y Cuautla, Morelos (García y Armienta 1996).
Se han desarrollado estudios de toxicidad y costos para la implementación de sistemas de remoción de metales en las plantas potabilizadoras por medio de la Organización Mundial de la Salud (OMS), la Unión Europea, la Agencia de Protección Ambiental de Estados Unidos (USEPA), entre otros organismos internacionales (Mohan y Pittman 2007). Gracias a lo anterior se han establecido los límites máximos permisibles de arsénico en agua para consumo humano (Cuadro I).

La química del arsénico en medio acuoso es compleja y depende de varios factores, incluyendo pH y potencial redox (Eh). De acuerdo al diagrama potencial–pH mostrado en la figura 1, el arsénico es un elemento más o menos noble; es decir, se requieren condiciones de oxidación o reducción moderadas o altas para solubilizarlo. La presencia del oxígeno atmosférico u otro oxidante promueve su disolución (Pourbaix 1966).

Los estados de oxidación más comunes de arsénico inorgánico en el agua son el arsénico trivalente As+3, encontrado en aguas subterráneas, y el arsénico pentavalente As+5 que prevalece en aguas superficiales. El As+5 es presentado como H3AsO4; sus correspondientes productos de disociación son H2AsO4–, HAsO42– y AsO43–. As+3 aparece como H3AsO3; sus productos de disociación son H4AsO3+, H2AsO3–, HAsO32– y AsO33–, considerado el más tóxico (Cullen y Reimer 1989).
Existen diversas tecnologías para remover arsénico del agua:
i) Coagulación/precipitación: proceso de desestabilización de las partículas suspendidas, donde se reducen las fuerzas de separación entre ellas, formando una malla tridimensional y porosa de coágulos (Fiol y Villaescusa 2001).
ii) Osmosis inversa: consiste en separar los iones metálicos del efluente al hacerlos pasar a través de una membrana semipermeable con alta presión, quedando retenidos en la membrana (Lankford y Eckenfelder 1990).
iii) Electrodiálisis: consiste en separar iones de un fluido mediante la utilización de membranas selectivas catiónicas y aniónicas. Estas membranas se colocan de forma alterna, constituyendo celdas; al final del apilamiento de membranas se activan electrodos, estableciendo una diferencia de potencial eléctrico (Ochoa 1996).
iv) Adsorción: se utiliza un sólido como adsorbente para eliminar sustancias solubles del agua, las cuales se unen a la superficie mediante fuerzas electrostáticas o de van derWaals. Dentro de los materiales con capacidades más altas de adsorción están el carbón activado, alúmina activada, arenas, zeolitas naturales, entre otros (Goel et al. 2004).
Existen otras alternativas como los medios basados en adsorbentes modificados, como el hierro con sulfuro, hidróxido férrico granular, óxido de titanio, las arenas cubiertas con óxido de hierro o de manganeso, bauxita, hematita, feldespato, laterita, minerales arcillosos (bentonita, caolinita), carbón de hueso y material celulósico (D'Ambrosio 2005). Algunos investigadores han descrito diferentes formas de preparación en las zeolitas naturales con disoluciones de sales o hidróxidos (Chen y Degnan 1988, Gómez 2001). Se han utilizado compuestos metálicos como adsorbentes selectivos para cationes y aniones como el arsénico en soluciones acuosas, como es el caso de hierro, zirconio, hidróxido de magnesio, ferromanganeso y bauxita, entre otros (Petkova et al. 1997, SAND 2002). El objetivo del presente estudio es desarrollar una metodología para modificar una zeolita natural tipo chabazita con hidróxido de magnesio y determinar la capacidad para disminuir la concentración de arsénico en agua para consumo humano.
MATERIALES Y MÉTODOS
Se utilizó una zeolita natural, chabazita (Ca2 [(AlO2)4(SiO2)8]•12H2O), proveniente del depósito La Palma, ubicado en el municipio de Divisaderos, Sonora, México. La zeolita se redujo de tamaño con una quebradora de quijada marca Le land Faraday de 170 X 135 mm, 5 HP y quebradora de cono de cabeza corta, marca General Electric, de 222 mm, de 1 HP. El producto se tamizó en una cribadora rotatoria portátil Rx–24; 80 % pasó por la malla #40 (0.424 mm) y 40 % quedó en la malla #60 (0.24 mm). La caracterización se llevó a cabo por medio de un análisis químico convencional, determinando %w (porcentaje en peso) de la relación Si/Al, %Al, %Al2O3 y %SiO2 con técnicas ya establecidas por la NOM–021–SEMARNAT–2000 (SEMARNAT 2000). En el cuadro II se presentan los resultados de dichos análisis.

Preparación de la zeolita pretratada
Se preparó una solución de ácido clorhídrico (HCl) 2M, sobresaturada con óxido de magnesio (MgO) a 98 % en un matraz erlenmeyer de 250 mL. Se separó la solución del exceso de MgO y se utilizó la solución para la preparación de la zeolita pretratada (ZP). Por otra parte, en otro matraz erlenmeyer de 250 mL se colocaron 10 g de zeolita natural (ZSP) y se mezclaron con 100 mL de la solución sobresaturada con MgO. Se dejó en agitación magnética por 20 horas. Después se filtró la mezcla y se secó en un horno a 110 °C. El diagrama experimental se muestra en la figura 2. El pretratamiento es sencillo y económico comparado con otros que requieren un proceso más complejo, como es el caso del estudio realizado por Gu et al. (2005).

Análisis de la zeolita natural y pretratada
Las muestras se examinaron con un microscopio electrónico de barrido (MEB) JEOL 5300, para observar la morfología y realizar el análisis de los elementos en varios puntos previamente seleccionados. Se utilizaron 8 \\m de distancia y voltaje de aceleración de 15 kV. El análisis de difracción de rayos–X se realizó con un difractómetro de rayos–X (D8–Advance), utilizando los siguientes parámetros: λ=1.52, 45 kV y 40 mA.
Diseño de experimentos
Se siguió una metodología de superficie de respuesta (MSR) de segundo orden y un diseño central compuesto 24 con ocho puntos axiales y una cara centrada (Box y Wilson 1951, Montgomery 2002).
La representación matemática expresada en la ecuación (1) es del modelo de MSR de segundo orden (Figueroa 2003):

donde e representa el ruido o error observado en la respuesta y.
En el cuadro III se observan los límites de los factores cuantitativos del diseño de experimentos realizados en el programa estadístico JMP IN 5.1 (SAS Institute Inc. 2004).

Pruebas de adsorción
Las soluciones de arsénico se prepararon con arsenato de sodio (Na2HAs4.7H2O,98 %) para obtener concentraciones iniciales de arsénico de 0.05, 0.275 y 0.5 mg/L. Se colocó la zeolita natural pretratada con un contenido en peso de 1, 5.5 y 10 g, respectivamente en tubos de plástico de 50 mL, con 25 mL de solución de arsenato de sodio a diversas concentraciones (0.05, 0.275 y 0.5 mg/L). La agitación de las muestras se mantuvo por 5, 32.5 y 60 minutos, a pH de 5, 7 y 9, el cual se ajustó con soluciones de HNO31M y NaOH 1M, posteriormente, las muestras se filtraron con papel Whatman 41. El análisis de arsénico se realizó por espectrofotometría de absorción atómica, con generador de hidruros, en un Perkin Elmer 2380 a una longitud de onda de 193.7 nm, de acuerdo al procedimiento señalado por laNOM–117–SSA1–1994 (SSA 1994).
Isotermas de adsorción
El estudio de las isotermas de adsorción se llevó a cabo a diferentes concentraciones iniciales de As+5: 0.05, 0.1 0.5 y 1 mg/L. La masa del adsorbente en la zeolita natural pretratada se mantuvo constante en 1 g durante el experimento, con un volumen de 25 mL de solución de arsénico, tomando una alícuota de 5 mL a los siete y catorce días de contacto, a temperatura promedio de 25 °C.
RESULTADOS Y DISCUSIÓN
Análisis de la caracterización de la zeolita natural y pretratada
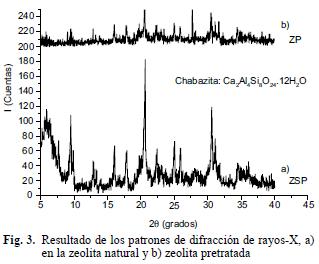
La composición química de la zeolita natural (ZSP) y zeolita pretratada (ZP) se muestra en el cuadro II; los porcentajes de Al, Al2O3 y SiO2 son muy similares para ambas. Los sitios más activos de una zeolita son donde ocurre el intercambio de los átomos de aluminio que tienen la carga no balanceada (Leyva et al. 2001); es decir que al aumentar el contenido de aluminios, disminuye la relación Si/Al. En la figura 3 se muestran los resultados de difracción de rayos–X en ZSP y ZP. Los picos de difracción en ZSP se observan en la figura 3a, los cuales coinciden con la carta JCPDS–34–0137 (Centro Internacional de Datos de Difracción). Esto indica que el componente principal es de zeolita natural de tipo chabazita (Ca2Al4Si8O24•12H2O) y en menor proporción se observan heulandita (Ca2(Al2Si7O18)•6H2O), cuarzo (SiO2) y erionita (K1.96Ca3.56 (Al9.48Si26.52O72) (H2O)30.78). En la figura 3b se observan los resultados de difracción de rayos–X en ZP, donde hay presencia de ruido debido a los compuestos amorfos que se incorporan durante el pretratamiento, como óxidos e hidróxidos de la solución sobresaturada de MgO.
Análisis de microscopía electrónica de barrido (MEB)
Una imagen en MEB de la zeolita proporciona información de la morfología de la superficie, forma, distribución de los tamaños del cristal y presencia de material amorfo (Hunter 1981). En la figura 4a se observa la chabazita natural a escala de 100 mm; presenta una variación de tamaño de partículas con forma estructural porosa y diferentes cavidades en su estructura cristalina. En la figura 4b se muestra un diagrama de espectroscopía de rayos X por dispersión de energía (EDX), que indica los elementos presentes en la zeolita natural. En la figura 5a se muestra el recuadro donde se llevó a cabo el análisis MEB de la zeolita pretratada; se aprecian partículas más pequeñas y finas comparadas con zeolita natural, tomando en cuenta que la escala se incrementó para poder observar mejor la morfología. El análisis semi–cuantitativo de los elementos en las zeolitas natural y pretratada se muestra en el cuadro IV, donde se observa que no hay cambios significativos en las zeolitas; sin embargo, se presentó un incremento de magnesio en la zeolita pretratada con respecto a la natural. En la figura 5b se observa el incremento de magnesio en el espectro EDX; esto indica la incorporación de óxido de magnesio durante el pretratamiento.



Adsorción de arsénico
En la figura 6 se muestra que la zeolita pretratada tiene resultados muy favorables, superiores a 90 % de arsénico adsorbido. Se considera que la incorporación de óxido de magnesio sobre la zeolita contribuye a que se obtengan altos porcentajes de adsorción. También se observa que el tiempo no tiene un efecto significativo, dado que la cinética de adsorción es muy rápida. Se ha reportado que el óxido de magnesio es un adsorbente muy eficiente para remover arsénico del agua, el cual puede dispersarse en las cavidades de las zeolitas y actuar como centro básico con más fuerza que el propio de la zeolita; estos centros constan de átomos de oxígeno de la superficie de los tetraedros [AIO4]5– cargados negativamente debido a la sustitución isomórfica de Si4+ por Al3+. Sin embargo, tienen el inconveniente de que se pueden carbonatar fácilmente con el dióxido de carbono (CO2) atmosférico, provocando la disminución de eficiencia en la adsorción de arsénico (Mirodatos et al. 1976, Gómez 2001, SAND 2002). Payne y Abdel–Fattah (2005) comparan a la zeolita natural clinoptilolita con chabazita, tratadas ambas con hierro; indican que el mejor adsorbente de As+5 fue la chabazita, que adsobrió aproximadamente 50 % con un tiempo de contacto de 48 h y 0.1 g del adsorbente. Se puede observar que los resultados del presente estudio son más favorables para la adsorción de arsénico utilizando chabazita pretratada con MgO. Debe tomarse en cuenta que algunos factores son diferentes, como el tipo de yacimiento de la zeolita, la forma en que se pretrató, el compuesto con el que se pretrató y las condiciones de adsorción.

Comportamiento de los parámetros de adsorción
En el cuadro V se muestran los parámetros del diseño de experimentos que se tomaron en cuenta para el estudio de adsorción para zeolita pretratada. Se observa que los porcentajes de arsénico adsorbido para los cincuenta experimentos van de 78.1 a 98.69 % [As]ads. Los resultados se aprecian de mejor forma en el análisis de predicción.

La figura 7 muestra el análisis de los parámetros del diseño de experimentos realizado en JMP IN 5.1.2, donde los parámetros estudiados revelaron los siguientes resultados con respecto al porcentaje de arsénico adsorbido. Se observó que el tiempo de contacto y el pH no tienen efectos con respecto a la adsorción, ya que se considera que su cinética es muy rápida. Sin embargo, para los parámetros de la relación sólido/líquido (S/L) y las concentraciones iniciales ([As]0) sí presentaron cambios significativos. La figura 8 muestra que no hay un efecto significativo de pH con la adsorción de arsénico para zeolita pretratada. Se ha reportado que As+5 permanece principalmente en forma de H2AsO4– en rangos de pH entre 3 y 6; mientras que HAsO42– predomina en valores de pH entre 8 y 10.5. En la región intermedia, en el rango de pH entre 6 y 8, ambas especies coexisten (Xu et al. 2002); se puede decir que se adsorben efectivamente por ZP a un pH óptimo entre 5 y 9, considerando este rango extenso para un funcionamiento práctico. Se han encontrado otros adsorbentes muy efectivos para el arsénico en rangos de pH muy similares, como la alúmina impregnada de La+3 y Y+3, con pH óptimo entre 6–8 y grano de chitosan impregnado de molibdeno, con pH óptimo entre 2 y 4 (Wasay et al. 1996, Dambies et al. 2000).


En la figura 9 se muestra que al incrementar la relación S/L, la adsorción de arsénico es mayor en el rango de 220 g/L a 440 g/L. Se observó que el incremento de la concentración inicial de arsénico fue un factor favorable en su adsorción, alcanzando valores superiores a 95 %. En la figura 10a se muestra el perfil de contorno del diseño de experimentos. Se puede observar que los valores de respuesta aumentan conforme los círculos se cierran, llegando a una región óptima (RO) de mayor adsorción para los factores cuantitativos más significativos (x2=[As]0 y x3=relación S/L). En la figura 10b se muestra la representación geométrica del diseño de superficie de respuesta en una placa con curvatura, alcanzando una máxima adsorción cuando se tienen altas concentraciones de [As]0 y de relación S/L. La ecuación (2) describe los parámetros más significativos del diseño de experimentos con respecto al porcentaje de adsorción de arsénico, determinado en el programa estadístico:



Isoterma de adsorción
La ecuación (3), expresada por Letterman y la American Water Works Association (2002), corresponde a la forma logarítmica de las isotermas de Freundlich:

donde qe es unidad de masa del adsorbato entre la masa del adsorbente en el equilibrio (mg/g), Kes la constante de Freundlich, relacionada con la capacidad de adsorción, 1/n es la intensidad de adsorción y Ce es la concentración inicial en equilibrio (mg/L). Valores menores a 1 de 1/n indican un mejor mecanismo de adsorción y de formación relativamente más fuerte entre adsorbato y adsorbente (Patil et al. 2006).
En la figura 11 se muestran los resultados de los parámetros obtenidos de las isotermas de adsorción, que se ajustaron de mejor forma al modelo de Freundlich, correspondiente a la ecuación (3), con lo que se obtuvo una recta del log qe contra log Ce. Con estos resultados se comprueba un mejor mecanismo de adsorción con 1/n = 0.705, de acuerdo con los que mencionan Patil et al. (2006). El coeficiente de correlación del modelo de Freundlich es significativo, alcanzando una R2 = 0.943 y la capacidad de adsorción es K = 20.17 mg/g.

CONCLUSIONES
La zeolita pretratada es un buen adsorbente de arsénico, con más de 90 % de adsorción. Se puede decir que la incorporación de óxidos de magnesio sobre la zeolita es un factor muy significativo para obtener resultados favorables en la adsorción de arsénico.
Los resultados del diseño de experimentos determinaron que las concentraciones iniciales de arsénico y la relación sólido/líquido son los parámetros más significativos para la adsorción de arsénico. Se encontraron los siguientes efectos:
La relación sólido/líquido, en el rango de 50 a 225 g/L aproximadamente, presenta un incremento significativo con respecto a la adsorción de arsénico; después de 225 g/L permanece constante hasta 440 g/L, debido a que alcanza un máximo de adsorción.
Se observa que el tiempo de contacto no influye, dado que la cinética de adsorción es muy rápida.
El pH no tiene un efecto en la adsorción de arsénico por la zeolita pretratada. En cambio, al incrementar la concentración inicial de arsénico, hay un porcentaje de remoción muy favorable.
Los datos experimentales se representaron de mejor forma con el modelo de Freundlich.
AGRADECIMIENTOS
Este estudio se realizó a través del apoyo otorgado por el Consejo Nacional de Ciencia y Tecnología (CONACyT, México), el Departamento de Ingeniería Química y Metalurgia de la Universidad de Sonora y el Posgrado en Ciencias e Ingeniería de la Universidad Autónoma de Baja California. En forma especial, se agradece al Dr. Wendell Ela de la Universidad de Arizona y al Dr. Felipe Castillón de la Universidad Nacional Autónoma de México, por el apoyo brindado en la investigación.
REFERENCIAS
Box G.E. y Wilson K.G. (1951). On the experimental attainment of optimum conditions. J. Royal Statist. Soc.B13, 1–45. [ Links ]
Carbonell A.A., Burló F.M. y Matalx J.J. (1995). Arsénico en el sistema suelo–planta: significado ambiental. Espagrafic, Alicante, España, 20 p. [ Links ]
Castro A., Torres L.G. e Iturbe R. (2003). Risk of aquifers contamination in Zacatecas, Mexico, due to mine tailings. Memorias. 10th International Conference on Tailings and Mine Waste. Vail, CO. 12 al 15 octubre, 2003, pp 255–262. [ Links ]
Chen N.Y. y Degnan T.E. (1988). Industrial catalytic applications of zeolites. Chem. Eng. Prog. 84, 32–41. [ Links ]
Cullen W.R. y Reimer K.J. (1989). Arsenic speciation in the environment. Chem. Rev. 89, 713–764. [ Links ]
Dambies L., Guibai E. y Roze A. (2000). Arsenic (V) sorption on molybdate–impregnated chitosan beads. Colloid. Surface. A. 170, 19–31. [ Links ]
D'Ambrosio C. (2005). Evaluación y selección de tecnologías disponibles para remoción de arsénico. Memorias. IV Congreso Hidrogeológico Argentino. Río Cuarto, Argentina. 25 al 28 de octubre, 2005. pp 1–11. [ Links ]
Diario Oficial de la República de Chile (1984). Norma Chilena Oficial N°409/1 Of. N°84. Agua potable. Parte I: Requisitos. Aprobada por el Ministerio de Salud mediante Decreto Supremo N°11, 3 de marzo de 1984. [ Links ]
European Union (1998). Directive 98/83/CE relative to human drinking water quality. Official Journal of European Communities L330. España, 40 p. [ Links ]
Figueroa G. (2003). Optimización de una superficie de respuesta utilizando JMP IN (en línea). http://semana.mat.uson.mx/MemoriasXVII/XIII/gudelia.pdf 15/08/2008 [ Links ]
Fiol N. y Villaescusa I. (2001). Adsorción de Cu (II) y Pb (II) de disoluciones acuosas y residuos de pinyol de oliva. Tesina de Licenciatura, Departamento de Ingeniería Química Agraria y Tecnología Agroalimentaria. Universidad de Gerona, Gerona, España, 13 p. [ Links ]
García E.A. y Armienta H.M. (1996). Distribución de arsénico en sedimentos fluviales a lo largo del río Tolimán, Zimapán. Actas INAGEQ. 6° Congreso Nacional de Geoquímica. San Luis Potosí, SLP. 23 al 27 de septiembre, 1996. pp. 327–329. [ Links ]
Goel R., Kapoor S.K., Misra K. y Sharma R.K. (2004). Removal of arsenic from water by different adsorbents. Indian J. Chem. Tech. 11, 518–525. [ Links ]
Gómez M.J. (2001). Síntesis, caracterización y aplicaciones catalíticas de zeolitas básicas. Tesis de Doctorado. Facultad de Ciencias Químicas. Universidad Complutense de Madrid. Madrid, España, 25 p. [ Links ]
Gu Z., Fang J. y Deng B. (2005). Preparation and evaluation of GAC–based iron containing adsorbents for arsenic removal. Environ. Sci. Technol. 39, 3833–3843. [ Links ]
Hunter R.J. (1981). Zeta potential in colloid science: principles and applications. Academic Press. London, Nueva York, 239 p. [ Links ]
Lankford P.W. y Eckenfelder W.W. (1990). Toxicity reduction in industrial effluents. Van Nostrand Reinhold, Nueva York, 100 pp. [ Links ]
Letterman R.D. y American Water Works Association. (2002). Calidad y tratamiento del agua. Manual de suministro de agua comunitaria. 5a ed. McGraw Hill Interamericana de España. Madrid, España, 834 p. [ Links ]
Leyva R.R., Sánchez M.A., Hernández M.V. y Guerrero R.M. (2001). Remoción de metales pesados de solución acuosa por medio de clinoptilolitas naturales. Rev. Int. Contam. Amb. 17, 129–136. [ Links ]
Mahlknecht J., Steinich B. y Navarro de Leon I. (2004). Groundwater chemistry and mass transfers in the Independence aquifer, central Mexico, by using multivariate statistics and mass–balance models. Environ. Geol. 45, 781–795. [ Links ]
Mejía F.A. (2008). Adsorción de arsénico en zeolita natural (chabazita) pretratada. Tesis de Maestría. División de Ingeniería. Universidad de Sonora. Sonora, México, 21 p. [ Links ]
Mirodatos C., Pichat P. y Barthomeuf D. (1976). Generation of catalytically active acidic OH groups upon CO2 neutralization of basic sites in Mg– and Ca–Y zeolites. J. Phys. Chem. 80, 1335–1342. [ Links ]
Mohan D. y Pittman J.C.U. (2007). Arsenic removal from water/wastewater using adsorbents – A critical review. J. Hazard. Mater. 142, 1–53. [ Links ]
Montgomery D.C. (2002). Diseño y análisis de experimentos. 2a ed. Limusa Wiley. México, 482 p. [ Links ]
Ochoa J.R. (1996). Electrosíntesis y electrodiálisis. Fundamentos, aplicaciones tecnológicas y tendencias. McGraw–Hill. Madrid, España, 410 p. [ Links ]
Ozaki H., Watanabe I. y Kuno K. (2004). As, Sb and Hg distribution and pollution sources in the roadside soil and dust around Kamikochi, Chubu Sangaku National Park, Japan. Geochem. J. 38, 473–484. [ Links ]
Patil S.J., Brole A.G. y Natarajan G.S. (2006). Scavenging of Ni(II) metal ions by adsorption on PAC and babhul bark. J. Environ. Sci. Eng. 48, 203–208. [ Links ]
Payne K.B. y Abdel–Fattah T.M. (2005). Adsorption of arsenate and arsenite by iron treated activated carbon and zeolites: effects of pH, temperature, and ionic strength. J. Environ. Sci. Heal. A 40, 723–749. [ Links ]
Petkova V., Rivera M.L., Piña M., Avilés M. y Pérez S. (1997). Evaluación de diversos minerales para la remoción de arsénico de agua para consumo humano. Memorias Técnicas. 11° Congreso Nacional de Ingeniería Sanitaria y Ciencias Ambientales. Zacatecas, México. 4 al 7 de noviembre, 1997. pp. 1–10. [ Links ]
Pourbaix M. (1966). Atlas of electrochemical equilibrium in aqueous solutions. Pergamon Press, Oxford, Nueva York, 282 p. [ Links ]
Rivera M.L. y Piña M. (2005). Tratamiento de agua para remoción de arsénico mediante adsorción sobre zeolita natural acondicionada. (en línea). http://www.zeocat.es/docs/aguaarsenico2.pdf 30/09/2007 [ Links ]
Romero F. M., Armienta M. A., Gutiérrez M. E. y Villaseñor G. (2008). Factores geológicos y climáticos que determinan la peligrosidad y el impacto ambiental de jales mineros. Rev. Int. Contam. Ambient. 24, 43–54. [ Links ]
Rosas I., Belmont R., Armienta A. y Baez A. (1999). Arsenic concentrations in water, soil, milk and forage in Comarca Lagunera, Mexico. Water Air Soil Poll. 112, 1–2. [ Links ]
SAND (2002). SAND2002–3641. Sorption of arsenic from drinking water to Mg(OH)2, Sorrel's cements, and zirconium doped materials. Sandia National Laboratories, United States Department of Energy. Reporte técnico. Albuquerque, NM. 10 p. [ Links ]
SAS Institute Inc. (2004). JMP design of experiments, version 5.1.2. Manual de usuario. Cary, NC, 90 pp. [ Links ]
SEMARNAT (2000). Norma Oficial Mexicana NOM–021–SEMARNAT–2000. Establece las especificaciones de fertilidad, salinidad y clasificación de los suelos, estudio, muestreo y análisis. Secretaría del Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación, México, 23 de abril de 2003. [ Links ]
Söros C., Bodó E.T., Fodor P. y Morabito R. (2003). The potential of arsenic speciation in mollusks for environmental monitoring. Anal. Bioanal. Chem. 377, 25–31. [ Links ]
SSA (1994). Norma Oficial Mexicana NOM–117–SSA1–1994. Bienes y servicios. Método de prueba para la determinación de cadmio, arsénico, plomo, estaño, cobre, fierro, zinc y mercurio en alimentos, agua potable y agua purificada por espectrometría de absorción atómica. Secretaría de Salud. Diario Oficial de la Federación, México, 16 de agosto de 1995. [ Links ]
SSA (1994). Modificación de Norma Oficial Mexicana NOM–127–SSA1–1994. Salud ambiental. Agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización. Secretaría de Salud. Diario Oficial de la Federación, México, 22 de noviembre de 2000. [ Links ]
Thirunavukkarasu O.S., Viraraghavan T., Subramanian K.S. y Tanjore S. (2002). Organic arsenic removal from drinking water. Urban Water. 4, 415–421. [ Links ]
USEPA (2001). EPA–816–K–02–18. Implementation guidance for the arsenic rule. Office of Ground Water and Drinking Water, United States Environmental Protection Agency. Manual. Washington, DC. 6978 p. [ Links ]
Wasay S.A., Tokunaga S. y Park S.W. (1996). Removal of hazardous anions from aqueous solutionby La(III)–and Y(III)–impregnated alumina. Sep. Sci. Technol. 31, 1501–1514. [ Links ]
WHO (2004). Guidelines for drinking water quality. World Health Organization. Manual. Ginebra, Suiza. 515 p. [ Links ]
Xu Y.H., Nakajima T. y Ohki A. (2002). Adsorption and removal of arsenic (V) from drinking water by aluminum–loaded Shirasu–zeolite. J. Hazard. Mater. B92, 275–287. [ Links ]














