Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.24 no.4 Ciudad de México nov. 2008
Daphnia exilis Herrick, 1895 (Crustacea: Cladocera). Una especie zooplanctónica potencialmente utilizable como organismo de prueba en bioensayos de toxicidad aguda en ambientes tropicales y subtropicales
Daphnia exilis Herrick, 1895 (Crustacea: Cladocera). A zooplankter potentially usable as test organism for acute toxicity tests in tropical and subtropical environments
Fernando MARTÍNEZ–JERÓNIMO, Jesús RODRÍGUEZ–ESTRADA y Laura MARTÍNEZ–JERÓNIMO
Laboratorio de Hidrobiología Experimental. Escuela Nacional de Ciencias Biológicas, I.P.N. Prol. Carpio Esq. Plan de Ayala s/n, Col. Sto. Tomás, México, D. F. 11340, México. Tel: +52 (55) 5729–6000 ext. 62424. Fax: +52 (55) 5729–6000 ext. 46211. Correo electrónico: fjeroni@ipn.mx , ferjeronimo@hotmail.com
Recibido febrero 2008
Aceptado junio 2008
RESUMEN
La evaluación biológica de los efectos tóxicos que producen los contaminantes químicos sobre los organismos acuáticos es fundamental para establecer medidas de control que restrinjan o limiten la contaminación en los ecosistemas acuáticos receptores de descargas. Para realizar esta valoración con frecuencia se emplean como organismos de prueba a diferentes especies planctónicas, siendo Daphnia magna el cladócero más utilizado en todo el mundo en pruebas de toxicidad, pese a que su utilidad en ambientes tropicales y subtropicales es cuestionada. La propuesta de especies alternativas se dificulta por la falta de información biológica y toxicológica que sustenten la conveniencia de su uso. En este estudio se desarrolló un método para la producción controlada de neonatos de Daphnia exilis, un cladócero de gran talla que está ampliamente distribuido en América del Norte, y se evaluó su sensibilidad mediante bioensayos de toxicidad aguda a 20 y 25 °C, con el tóxico de referencia cromo hexavalente (Cr(VI)). La concentración letal media (CL50) determinada a 48 h fue de 0.1170 ± 0.0068 y 0.0802 ± 0.0057mg L-1, respectivamente a 20 y 25 °C, que son valores menores a los reportados para D. magna (0.2076 ± 0.0164 y 0.1544 ± 0.0175 4 mg L-1, a 20 y 25 °C respectivamente), lo que indica una mayor sensibilidad. Debido a su talla, facilidad de manejo y cultivo, así como por su sensibilidad, se sugiere a D. exilis como un organismo de prueba adecuado para la realización de estudios toxicológicos en latitudes tropicales y subtropicales.
Palabras clave: cromo hexavalente, zooplancton, toxicología acuática, Daphnia magna
ABSTRACT
The assessment of the toxic effects of chemical pollutants on the aquatic biota is fundamental for the accomplishment of control measures aimed to prevent and limit the pollution of aquatic ecosystems. Zooplankters are frequently used as test organism in the aquatic toxicity evaluation, and the cladoceran Daphnia magna is the main species globally used for this purpose, yet the convenience of use D. magna in tropical and subtropical regions has being discussed. Nevertheless, the proposal of other surrogate species is restricted due to the lack of biological and toxicological information which justify and give support to these alternatives. Daphnia exilis is a big cladoceran widely distributed in North America; in this study, a method for the controlled production of D. exilis neonates was tested. The sensitivity of this cladoceran was assessed with the reference toxicant hexavalent chromium (Cr(VI)), at 20 and 25 °C. The 48–h median lethal concentration (LC50) was 0.1170 ± 0.0068 and 0.0802 ± 0.0057mg L-1, respectively at 20 y 25 °C; these values were lower than those reported for D. magna (0.2076 ± 0.0164 and 0.1544 ± 0.0175 mg L-1, at 20 y 25 °C respectively), thus indicating a higher sensitivity of D. exilis. Considering its large size (both for adults and neonates), the easy culture and management, and its high sensitivity, we suggest D. exilis as a test organism adequate for toxicological studies in tropical and subtropical regions.
Key words: chromium, Cr(VI), zooplankton, aquatic toxicology, Daphnia magna
INTRODUCCIÓN
La determinación de los efectos tóxicos de los compuestos químicos que ingresan como contaminantes a través de efluentes descargados en los sistemas acuáticos, constituye una de las principales tareas de los investigadores dedicados al análisis de la calidad del agua y actualmente a los que realizan estudios de evaluación de riesgo ambiental.
En países desarrollados, esta problemática se ha canalizado efectivamente a través de esquemas normativos que incluyen de manera importante la determinación de los efectos sobre los sistemas biológicos, tanto en exposiciones de corto como de largo plazo (Hobbs et al. 2005), y se ha llegado incluso hasta el nivel de no sólo determinar lo que ocurre con las especies aisladas, representativas de estos ambientes, sino que se han impulsado de manera importante los estudios sobre las rutas y mecanismos de transporte de los contaminantes en los ecosistemas y la determinación de la acumulación, transformación y efectos diferenciales que ocurren en las comunidades que habitan ahí, lo que ha dado lugar al desarrollo de una nueva disciplina científica conocida como ecotoxicología (Maki 1983).
En nuestro país todavía es incipiente la inclusión de criterios biológicos en la normatividad ambiental, pues se sustenta en estándares de calidad ambiental que se basan en niveles máximos permisibles para algunos contaminantes considerados como importantes por sus efectos biológicos, pero sin que exista una evaluación biológica que permita determinar si tales estándares son en realidad efectivos para lograr la protección de la vida acuática, y al igual que en otras partes del mundo, se aplican técnicas y procedimientos desarrollados para ambientes templados, pese a que las condiciones físicas, químicas y biológicas en los trópicos y subtrópicos suelen ser muy diferentes (Lacher y Goldstein 1997, Kwok et al. 2007).
La evaluación de los efectos tóxicos de los contaminantes se realiza a través de la exposición controlada de organismos de prueba seleccionados (que deseablemente son representativos de las comunidades en los ambientes acuáticos), a concentraciones establecidas de compuestos químicos (puros o en mezclas), o bien directamente a diluciones de muestras de efluentes contaminantes, muestras de agua de sistemas receptores de descargas, o muestras de formulaciones químicas comerciales, de composición conocida o desconocida, cuya toxicidad desea determinarse, normalmente en exposiciones cortas, lo que permite expresar el resultado como una concentración letal media (CL50), para un tiempo de exposición determinado.
Para la evaluación de los efectos tóxicos de los contaminantes químicos es importante la adecuada elección del organismo de prueba que se empleará, pues no sólo es necesario contar con un valor de CL50, sino que es también indispensable el poder inferir posibles daños sobre las comunidades acuáticas en los sistemas receptores, a partir de este resultado (Dorn et al. 1987, Chapman 2000).
Por cuestiones prácticas, relacionadas principalmente con la facilidad de cultivo, de manejo y sobre todo por su importancia ecológica, con frecuencia se recurre a especies planctónicas como organismos de prueba, y de manera particular a los cladóceros, pues son estos un componente fundamental en la comunidad zooplanctónica, siendo un grupo dominante que funciona como el enlace principal entre los productores primarios y los consumidores de niveles tróficos superiores (Mount y Norberg 1984). Entre los cladóceros, Daphnia magna es la especie más utilizada y ha sido propuesta como especie de referencia en múltiples protocolos estandarizados de entidades reguladoras y organismos internacionales involucrados en la normalización de procedimientos de prueba (Martínez–Jerónimo et al. 2000).
En la evaluación de riesgos ecológicos, la información toxicológica para especies tropicales y subtropicales es prácticamente nula, por lo que los países de estas regiones emplean criterios de calidad del agua que han sido desarrollados para especies de ambientes templados, lo que conlleva un fuerte grado de incertidumbre sobre su alcance real (Kwok et al. 2007). Ejemplo de esto se presenta en la normatividad ambiental de México, en la que se incluyen tres pruebas biológicas aceptadas para la evaluación de la toxicidad, y una de ella se refiere a Daphnia magna como organismo de prueba, pese que este cladócero se distribuye naturalmente en lagos templados de la región Holártica.
El número de especies estandarizadas para realizar la evaluación de efectos tóxicos en el agua es bastante limitado, si se considera la riqueza específica que es común encontrar en muchos de los ecosistemas naturales, y principalmente en los tropicales, que en su conjunto representan alrededor del 75% de la biodiversidad mundial (Lacher y Goldstein 1997). Sin embargo, la propuesta de otras opciones como organismos de prueba, normalmente se enfrenta a obstáculos como la falta de información biológica para entender los mecanismos de reacción e interpretar adecuadamente las respuestas de intoxicación observadas, dificultades para obtener lotes confiables de organismos de ensayo (Arenzon et al. 2003), falta de consistencia en los resultados, y desconocimiento de los intervalos "normales" de respuesta a fin de determinar cuando un resultado denota realmente un efecto significativo. No obstante, es necesario buscar y proponer especies alternativas debidamente sustentadas, que proporcionen información más adecuada y fácil de entender y extrapolar, de acuerdo a las condiciones ambientales de la biota acuática que prevalece en áreas geográficas que no están incluidas en las zonas templadas del mundo (Kwok et al. 2007).
En el presente estudio se establecieron las condiciones de propagación más adecuada para la obtención confiable de organismos de prueba de un cladócero de talla comparativamente grande (semejante a D. magna), que se distribuye desde el Norte de los Estados Unidos de Norteamérica hasta México (incluyendo la región Neártica y parte de la Neotropical) (Hairston et al. 1999, Benzie 2005), que presenta muchas semejanzas morfológicas, reproductivas y de ciclo de vida con Daphnia magna, y que potencialmente podría ser considerado como especie de referencia para la evaluación de los efectos tóxicos de contaminantes acuáticos en México.
MATERIALES Y MÉTODOS
La cepa de Daphnia exilis Herrick, 1895 que se empleó en este estudio fue obtenida del Cepario de Cladóceros del Laboratorio de Hidrobiología Experimental de la Escuela Nacional de Ciencias Biológicas (Instituto Politécnico Nacional). Esta cepa fue aislada de charcas temporales ubicadas en el vaso del ex–lago de Texcoco (19° 27' 08.49" N, 98° 59' 41.54" W), y ha sido mantenida exitosamente en cultivo controlado por más de 10 años.
Para el sistema de producción de neonatos (juveniles con edad menor a 24 h después de ser liberados de la cámara incubatriz de las progenitoras, que es la fase de desarrollo que se emplea como organismo de prueba para los ensayos de toxicidad por ser la más sensible), se utilizaron recipientes de 500 ml que contenían 400 ml de agua dura reconstituida (US EPA 2002) y en los que se colocaron 10 neonatos hembras obtenidos de un lote de reproductores de edad conocida. Para propósitos de este estudio se implementaron un total de 10 de estas unidades de producción asexual de crías (por partenogénesis), que serían empleadas en las pruebas de toxicidad que se detallan más adelante, y que fueron mantenidos a 22±2 °C, con fotoperiodo de 16:8 (luz: obscuridad).
Como alimento para D. exilis se suministró la microalga clorofícea Pseudokirchneriella subcapitata (cultivada asépticamente en medio basal de Bold esterilizado en autoclave), en una concentración inicial de 1,000,000 céls. mL-1. El medio de cultivo y el alimento fueron renovados en su totalidad cada dos días, por lo que la cantidad de microalgas se mantuvo aproximadamente constante durante todo el tiempo.
Una vez que se inició la reproducción, las hembras partenogenéticas adultas eran separadas y todos los neonatos producidos eran colectados cuidadosamente mediante filtración del medio en un tamiz de 125 µxm. Las crías producidas a partir de la tercera reproducción fueron utilizadas para los ensayos de toxicidad. La vida máxima del lote de reproductores en cada unidad de cultivo fue de 28 días, al término de los cuales se desecharon y fueron sustituidos por un lote nuevo. Esto se hizo con el propósito de evitar variabilidad en la sensibilidad de los neonatos, pues las primeras y últimas reproducciones en el ciclo vital de las hembras partenogenéticas están constituidas por crías de relativamente menor tamaño, que se supone son también de mayor sensibilidad en su respuesta tóxica (Martínez–Jerónimo et al. 2006).
Para las pruebas de toxicidad aguda, que tuvieron una duración de 48 h, se evaluó la respuesta de los neonatos al cromo hexavalente (Cr(VI)), metal considerado como tóxico de referencia (Dorn et al. 1987). Las concentraciones de prueba fueron obtenidas a partir de soluciones concentradas de dicromato de potasio de alta pureza (J. T. Baker®, 99.98 %).
La toxicidad aguda fue determinada a 20 y 25 °C, temperaturas que corresponden a las consideradas como óptimas para ensayos de toxicidad con especies tropicales (Kwok et al. 2007). Se realizaron más de 60 bioensayos (3 6 pruebas a 20° y 30 ensayos a 25 °), siguiendo el protocolo sugerido por la OECD (2004). La concentración letal media (CL50) fue determinada mediante la aplicación de un programa de cómputo (Stephan 1977) que permitió establecer el valor estimado y el correspondiente intervalo de confianza (95 %) con al menos cuatro métodos distintos (Probit, Logit, Ángulos Móviles Promedio y Binomial).
Con los resultados de todos los bioensayos se calculó también el coeficiente de variación con la fórmula: CV % = 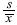 100 (Zar 1999).
100 (Zar 1999).
Con los valores de CL50 a cada temperatura se construyeron las cartas control, que con posterioridad pudieran ser de utilidad en la determinación de la variabilidad en la sensibilidad de esta especie en aquellos laboratorios en los que se utilizara como organismo de prueba.
Como otra característica a tomar en cuenta para respaldar el empleo de D. exilis en ensayos de toxicidad, se encuentra su talla, que es grande comparativamente con otras especies de cladóceros distribuidos naturalmente en latitudes subtropicales y tropicales. Para documentar esto se determinó la talla (en mm) de organismos adultos a los 28 días (la máxima vigencia del lote), midiendo la longitud corporal (Lc, desde el extremo de la porción cefálica hasta la inserción de la espina caudal), la longitud de la espina caudal (E), y la anchura máxima (A, la máxima longitud entre la parte dorsal y ventral del organismo). También se registró la talla de los neonatos (longitudes total, corporal y de la espina caudal) en camadas consecutivas de hembras reproductoras mantenidas a 20 °C. Esta evaluación fue realizada sólo a esta temperatura a fin de reducir la posibilidad de que se pudieran tener estadios juveniles mezclados en la progenie y que esto aumentara la variabilidad en la medidas.
RESULTADOS
El método de producción de crías resultó ser muy eficiente para abastecer de organismos de prueba adecuados para realizar un número suficiente de ensayos de toxicidad a ambas temperaturas. De acuerdo a cuantificaciones realizadas de manera paralela, en las que se contaba diariamente toda la progenie producida en cada uno de los recipientes de cultivo, se pudo establecer una producción promedio de 85 ± 4.5 neonatos por día (P = 95 %), por lo que las crías producidas en sólo dos unidades de cultivo eran suficientes para preparar un bioensayo completo diariamente.
Se realizaron un total de 36 y 30 bioensayos a 20 y 25 °C, respectivamente. Aún cuando la CL50 fue determinada por cuatro métodos distintos, se optó por presentar en este estudio exclusivamente los resultados obtenidos mediante el ajuste Probit, por ser el que resultó mas consistente para todos los datos analizados, además de que es un método adecuado para el tipo de ensayos de toxicidad realizados (Finney, 1971).
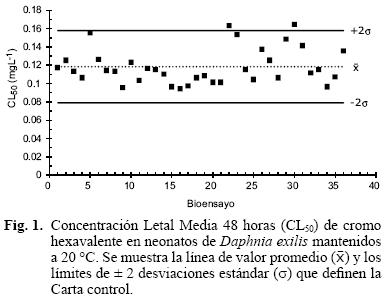
En la figura 1 se muestran todos los valores de CL50 determinados a 20 °C. Como se puede observar, la variabilidad registrada es relativamente baja, lo que se confirma por el valor del coeficiente de variación (CV), que fue de 16.54 %. El valor promedio de CL50 fue de 0.1182 mg L–1, con un intervalo de confianza (P = 0.95) de ± 0.0064 mg L–1. En esta misma figura se muestran la línea de valor promedio y los límites  ± 2σ (media ± 2 desviaciones estándar), que forman parte de lo que se denomina como Carta Control para este tóxico de referencia, y que es de utilidad al momento de realizar un análisis de toxicidad aguda, para determinar si la respuesta en los controles positivos cae dentro de los límites de variabilidad aceptables para esta especie, lo que permitiría confirmar la validez de las respuestas observadas en ensayos toxicológicos.
± 2σ (media ± 2 desviaciones estándar), que forman parte de lo que se denomina como Carta Control para este tóxico de referencia, y que es de utilidad al momento de realizar un análisis de toxicidad aguda, para determinar si la respuesta en los controles positivos cae dentro de los límites de variabilidad aceptables para esta especie, lo que permitiría confirmar la validez de las respuestas observadas en ensayos toxicológicos.
Los valores de CL50 determinados a 25 °C se muestran en la figura 2. El valor de CL50 promedio fue de 0.0802 mg L–1, con intervalo de confianza (P = 0.95) de ± 0.0057 mg L–1. El coeficiente de variación en este caso fue de 19.72 %, un valor que aunque es ligeramente superior al determinado a 20 °C, sigue siendo comparativamente bajo, pues la US EPA (2002) reporta para D. magna un intervalo de CV intra–laboratorio entre 21 y 58 %, con diferentes tóxicos de referencia. La línea de valor promedio para la CL50 y los límites  ± 2σ, que definen la Carta Control para D. exilis a 25 °C, también se muestran en la Fig. 2.
± 2σ, que definen la Carta Control para D. exilis a 25 °C, también se muestran en la Fig. 2.

Las medidas promedio y el intervalo de confianza (95 %) de las hembras partenogenéticas en los lotes de reproductores al término de su periodo útil (28 días) fueron: Lc=3.59 ± 0.04 mm (3.1–3.8 mm, mínimo–máximo), E=1.43±0.07 mm (0.8–1.8 mm, mínimo–máximo), y A = 2.27 ± 0.05 mm (2.0–2.6 mm, mínimo–máximo).
La talla de los neonatos varió dependiendo de la camada, como se muestra en la Fig. 3, y aunque en todos los casos correspondieron a neonatos (en el sentido en el que fueron definidos previamente), es posible que la variación observada en camadas consecutivas se pueda deber a diferencias ligeras (de unas cuantas horas) en el tiempo posterior a su liberación de la cámara incubatriz, aunque claramente la talla de los pertenecientes a la primer camada fue más pequeña. El valor promedio para la longitud total fue de 1.64 ± 0.09 mm (P = 0.95), que corresponde a una talla razonablemente adecuada para poder ser manipulada sin necesidad de emplear algún equipo óptico.

DISCUSIÓN
Del análisis de las figuras 1 y 2 resalta notablemente que los neonatos de D. exilis fueron más sensibles al cromo hexavalente a 25 que a 20 °C, lo cual muestra que una mayor temperatura de exposición hace que la CL50 sea menor. Esta diferencia en sensibilidad coincide con lo determinado para D. magna con este mismo tóxico de referencia (Martínez–Jerónimo et al. 2006), aunque esos autores determinan a las mismas temperaturas valores mayores de CL50 (0.2076 ± 0.0164 mg L–1 y 0.1544 ± 0.0175 mg L–1, a 20 y 25 °C, respectivamente), pese a que las temperaturas consideradas como óptimas para ensayos de toxicidad con especies templadas se ubican entre 12 y 18 °C (Kwok et al. 2007). De esta manera se demuestra que D. exilis es un cladócero más sensible que D. magna al cromo hexavalente. Este resultado difiere de lo reportado por Kwok et al. (2007) quienes señalan que, en general, las especies de aguas templadas son más sensibles que las tropicales al efecto tóxico de los metales.
Los resultados obtenidos en el presente estudio también demuestran la consistencia de las respuestas de D. exilis al Cr(VI), lo que se aprecia por los valores bajos del coeficiente de variación y por el mayor número de ensayos realizados para contar con información más confiable; éste último supera con mucho al reportado en otros estudios para un solo laboratorio (Dorn et al. 1987). Debe resaltarse que tanto la facilidad de cultivo como la sensibilidad y la repetitividad de los resultados son características deseables en la propuesta de organismos de prueba alternativos (Arenzon et al. 2003).
La controversia por el uso de D. magna como organismo de prueba no es reciente, pues no obstante las enormes ventajas que se le reconocen, también se cuestiona su distribución geográfica y las condiciones de propagación y de exposición durante las pruebas, así como lo prolongado de su ciclo de vida (Mount y Norberg 1984). Sin embargo, a nuestro juicio la principal objeción es la imposibilidad de poder obtener organismos de campo en ambientes tropicales y subtropicales, y las dificultades para poder entender y expresar los resultados obtenidos en un marco ambiental que es significativamente distinto al que corresponde al ámbito de distribución natural de este cladócero. No obstante es preciso reconocer la enorme cantidad de información biológica y toxicológica de la que se dispone, lo que lo convierte indiscutiblemente en el organismo zooplanctónico mejor conocido y más empleado como organismo de prueba en toxicología acuática (Martínez–Jerónimo et al. 2000).
La búsqueda de cladóceros alternativos, con ventajas semejantes a las de D. magna pero con mayor presencia en ambientes tropicales y subtropicales, ha sido una constante en varios países de América Latina y el caso más relevante es el de D. similis, una especie que desde 1993 forma parte de la normatividad ambiental en Brasil (Buratini et al. 2004). D. similis al igual que D. exilis pertenecen al género Ctenodaphnia, en el cual también se ubica a D. magna (Hairston et al. 1999, Benzie 2005), y que incluye a los dáfnidos de mayor talla. En el aspecto taxonómico, también se señala que D. exilis, se ubica dentro del complejo de especies agrupado en D. similis (Hairston et al. 1999), lo cual establece semejanzas importantes en su potencialidad, no obstante que paraD. similis sí se cuenta con información experimental y toxicológica publicada. Hairston et al. (1999) indican que D. exilis, que se reconoce claramente como un taxa distinto dentro del grupo similis, se distribuye principalmente en México y en la parte sur de los Estados Unidos de Norteamérica, y aunque ha invadido latitudes más norteñas, no ha tenido éxito en su colonización.
La talla de los organismos es importante en la selección de un organismo de prueba, pues influye en el manejo de los reproductores y de los neonatos, que son la fase de desarrollo normalmente empleada en ensayos de toxicidad. Hairston et al. (1999) reportan que la longitud corporal de hembras adultas de D. exilis en muestras de campo fluctúa de 1.8 a 4.5 mm. La talla máxima determinada en este estudio fue de 3.8 mm, pero debe tomarse en cuenta que ésta corresponde a una edad de 28 días, por lo que es posible alcanzar tallas mayores pues el ciclo vital se puede prolongar hasta 60 días (Martínez–Jerónimo, datos no publicados). De cualquier forma, la talla determinada tanto en adultos como en crías permitesu manejo sin necesidad del empleo de equipo óptico, pues en particular las crías pueden ser fácilmente visualizadas antes, durante y al término de las pruebas de toxicidad, como aquí se pudo comprobar.
Con respecto a D. similis, Buratini et al. (2004) determinaron que no fue más sensible que D. magna al dicromato de potasio, pero sus resultados no pueden ser comparados con los nuestros, pues su tiempo de exposición fue menor (24 h). Ellos también reportan que para varios otros tóxicos ensayados D. similis tuvo una sensibilidad semejante y en algunos casos mayor a la de D. magna. Por su parte Utz y Boher (2001) evaluaron el efecto de dos sales (KCl y KC2H3O2) con D. similis y Ceriodaphnia dubia, y aunque no es posible determinar su sensibilidad comparativa, D. similis fue muy sensible a ambos compuestos, confirmando su utilidad como organismo de prueba.
A diferencia de D. similis, especie para la cual se considera que existe un cúmulo importante de información y se cuenta con una metodología de producción y ensayo bien definidas (de Medeiros et al. 2001), en el caso de D. exilis no se dispone de información publicada sobre su biología experimental ni sobre antecedentes de su uso como organismo de prueba en toxicología. Por lo anterior este estudio puede considerarse inédito, máxime que en este momento se realizan esfuerzos institucionales importantes para poder determinar métodos de prueba adecuados para ser integrados en la normatividad ambiental nacional. Como resultado de estos trabajos hemos propuesto la inclusión de D. exilis y el presente sería el primer documento que aporta elementos biológicos y de sensibilidad importantes para sustentar esta propuesta. Sin embargo, como complemento al presente estudio, sería necesario repetir este ejercicio con otros compuestos tóxicos a fin de poder refrendar la conveniencia de emplear en latitudes como la de México no sólo especies con mayores intervalos de distribución geográfica, sino también aquellas que demostraran una mayor sensibilidad a un amplio espectro de tóxicos.
AGRADECIMIENTOS
Los autores agradecen a la COFAA del IPN y al sistema EDI del IPN por los apoyos recibidos. También a la M. en C. Sandra Luz Guerra Martínez, responsable del Cepario de microalgas y cianobacterias del Laboratorio de Hidrobiología Experimental, ENCB–IPN, quien proporcionó los cultivos de microalgas que se utilizaron durante todo el estudio. Por último expresamos nuestro agradecimiento a dos revisores anónimos, por sus acertadas sugerencias y correcciones.
REFERENCIAS
Arenzon A., Fontana Pinto R., Colombo P. y Raya–Rodríguez M. T. (2003). Assessment of the freshwater annual fish Cynopoecilus melanotaenia as a toxicity test organism using three reference substances. Environ. Toxicol. Chem. 22, 2188–2190. [ Links ]
Benzie J.A.H. (2005). Cladocera: The genus Daphnia (including Daphniosis). Guides to the identification of the microinvertebrates of the continental waters of the world. No. 21. Kenobi Productions, Ghent, 376 p. [ Links ]
Buratini S.V., Bertoletti E. y Zagatto P.A. (2004). Evaluation of Daphnia similis as a test species in ecotoxicological assays. Bull. Environ. Contam. Toxicol., 73, 878–882. [ Links ]
Chapman P.M. (2000). Whole effluent toxicity testing–usefulness, level of prediction, and risk assessment. Environ. Toxicol. Chem. 19, 3–13. [ Links ]
De Medeiros V.M., Watanabe T., Coler R.R. y Coler R.A. (2001). Development of methods to assess the impact of herbicide use on the benthos of littoral impoundments in northeast Brazil. J. Aquat. Ecosyst. Stress Recov. 9, 67–71. [ Links ]
Dorn P.B., Rodgers Jr. J.H., Kop K.M., Raia J.C. y Dickson K.L. (1987). Hexavalent chromium as a reference toxicant in effluent toxicity tests. Environ. Toxicol. Chem. 6, 435–444. [ Links ]
Finney D.J. (1971). Probit analysis. Cambridge University Press. Cambridge, 333 p. [ Links ]
Hairston N.G. Jr., Perry L.J., Bohonak A.J., Fellows M. Q., Kearns C. M. y Engstrom D.R. (1999). Population biology of a failed invasion: Paleolimnology of Daphnia exilis in upstate New York. Limnol. Oceanogr. 44, 477–486. [ Links ]
Hobbs D.A., Warne M. St. J. y Markich S.J. (2005). Evaluation of criteria used to assess the quality of aquatic toxicity data. Environ. Toxicol. Chem. 1, 174–180. [ Links ]
Kwok K.W.H., Leung K.M.Y., Lui G.S.G., Chu V.K.H., Lam P.K.S., Morrit D., Maltby L., Brock T.C.M., Van den Brink P.J., Warne M. St. J. y Crane M. (2007). Comparison of tropical and temperate freshwater animal species' acute sensitivities to chemicals: Implications for deriving safe extrapolation factors. Environ. Toxicol. Chem. 3, 49–67. [ Links ]
Lacher T.E. y Goldstein M.I. (1997). Tropical ecotoxicology: Status and needs. Environ. Toxicol. Chem. 16, 100–111. [ Links ]
Maki A.W. (1983). Ecotoxicology– Critical needs and credibility. Environ. Toxicol. Chem. 2, 259–260. [ Links ]
Martínez–Jerónimo F., Espinosa–Chávez F. y Villaseñor–Córdova R. (2000). Effect of culture volume and adult density on the neonate production of Daphnia magna, as test organisms for aquatic toxicity tests. Environ. Toxicol. 15, 155–159. [ Links ]
Martínez–Jerónimo, F., Martínez–Jerónimo L. y Espinosa–Chávez F. (2006). Effect of culture conditions and mother's age on the sensitivity of Daphnia magna Straus 1820 (Cladocera) neonates to hexavalent chromium. Ecotoxicology, 15, 259–266. [ Links ]
Mount, D.I. y Norberg T.J. (1984). A seven–day life cycle cladoceran toxicity test. Environ. Toxicol. Chem. 3, 425–434. [ Links ]
OECD (2004). Daphnia sp. acute immobilisation test. OECD Guideline for testing of chemicals No. 202, 12 p. [ Links ]
Stephan C.E. (1977). Methods for calculating an LC50. En: (F.L. Mayer y J.L. Hamelink Eds.). Aquatic toxicology and hazard evaluation. American Society for Testing and Materials (ASTM) pp. 65–84, 534, Philadelphia, Pennsylvania. [ Links ]
USEPA (2002). Methods for measuring the acute toxicity of effluents and receiving waters to freshwater and marine organisms, 5a ed. US Environmental Protection Agency, Office of Water (4303T). NW. Washington, DC 20460. EPA–821–R–02–012, 266 p. [ Links ]
Utz L.R.P. y Bohrer M.B.C. (2001). Acute and chronic toxicity of Potassium Chloride (KCl) and Potassium Acetate (KC2H3O2) to Daphnia similis and Ceriodaphnia dubia (Crustacea; Cladocera). Bull. Environ. Contam. Toxicol. 66, 379–385. [ Links ]
Zar J.H., 1999. Bio statistical analysis. 4a ed. Prentice–Hall, New Jersey, EUA 663 p. [ Links ]














