Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.24 no.3 Ciudad de México ago. 2008
Biosorción de cobre en sistema por lote y continuo con bacterias aerobias inmovilizadas en zeolita natural (clinoptilolita)
Cooper biosorption in batch and continuos evaluation using immobilized aerobic bacteria in clinoptilolite
Onofre MONGE–AMAYA1, Jesús L. VALENZUELA–GARCÍA1, Evelia ACEDO–FÉLIX2, María T. CERTUCHA–BARRAGÁN1 y Francisco J. ALMENDÁRIZ–TAPIA1
1 Universidad de Sonora, Departamento de Ingeniería Química y Metalurgia. Blvd. Luis Encinas y Rosales s/n, Colonia Centro. C.P. 83000. Hermosillo, Sonora, México. Correo electrónico: onofrem@iq.uson.mx
2 Centro de Investigación en Alimentación y Desarrollo, A.C. Km. 0.6 Carretera a La Victoria. Hermosillo, Sonora, México
Recibido diciembre 2007
Aceptado mayo 2008
RESUMEN
En el presente trabajo se estudió la biosorción de cobre utilizando bacterias aisladas del río San Pedro, Sonora, México. Se aislaron 123 cepas bacterianas en tres muestreos realizados en diferentes épocas del año y se seleccionaron Escherichia coli y Burkholderia cepacia para realizar pruebas de biosorción en lote, las cuales presentaron un 73 % de biosorción del cobre, en 75 minutos, mientras que al utilizar zeolita sin activar como soporte de la bacteria, se obtuvo un 75 % de biosorción en el mismo tiempo. Las pruebas de biosorción en continuo se realizaron durante 28 días en un reactor aerobio de flujo ascendente empacado con zeolita (RAEFA–EZ), el cual fue inoculado con un consorcio de 10 cepas seleccionadas debido a que se desarrollaron en un medio ácido y se mantuvo en recirculación hasta obtener 1g/L de biomasa, posteriormente se alimentó con solución sintética de cobre a 50 mg Cu(II)/L, flujo de alimentación de 2.5 mL/min, flujo de aire a 36 mL/min, tiempo de retención hidráulico (TRH) de 0.87 días, temperatura a 30 °C y pH entre 3–4. La capacidad de biosorción de RAEFA–EZ fue de un 97 % en el primer día de experimentación y finalmente llega a la saturación a partir del onceavo día. Se concluye que la biomasa activa utilizada es capaz de biosorber metales pesados como el cobre y la zeolita utilizada sin activar sólo sirvió como soporte de la biomasa.
Palabras clave: biosorción, cobre, reactor, aerobio, zeolita
ABSTRACT
This study was conducted to evaluate the biosorption of copper by isolated bacteria from the San Pedro River located in the state of Sonora, México. Escherichia coli and Burkholderia cepacia were selected and isolated from 123 bacterial stocks taken during three sampling campaigns collected at different seasons of the year. These bacteria were utilized to conduct batch biosorption tests, which achieved 73 % of copper biosorption in 75 minutes. In addition by utilizing zeolite as bacterial support a 75 % of copper biosorption was obtained in the same period. The continuous biosorption tests were completed in 28 days in a zeolite packed up flow reactor (UAPZR). The inoculation was performed with a mix of 10 selected stocks. In addition, the bacteria were developed in an acid environment that was recycled until 1 g per liter of biomass was produced. At this time a copper solution containing 50 mg of Cu(II) per liter at a flow of 2.5 mL/min, was added to the reactor and its conditions set to an air flow of 36 mL/m, hydraulic retention time of 0.87 days, temperature of 30 °C and pH between 3 and 4. The biosorption efficiency of the UAPZR was 97 % in the first day of operation and reached saturation on the eleventh day. It is concluded that the active biomass utilized was able to heavy metals biosorption, such as copper, and demonstrates that the zeolite acts only as biomass support.
Key words: biosorption, copper, reactor, aerobe, zeolite
INTRODUCCIÓN
La preocupación por la contaminación ambiental ha dado como resultado investigación más intensa y el desarrollo de tecnologías sustentables, así como una normatividad cada vez más estricta. Como resultado, la introducción de tecnologías limpias en los procesos industriales ha logrado disminuir las descargas de sustancias contaminantes al ambiente. Sin embargo, en la mayoría de las empresas todavía se generan aguas residuales con concentraciones de sustancias contaminantes de consideración (Reyes et al. 2006).
La contaminación del agua, aire y suelo por metales pesados es uno de los problemas ambientales más severos, además de ser muy difícil de resolver. Las fuentes más comunes de contaminación por dichos metales son los procesos de refinación del petróleo, las plantas generadoras de energía y los procesos metalúrgicos (Acosta et al. 2007).
En México, como consecuencia del desarrollo industrial, se registra una creciente y preocupante contaminación ambiental, sobre todo debido a la poca educación ambiental durante varios siglos de actividad minera y, desde hace décadas, por la intensa explotación petrolera. La industria minera es una de las actividades económicas de mayor tradición en México, la cual es mayoritariamente metálica y se dedica principalmente a la producción de Cu, Zn, Ag y Pb. Esta actividad tiene un alto impacto ambiental, ya que afecta desde el subsuelo hasta la atmósfera, incluyendo suelos y cuerpos de agua. Debido al procesamiento de los recursos minerales, se han generado grandes cantidades de residuos sólidos, líquidos y gaseosos que han ocasionado una gran cantidad de sitios contaminados a lo largo de todo el país (Volke et al. 2004).
Un ejemplo de lo anterior se encuentra en el estado de Sonora, donde por varias décadas la minería se ha enfocado principalmente a la Ag y al Cu. Los distritos mineros más explotados en el estado se ubican en el municipio de Cananea, donde se han realizado estudios de calidad de agua superficial del río San Pedro durante los años 1997 y 1999, desde su origen cerca de la ciudad de Cananea, hasta el límite con Estados Unidos de América. Gómez–Álvarez et al. (2004) y recientemente Gómez–Álvarez et al. (2007) han realizado estudios sobre la evaluación de metales pesados (Cd, Cu, Fe, Mn, Pb y Zn) en los sedimentos del río San Pedro.
La cuenca del Río San Pedro se encuentra al norte del estado de Sonora, entre los paralelos 30° 52' y 31º 20' latitud norte y los meridianos 110° 06' y 110° 31' longitud este. Parte desde la ciudad de Cananea, a 1660 metros sobre el nivel del mar (msnm) y hacia el norte, hasta la estación hidrométrica Palominas en el estado de Arizona (EUA), aproximadamente a 1280 msnm (INEGI 1993).
La contaminación de las corrientes formadoras del río San Pedro ha sido evidente, ya que ha recibido en varias ocasiones desechos ácidos con elevados niveles de metales pesados provenientes del almacenamiento de aguas ácidas ferrocupríferas. Esto ha ocasionado problemas a nivel internacional con el vecino estado de Arizona, ya que dichos deshechos ácidos llegaron al río Gila provocando una gran mortandad de peces (Gómez–Álvarez et al. 2004).
Para el tratamiento de los efluentes líquidos que contienen metales pesados, existen diferentes métodos físicoquímicos, siendo los de mayor auge en la actualidad los siguientes: precipitación, intercambio iónico, ósmosis inversa y adsorción. Estos, aunque efectivos presentan varias desventajas cuando son aplicados a efluentes industriales constituidos por soluciones metálicas diluidas. Entre las desventajas se pueden mencionar los costos importantes en términos energéticos y de consumo de productos químicos. Además, la precipitación química aunque efectiva para la eliminación de metales pesados, crea un nuevo problema ambiental: el de los lodos que después tendrán que ser almacenados (Reyes et al. 2006).
El cobre está ampliamente distribuido en la naturaleza, se presenta principalmente en forma de sulfatos, carbonatos, sulfuros de Fe y Cu, calcopirita, bornita, cuprita (óxido de cobre), malaquita y azurita (carbonatos de cobre). La toxicidad de este metal puede estar relacionada con una ingestión excesiva del mismo, por encima de los requerimientos nutricionales; en forma aguda provoca hemólisis, necrosis hepática y hemorragias gastrointestinales (Rodríguez 2001).
Los microorganismos son una alternativa potencial sobre los procesos convencionales para la recuperación de metales de soluciones industriales, este fenómeno es conocido como biosorción y se refiere a las interacciones fisicoquímicas entre la biomasa microbiana y el metal pesado (Rivas et al. 2004).
En los últimos años, la tecnología de biosorción, basada en la habilidad de ciertas biomasas de capturar especies metálicas de soluciones acuosas, ha recibido especial atención por su potencialidad para el tratamiento de aguas residuales (Volesky 1999). Varios estudios han demostrado que la biomasa de diferentes especies de bacterias, hongos y algas es capaz de concentrar en su estructura iones metálicos que se encuentran en ambientes acuáticos (Basso et al. 2002).
Se han detectado bacterias de ambientes mineros, como las del género Pseudomonas, que presentan resistencia a metales pesados como Cd, Cu y Pb (Rivas et al. 2004). Asimismo algunas especies de microalgas marinas son útiles para la biosorción de cadmio (Basso et al. 2002) y también se ha determinado la bioadsorción de este metal con biomasa celular a partir de quince hongos (Acosta et al. 2007), y para la remoción de cromo, plomo y cobre de aguas residuales se ha utilizado Staphylococcus saprophyticus (Ilhan et al. 2004).
En otras investigaciones se tiene conocimiento de cepas microbianas que tienen la capacidad de biorremediar suelos contaminados con distintos metales y compuestos orgánicos. Se sabe que Escherichia coli es capaz de bioacumular cadmio en concentraciones de 5 mg/L, así como cobre y zinc que son tomados del medio de cultivo mediante un proceso en el cual ocurre una unión a péptidos secretados por la bacteria (Lasat 2002).
Leung et al. (2000) aislaron especies de Pseudomonas, Bacillus y Aeromonas de efluentes industriales y aguas residuales municipales para llevar a cabo la biosorción de metales pesados y reportan a Pseudomonas cepacia como una de las cepas que tiene buena capacidad de biosorción de cobre y plomo. En estudios de suelos contaminados tanto con metales pesados como con contaminantes orgánicos, utilizando los géneros Pseudomonas, Bacillus y Arthrobacter, se ha encontrado que resisten distintas concentraciones de cadmio. Algunas especies de Pseudomonas y Bacillus presentan un mecanismo de acumulación intracelular del metal, con una resistencia de hasta 225 y 275 µg/mL, respectivamente, mientras que otras especies de Pseudomonas y Arthrobacter resisten una concentración de 20 y 50 µg/mL del metal, respectivamente, formando una pared polimérica extracelular a la cual se une el metal (Mijares 2003).
El uso de biomasa en suspensión tiene algunas desventajas, una de las cuales es la separación final del efluente y la biomasa. Como el diseño de reactores para la remoción de metales pesados a partir de efluentes líquidos debe contemplar un contacto óptimo entre éstos y la biomasa, se ha considerado el uso de diferentes tipos de soportes para la inmovilización de la biomasa, con la finalidad de lograr una mayor eficiencia de eliminación de metales pesados. Uno de los materiales que se han estudiado como soporte de biomasa es el carbón activado por su porosidad y su gran superficie específica, además de ser un producto abundante que se obtiene como subproducto de la producción de aceite a partir de coco, oliva y el procesamiento de caña de azúcar (Reyes et al. 2006). Otros materiales que se han utilizado como soporte de biomasa son la sílica, gel de poliacrilamida y poliuretano (Gupta et al. 2000).
Las zeolitas naturales son aluminosilicatos cristalinos microporosos con estructuras bien definidas que constan de un andamiaje formado por tetraedros de [SiO4]4– y [AlO4]5–, unidos a través de los átomos de oxígeno (Leyva et al. 2005). La clinoptilolita es una zeolita natural formada a partir de cenizas volcánicas en lagos o aguas marinas desde hace millones de años. Es una de las zeolitas más estudiadas que se conoce como adsorbente de ciertos gases tóxicos como el sulfito de hidrógeno y el dióxido de azufre. En realidad son pocos los países que han contado con yacimientos en explotación, entre ellos: Japón, Italia, Estados Unidos, Rusia, Hungría, Bulgaria, Cuba, Yugoslavia y México (Nevarez y Astorga 2007).
En el presente trabajo se planteó como objetivo general desarrollar un proceso de biorremediación para reducir la concentración de cobre por biosorción con biomasa sola y utilizando como soporte zeolita clinoptilolita.
MATERIALES Y MÉTODOS
La localization geográfica de los sitios reportados con una alta concentración de cobre (Gómez–Álvarez et al. 2001, 2004) de las aguas del Río San Pedro son: estación 1 (Jales), latitud 30°59'45" y longitud 110°17'22" y estación 2 (Mezcla), latitud 30°59'57" y longitud 110°17'01".
Para llevar a cabo el análisis microbiológico y aislamiento de las cepas se recolectaron muestras de agua en recipientes de plástico estériles de 500 mL. Las muestras fueron tomadas de las estaciones 1 y 2, y se les realizaron lecturas de pH y temperatura in situ, seguidamente fueron almacenadas en hielo para su transporte al laboratorio de Biorremediación de la Universidad de Sonora–Hermosillo.
Acondicionamiento de las bacterias
La propagación de las bacterias y aislamiento se llevó a cabo por la técnica de placa vaciada con 1 mL de muestra. Se realizó además un enriquecimiento en medio líquido, para recuperar algunas de las especies que pudiesen estar en baja cantidad en la muestra, para lo que se inocularon 10 mL de muestra en 90 mL de caldo nutritivo. Los aislamientos posteriores se hicieron en diferentes medios selectivos: agar nutritivo para Bacillus y Pseudomonas; agar EMB (eosina azul de metileno) para enterobacterias; agar M17 para Enterococcus; y agar PDA (agar papa dextrosa) para hongos y levaduras (Koneman et al. 1999). Las bacterias fueron incubadas 35° C mientras que los hongos y las levaduras a 22 °C.
La caracterización macroscópica de las colonias se determinó de acuerdo con la observación de su apariencia general: forma, color, tamaño, consistencia, elevación y margen. La caracterización microscópica para observar forma, color y tamaño se llevó a cabo por medio de tinción Gram para bacterias, con colorante azul de lactofenol para hongos y solución salina para levaduras (Koneman et al. 1999).
Las cepas se sembraron en agar nutritivo y M17 modificando el pH (4, 4.5, 5, 5.5 y 6) con la finalidad de seleccionar aquellas que se desarrollaran. A las cepas seleccionadas se les realizaron las siguientes pruebas bioquímicas: producción de catalasa, reducción de nitratos, movilidad, producción de indol, utilización de citrato como fuente de carbono, producción de ureasa, rojo de metilo, Voges–Proskauer, fermentación de carbohidratos, hidrólisis del almidón, hidrólisis de gelatina e hidrólisis de esculina. (Koneman et al. 1999, Carrillo 2001, Mc Faddin 2003).
En el estudio de la cinética de crecimiento de las bacterias seleccionadas, 5 mL de cultivo de 24 h de ambas cepas se inocularon en 30 mL de caldo nutritivo. Las condiciones fueron: pH de 5, 35° C y 100 rpm. Las muestras se leyeron cada 30 minutos a 600 nm.
Pruebas de biosorción en sistema por lotes
Las pruebas de biosorción de cobre en sistema por lotes se llevaron a cabo con cada cepa en matraces Erlenmeyer de 500 mL con 90 mL de una solución sintética de cobre a una concentración inicial de 50 y 100 mg Cu(II)/L (CuSO4 como fuente del ión cobre) y adicionando 10 mL de cultivo de 24 h con una concentración de biomasa de 1 g/L. Como blanco se usaron 100 mL de la solución de cobre sin bacterias. Para las pruebas de biosorción con zeolita como soporte se utilizaron 5 g de zeolita clinoptilolita lavada sin activar, 10 mL de biomasa de 1 g/L. Como blanco se usaron 100 mL de solución de cobre con 5 g de zeolita. Las condiciones fueron: pH entre 4 y 5, 35° C y 100 rpm. Se tomaron muestras de 10 mL cada 15 minutos para medir la concentración de cobre residual por espectrofotometría de absorción atómica.
Pruebas de biosorción en sistema continuo
Las pruebas de biosorción de cobre en sistema continuo se llevaron a cabo en un reactor aerobio de flujo ascendente empacado con zeolita (RAEFA–EZ) de 3 L (Fig. 1), el cual consta de una columna de vidrio de 1.20 m de largo por 4.7 cm de diámetro interno, la parte superior del reactor con abertura de 12 cm de diámetro, con cuatro salidas laterales para la toma de muestras. El reactor fue empacado con 1450 g de zeolita clinoptilolita sin activar solo como medio de soporte de biomasa con un tamaño de partícula entre 1 y 6 mm y se alimentó con medio mineral ácido para favorecer el crecimiento de las bacterias y evitar que el cobre precipitara antes de la biosorción (Cuadro I). El medio mineral fue inoculado con 350 mL de un cultivo mixto de 10 cepas que se desarrollaron en medio ácido durante tres horas y el reactor se puso en recirculación. La concentración de la biomasa se estimó midiendo la absorbancia a una densidad óptica de 600 nm. Posteriormente el reactor se alimentó con una solución sintética de cobre a 50 mg Cu(II)/L. Las condiciones de operación del reactor fueron: flujo de aire 36 mL/min, flujo de alimentación 2.5 mL/min, tiempo de retención hidráulica (TRH) de 0.87 días, temperatura de 30 °C y pH entre 3 y 4.
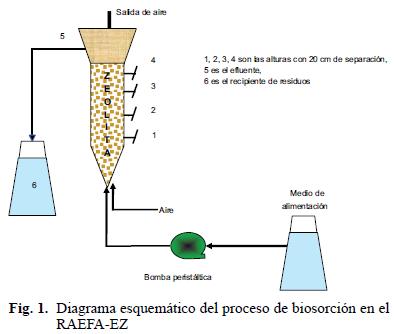

RESULTADOS Y DISCUSIÓN
Muestreo
Los tres muestreos de las aguas del río San Pedro se realizaron en enero, marzo y septiembre de 2006. Los valores de pH de la Estación 1 fueron ácidos y esto se puede deber a que es el lugar más próximo a la explotación minera, mientras que las aguas de la Estación 2 presentaron pH neutros debido a que son mezclas de la Estación 1 y de las aguas del drenaje de la ciudad de Cananea; además este punto de muestreo se encuentra más alejado de los deshechos industriales. Las temperaturas de las muestras variaron debido a la época del año en que se llevaron a cabo los muestreos del río (Cuadro II).

Aislamiento e identificación bacteriana
Con base en la morfología colonial se aislaron 113 bacterias, 7 levaduras y 3 hongos. Con la caracterizaron por tinción Gram se observó 58 gramnegativos y 55 grampositivos, entre bacilos y cocos.
Las 113 bacterias fueron sembradas en medio sólido ácido (pH entre 4 y 6) y 70 de ellas crecieron en estas condiciones, a estas se les realizaron las pruebas bioquímicas para conocer género y especie. De esta caracterización se identificaron Micrococcus sp., Pseudomonas sp., Klebsiella sp., Bacillus sp., Enterococcus sp., Escherichia coli y Burkholderia cepacia, anteriormente conocida como Pseudomonas cepacia (Holmes et al. 1998).
De las cepas aisladas del río se seleccionaron Burkholderia cepacia (Bc) y Escherichia coli (Ec) debido a que se desarrollaron a pH ácidos y están reportadas en la literatura como buenos bioadsorbentes de metales pesados (Leung et al. 2000, Lasat 2002, Mijares 2003, Rivas et al. 2004 y Vázquez 2005).
Cinética de crecimiento
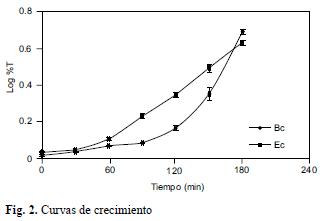
Para llevar a cabo las pruebas de biosorción se realizó la curva de crecimiento característica de cada microorganismo para mantenerlos en la fase de crecimiento exponencial el mayor tiempo que fuera posible, ya que la bacteria se encuentra en su máximo periodo de desarrollo. En la figura 2 se muestra la cinética de crecimiento para las cepas seleccionadas, donde se observa que la fase exponencial para ambas bacterias empieza a los 30 minutos y se mantienen en esta fase por 150 minutos.
Pruebas de biosorción en lote
En las pruebas de biosorción a 50 mg Cu(II)/L se observó un buen desarrollo con ambas cepas, mientras que a 100 mg Cu(II)/L el crecimiento de las cepas se inhibió. Mijares (2003) menciona que Pseudomonas y Arthrobacter resisten una concentración de 20 y 50 mg/L de cobre, con la ayuda de un mecanismo extracelular, ya que producen un exopolímero que se une al metal. Reyes et al. (2006) reportan que se han llevado a cabo estudios de adsorción con bacterias del género Bacillus para diferentes metales, en varias concentraciones, desde 1 hasta 88 mg/L.
En la figura 3 se muestran los resultados de biosorción de cobre a 50 mg Cu(II)/L con las dos cepas. A los 75 minutos, la biosorción obtenida con Bc y Ec fue de 73 y 72 %, respectivamente. Estos resultados concuerdan con los obtenidos por Vásquez (2005), que observó un porcentaje de biosorción del 75% y Leung et al. (2000) reportaron arriba del 61% de remoción de cobre y plomo con Pseudomonas y Micrococcus.

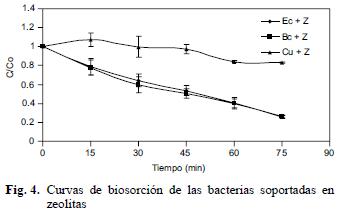
En la figura 4 se muestran los resultados de biosorción de cobre a 50 mg Cu(II)/L con las dos cepas en zeolita como soporte de biomasa y esto ayudó a que permaneciera el desarrollo poblacional. A los 75 minutos, la biosorción obtenida con Bc y Ec fue de 74 y 75 %, respectivamente, mientras que en el control sin bacterias la tendencia de la curva de concentración de cobre fue menos del 20 % en el mismo tiempo. Rivera–Utrilla et al. (2003) efectuaron experimentos de biosorción de metales pesados (Pb, Cd y Cr) al utilizar una cepa de Escherichia coli sobre soporte de carbón activado. Gupta et al. (2000) y Reyes et al. (2006) reportan diferentes materiales como son el poliuretano, sílica, polisulfona, gel de poliacrilamida y alginato de calcio, que se utilizan como soportes para biomasa en la eliminación de metales pesados y radiactivos.
El porcentaje de remoción de cobre en soluciones acuosas depende de la cantidad del metal que adsorbe la biomasa y esta cantidad a su vez es función de la capacidad de intercambio de la biomasa y el metal. Con base en esto, se consideró que bajo las mismas condiciones experimentales, la biomasa que tiene la mayor capacidad de intercambio del ión cobre es aquella que exhibe el mayor porcentaje de remoción. Ilhan et al. (2004) comparó la capacidad de adsorción con Staphylococcus saprophyticus para remover Cr, Pb y Cu, variando la temperatura, pH y concentración, y reporta que en todas las pruebas realizadas en dos horas, se alcanza el 70% de adsorción en los primeros 15 minutos.
En estos experimentos, las concentraciones iniciales de todos los tratamientos fueron de 50 mgCu(II)/L y se calculó el porcentaje de remoción por medio de la siguiente ecuación:

Donde,
Co = concentración inicial del soluto, mg/L
Cf = concentración final del soluto, mg/L
En la figura 5 se muestran los resultados de los porcentajes de remoción de cobre de los cuatro tratamientos, en donde se observa un comportamiento similar.Esto se debe a la capacidad que poseen estas bacterias para adsorber al cobre en donde la zeolita no interviene en el intercambio, debido a que no está activada y sólo se utiliza como soporte para la biomasa. El mayor porcentaje de biosorción se obtuvo a los 75 minutos, aunque diferentes trabajos han demostrado que la cinética de adsorción en la superficie bacteriana presenta un equilibrio muy rápido con una adsorción total de 5 a 30 minutos (Chang 1997, Atkinson et al. 1998, Ilhan et al. 2004, Vázquez 2005).

Las constantes de velocidad correspondieron a una reacción de primer orden con un factor de correlación de 0.98, las cuales se calcularon utilizando la ecuación 3 que se deduce de la ecuación de velocidad (2). En estas pruebas de biosorción las constantes cinéticas fueron de 0.0163 min-1 cuando se utilizó las bacterias sin zeolita y 0.0177 min-1 en las pruebas de bacteria con zeolita, lo que significa que la zeolita no participa en la biosorción del cobre.

De donde se deduce la siguiente ecuación:

Donde
K = Constante cinética de velocidad de reacción, min–1
Co = Concentración inicial del soluto, mg/L
CA = Concentración remanente, mg/L
t = tiempo, min
Biosorción de cobre en RAEFA–EZ
Al inocular el RAEFA–EZ con las 10 cepas (Pseudomonas putida, Bacillus cereus, Escherichia coli, Burkholderia cepacia, dos cepas del género Enterobacter y cuatro de Micrococcus) en medio ácido (pH de 3 a 4), se observó un rápido desarrollo poblacional. A partir del tercer día la biomasa alcanzó una concentración de 0.6 g/L y el reactor se mantuvo en recirculación por 12 días hasta obtener una biomasa de 1g/L. Durante los 28 días de experimentación el flujo de alimentación del reactor fue constante y el TRH se mantuvo en 0.87 días, por lo tanto el volumen de agua tratada fue de 100 L a una carga volumétrica de cobre de 57.5 mg Cu(II)/L/d.
En la figura 6 se muestra la capacidad de biosorción de Cu(II) en RAEFA–EZ a una concentración de 50 mg Cu(II)/L. Se puede observar la variación de la concentración, en el primer día se obtuvo un 97 % de remoción del metal, sin embargo se observa una disminución a 32% para el día seis y finalmente para el día once la biosorción fue nula, esto implica que la biomasa se saturó con el metal en el resto del experimento. Estudios específicos con Pseudomonas aeruginosa en la inmovilización de Cu, Cd y Pb demuestran que a los 5 minutos del proceso de biosorción se ha removido un 90% de los metales (Chang 1997).

La remoción del metal depende de diversos factores, como la composición química de la pared celular de las biomasas, pH, temperatura, materia orgánica, textura de la biomasa y presencia de otros iones (Acosta 2007). El pH se mantuvo en valores de 3–4 durante el experimento. El pH es un parámetro muy importante que influye en la biosorción ya que afecta la solubilidad de los metales o la activación de los grupos funcionales en la biomasa. Por lo tanto la interacción de los cationes metálicos con los sitios de unión de la biomasa son muy sensibles a los valores de pH (Vázquez 2005, Torres y Juviña 2005).
CONCLUSIONES
De los resultados obtenidos en la biosorción de cobre en sistema por lote, con bacterias aerobias inmovilizadas en la zeolita clinoptilolita sin activar, se encontró que la eficiencia del bioproceso está en función del microorganismo utilizado. Burkholderia cepacia y Escherichia coli fueron las responsables de realizar la biosorción obteniéndose resultados similares en los experimentos. Asimismo se comprobó que la zeolita no intervino en la adsorción del cobre, sino que sirvió como soporte para las bacterias y así se mantuvo su desarrollo durante el tiempo de la biosorción.
En el caso del sistema continuo, donde se trabajó en columna empacada con zeolita inoculando un consorcio de bacterias, estas presentaron un desarrollo poblacional rápido y al alimentar con la solución de cobre, la mayor biosorción de cobre se produjo durante los primeros días. La biomasa presentó una saturación rápida de cobre, esto demuestra el equilibrio entre el sorbato y el biosorbente. La densidad de población se mantuvo constante en el transcurso del experimento debido a que la zeolita ayuda a conservar por más tiempo viable a la biomasa y evita que se pierda en el efluente. Durante los días de experimentación fue importante mantener el pH ácido, con el fin evitar la precipitación del metal. En este trabajo se ha demostrado que la biomasa activa utilizada es capaz de biosorber cobre, además de que resistió una concentración de 50 mg Cu(II)/L y pH ácido, condiciones semejantes a las reportadas en las aguas del río San Pedro.
AGRADECIMIENTOS
Al Centro de Investigación en Alimentación y Desarrollo, A.C. (CIAD), en forma muy especial al Laboratorio de Microbiología Molecular, a la Dra. Evelia Acedo Félix y Q.B. Rosalva Pérez, por su apoyo en los análisis realizados. Al Departamento de Ingeniería Química y Metalurgia de la Universidad de Sonora por el apoyo brindado para realizar esta investigación, a Erika Nevarez y Carmen Astorga por su apoyo en el laboratorio.
REFERENCIAS
Acosta I., Moctezuma–Zárate M.G., Cárdenas J.F. y Gutiérrez C. (2007). Bioadsorción de cadmio (II) en solución acuosa por biomasas fúngicas. Inf. Tec. 18, 9–14. [ Links ]
Atkinson B.W., Box F. y Kasan H.C. (1998). Considerations for application of biosorption technology to remediate contaminated industrial effluents. Water SA. 24 (2), 129–135. [ Links ]
Basso M.C., Cerrella E.G. y Cukierman A.L. (2002). Empleo de algas marinas para la biosorción de metales pesados de aguas contaminadas. Avances en Energías Renovables y Medio Ambiente. Argentina. 6, 69–74. [ Links ]
Carrillo P.E. (2001). Aislamiento, identificación y evaluación de un consorcio de microorganismos con capacidad para degradar DDT. Tesis de Maestría en Ciencias de la Ingeniería. Universidad de Sonora, Hermosillo, Sonora. [ Links ]
Chang J.S., Law R. y Chang C.C. (1997). Biosorption of lead, copper and cadmium by biomass of Pseudomonas aeroginosa PU21. Water Research 31, 1651–1658. [ Links ]
Gómez–Álvarez A. (2001). Evaluación de la calidad física y química del agua y sedimento del Río San Pedro, Sonora, México, durante el periodo 1997–1999. Tesis de Maestría en Ciencias de la Ingeniería. Universidad de Sonora. Hermosillo, Sonora. [ Links ]
Gómez–Álvarez A., Villalba–Atondo A., Acosta–Ruiz G., Castañeda–Olivares M., y Kamp D. (2004). Metales pesados en el agua superficial del Río San Pedro durante 1997 y 1999. Rev. Int. Contam. Ambient. 20, 5–12. [ Links ]
Gómez–Álvarez A., Valenzuela–García J.L., Aguayo–Salinas S., Meza–Figueroa D., Ramírez–Hernández J., Ochoa–Ortega G. (2007). Chemical partitioning of sediment contamination by heavy metals in the San Pedro River, Sonora, Mexico. Chem. Spe. Bioavailab. 19, 25–36. [ Links ]
Gupta R., Prerna Ahuja, Seema Khan R.K. Saxena and Mohapatra H. (2000). Microbial biosorbents: meeting challenges of heavy metal pollution in aqueous solutions. Curr. Sci. India 78, 25. 967–973. [ Links ]
Holmes A., Govan J., Goldstein R. (1998). Agricultural use of Burkholderia (Pseudomonas) cepacia: a threat to human health? Emerg. Infect. Dis. 4, 221–227. [ Links ]
Ilhan S., Nurbas M.N., Kilicarslan S. y Ozdag H. (2004). Removal of chromium, lead and copper ions from industrial waste waters by Staphylococcus saprophyticus. Turkish Electron. J. Biotechnol. 2, 50–57. [ Links ]
INEGI (1993). Cartas topográficas H12B32, H12B33, H12B34, H12B42, H12B43, H12B44, H12B52, H12B53 Y H12B54. Esc 1:50, 000. Instituto Nacional de Estadística Geográfica e Informática, México, D.F. [ Links ]
Koneman E.W., Allen S., Janda W., Schenrchenberger P., Winn W. (1999). Diagnóstico microbiológico. Médica Panamericana, México. pp. 1–349, 1258–1357. [ Links ]
Lasat M.M. (2002). Phytoextraction of toxic metals: A review of biological mechanisms. J. Environ. Qual. 31,109–120. [ Links ]
Leyva R.R., Medellín C.N.A., Guerrero C.R.M., Berber M.M.S., Aragón P.A. y Jacobo A.A. (2005). Intercambio iónico de plata (I) en solución acuosa sobre clinoptilolita. Rev. Int. Contam. Ambient. 21, 193–200. [ Links ]
Leung W.C., Wong M–F., Chua H., Lo W., Yu P.H.F. y Leung C.K. (2000). Removal and recovery of heavy metals by bacteria isolated from activated sludge treating industrial effluents and municipal wastewater. Water Sci. Technol. 41, 233–240. [ Links ]
Mac Faddin J.F. (2003). Pruebas bioquímicas para la identificación de bacterias de importancia clínica. Médica Panamericana, México. pp. 54–421. [ Links ]
Mijares M.A.P. (2003). Aislamiento y caracterización de bacterias con capacidad para inmovilizar cadmio. Tesis de Licenciatura en Biología en el área de Biotecnología. Universidad de las Américas, Puebla, México. [ Links ]
Nevarez Ll.E.D. y Astorga V.C.R. (2007). Biosorción de cobre utilizando bacterias (Burkholderia cepacia y Escherichia coli), aisladas del río San Pedro. Tesis de Licenciatura en Ingeniería Química. Universidad de Sonora. Hermosillo, Sonora. [ Links ]
Pelczar J.M., Reid R. D. y Chan E.C.S. (1993).Microbiología. Mc Graw–Hill, México. 92 p. [ Links ]
Reyes E.D., Cerino C.F. y Suárez M.A. (2006). Remoción de metales pesados con carbón activado como soporte de biomasa. Ingenierías IX (31), 59–64. [ Links ]
Rivas B.G. A., Gutiérrez S. y Merino F. (2004). Biorremoción de metales pesados en solución por Pseudomonas fluorescens M1A–4S aisladas de ambientes mineros. En: Segunda Semana de Ciencia y Tecnología II–SCT–2004. Asociación Chotana de Ciencias. Perú. [ Links ]
Rivera–Utrilla J., Bautista–Toledo I., Ferro–García M.A. y Moreno–Castilla C. (2003). Bioadsorption of Pb(II), Cd(II) and Cr(VI) on activated carbon from aqueous solutions. Carbon 41, 323–330. [ Links ]
Rodríguez H. (2001). Estudio de la contaminación por metales pesados en la Cuenca de Llobregat. Tesis Doctoral. Universitat Politécnica de Catalunya, Barcelona. [ Links ]
SEDUE (1989). Acuerdo por el que se establecen los Criterios Ecológicos de Calidad de Agua CE–CCA–001/89. Secretaría de Desarrollo Urbano y Ecología. Publicado en el Diario Oficial de la Federación del 2 de diciembre de 1989. Tomo CDXXX, No. 9. México, D.F. [ Links ]
Torres R. A. y Juviña P. J. (2005). Desarrollo e implementación de un sistema de monitorización mediante sensores químicos de un proceso de biosorción para la recuperación de ion cobre (II) en efluentes acuosos. Universitat Politécnica de Catalunya. Escola Técnica Superior d'Enginyeria Industrial de Barcelona. http://bibliotecnica.upc.es/pfc/mostrar_dades_PFC.asp?id=41356. 28–septiembre–2006. [ Links ]
Vázquez V.R. (2005). Biosorción de metales pesados en solución acuosa mediante biomasa bacteriana muerta. Tesis de Licenciatura. Biología. Departamento de Química y Biología, Escuela de Ciencias, Universidad de las Américas, Puebla, México. [ Links ]
Volesky B. (2004). Biosorption of heavy metals. CRC Press, Boca Raton, Florida. 408 pp. [ Links ]














