Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.24 no.3 Ciudad de México ago. 2008
Evaluación de tres hongos lignolíticos y de Aspergillus niger como alternativa para el tratamiento de aguas residuales del curtido de pieles
Phanerochaete chrysosporium, Trametes versicolor, Plerotus ostreatus and Aspergillus niger as alternative for the tanning wastewater treatment
Sandra GÓMEZ–BERTEL2, Diana AMAYA–BULLA2, Claudia MALDONADO–SAAVEDRA1, María Mercedes MARTÍNEZ–SALGADO2, Balkys QUEVEDO–HIDALGO1, Ana Bertha SOTO–GUZMÁN3 y Aura Marina PEDROZA–RODRÍGUEZ1
1 Laboratorio de Biotecnología Aplicada. Grupo de Biotecnología Ambiental e Industrial. Pontificia Universidad Javeriana, Carrera 7 No. 43–82, Bogotá, Colombia. Correo electrónico: apedroza@javeriana.edu.co
2 Laboratorio de Microbiología Ambiental y Suelos. Grupo de Biotecnología Ambiental e Industrial. Pontificia Universidad Javeriana
3 Departamento de Física. Centro de Investigaciones y de Estudios Avanzados del Instituto Politécnico Nacional. CINVESTAV–IPN. Avenida Politécnico Nacional 2508. México D.F., México
Recibido septiembre 2007
Aceptado febrero 2008
RESUMEN
Con el fin de evaluar la capacidad de biodecoloración y remoción de cromo por parte de los hongos Pleurotus ostreatus, Phanerochaete chrysosporium, Trametes versicolor y Aspergillus niger, usando aguas residuales proveniente de la etapa de curtido de pieles y soluciones con dicromato de potasio y sulfato de cromo, se determinó la concentración mínima inhibidora de cada sal siguiendo el método de difusión en agar. P. chrysosporium fue significativamente más tolerante (p< 0.0001) con valores de 30,000 mg L–1 para sulfato de cromo y 7500 mg L–1 para dicromato de potasio. El efecto de la dilución del residual sobre la capacidad de biodecoloración y formación de biomasa fue evaluada utilizando un diseño experimental 22. P. chrysosporium presentó mayor capacidad de decoloración asociada con la cantidad de biomasa con valores de 39 % y 16 mg L–1 a los diez días de evaluación. En respuesta a la suplementación del agua residual con carbono y nitrógeno este microorganismo puede emplearse bajo las dos condiciones nutricionales sin que se presenten diferencias significativas (p>0.0001) entre tratamientos. A partir de estos resultados la cepa fue inmovilizada en espuma de poliuretano para llevar a cabo los experimentos de tratabilidad del residual al 100 % (v/v) por diez días a 25 °C, observando que la biomasa viable inmovilizada removió el 97 % de CrT, 97 % de Cr (III), 85 % Cr(VI), 12 % DQO y 67 % de color; estos parámetros se correlacionaron positivamente con la cantidad de biomasa inmovilizada y la actividad enzimática tipo LiP (0.2 U L–1) y MnP (7 U L–1). La biomasa inmovilizada e inactiva y la espuma como único soporte, también fueron eficientes frente a los parámetros anteriores pero en menor proporción. Al realizar el microanálisis de EDX se encontró que tanto la biomasa viable como la inactiva presentan importantes características que favorecieron la adsorción de cromo total expresado como porcentaje atómico.
Palabras clave: cromo, Phanerochaete chrysosporium, Pleurotus ostreatus, Trametes versicolor, Aspergillus niger, poliuretano, bioadsorción
ABSTRACT
In order to evaluate the capacity of chromium and color removal of the white rot fungus Pleurotus ostreatus, Phanerochaete chrysosporium, Trametes versicolor and the deuteromycete Aspergillus niger, using chromium salts and tanning wastewater, the tolerance to two chromium salts using the inhibitory minimum concentration test (IMC) was studied. According to the results, significant differences (p <0.0001) demonstrate that P. chrysosporium was the most tolerant microorganism with IMC of 30,000 mg L–1 for chromium sulfate and 7,500 mg L–1 for dichromate of potassium. The effect of the dilution of residual on the capacity of biodecoloration and the formation of biomass were evaluated using a 22 experimental design. P. chrysosporium displayed greater capacity of decoloration associated with the amount of biomass with values of 39% and 16 mg L–1 in 10 days of evaluation. When supplementing this microorganism with carbon and nitrogen sources it was observed that both nutritional conditions could be used without significant differences (p>0.0001) between treatments. From these results the microorganisms were immobilized in polyurethane foam to carry out the experiments of treatment capacity of residual to the 100% by 10 days at 25° C, observing that the immobilized viable biomass removed 97% of CrT, 97% of Cr(III), 85% Cr(VI), 12% DQO and 67% of color. These parameters were correlated positively with the amount of biomass immobilized and the enzymatic activity type LiP (0.2 U L–1) and MnP (7 U L–1). The immobilized and inactivated biomasses, and the foam as unique support, were also efficient concerning the previous parameters but in smaller proportion. Micro EDX analysis indicated that both the viable and inactive biomasses present important adsorptive characteristics that favored the expressed total chromium removal in atomic percentage.
Key words: leather tanning wastewaters, chromium, Phanerochaete chrysosporium, Pleurotus ostreatus, Trametes versicolor, Aspergillus niger, polyurethane, biosorption
INTRODUCCIÓN
Con el incremento de la actividad industrial en el mundo, los cuerpos de agua reciben continuamente descargas de contaminantes tóxicos de tipo metálico que exceden la capacidad de autodepuración, trayendo como consecuencia graves problemas de contaminación ambiental y alto riesgo toxicológico para el hombre y los animales (Filipovíc et al. 2000, Park et al. 2005, Iqbal y Saeed 2007).
En Colombia la industria procesadora de pieles para marroquinería es una de las responsables de la contaminación acuática por el vertimiento de cromo trivalente y hexavalente. Durante el proceso productivo se utilizan como materias primas pieles de animales, especialmente vacunos y caprinos, que son sometidas a una serie de tratamientos con sustancias llamadas curtientes, con el fin de producir modificaciones químicas y físicas en las pieles y convertirlas en un material duradero, suave, elástico y flexible (Téllez et al. 2004). Las aguas residuales generadas durante todo el proceso se vierten directamente al río Bogotá en especial en las zonas cercanas al Municipio de Villapinzón, donde existen cerca de 190 curtiembres artesanales y con tecnificación media. Adicionalmente se presenta contaminación por materia orgánica (pelo, sangre, estiércol, grasas, carne y cuero) y elementos químicos como cromo, cloro, azufre, amoniaco, taninos, sulfuros y sulfatos, lo que resulta en concentraciones altas de DBO5 (3750 mg L–1), DQO (11,776 mg L–1), pH (3.8), color, sulfuros disueltos (1803 mg L–1) sólidos totales (32,110 mg L–1) y cromo total (1840 mg L–1) (CAR 2004).
En lo concerniente al cromo, este metal se encuentra presente en el ambiente principalmente en dos estados de oxidación como Cr(VI) y Cr(III). La proporción de cromo hexavalante es más baja que el cromo trivalente, sin embargo esta es la forma más tóxica para plantas y animales, ya que se considera un agente fuertemente oxidante y potencialmente carcinogénico, bioacumulable y biomagnificable (Park et al. 2005, Ahluwalia y Goyal 2007). Por el contrario el cromo trivalente generalmente es tóxico solamente para plantas a elevadas concentraciones y es menos tóxico para animales (Anderson 1997). Por estas diferencias la Environmental Protection Agency de los EUA (EPA) determinó que las descargas de Cr(VI) en aguas superficiales deben ser menores de 0.005 mg L–1, mientras que las de cromo total, incluyendo cromo trivalente, hexavalente y en otros estados, deben ser de 2 mg L–1 (Baral y Engelken 2002). En Colombia, según la Corporación Autónoma Regional de Cundinamarca (CAR 2004), las concentraciones máximas permisibles para verter en un cuerpo de agua o red de alcantarillado público no deben exceder de 0.005 mg L–1 para Cr (VI) y de 0.01 mg L–1 para cromo total. Con respecto al uso del agua para fines agrícolas, pecuario y preservación de flora y fauna, el decreto 1594/84 del Ministerio de Salud de Colombia estipula que las concentraciones para cada uno de los casos no deben exceder 0.1 mg L–1, 1.0 mg L–1 y 0.001 mg L–1 CL5096, respectivamente. Por esta razón es imperativo reducir las descargas, promover la reutilización del agua dentro de las empresas y desarrollar métodos de tratamiento que sean eficientes, económicos y ambientalmente amigables (Ministerio de Salud 1984, Coulibaly et al. 2003, Morato et al. 2003).
Los métodos convencionales para la remoción de metales pesados como precipitación química, óxido reducción química, filtración, intercambio iónico y tratamiento electroquímico (Zouboulis et al. 2004, Srivastava y Thakur 2006, Iqbal y Saeed 2007) pueden tener algunas desventajas como los costos, producción de residuos secundarios, poca efectividad a bajas concentraciones y rápida saturación, lo que los convierte en métodos inviables para pequeñas comunidades. Como alternativa surge la posibilidad de utilizar la biomasa viable e inactiva de los hongos lignolíticos que crecen sobre la madera (Dilek et al. 2002, Jarosz–Wilkolazka et al. 2002, Qingbiao et al. 2004, BayramoÄlu et al. 2005). La remoción de metales pesados con este grupo de microorganismos se puede llevar a cabo como proceso activo dependiente del metabolismo, también conocidos como bioacumulación y reacciones de oxido–reducción asociadas con enzimas o de forma pasiva independiente del metabolismo por medio de quelación, quimiosorción, complej ación y bioadsorción (Kapoor y Viraraghavan 1995, Coulibaly et al. 2003). Esta última se define como la capacidad que tiene la biomasa fúngica viva o inactiva para unir y concentrar metales pesados a partir de soluciones acuosas, la cual puede ser, física o química determinando que la biomasa fúngica actúe como un posible intercambiador de tipo biológico (Ahluwalia y Goyal 2007). El principal responsable de este proceso es la presencia de quitina, quitosano y glucanos en la pared celular (Coulibaly et al. 2003). Es por esto que producir grandes cantidades de biomasa empleando subproductos agroindustria–les permite utilizarla como bioadsorbente natural, económico y de fácil obtención.
En el presente trabajo se evaluó la tolerancia de los hongos Phanerochaete chrysosporium, Trametes versicolor, Pleurotus ostreatus y Aspergillus niger frente al dicromato de potasio y sulfato de cromo, encontrando que P. chrysosporium es un hongo hipertoletante a las dos sales y fue empleado para el tratamiento de aguas residuales de curtiembres, inmovilizándolo sobre un soporte inerte para comparar la eficiencia entre biomasa viable, inactiva y el soporte solo, por un periodo de diez días sin control de esterilidad durante el proceso.
MATERIALES Y MÉTODOS
Microorganismos
Se utilizaron tres hongos ligninocelulolíticos Phanerochaete chrysosporium (CINVESTAV–IPN. México), Trametes versicolor y Pleurotus ostreatus (Pontificia Universidad Javeriana, Colombia) y Aspergillus niger (Universidad Industrial de Santander, Colombia). La reactivación de los tres primeros se realizó en agar extracto de salvado (Gómez et al. 2005) y para A. niger se utilizó agar extracto de levadura (Morato et al. 2003); todas las cajas se incubaron durante ocho días a 25 °C.
Caracterización del agua residual
El agua residual fue obtenida de una industria procesadora de cuero, luego del tratamiento de curtido de piel con sulfato de amonio y sulfato de cromo. A través de la caracterización inicial se determinó que tenía la siguiente composición: 2360 mg L–1 de cromo total (CrT), 100 µg L–1 de cromo hexavalente Cr(VI), 4462 mg L–1 de demanda química de oxígeno (DQO), 8295 unidades de color, pH 4.0 y la presencia de hongos levaduriformes en recuentos de 52x104 UFC mL–1.
Determinación de la concentración mínima inhibidora (CMI)
La tolerancia a diferentes concentraciones de sulfato de cromo y dicromato de potasio se realizó sembrando masivamente 0.1 mL de una suspensión de 1x108 conidios mL–1 en agar extracto de salvado (P. ostreatus y P. chrysosporium) y agar extracto de levadura (A. niger) en presencia de las sales de cromo. Como testigo negativo se inocularon 0.1 mL de la suspensión de conidios en agar sin sales de cromo, todas las cajas se incubaron a 25 °C por ocho días (Shaheen et al. 2007, modificado por los autores). Para T. versicolor se modificó la técnica, adicionando las diferentes concentraciones de las sales de cromo al agar extracto de salvado y posteriormente se colocó un disco de agar colonizado con micelio de T. versicolor. El crecimiento radial se evaluó al octavo día. El testigo negativo fue el mismo medio sin sales, que se sembró en la misma forma que los tratamientos. La CMI fue definida como la concentración de metal pesado que inhibe totalmente el crecimiento de los hongos evaluados (Shaheen et al. 2007).
Efecto de la dilución del residual sobre la capacidad de decoloración, producción de biomasa libre y actividad enzimática
Para evaluar el efecto de la dilución del residual sobre la capacidad de decoloración, producción de biomasa y actividad enzimática, se llevó a cabo un diseño experimental 22. Las pruebas se realizaron en matraces Erlenmeyer de 100 mL que contenían 20 mL de efluente preparado de acuerdo con cada tratamiento y 20 discos de agar obtenidos de la zona de crecimiento activo para cada hongo. Los Erlenmeyer fueron incubados en un agitador orbital (150 rpm) a 25 °C durante diez días. El diseño generó una matriz de cuatro tratamientos por triplicado. Los factores estudiados fueron dilución del residual y el tipo de cepa; como variables de respuesta se evaluaron la decoloración en porcentaje, biomasa seca en mg mL–1, actividad enzimática manganeso peroxidasa (MnP) en U L–1 (Michel et al. 1991), lignino peroxidasa (LiP) en U L–1 (Tien y Kirk 1988) y actividad lacasa en U L–1 (Tinoco et al. 2001). En el cuadro I se observa la matriz generada para cada factor y su respectivo nivel (Montgomery 2003). El análisis de datos se realizó usando los programas SAS 9.0 y Desing Expert 6.0 y los resultados fueron tratados con un modelo empírico el cual relaciona las respuestas cuantificadas con los factores evaluados y sus respectivos niveles. Para un diseño de dos factores el modelo de primer orden es:
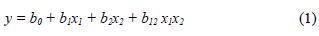
Donde y, corresponde a la variable dependiente; bo es el intercepto, b1, b2, son los coeficientes lineales y x1 x2 son los factores o variables independientes.
Efecto de dos condiciones nutricionales sobre la capacidad de decoloración y formación de biomasa
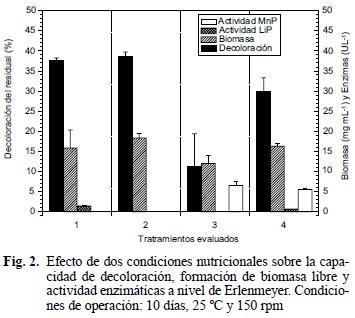
El experimento se llevó a cabo en un matraz Erlenmeyer de 100 mL con 20 mL de agua residual al 100 % (v/v), con y sin suplemento de glucosa (2.5 g L–1) y extracto de levadura (1 g L –1). Cada tratamiento se inoculó con 20 discos de agar extracto de salvado crecidos con cada microorganismo. Los Erlenmeyer fueron incubados en un agitador orbital (150 rpm) a 25 °C por diez días. Las variables de respuesta fueron decoloración, biomasa mg mL–1, actividad LiP, MnP, azúcares reductores totales y pH (Gómez et al. 2005, Pedroza et al. 2007).
Comparación de la capacidad de remoción con biomasa viable e inactiva inmovilizadas sobre espuma de poliuretano
La biomasa de P. chrysosporium se inmovilizó en cubos de espuma de poliuretano de 1 cm3, sembrándolos en matraces Erlenmeyer de 1000 mL que contenían 250 mL de caldo extracto de salvado de trigo. Cada Erlenmeyer con 50 cubos fue inoculado con 10 discos agar con micelio de P. chrysosporium (Martínez et al. 2005). La colonización del soporte se realizó por ocho días a 25 °C con agitación continua de 150 rpm. El producto de la inmovilización se recuperó por filtración con papel filtro Whatman N° 22 y posteriormente se tomaron veinte cubos colonizados y se transfirieron a un Erlenmeyer de 500 mL que contenía 200 mL de efluente de curtido al 100 % (v/v), sin ajuste nutricional. Se evaluaron tres tratamientos: biomasa viable inmovilizada sobre espuma, biomasa inactiva inmovilizada sobre el mismo soporte y espuma de poliuretano sin biomasa fúngica. El proceso se mantuvo por 10 días a 25 °C, 150 rpm. Al finalizar el experimento se recuperó el efluente tratado para determinar pH, azúcares reductores totales (Miller 1959), porcentaje de decoloración (Martínez et al. 2005), CrT por medio de espectroscopía de absorción atómica de llama (Barajas et al. 2007), Cr(VI) por el método colorimétrico de difenilcarbazida número 3500B, demanda química de oxígeno (DQO) por el método colorimétrico de reflujo cerrado 5220D reportado en los métodos estándar (Eaton et al. 2005), actividad enzimática tipo manganeso peroxidasa (Michel et al. 1991), lignino peroxidasa (Tien y Kirk 1988), lacasa (Tinoco et al. 2001) y recuento de poblaciones microbianas presentes en el agua residual que se realizó mediante la técnica de microgota reportada por Doyle (2000). Las diferencias entre tratamientos se determinaron por una prueba de comparación de medias (Tukey, α= 0.05). Los datos se analizaron con el programa estadístico SAS 9.0®
Adicionalmente los cubos colonizados con biomasa de P. chrysosporium se prepararon para microscopía electrónica de barrido siguiendo la metodología reportada por Pedroza et al. (2007). Se utilizó un microscopio electrónico marca JEOL JSM–6300 adaptado a un detector de rayos X por dispersión de energía No ral Voyager II software 1100/1110, para llevar a cabo el microanálisis de cromo total en porcentaj e atómico por la técnica de espectrometría de dispersión de energía de rayos X (EDX).
RESULTADOS Y DISCUSIÓN
Concentración mínima inhibidora
Los resultados de CMI sugieren que la tolerancia al cromo depende del estado de oxidación, la concentración de la sal de cromo y el microorganismo evaluado. El di cromato de potasio fue la forma más tóxica para los cuatro microorganismos investigados, con valores de 300, 1000, 4500 y 7500 mg L–1 para T. versicolor, A. niger, P. ostreatus y P. chrysosporium, respectivamente. Con relación al sulfato de cromo las concentraciones mínimas inhibidoras fueron de 5000, 12,500, 15,000 y 30,000 mg L–1 para A. niger, P. ostreatus, T. versicolor y P. chrysosporium, respectivamente (Fig. 1). De acuerdo con el análisis estadístico, el hongo P. chrysosporium fue significativamente más tolerante alas dos sales de cromo (p<0.0001). La razón por la cual esta cepa fue superior podría estar relacionada con un mecanismo adaptativo asociado a tolerancia genética o fisiológica que surgió por la exposición prolongada al cromo, ya que progresivamente fue cultivada en concentraciones ascendentes de las dos sales por periodos de ocho días en cada una. Durante cada tratamiento la cepa pudo desarrollar de manera paralela varios mecanismos que le permitieron adquirir la tolerancia, como un engrosamiento de la pared para bioadsorber mayor cantidad de cromo, síntesis de melaninas como la 1,8 dihidroxinaftaleno (DHN) y la producción de ácidos orgánicos como el ácido oxálico que actúa como quelante para formar cristales con los metales que precipitan a nivel extracelular (Cervantes y Gutiérrez 1994). Es factible que los dos primeros mecanismos se hayan llevado a cabo, ya que en las fotografías obtenidas por microscopía óptica se observó un engrosamiento de las hifas, que tomaron una pigmentación café claro (datos no mostrados). Los resultados obtenidos en esta prueba concuerdan con la definición de tolerancia a metales propuesta por Shaheen et al. (2007). Estos autores definen la tolerancia como la habilidad que tiene un organismo para sobrevivir en presencia de un metal por medio de la activación de mecanismos directos e indirectos que pueden ser inmediatos o progresivos como respuesta a la exposición del metal.
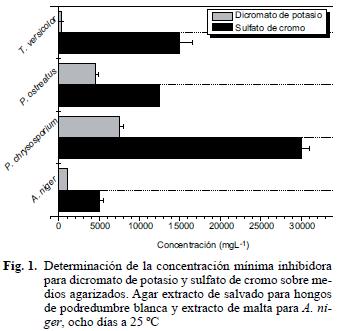
P. chrysosporium ha sido ampliamente reportado para la bioadsorción de metales pesados como cadmio, plomo, níquel y cobre, por ser tolerante, producir cantidades significativas de biomasa con gran área superficial apta para la remoción y por la facilidad de cultivo con células libres e inmovilizadas (Say et al. 2001, Kacar et al. 2002, Qingbiao et al. 2004, Iqbal y Saeed 2007). Sin embargo, la utilización de P. chrysosporium para la remoción y biodecoloración de aguas residuales de la etapa de curtido de pieles no ha sido reportada, lo que resalta la importancia de los resultados obtenidos en esta investigación, especialmente porque esta especie toleró elevadas concentraciones de las dos formas de cromo. Así se convierte en una alternativa económica para la remoción de metales pesados, por la facilidad con que se cultiva en sustratos agroindustriales como el salvado de trigo y por sus elevados rendimientos de biomasa, tal como lo reporta Pedroza (2006) en su estudio con T. versicolor, P. chrysosporium y P. ostreatus, inmovilizados sobre espuma para el tratamiento de aguas residuales de la industria papelera.
A. niger es uno de los hongos de la subdivisión Deuteromycotina que más se ha investigado para la remoción de cromo (Kovacevic et al. 2000, Nasseri et al. 2002, Acosta et al. 2004, Srivastava y Thakur 2006). En estudios previos realizados por Morato et al. (2003), se observó que esta cepa se inhibía en presencia de 900 mg L–1 de dicromato y 4000 mg L–1 de sulfato, con agua residual sintética, por tal razón en este trabajo se quiso evaluar este hongo, pero con agua residual proveniente de la industria de procesamiento de cuero.
Efecto de la dilución del residual sobre la capacidad de decoloración y crecimiento de la biomasa fúngica libre a escala de Erlenmeyer diseño factorial 22
De acuerdo con el análisis de varianza para porcentaje de decoloración (cuadros I y II) en la interacción de x1 (tipo de cepa) y x2 (concentración del residual) no se presentó un efecto significativo en la variable de respuesta (p>0.0001); sin embargo el factor x1 en su nivel bajo tuvo un efecto significativo (p=0.0005) sobre la decoloración, alcanzando valores de 39 % cuando se utiliza la cepa de P. chrysosporium con efluente sin diluir y 41 % cuando el efluente se diluye al 80 % (v/v) con agua destilada. Al realizar una comparación de medias entre los dos tratamientos no se presentaron diferencias significativas (p=0.0001) que determinen la influencia de la dilución del residual sobre la decoloración. Con base en estos resultados el residual se podría utilizar sin modificación alguna respecto a su salida de la etapa de curtido, lo que representa un ahorro en el costo de tratamiento.
Con respecto al efecto de la interacción de x1 y x2 sobre la cantidad de biomasa formada no se presentó un efecto significativo (p=0.0039), la mayor cantidad de biomasa se obtuvo con la cepa de P. crhysosporium con efluente al 100 % con un valor máximo de 16 mg L–1. La caracterización química del efluente indicó DQO de 4462 mg L–1 y DBO5 de 250 mg L–1, con relación DBO5/DQO igual a 0.05. Esto indica una relación baja de C/N del residual y por ende la difícil degradación, lo que sugiere entonces que compuestos como restos de grasa, proteínas y azúcares reductores, posiblemente provenientes de la fase de ribera, fueron utilizados por P. chrysosporium para mantener su metabolismo (Álvarez et al. 2004).
Para la actividad LiP y MnP la interacción de x1 y x2 fue muy significativa, la actividad LiP fue similar en los cuatro tratamientos con valores para P. chrysosporium de 1.4 U L–1 y 1.7 U L–1 en el residual al 100 y 80 %. Con respecto a la actividad MnP, esta se cuantificó únicamente con A. niger en residual al 100 %. Los posibles mecanismos implicados en la producción de las enzimas podrían ser explicados por dos teorías asociadas con la presencia de metales pesados. La primera considera que estos elementos estimulan procesos a nivel transcripcional, generando un incremento en los niveles de ARNm, dando como resultado un incremento en la síntesis de proteínas relacionadas con la protección, como las metalotioneínas (Cervantes y Gutiérrez 1994, Palmieri et al. 2000, Galhaup y Haldrich 2001). La segunda tiene que ver con la producción de melaninas por la presencia de los metales, actividad considerada como un mecanismo de protección en la que intervienen las peroxidasas y las polifenol oxidasas (Caesar et al. 1995). La actividad de la lacasa no se detectó en ninguno de los tratamientos, resultado esperado ya que P. chrysosporium no produce esta enzima (Kirk y Farell 1997, Dávila y Vázquez–Duhalt 2006).
Efecto de dos condiciones nutricionales sobre la capacidad de decoloración y formación de biomasa
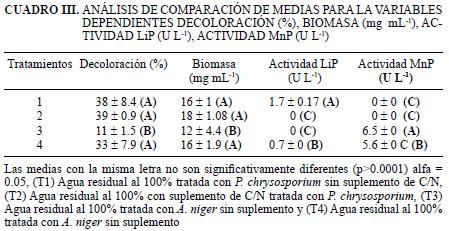
Con respecto a la respuesta de las dos cepas a la suplementación con carbono y nitrógeno se observó nuevamente que P. chrysosporium presentó mayor capacidad de decoloración con 38 y 39 % para residual sin suplemento y con suplemento, indicando adicionalmente correlación positiva con la biomasa producida (16 y 18 mg L–1). Con respecto a la actividad enzimática solamente se cuantificó LiP con valores de 1.4 y 0.7 U L–1, respectivamente (Fig. 2, cuadro III). Este ligero incremento en las variables de respuesta pudo estar relacionado con un fenómeno de competencia, por la fuente de carbono y nitrógeno, con un hongo levaduriforme que se recuperó a partir del agua residual, microorganismo que presentó un incremento de 52x104 UFC mL–1 a 58x105 UFC mL–1 al final de experimento. Los resultados obtenidos son contrarios a los publicados por Nasseri et al. (2002) y Srivastava y Thakur (2006) quienes sugieren que al incrementar la relación C/N tanto en agua residual como en agua sintética, se incrementa la remoción de cromo hexavalente, trivalente y el porcentaje de decoloración producto de la asimilación rápida de sustratos carbonados y nitrogenados que facilitan la mayor producción de biomasa metabólicamente activa con capacidad de bioadsorción. Es importante resaltar que en los estudios de Nasseri et al. y Srivastava y Thakur mencionados arriba, la condición de esterilidad se controló permanentemente, lo que permite garantizar que el ajuste nutricional solamente es aprovechado por el microorganismo modelo.
Evaluación de la capacidad de remoción con células inmovilizadas a escala de Erlenmeyer empleando el agua residual de curtido
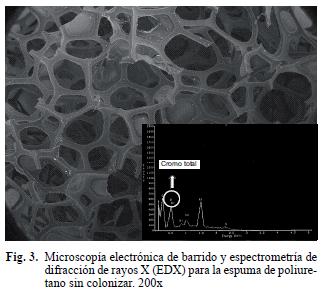
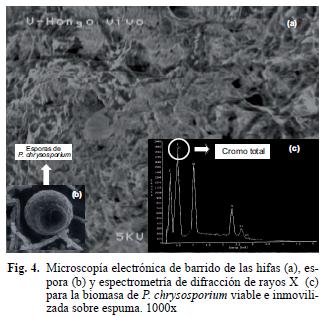
Características de la biomasa inmovilizada y de la actividad enzimática. En la figura 3 se observa la característica microscópica del soporte empleado para la inmovilización. Corresponde a un material poroso, con densidad baja y elevada área superficial, estructuralmente formado por una extensa red de canales de diferentes tamaños, los cuales se convierten en sitios potenciales para la colonización. Una vez que se llevó a cabo el protocolo de inmovilización, se realizaron cortes para visualizar la biomasa y la profundidad de la colonización, observando que P. chrysosporium formó hifas delgadas septadas con presencia de esporas (Fig. 4a, b), estructuras que posiblemente fueron utilizadas como mecanismos para acceder a varias zonas de la espuma, en especia a las áreas más superficiales en las que la concentración de oxígeno disuelto es superior y no es un factor limitante para el crecimiento. Choi et al. (2002), observaron una colonización similar al inmovilizar a P. chrysosporium en espuma, y proponen que hacia el interior se pueden presentar concentraciones muy bajas de oxígeno que afectan el metabolismo del microorganismo.
La concentración de biomasa final en el tratamiento fue de 37 mg cm–3, es decir, 2 miligramos más que al inicio del experimento, el incremento se presentó por la utilización de azúcares reductores que al final estaban en una concentración de 0.110 g L–1 (Fig. 5), lo que demuestra que posiblemente fueron utilizados por el hongo inmovilizado, sin descartar una competencia con el hongo levaduriforme. En los demás tratamientos el consumo fue menor y se llevó a cabo por el microorganismo presente en el agua residual. Varios autores reportan que la remoción de metales pesados en ecosistemas acuáticos y en el suelo es facilitada por la presencia o adición de una fuente de carbono sencilla que favorece el incremento de la biomasa en función del tiempo, obteniendo mayor cantidad de bioadsorbente (Nasseri et al. 2002, Srivastava y Thakur 2006). Es importante resaltar que a diferencia de estas investigaciones en el presente trabajo no se realizó ningún ajuste nutricional al agua residual, el hongo solamente utilizó la materia orgánica disponible.
Con respecto al comportamiento del pH, la acidificación (pH 3.0) del residual a expensas de los ácidos orgánicos producidos (posiblemente ácido oxálico) es un cambio favorable para la remoción de metales pesados, básicamente porque a pH ácido la protonación de los grupos amino presentes en la pared favorecen la bioadsorción de cromo (Park et al. 2005). El fenómeno ha sido reportado por BayramoÄlu et al. (2005), quienes trabajaron con micelio del basidiomiceto Lentinus sajor–caju para la remoción de Cr(VI), y observaron que a valores de pH ácido la bioadsorción se favorece al comparar con valores de pH alcalinos y neutros.
La actividad enzimática se presentó únicamente para el tratamiento en el que se usó la biomasa viva con valores de 7 U L–1 para MnP y 0.22 U L–1 LiP; la producción de las dos enzimas se correlacionó positivamente con la decoloración, remoción de DQO y cromo total (p<0.0001) (Fig. 5). La actividad enzimática se relacionaría con los mecanismos de tolerancia al metal, ya que al presentarse una posible síntesis de melaninas, quedaron expuestos adicionalmente grupos funcionales del tipo carboxilo, fenólico, hidroxilo y amino que sirvieron como sitios activos de unión para el cromo (Fogarty y Tobin 1996). Por otro lado la producción de enzimas ligninolíticas también se estaría relacionando con una posible transición hacia metabolismo secundario, desencadenado por un déficit en la fuente de carbono o de nitrógeno. Este comportamiento ha sido el más estudiado y se considera como el mecanismo más importante en la regulación de la expresión enzimática en hongos de podredumbre blanca (Kirk y Farell 1997). Sin embargo, en aguas residuales con elevadas concentraciones de metales pesados y contenido bajo de materia orgánica, no se han realizado estudios más detallados para confirmar cuál de los dos mecanismos sería el predominante o si por el contrario los dos pueden estar actuando de manera combinada.
Remoción de color y DQO
Al inicio del experimento el agua residual presentó un color verde oscuro, asociado con las altas concentraciones de sulfato de cromo, el cual fue cambiando progresivamente hasta alcanzar un verde claro que correspondió a un porcentaje de decoloración del 67 y 61 % para la biomasa inmovilizada viable e inactiva; la decoloración obtenida con la espuma fue significativamente menor (49 % p<0.0001) (Fig. 6). En este tipo de aguas residuales la decoloración está relacionada con la bioadsorción de las sales metálicas a la pared fúngica y al soporte de inmovilización. En relación con esto, varios autores sugieren que no se lleva a cabo ninguna modificación de tipo estructural en la sal que genere un cambio en el espectro de absorción. Adicionalmente se obtuvo una correlación positiva muy significativa (p<0.0001) entre la concentración de biomasa, porcentaje de decoloración y remoción de cromo total. Varios autores como Fu y Viraraghavan (2001), Pedroza et al. (2007) y Henao–Jaramillo et al. (2007), demostraron que al utilizar hongos de podredumbre blanca para el tratamiento de aguas residuales papeleras y remoción de colorantes, la cantidad de biomasa y decoloración están directamente relacionadas.
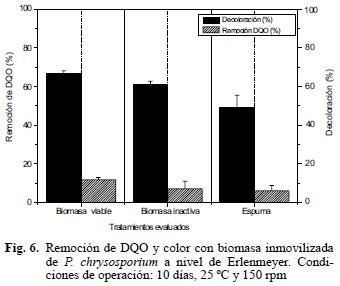
Con respecto a la remoción de DQO, el residual inicial contenía 4462 mg L–1 de DQO; al finalizar los tres tratamientos los porcentajes de remoción obtenidos fueron de 12, 7 y 6 % para la biomasa viable, inactiva y espuma (Fig. 6). La remoción de DQO fue baja, por lo tanto el sistema tendría restricciones si se utiliza como único tratamiento, ya que no cumple con los límites máximos permisibles para vertimiento puntual después de haber realizado tratamiento biológico, que en Colombia son de 120 mg L–1 para DQO y 60 mg L–1 DBO5 (CAR 2004). La presencia de ciertos compuestos como sulfatos que no fueron cuantificados, pudieron afectar parcialmente el metabolismo de P. chrysosporium y del hongo levaduriforme acompañante, interfiriendo en la remoción de DQO, pues como lo demostraron Ram et al. (1999), la eficiencia en la remoción de DQO, DBO5 y cromo total presente en agua de curtiembres se puede incrementar si previamente al tratamiento con lodos activados se realiza un pretratamiento con coagulantes para disminuir la concentración de sulfitos y de cromo. Igualmente, Rama y Ligy (2005), empleando Ganoderma lucidum para el tratamiento de aguas residuales de curtiembres, encontraron que el hongo inmovilizado en gravilla remueve aproximadamente el 40 % de la DQO inicial, lo que permite suponer que en este tipo de residuales de difícil degradación la remoción de DQO es muy alta.
Remoción de cromo
Con respecto al comportamiento del cromo en los tratamientos evaluados se determinó que no existen diferencias significativas entre la remoción obtenida con biomasa inmovilizada viable e inactiva. Cualquiera de los dos sistemas podría ser utilizado para el tratamiento, pero el preparar un producto inmovilizado para luego inactivarlo por tratamiento térmico se convertiría en un paso adicional que implicaría más tiempo y costo (Fig. 7). Esto se justificaría con estudios complementarios que demuestren que la biomasa inactiva es más eficiente y estable por largos periodos de operación y con diferentes lotes de agua residual. La remoción obtenida con la espuma fue menor (p<0.0001) que en los tratamientos con biomasa fúngica. El soporte sin microorganismo inmovilizado puede tener propiedades adsortivas altas debido a que su composición es una mezcla de poliol e isocianato, compuestos de carga negativa que actuarían como intercambiador catiónico de tipo químico (Castillo y Ortega 2007). Los porcentajes de remoción obtenidos para CrT fueron 97, 96 y 65 % para biomasa viable, inactiva y espuma. Para Cr(VI) 85, 50, 11 y 97 % y 96 % para Cr(III) respectivamente para cada tratamiento. La remoción de los dos tipos de cromo presentó correlación positiva muy significativa con la decoloración y con la cantidad de biomasa retenida en el soporte (p<0.0001).
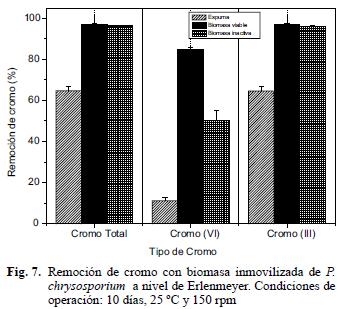
Los posibles mecanismos implicados en la remoción del metal fueron de tres tipos: reducción de Cr(VI) a Cr(III) en solución; el segundo la unión del Cr(VI) a grupos amino cargados positivamente presentes en la pared fúngica para que se lleve a cabo una reducción de Cr(VI) a Cr(III) y por último la liberación de Cr(III) a la solución acuosa (desorción) por la repulsión de cargas entre los grupos cargados positivamente y el cromo trivalente (Park et al. 2005). Esta última opción posiblemente no se presentó, pues el cromo trivalente no aumentó, por el contrario disminuyó, por esta razón es factible considerar que pudo sufrir un proceso de precipitación como Cr(OH)3 o se presentó una complejación con ciertas fracciones de materia orgánica presentes en el agua residual (Rama y Ligy 2005).
La biomasa inactivada por tratamiento térmico pudo modificarse y adherirse fuertemente a la espuma, de esta forma se generaron otros sitios de unión para el metal y se incrementó el área superficial disponible para la adsorción (Bai y Abraham 2001). Esto se observó al analizar las fotografías de microscopía electrónica de barrido en las cuales se visualizó adelgazamiento y compactación de las hifas con el soporte (Fig. 8). Bayramoglu et al. (2005) reportaron que los tratamientos físicos y químicos pueden incrementar la capacidad adsorbente de la biomasa inactiva, básicamente porque los ácidos causan desnaturalización de proteínas y protonación de la hexosamina con lo que se incrementan los sitios activos de unión (–NH2) y la posibilidad de adsorber mayor cantidad de metal a pH ácido.
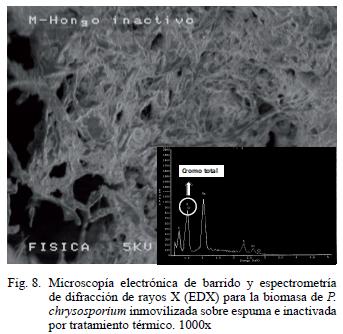
Al comparar este estudio con otros trabajos, es importante destacar que la remoción de cromo con P. chrysosporium inmovilizado en espuma no ha sido reportado y las eficiencias alcanzadas son altas tanto con biomasa viable como con inactiva. Rama y Ligy (2005) utilizaron el hongo de la madera Ganoderma lucidum inmovilizado en gravilla en reactor de mezcla completa y obtuvieron un remoción de cromo hexavalente del 80 % a las ocho horas de tratamiento, datos similares a los obtenidos con P. chrysosporium inmovilizado en espuma de poliuretano sin control de esterilidad durante el proceso.
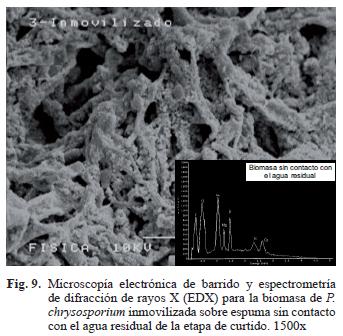
Espectrometría de dispersión de energía por rayos X (EDX)
Adicionalmente se realizó una caracterización y semicuantificación por EDX antes y después del tratamiento con el agua residual (Figs. 3, 4 y 8) y se observó que el cromo total está presente en la biomasa inmovilizada viable, inactiva y en la espuma. Sin embargo, el porcentaje atómico en esta última fue significativamente menor (p< 0.0001) con respecto al acumulado en la biomasa viable e inactiva, resultados que ayudaron a confirmar por métodos físicos que la biomasa inmovilizada es mejor para la remoción del metal. Como testigo se utilizó una muestra de micelio de P. chrysosporium que no estuvo en contacto con el agua residual y en el microanálisis de EDX (Fig. 9) no se observó la presencia de cromo. La elevada resolución de los picos obtenidos en el EDX indican que el cromo total se unió significativamente a la biomasa. Por otro lado se encontraron trazas de otros elementos como azufre, cloro, níquel, sodio, aluminio, carbono y oxígeno, presentes en las tres muestras de residual. Estos elementos provienen del agua y también fueron adsorbidos a la superficie de los materiales evaluados. Fahim et al. (2006) confirman que es factible que el azufre y el cloro estén presentes en concentraciones superiores a 1000 ppm en aguas residuales de curtiembres . Akar et al. (2005) también demostraron que otros materiales diferentes al metal pesado pueden observarse en los microanálisis de EDX cuando se utiliza a Botrytis cinerea como nuevo bioadsorbente para la remoción de Pb (II) en solución.
CONCLUSIONES
P. chrysosporium fue significativamente más tolerante al sulfato de cromo (30,000 mg L–1) y al dicromato de potasio (7500 mg L–1) que A. niger, T. versicolor y P. ostreatus, demostrando que es una cepa hipertolerante a cromo no reportada como tal hasta el momento. Esta capacidad pudo ser desarrollada por medio de mecanismos adaptativos generados como respuesta a la exposición prolongada y ascendente a las sales de cromo.
La dilución del agua residual con agua potable y la suplementación nutricional de la misma con carbono y nitrógeno no tuvieron efectos significativos sobre la capacidad de biodecoloración de P. chrysosporium. Esto significa que la cepa podría ser utilizada para tratar el agua tal y como sale de la etapa de curtido, lo que disminuiría los costos de tratamiento, por no ser necesario un acondicionamiento previo.
P. chrysosporium se inmovilizó en espuma de poliuretano para desarrollar un portador bifásico resistente y eficiente para la remoción de color, DQO y cromo provenientes de aguas residuales de la etapa de curtido. Se demostró que tanto la biomasa viable como la inactiva podrían ser utilizadas como alternativa biotecnológica no convencional para el tratamiento de este tipo de aguas residuales sin control de esterilidad durante el proceso.
AGRADECIMIENTOS
El presente estudio forma parte del proyecto No. 000410 registrado en la Oficina de Fomento a la Investigación de la Vicerrectoría Académica de la Pontificia Universidad Javeriana, Bogotá, Colombia.
Los investigadores expresan su agradecimiento a las doctoras Refugio Rodríguez Vázquez y Martha Barajas Aceves, investigadoras del Laboratorio de Compuestos Xenobióticos, Departamento de Biotecnología y Bioingeniería del Centro de Investigaciones y de Estudios Avanzados del Instituto Politécnico Nacional, CINVESTAV–IPN, México, D.F., por su autorización para evaluar la cepa de Phanerochaete chrysosporium en Colombia y por su asesoría técnica, como parte del convenio de cooperación interinstitucional CINVESTAV–IPN/Pontificia Universidad Javeriana 2000.
Los investigadores expresan su agradecimiento al Dr. Ciro Falcony, investigador del Departamento de Física por el apoyo en los estudios de microscopía electrónica de barrido y los microanálisis de EDX.
REFERENCIAS
Acosta I., Rodríguez X., Gutiérrez C. y Moctezuma M.G. (2004). Biosorption of chromium (VI) from aqueous solutions onto fungal biomass. Bioorganic. Chem. Appl. 2, 1–2. [ Links ]
Ahluwalia S. y Goyal D. (2007). Microbial and plant derived biomass for removal of heavy metals from wastewater. Bioresour. Technol. 98, 2243–2257. [ Links ]
Akar T., Tunali S. y Kiran I. (2005). Botrytis cinerea as a new fungal biosorbent for removal of Pb(II) from aqueous solutions. Biochem. Eng. J. 25, 227–235. [ Links ]
Anderson R.A. (1997). Chromium as an essential nutrient for humans. Regul. Toxicol. Pharmacol. 26, S35–S41. [ Links ]
Álvarez S., Maldonado M., Gerth A. y Kuschk P. (2004). Characterization of tannery effluents and study of the water hyacinth in chromium recovery. Información Tecnológica. 15, 75–80. [ Links ]
Bai R.S. y Abraham T.E. (2003). Studies on chromium (VI) adsorption–desorption using immobilized fungal biomass. Bioresour. Technol. 87, 17–26. [ Links ]
Barajas–Aceves M., Ocampo–Velásquez R. y Rodríguez–Vázquez R. (2007). Effects of Cr3+, Cr6+ and tannery sludge on C and N mineralization and microbial activity in semi–arid soils. J. Hazard. Mat. 143, 522–531. [ Links ]
Baral A. y Engelken R.D. (2002). Chromium–based regulations and greening in metal finishing industries in the USA. Environ. Sci. Policy. 5, 121–133. [ Links ]
Bayramoglu G., Celik G., Yalcin E., Yilmaz M. y Yakup–Arica M. (2005). Modification of surface properties of Lentinus sajor–caju mycelia by physical and chemical methods: evaluation of their Cr6+ removal efficiencies from aqueous medium. J. Hazard. Mat. B119, 219–229. [ Links ]
Caesar T.C., Kloeke F.V., Geesey G. y Henson J. (1995). Melanin production by a filamentous soil fungus in response to copper and localization of copper sulfide by sulfide silver staining. Appl. Environ. Microbiol. 61, 1968–1975. [ Links ]
CAR (Corporación Autónoma Regional) (2004). Acuerdo 08 del 2004. Norma de vertimiento de la industria de curtido de pieles, pp. 1–20. [ Links ]
Castillo L. y Ortega K. (2007). Efecto del soporte de inmovilización y co–sustrato sobre la capacidad de remoción del negro reactivo 5, empleando T. versicolor. Tesis de Pregrado. Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, Colombia, 56 p. [ Links ]
Cervantes C. y Gutiérrez C. (1994). Copper resistance mechanisms in bacteria and fungi. FEMS. Microbiol. Rev. 4, 121–138. [ Links ]
Choi S., Moon S. y Gu M. (2002). Biodegradation of chlorophenols using the cell–free culture broth of Phanerochaete chrysosporium immobilized in polyurethane foam. J. Chem. Technol. and Biotech. 77, 999–1004. [ Links ]
Coulibaly L., Gourene G. y Spiros A. (2003). Utilization of fungi for biotreatment of raw wastewaters. African J. Biotech. 2, 620–630. [ Links ]
DAMA (Departamento Técnico Administrativo del Medio Ambiente) (1997). Norma 1074/97. República de Colombia. Estándares Ambientales en términos de vertimientos. 1–2. [ Links ]
Dávila A. y Vázquez–Duhalt R. (2006). Enzimas ligninolíticas fúngicas para fines ambientales. Mensaje Bioquímico. 30, 29–55. [ Links ]
Dilek F.B., Erbay A. y Yetis U. (2002). Ni(II) biosorption by Polyporous versicolor. Process Biochem. 37, 723–726. [ Links ]
Doyle M. (2000). Microbiología de los alimentos. Fundamentos y fronteras. Acribia, Zaragoza, España, pp. 312–320. [ Links ]
Eaton A., Clesceri L., Rice E. y Greenberg A. (2005). Standard methods for the examination of water and wastewater. 21 ed. American Public Health Association. Washington, D.C, 1368 p. [ Links ]
Fahim N.H., Barsoum B.N., Eid A.E. y Khalil M.S. (2006). Removal of chromium (III) from tannery wastewater using activated carbon from sugar industrial waste. J. Hazard. Mat. B136, 303–309. [ Links ]
Filipovíc–Kovacevic Z., Sipos L. y Briski F. (2000). Biosorption of chromium, copper, nickel and zinc ions onto fungal pellets of Aspergillus niger 405 from aqueous solutions. Food Technol. Biotechnol. 38, 211–216. [ Links ]
Fogarty R. y Tobin J. (1996). Fungal melanins and their interaction with metals. Enz. Microbial. Technol. 19, 311–317. [ Links ]
Fu Y. y Viraraghavan T. (2001). Fungal decolorization of dye wastewater: a review. Bioresour. Technol. 79, 251–261. [ Links ]
Galhaup C. y Haltrich D. (2001). Enhanced formation of laccase activity by the white–rot fungus Trametes pubescens in the presence of copper. Appl. Microbiol. Biotechnol. 56, 225–232. [ Links ]
Gómez–Dorado C., Martínez–Salgado M.M., Nieto–Mosquera D., Pedroza–Rodríguez A., Rodríguez–Vázquez R. y Rosas–Acosta J. (2005). Estudio de efecto de dos inductores y un protector enzimático sobre la actividad lacasa y MnP producida por T. versicolor y su efecto en la decoloración de efluentes papeleros. Universitas Scientiarum, 10, 37–45. [ Links ]
Henao–Jaramillo L., Fernández–González J., Castillo–Carvajal L., Ortega–González K., Quevedo–Hidalgo B., Florido–Cuéllar A. y Pedroza–Rodríguez A.M. (2007). Remoción del colorante negro reactivo 5 con biomasa viable e inmovilizada de hongos de podredumbre blanca. Memorias de XII Congreso Nacional de Biotecnología y Bioingeniería. Morelia, Michoacán, México, 23 p. [ Links ]
Iqbal M. y Saeed A. (2007). Production of an immobilized hybrid biosorbent for the sorption of Ni(II) from aqueous solution. Process. Biochem. 42, 148–157. [ Links ]
Jarosz–Wilkolazka A., Bieta–Malarczyk E., Pirszel J., Skowronuski T. y Leonowicz A. (2002). Uptake of cadmium ions in white rot fungus Trametes versicolor: Effect of Cd (II) ions in the activity of laccase. Cell Biol. Inter. 26, 605–613. [ Links ]
Kacar Y., Arpa C., Tan S., Denizli A., Genc O. y Arica M. (2002). Biosorption of Hg(II) and Cd(II) from aqueous solutions: comparison of biosorptive capacity of alginate and immobilized live and heat inactivated Phanerochaete chrysosporium. Process Biochem. 37, 601–610. [ Links ]
Kapoor A. y Viraraghavan T. (1995). Fungal biosorption, an alternative treatment option for heavy metal bearing wastewater: A review. Bioresour. Technol. 53, 195–206. [ Links ]
Kirk K. y Farrell R. (1997). Enzymatic combustion: the microbial degradation of lignin. Ann. Rew. 41, 465–505. [ Links ]
Kovacevic Z., Sipos L. y Briski F. (2000). Biosorption of chromium, copper, nickel and zinc ions onto fungal pellets of Aspergillus niger 405 from aqueous solutions. Food Technol. Biotechnol. 38, 211–216. [ Links ]
Martínez–Salgado M.M., Pedroza–Rodríguez A., Rodríguez–Vázquez R. y Rosas–Acosta J. (2005). Efecto de la glucosa y nitrato de amonio sobre las enzimas ligninolíticas producidas por T. versicolor inmovilizado en espuma y la decoloración de un efluente papelero en un reactor de lecho fluidizado. Universitas Scientiarum, 10, 27–36. [ Links ]
Michel F., Balachandra S., Grulke E. y Adinarayana C. (1991). Role of manganese peroxidases and lignin peroxidases of Phanerochaete chrysosporium in the decolorization of kraft bleach plant effluent. Appl. Environ. Microbiol. 57, 2368–2375. [ Links ]
Miller G. (1959). Use of dinitrosalicilic acid reagent for determination of reducing sugar. Ana. Chem. 35, 426–428. [ Links ]
Ministerio de Salud República de Colombia. (1984). Decreto 1594. Usos del agua y residuos líquidos. pp. 1–52. [ Links ]
Montgomery D.C. (2003). Diseño y análisis de experimentos. Limusa Wiley, México D.F. 218 p. [ Links ]
Morato R., Ríos M., Pedroza A.M. y Martínez M.M. (2003). Evaluación de un sistema de flujo discontinuo para la remoción de cromo con Aspergillus niger. Memorias de III Congreso de Investigación de la Pontificia Universidad Javeriana, Bogotá, Colombia, p. 67. [ Links ]
Nasseri S., Mazaheri–Assadi M., Moori–Sepehr M., Rostami Kh., Shariat M. y Nasadfi K. (2002). Chromium removal from tanning effluents using biomass of Aspergillus oryzae. Pakistan J. Biol. Sci. 5, 1056–1059. [ Links ]
Palmieri G., Giardina P., Bianco P., Fontanella B. y Sannia G. (2000). Copper induction of laccase isoenzyme in the ligninolytic fungus Pleurotus ostreatus. Appl. Environ. Microbiol. 66, 920– 924. [ Links ]
Park D., Yun J., Jo J. y Parka J. (2005). Mechanism of hexavalent chromium removal by dead fungal biomass of Aspergillus niger. Water Res. 39,533–540. [ Links ]
Pedroza–Rodríguez A.M., Mosqueda R., Alonso–Vante N. y Rodríguez–Vázquez R. (2007). Sequential treatment via T. versicolor and UV/TiO2/RuxSey to reduce contaminants in waste water resulting from the bleaching process during paper production. Chemosphere. 67, 793–801. [ Links ]
Pedroza–Rodríguez A.M. (2006). Tratamiento de aguas residuales de la industria papelera mediante un sistema secuencial: hongos ligninolíticos y un proceso fotocatalítico nanoestructurado de TiO2/RuxSey. Tesis de Doctorado en Ciencias. Centro de Investigaciones y de Estudios Avanzados del Instituto Politécnico Nacional. México D.F, México. 219 p. [ Links ]
Qingbiao L., Songtao W., Gang L., Xinkai L., Xu D., Daohua S., Yuelin H. y Yili H. (2004). Simultaneous biosorption of cadmium (II) and lead (II) ions by pretreated biomass of Phanerochaete chrysosporium. Separat. Purificat Technol. 34, 135–142. [ Links ]
Rama K. y Ligy P. (2005). Bioremediation of Cr(VI) in contaminated soils. J. Hazard. Mater. B121, 109–117. [ Links ]
Ram B., Bajpai P. y Parwane H. (1999). Kinetics of chrome–tannery effluent treatment by the activated–slugde sytem. Process. Biochem. 35, 255–265 [ Links ]
Say R., Denizli A. y Arica M. (2001). Biosorption of cadmium(II), lead(II) and copper(II) with the filamentous fungus Phanerochaete chrysosporium. Bioresour. Technol. 76, 67–70. [ Links ]
Shaheen Z., Farrukh A. e Iqbal A. (2007). Metal tolerance and biosorption potential of filamentous fungi isolated from metal contaminated agricultural soil. Bioresour. Technol. 98, 2557–2561. [ Links ]
Srivastava S. y Thakur I. (2006). Evaluation of bioremediation and detoxification potentiality of isolation and process parameter optimization of Aspergillus sp. for removal of chromium from tannery effluent. Bioresour. Technol. 97, 1167–1173. [ Links ]
Téllez M. J., Carvajal R.M. y Gaitán A.M. (2004). Aspectos toxicológicos relacionados con la utilización del cromo en el proceso productivo de curtiembres. Rev. Fac. Med. Univ. Nal. Colombia. 52, 1–3. [ Links ]
Tien M. y Kirk T.K. (1988). Lignin peroxidase of Phanerochaete chrysosporium. Methods Enzymol. 161, 238–249. [ Links ]
Tinoco R., Pickard M.A. y Vázquez–Duhalt R. (2001). Kinetic differences of purified lacease from six Pleurotus ostreatus strains. Letter Appl. Microbiol. 32, 331–335. [ Links ]
Zouboulis A.I., Loukidou M.X. y Matis K.A. (2004). Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal–polluted soils. Process. Biochem. 39, 909–916. [ Links ]














