Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.24 no.2 Ciudad de México may. 2008
Genotoxicidad y determinación de compuestos tóxicos en un residuo líquido hospitalario de Buenos Aires, Argentina
Genotoxicity and assessment of toxic compounds in a hospital liquid residual from Buenos Aires, Argentina
Marta PAZ, Anahí MAGDALENO, Carina TORNELLO, Natalia BALBIS y Juan MORETTON
Cátedra de Higiene y Sanidad. Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires. Junín 956, 4° piso, (1113) Ciudad de Buenos Aires, Argentina. Correo electrónico: jamorett@ffyb.uba.ar
(Recibido septiembre 2007, aceptado abril 2008)
RESUMEN
Los líquidos residuales no tratados provenientes de centros de salud presentan un riesgo potencial para la salud y el ambiente debido a que transportan sustancias químicas con efectos tóxicos y genotóxicos. La composición de estos líquidos residuales fluctúa continuamente debido a la gran diversidad de medicamentos, desinfectantes, solventes, reactivos de laboratorio, detergentes y otros compuestos vertidos a los mismos. En la Ciudad de Buenos Aires, las aguas residuales procedentes de los centros hospitalarios no son tratadas in situ, sino que se transportan a través del sistema cloacal y se vierten con un mínimo tratamiento al Río de La Plata, principal fuente de abastecimiento de agua potable para una población de 10 millones de habitantes. El objetivo de este trabajo es analizar la presencia de compuestos tóxicos y la genotoxicidad en aguas residuales del Hospital de Clínicas San Martín de la Universidad de Buenos Aires, centro médico de alta complejidad que vuelca diariamente 565 m3 de agua residual al colector cloacal. Se tomaron muestras de este líquido de lunes a viernes, que se ensayaron como agua cruda filtrada y como extracto obtenido por pasaje a través de resinas XAD4. La determinación de toxicidad y genotoxicidad del efluente hospitalario se realizó utilizando distintos sistemas biológicos normatizados: los ensayos de Ames, Saccharomyces cereviciae D7 y Rec (+/–) con Bacillus subtilis. En ninguno de estos ensayos se evidenció efecto tóxico sobre las cepas empleadas. Los datos obtenidos con los ensayos de Ames y Rec (+/–) no permitieron demostrar actividad mutagénica ni en las muestras de agua cruda ni en los extractos XAD4. Las determinaciones realizadas con Saccharomyces cereviciae D7 mostraron actividad genotóxica en el agua residual del día viernes. Se determinó, además, el perfil de tóxicos presentes en las muestras al seleccionar los más probables, como cadmio, cromo, mercurio y compuestos orgánicos halogenados; en todos los casos, las concentraciones de estos compuestos en las aguas residuales fueron inferiores a los límites establecidos para los vertidos industriales a colectores cloacales. El efecto genotóxico no pudo ser relacionado con la presencia de estos contaminantes, lo que demuestra la importancia de utilizar ensayos químicos y biológicos para determinar el posible riesgo ambiental de estos vertidos.
Palabras clave: toxicidad, genotoxicidad, efluentes hospitalarios
ABSTRACT
Raw wastewaters from health centers transport a great variety of chemical compounds like medical drugs, disinfectants, detergent, laboratory reagents, etc. The complex and fluctuant chemical composition of these effluents opens the possibility of an environmental toxicity scenario. Even considering that these wastewaters are diluted after their discharge towards the municipal sewer system, certain substances present in the effluents can generate by cumulative effect a biological imbalance in aquatic ecosystems. In Buenos Aires city, the urban sewer waters are delivered into the Río de la Plata with no previous depuration treatment, being the latter the main source of drinking water for the city. The objective of this work is to analyze the toxicity and genotoxicity in wastewater samples of San Martin Hospital, an important medical center that daily releases 565 m3 of wastewaters to the sewer system. The evaluation of the genotoxic potential of hospital effluents was performed with different biological systems: the Ames test, the Saccharomyces cereviciae D7 test and the Rec (+/–) assay with Bacillus subtilis. Samples of raw wastewater and the correspondent XAD4 extract were submitted to biological test. No mutagenic effect, either with the Ames test or the Rec (+/–), was detected. Only those samples taken on Friday induced gene conversion in Saccharomyces cereviciae D7. Simultaneously, the chemical toxicity profile of the samples was studied. Cadmium, chromium, mercury and organic halogenated compounds concentrations were in all cases below the toxicity limits established for effluents release to the sewer system. The results obtained confirm the existence of unidentified hazardous substances in hospital wastewater. The determination of toxicants or toxic substances concentration in the samples, in addition to a test battery for genotoxicity detection studies, provide more meaningful information to decision–makers in the estimation of environmental risk of hospital wastewaters.
Key words: toxicity, genotoxicity, hospital wastewaters
INTRODUCCIÓN
Los centros de salud eliminan grandes volúmenes de residuos líquidos contaminados con materia orgánica a la que se suman antibióticos, antisépticos, detergentes, solventes, medicamentos, excretas y secreciones humanas contaminadas por diferentes tipos de microorganismos patógenos. Estos efluentes constituyen un riesgo potencial para el ser humano y el ambiente, lo que se traduce en un impacto para la salud pública (Ortolan 1999).
La magnitud de dicho impacto ha comenzado a evaluarse en los últimos años en ámbitos científicos y gubernamentales (Dremont y Hadjali 1997, Pruess et al. 1999, Bassi y Moretton 2003, Paz et al. 2004, Nuñez y Moretton 2006).
En las grandes ciudades los efluentes hospitalarios líquidos son descargados, sin tratamiento previo, a la red cloacal municipal que los transporta, junto con las aguas residuales domésticas, a las plantas para tratamiento de efluentes.
La composición de los efluentes hospitalarios líquidos presenta variaciones notables en la composición cualicuantiativa debido a la gran diversidad de compuestos químicos y de secreciones humanas contaminadas que pueden aparecer en su contenido (Richardson y Bowron 1985, Kümmerer 2001). Reconociendo esta situación, la Organización Mundial de la Salud, a través de la División de Apoyo Operacional en Salud Ambiental y el Centro Europeo de Salud Ambiental, ha formado un grupo internacional para estudiar el problema de los residuos en los centros de salud en países de desarrollo (OPS 1993, Pruess et al. 1999).
Uno de los principales problemas sanitarios relativos a la contaminación ambiental es el vertido de residuos tóxicos a las aguas. Por ello es importante efectuar investigaciones de los riesgos que pueden producir los contaminantes presentes en las aguas residuales de centros de salud sobre los ecosistemas (Stumpf et al. 1999). Entre los contaminantes ambientales se encuentran sustancias que poseen la capacidad de inducir mutaciones y cambios genéticos en el ecosistema acuático con efectos genotóxicos (Würgler y Kramers 1992, Ferreira La Rosa et al. 2000, Pitot y Dragan 2001, Emmanuel et al. 2005).
En la Ciudad de Buenos Aires, las aguas residuales procedentes de los centros hospitalarios no son tratadas in situ, sino que se transportan a través del sistema cloacal. A su vez, las aguas cloacales de la ciudad no son derivadas a una planta para depuración, y se vierten con un mínimo tratamiento al Río de la Plata, principal fuente de abastecimiento de agua potable para una población de 10 millones de habitantes.
El objetivo de este trabajo es determinar la presencia de los compuestos tóxicos más importantes y la genotoxicidad de las aguas residuales del Hospital de Clínicas San Martín de la Universidad de Buenos Aires, Argentina. Este hospital de alta complejidad libera aproximadamente 565 metros cúbicos de agua residual no tratada diariamente al sistema cloacal municipal (Paz et al. 2004). Se ensayó el agua residual y el extracto empleando tres sistemas biológicos el ensayo de Ames, el ensayo de levaduras con Saccharomyces cerevisiae D7 y el ensayo de Rec (+/–) con Bacillus subtilis, y en cada muestra se efectuó simultáneamente la búsqueda de compuestos orgánicos halogenados totales y metales pesados como mercurio, cromo y cadmio.
MATERIALES Y MÉTODOS
El sitio seleccionado para la extracción de muestras de agua residual fue la cámara para inspección del vertido al sistema cloacal urbano, ubicada en el sector Azcuénaga del Hospital de Clínicas San Martín.
La estrategia de muestreo para este estudio fue planteada considerando cuatro tomas de muestra diarias, realizadas durante los cinco días de una misma semana. Debido a la variabilidad en la composición, caudal y concentración del agua residual del hospital durante las distintas horas del día, se utilizaron muestras compuestas, representativas de los vertidos realizados durante un período de ocho horas, correspondiente al horario de mayor actividad del hospital. Se tomaron muestras sucesivas de tres litros cada una, extraídas con intervalos no superiores a dos horas. Se mezclaron y se mantuvieron a 4 °C.
Determinación de metales pesados
Se determinó la concentración de cadmio, cromo y mercurio en las muestras compuestas correspondientes a cada día de la semana. La determinación de mercurio se realizó por espectrofotometría de absorción atómica acoplado a generador de hidruros en vapor frío (espectrómetro de absorción atómica marca Varian AA 475, acoplado a generador de hidruros GVA77). Para la determinación de cadmio y cromo se utilizó espectrofotometría de absorción atómica con atomización a llama. En ambos casos se siguieron las técnicas descritas en American Public Health Association Standard Methods (1998).
Determinación de compuestos orgánicos halogenados totales
Para la extracción de semivolátiles se aplicó lo descrito en la norma USEPA 3510 C (1996), la muestra de 1 litro se acidificó a pH 2 y se extrajo con dos porciones de diclorometano (80 mL cada una). El método de análisis por cromatografía gaseosa fue el descrito en la norma USEPA 8270 C (1998) y se utilizó un equipo Hewlett–Packard 5890 Serie II con detector de espectrometría de masa modelo 5972, columna HP5–MS, límite de cuantificación 0.3 mg/L y límite de detección 0.1 mg/L.
Para determinar los tiempos de retención y respuesta de los compuestos buscados se utilizaron como patrones certificados cloroformo, tricloroetileno, clorobenceno, tetracloroeteno y tetracloruro de carbono. Los compuestos orgánicos volátiles se analizaron por la técnica de head space al colocar 5 mL de muestra en un vial cerrado herméticamente y calentarlo a 80° C para finalmente inyectar en el cromatógrafo 1 mL del gas en equilibrio con la muestra.
Ensayos de genotoxicidad
La determinación de genotoxicidad del efluente hospitalario se llevó a cabo utilizando tres sistemas biológicos: los ensayos de Ames, Saccharomyces cerevisiae D7 y Rec con Bacillus subtilis.
Las muestras de efluente para estas determinaciones biológicas se procesaron de dos maneras: por filtración a través de filtros Millipore 0,22 µm, y por pasaje a través de resinas XAD–4 para concentrar los compuestos genotóxicos no polares presentes en las aguas residuales. Las resinas se trataron con éter etílico para la extracción de dichos compuestos, el éter fue luego evaporado a presión reducida. El residuo seco se resuspendió en dimetilsulfóxido, obteniendo así un extracto concentrado 100 veces (Dressler 1979, Mortelmans y Zeiger 2000, Siddiqui y Ahmad 2003).
Ensayo de Ames
Se utilizaron cepas TA98 y TA100 de Salmonella typhimurium, las cuales permitieron determinar la capacidad de las muestras de efluente para inducir sustitución de pares de bases y corrimientos en el marco de lectura de la molécula de ADN.
Se realizó el ensayo de incorporación en placa a 2 mL de top–agar fundido y mantenido a 45 °C en baño de agua. Se agregó 0.1 mL de un caldo de cultivo de 107–108 células/mL de la cepa bacteriana correspondiente, 0.1 mL de la muestra en ensayo y 0.5 mL solución reguladora de fosfato ó 0.5 mL de S9 mix. El contenido de los tubos así preparados se mezcló y volcó inmediatamente en placas de Petri que contenían sobre la superficie 15 ml de medio mínimo suplementado con glucosa y sales de Vogel–Bonner. Las determinaciones se realizaron con y sin la adición de fracción de microsomas (S9), utilizando la técnica descrita por Mortelmans y Zeiger (2000). El ensayo indica mutagenicidad cuando el número de unidades formadoras de colonias (UFC) –en las placas correspondientes a células tratadas con la muestra analizada– como mínimo duplica las UFC en las placas del testigo.
El ensayo con agua residual cruda se realizó a una concentración de 0.5% V/V de muestra y con la fracción no polar al 50 % V/V de muestra en dimetil sulfóxido.
Los resultados de la prueba de Ames fueron interpretados según USEPA 712 C 98–247 (1998).
Ensayo con Saccharomyces cerevisiae D7
La cepa D7 de Saccharomyces cerevisiae, proveniente de cultivos en caldo en fase logarítmica tardía de crecimiento, se puso en contacto con agua residual cruda y con sus correspondientes extractos durante 2 y 24 horas a 28° C. Para las determinaciones con agua cruda residual 50 % V/V de muestra, se mantuvieron en contacto con las células durante 2 y 24 horas; en el caso del extracto se ensayaron diluciones al medio y al décimo, equivalentes al 25 % V/V y 5 % V/V respectivamente del extracto 100 veces concentrado. Transcurrido el periodo de incubación, la mezcla se lava y resuspende en solución salina para su inoculación en tres medios mínimos: con isoleucina, triptofano y en medio completo. Finalizado el periodo de incubación se procedió al recuento de las UFC, promediándose los valores obtenidos para cada dilución inoculada. A continuación se calcularon las UFC por mililitro. Las frecuencias de conversión o reversión surgieron de la relación UFC/mL de convertantes o revertantes y UFC/mL totales. Los resultados se consideraron genotóxicos cuando las frecuencias de conversión o de reversión génica mitótica superaron en más de dos veces las frecuencias del testigo.
Este ensayo permite detectar simultáneamente diversos fenómenos genéticos, tales como conversión génica mitótica y mutación reversa (Zimmermann 1979, Lah et al. 2005).
Los resultados obtenidos fueron interpretados según USEPA 712 C 98–232 (1998).
Ensayo de Rec (+/–) con Bacillus subtilis
Se trabajó con Bacillus subtilis PB 1652 (+), cepa salvaje que conserva intactos sus mecanismos de reparación del ADN, y Bacillus subtilis PB 1791 (–), cepa mutante, deficiente en el sistema de reparación por recombinación de la molécula de ADN. La técnica utilizada permitió determinar daños inducidos por las muestras a la molécula de ADN, incluyendo intercalación, ruptura de la molécula de ADN y cambios químicos en las bases nitrogenadas.
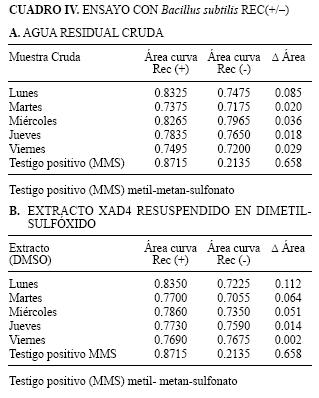
Se utilizó la técnica de eficiencia de plaqueo, con concentraciones 0.05, 0.25 y 0.5 % V/V de agua residual cruda y 5, 25 y 50 % V/V del extracto, de acuerdo a lo descrito por Mazza (1982).
El criterio para evaluar la genotoxicidad en este ensayo se basó en lo descrito por Takigami et al. (2002). Se gráfico la frecuencia de sobrevivencia de las cepas Rec (+) y Rec (–) en función de la concentración de las muestras y se calculó la diferencia de áreas bajo las correspondientes curvas. En estas condiciones pueden considerarse tres rangos de valores de genotoxicidad: más de 0.593 altamente genotóxico (++); entre 0.200 y 0.592 genotóxico (+); entre – 0.123 y 0.199 no genotóxico (–).
RESULTADOS Y DISCUSIÓN
En un trabajo anterior (Paz et al. 2006) se realizaron determinaciones preliminares en una serie de muestras obtenidas en distintos sitios de extracción del Hospital de Clínicas San Martín. Los resultados que se obtuvieron indicaron la necesidad de estudiar las oscilaciones de un periodo más acotado y de correlacionar los datos con la presencia de metales pesados y compuestos orgánicos halogenados totales en las muestras de agua residual.
Un grupo de compuestos capaces de alcanzar concentraciones con efectos tóxicos son los conocidos genéricamente como compuestos orgánicos halogenados totales. Se originan principalmente por el contacto de hipoclorito de sodio con materia orgánica, lo que da como resultado la aparición de trihalometanos (THM), productos organoclorados alifáticos y aromáticos, muchos de ellos genotóxicos (Emmanuel et al. 2004). El Hospital de Clínicas San Martín emplea mensualmente más de tres mil litros de solución al 5% de hipoclorito de sodio para desinfectar grandes superficies como pisos, paredes, sanitarios y para lavado de ropa. La mezcla resultante de esta desinfección, arrastrada por grandes volúmenes de agua corriente, se vierte en forma más o menos continua a los efluentes hospitalarios. Los ensayos de compuestos clorados totales realizados en las muestras de efluentes no mostraron la presencia de cantidades que puedan considerarse significativas desde el punto de vista biológico. Dos son los factores que pueden influir para esta situación: por una parte la gran dilución que sufre el efluente en general y por otra la escasa formación de THM debido a que la solución de hipoclorito no toma contacto directo suficiente tiempo con la materia orgánica, lo cual ocurre si la desinfección con este compuesto se realiza después de lavar las superficies con detergente.
La OMS considera a los metales pesados como una categoría especial de contaminantes químicos con alta toxicidad que pueden aparecer en residuos hospitalarios. Los residuos de mercurio se generan principalmente por los derrames de este metal debidos a la rotura de instrumental utilizado en la clínica. La concentración de este metal debería ser muy baja debido a que los instrumentos con mercurio han sido ya reemplazados, en gran parte, por instrumentos electrónicos. Otra fuente posible de mercurio en agua está dada por el uso de sales de mercurio y compuestos orgánicos de mercurio tanto en el laboratorio como en la desinfección (mercurocromo, bicloruro de mercurio); también en estos casos el uso ha disminuido. El cadmio proviene principalmente del descarte de baterías y podría aparecer en forma ocasional en las aguas. Los compuestos de cromo tienen diversos usos en el laboratorio de análisis clínico y aún se utilizan para la preparación de mezclas destinadas a la limpieza de material de vidrio (mezcla sulfocrómica).
En ninguna de las muestras ensayadas se detectó una concentración a la que pudieran adjudicarse efectos biológicamente significativos de los metales pesados antes mencionados (Cuadro I). En contraste, los datos que se obtuvieron de las muestras del efluente hospitalario evidenciaron valores inferiores a los hallados en efluentes similares por otros autores (Ferreira La Rosa et al. 2000, Kümmerer 2001). Los valores bajos eran previsibles debido a que se estimaba una baja concentración de los compuestos buscados en el agua residual por razones de uso, a los que debería sumarse un importante efecto de dilución por el alto volumen del efluente hospitalario.

Para realizar un correcto estudio de la genotoxicidad en muestras ambientales se requiere utilizar como mínimo dos sistemas biológicos cuyos resultados puedan considerarse complementarios. En este caso, con el objeto de aportar datos para un monitoreo rápido, sencillo y económico aplicable a un efluente como el generado por hospitales, se seleccionaron los siguientes ensayos. El ensayo de Ames, el más difundido, puede considerarse como el ensayo básico para la determinación de mutagenicidad. Los resultados obtenidos en Ames se complementan con los del ensayo REC +/–, que permite determinar la efectividad en la reparación de las alteraciones inducidas al genoma, en particular la intercalación y ruptura de la molécula de ADN y los cambios químicos de las bases nitrogenadas. Por último, el sistema con la levadura Saccharomyces cerevisiae permite determinar la actividad genotóxica de los agentes químicos presentes en la muestra sobre una célula eucarionte y determinar frecuencias de intercambios de segmentos de ADN entre cromosomas.
Los resultados que se obtuvieron en las muestras de agua residual hospitalaria en los tres ensayos para el estudio de genotoxicidad se muestran en las Cuadros II A–B, III A–B y IV A–B. Tanto en el ensayo de Ames como en la prueba con Saccharomyces cerevisiae D7 donde se emplean incubaciones prolongadas, no se detectó actividad tóxica para las células microbianas. Tampoco se detectaron efectos genotóxicos en la mayoría de las muestras de acuerdo a en los ensayos realizados con los tres sistemas. El único resultado positivo se obtuvo en el muestreo del día viernes, con el sistema de Saccharomyces cerevisiae D7 que mostró un efecto genotóxico, con incremento en las frecuencias de conversión génica.

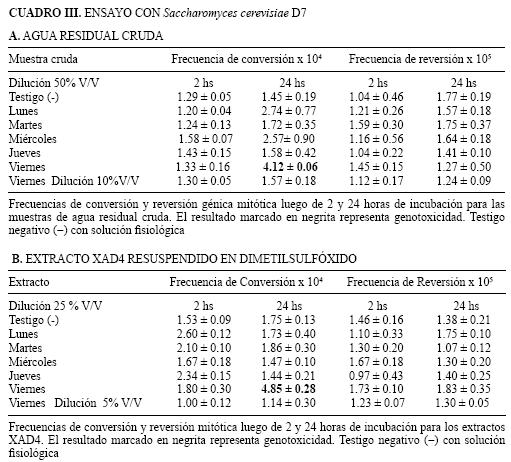
Este efecto pudo evidenciarse tanto en los ensayos con la muestra de agua cruda como en los realizados con el extracto, luego de 24 horas de incubación. En los sistemas de Ames con y sin activación microsomal y Rec con Bacillus subtilis, no se observaron efectos genotóxicos con dicha muestra.
La conversión génica mitótica es un fenómeno asociado a daños importantes en el genoma de Saccharomyces cerevisiae que llevan a activar los sistemas para reparación de la molécula de ADN, produciendo como resultado un intercambio no recíproco de material genético entre cromátides no hermanas. Por otra parte, la inducción de reversión génica mitótica en esta levadura tiene características similares a la que ocurre en bacterias (Zimmermann, 1979). Tal como lo describe Zimmermann (1975), es poco probable que al ensayar una muestra se observe la inducción de ambos fenómenos génicos en forma simultánea. Esto se debe a que los compuestos responsables de la inducción de conversión génica y de reversión génica tienen diferentes características. Si se considera el ensayo de levaduras en relación con los demás sistemas biológicos utilizados, puede comprobarse que con Saccharomyces cerevisiae D7 se dispone de mayor tiempo para el contacto entre las células y agua residual o los extractos. Existe además la posibilidad de ensayar un volumen mayor de muestra. Esas dos variables permitirían aumentar la sensibilidad para detectar genotoxicidad en mezclas complejas como las que pueden generarse en el agua residual hospitalaria.
La gran diversidad de actividades en el hospital de Clínicas San Martín, genera un efluente complejo con una combinación de sustancias cuyo efecto sólo puede ser determinado mediante el uso de distintos sistemas biológicos. Los efectos biológicos de mezclas son por lo general imprevisibles, dado que la actividad genotóxica puede ser atribuida a un conjunto de propiedades e interacciones químicas entre varios compuestos (Moretton et al. 1991, Vargas et al. 1993). El efecto de la mezcla de productos químicos es con frecuencia diferente de lo previsto para los componentes ensayados por separado, ya que pueden observarse sinergismos o antagonismos entre distintos agentes químicos (Moretton et al. 1991, Houk 1992, Vargas et al. 1993, De Marini 1998, Ausley, 2000). La medición del flujo del agua residual en la colectora cloacal (sector Azcuénaga) permitió estimar que el volumen de líquido residual eliminado a lo largo de las 8 horas del muestreo fue de 270 m3. En estas condiciones debe tenerse en cuenta que existe un considerable efecto de dilución para aquellas sustancias que no son eliminadas continuamente. Así, vertidos únicos de concentraciones bajas de agentes genotóxicos, como los citostáticos, pueden alcanzar concentraciones no detectables.
Los resultados hallados en este trabajo mostraron que el riesgo que representa esta fracción de agua residual para el ecosistema es relativamente bajo en lo referente a inducción de genotoxicidad, ya que los valores positivos se detectaron sólo luego de un contacto prolongado entre las células y el agua residual y aun así el efecto desapareció con una dilución fácilmente alcanzable en el sistema cloacal.
Aún con las bajas concentraciones de compuestos tóxicos detectadas en las muestras pudo demostrarse un efecto mutagénico, lo que indica la importancia de utilizar sistemas biológicos en el monitoreo de este tipo de efluentes.
El trabajo realizado en el Hospital de Clínicas San Martín pretende ser una referencia para orientar en la elaboración de normas de procedimientos para la correcta disposición de los vertidos de aguas residuales.
AGRADECIMIENTOS
Agradecemos a la Dra. Alicia Fabricio de Iorio y a su equipo de la Facultad de Agronomía UBA por las determinaciones de metales pesados. Este trabajo fue parcialmente financiado con un subsidio de la Secretaría de Ciencia y Técnica de la Universidad de Buenos Aires. Agradecemos también al Dr. Bruce Ames de la Universidad de Berkeley CA USA, quien gentilmente cedió las cepas de Salmonella typhimurium.
REFERENCIAS
American Public Health Association (APHA) (1998) Standard Methods for the Examination of Water and Waste Water. 20th Edition. Washington DC. [ Links ]
Ausley L.W. (2000). Reflection on whole effluent toxicity: The Pellston workshops. Environ. Toxicol. Chem. 19 (1), 1–2. [ Links ]
Bassi M.D. y Moretton J. (2003). Mutagenicity of antineo–plastic drug residues treated in health care waste autoclave. Bull. Environ. Contam. Toxicol. 71, 170–175. [ Links ]
De Marini D. (1998). Mutation spectra of complex mixtures. Mutat. Res. 411, 11–18. [ Links ]
Dremont C. y Hadjali J. (1997). La gestión des effluents liquides en Milieu Hospitalier. Projet DESS "TBH", UTC, 30. http://www.utc.fr/~farges/DESS_TBH/96-97/Projets/EL/EL.htm (Consulta: 19 agosto 2007). [ Links ]
Dressler M. (1979). Extraction of trace amounts of organic compounds from water with porous organic polymers. J. Chromatogr. 165, 167–206. [ Links ]
Emmanuel E., Keck G., Blanchard J.M., Vermande P., Perrodin Y. (2004).Toxicological effects of disinfections using sodium hypochlorite on aquatic organisms and its contribution to AOX formation in hospital wastewater. Environ. Intern. 30, 891–900. [ Links ]
Emmanuel E., Perrodin Y., Keck G., Blanchard J.M. y Vermande P. (2005). Ecotoxicological risk assessment of hospital wastewater: a proposed framework for raw effluents discharging into urban sever network Journal of Hazardous Materials. 117, 1–11. [ Links ]
Ferreira La Rosa A. M., Moschem Tolfo A., Olinto Monteggia L., Nascimento de Almeida M. M., da Silva Ortolan M. G., Genro Bins M. J., de Almeida Bendati M. M. y Raya Rodriguez M. T. (2000). Gestao de efluentes de serviqos de saúde em Porto Alegre. Anais XXVII Congresso Interamericano de Engenharía Sanitária e Ambiental. ABES Associacao Brasileira de Engenharía Sanitária e Ambiental. VI–037, 1–13. [ Links ]
Houk V. (1992). The genotoxicity of industrial wastes and effluents. A review. Mutat. Res. 277, 91–138. [ Links ]
Kümmerer K. (2001). Drugs in the environment: emission of drugs, diagnostic aids and disinfectants into wastewater by hospitals in relation to other sources – a review. Chemosphere 45, 957–969. [ Links ]
Lah B., Zinko B., Tisler T. y Marinsek–Logar R.M. (2005). Genotoxicity Detection in Drinking Water by Ames Test, Zimmermann Test and Comet Asssay. Acta Chim. Slov. 52, 341–348. [ Links ]
Mazza G. (1982). Bacillus subtilis "rec assay" test with isogenic strains. Appl. Environ. Microbiol. 43, 177–184. [ Links ]
Moretton J., Baro P., Zelazny A. y D'Aquino M. (1991). Polluted water concentrates. Induction of genetic alterations in Saccharomyces cerevisiae D7 strain. Bull. Environ. Contamin. Toxicol. 46, 203–207. [ Links ]
Mortelmans K. y Zeiger E. (2000). The Ames Salmonella / microsome mutagenicity assay. Mutat. Res. 455, 29–60. [ Links ]
Nuñez L. y Moretton J. (2006). Perfil microbiológico y resistencia a desinfectantes en aguas residuales de hospital. Hig. Sanid. Ambient. 6, 197–201. [ Links ]
OPS. Organización Panamericana de la Salud (1993). Nuestro planeta, nuestra salud. Informe de la comisión de salud y medio ambientede la OMS. Publicación científica N° 544. OPS Washington DC 340 p. [ Links ]
Ortolan M. G. S. (1999). Avaliacáo do efluente do Hospital de Clinicas de Pôrto Alegre: citotoxicidade, genotoxicidade, perfil microbiológico de bacterias mesofílicas e resistencia a antibióticos. Porto Alegre UFRGS. Dissertação de Mestrado–Facultade de Agronomía. Universidad Federal de Rio Grande do Sul. Porto Alegre, Brasil, 115 p. [ Links ]
Paz M., Muzio E. H., Gemini V., Magdaleno A., Rossi S., Korol S. y Moretton J. (2004). Aguas residuales de un centro hospitalario de Buenos Aires, Argentina: características químicas, biológicas y toxicológicas. Hig. Sanid. Ambient. 4, 83–88. [ Links ]
Paz M., Muzio H., Mendelson A., Magdaleno A., Tornello C., Balbis N. y Moretton J. (2006). Evaluation of genotoxicity and toxicity of Buenos Aires city hospital wastewaters samples. J. Braz. Soc.Ecotoxicol. 1, 1–6. [ Links ]
Pitot H.C. y Dragan Y.P. (2001). Chemical carcinogenesis. En Casarett and Dowll´s Toxicology. The basic science of poisons. 6th Edition (Klaassen C. D. Ed.). McGraw Hill, New York. Cap.8, pp. 241–319. [ Links ]
Pruess A., Giroult E. y Rushbrook P. (1999). Safe management of wastes from health–care activities. The World Health Organization (WHO–GENEVA). 228 p. [ Links ]
Richardson M. L. y Bowron J. M. (1985). The fate of pharmaceutical chemicals in the aquatic environment. J. Pharm. Pharmacol. 37, 1–12. [ Links ]
Siddiqui A.H. y M. Ahmad (2003). The Salmonella mutagenicity of industrial, surface and ground water samples of Aligarth region of India. Mutat. Res. 541: 21–29. [ Links ]
Stumpf M., Ternes T. A., Wilken Rodrigues S. V. y Baumann W. (1999). Polar drug residues in sewage and natural waters in the state of Rio de Janeiro, Brazil. The Science of the Total Environment. 225, 135–141. [ Links ]
Takigami H., Matsui S., Matsuda T. y Shimizu Y. (2002). The Bacillus subtilis rec–assay: a powerful tool for the detection of genotoxic substances in the water environment. Prospect for assessing potential impact of pollutants from stabilized wastes. Waste Management. 22, 209–213. [ Links ]
USEPA (1996). United States Environmental Protection Agency. Method 3510 C. Method. separatory funnel liquid–liquid–extraction. 8 p. [ Links ]
USEPA (1998). United States Environmental Protection Agency. Health Effects Test Guidelines: OPPTS 870.5100. Bacterial Reverse Mutation Test. EPA 712 C– 98–247. 11 p. [ Links ]
USEPA (1998). United States Environmental Protection Agency. Health Effects Test Guidelines: OPPTS 870.5575. Mitotic Gene Conversion in Saccharomyces cerevisiae. EPA 712 C 98–232. 4 p. [ Links ]
USEPA (1998). United States Environmental Protection Agency. Method 8270 C. Analysis method GC/MS. 54 p. [ Links ]
Vargas V.M.F., Motta V.E.P. y Henriques J.A.P. (1993). Mutagenic activity detected by the Ames test in river water underthe influence of petrochemical industries. Mutat. Res.319, 31–45. [ Links ]
Wurgler F. y Kramers P. (1992). Environmental effects of genotoxins. Mutagenesis. 7, 321–327. [ Links ]
Zimmermann F. K. (1979). Procedures used in the induction of mitotic recombination and mutation in the yeast Saccharomyces cerevisiae. En: Handbook of Mutagenicity Tests Procedures (Kilby B.J., Legator M., Nicols W y Ramel C., Ed.). Elsevier, Ámsterdam. pp. 119–134. [ Links ]
Zimmermann F. K., Kern R. y Rasenberger H. (1975). A yeast strain for simultaneous detection of induced mitotic crossing–over, mitotic gene conversion and reverse mutation. Mutat. Res. 28, 381–388. [ Links ]














