Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.24 no.1 Ciudad de México ene./mar. 2008
MODELACIÓN MATEMÁTICA DE LA REACCIÓN DE EVOLUCIÓN DEL HIDRÓGENO
UTILIZANDO HCLO4 Y H2SO4 COMO ELECTROLITOS
Mathematical modeling of hydrogen evolution reaction in percloric and sulfuric acid solutions
Laura ORTEGA–CHÁVEZ1,2, Eduardo HERRERA–PERAZA2, Gabriel ALONSO–NÚÑEZ2, Luisa MANZANAREZ–PAPAYANOPOULOS3, Ysmael VERDE–GÓMEZ4, Arturo KEER–RENDÓN
1 Instituto Tecnológico de Chihuahua II, Av. De las Industrias 11101, Chihuahua, Chih., México
2 Centro de Investigación en Materiales Avanzados, Miguel de Cervantes 120, Complejo Industrial Chihuahua,
C.P. 31109, Chihuahua, Chih. México.
3 PROFEPA, Carretera Picacho–Ajusco 200, Col. Jardines en la Montaña, Deleg.Tlalpan, C.P. 14210, México D.F., México
4 Instituto Tecnológico de Cancún, Av. Kabah Km. 3, Cancún, Quintana Roo, México
(Recibido mayo 2007, aceptado enero 2008)
RESUMEN
Las celdas de combustible constituyen en la actualidad una de las principales tecnologías que son objeto de continuas investigaciones en la búsqueda de fuentes alternativas de energía, cuyo impacto al ambiente sea mínimo. Sin embargo la utilización de esta tecnología, se ha visto limitada por factores tales como el elevado costo de los distintos componentes que conforman una celda de combustible. Por ejemplo, el platino empleado por excelencia como el mejor catalizador para llevar a cabo la reacción química entre hidrógeno y oxígeno, responsable de la producción de energía eléctrica. En la búsqueda de la optimización o sustitución del platino, es importante contar con una metodología que permita realizar un diagnóstico in situ del estado de dicho catalizador. Este diagnóstico involucra aspectos tales como la determinación de los sitios activos y la carga y la degradación que el catalizador puede ir sufriendo durante el funcionamiento de la celda. El presente trabajo consiste en el desarrollo de un modelo matemático que alimentado con las constantes de velocidad y los fenómenos involucrados en la reacción de la evolución del hidrógeno, produce como datos de salida, las curvas de polarización (E vs I) y de espectroscopia de impedancia electroquímica para dicha reacción. Se consideró para la modelación, al Pt monocristalino preferenciado en las direcciones (111) y (100) como catalizador y usando diversos ácidos como electrolitos. Las curvas obtenidas con el algoritmo matemático muestran una correlación de la influencia del tipo y concentración de los ácidos usados como electrolitos y la densidad de corriente eléctrica debido a la evolución del H2. Finalmente, este modelo deja abierta la posibilidad de explorar el efecto del cambio en los valores de las variables involucradas en las reacciones de una celda de combustible, lo que nos permitirá evaluar in situ el estado y comportamiento del catalizador.
Palabras clave: celdas de combustible, catalizador, platino, evolución del hidrógeno, curvas de polarización, impedancia electroquímica.
ABSTRACT
Fuel cells constitute at the present time, one of the main technologies that are object of continuous investigations in the search of alternative power sources with a minimum environmental impact. Nevertheless, the use of fuel cell technology has been limited by factors such as the high cost of the different components from which a fuel cell is constituted. One of such components is platinum, used because it is the best catalyst to carry out the electrochemical reaction between hydrogen and oxygen, responsible for the production of electrical energy. In the search of the optimization and/or substitution of platinum, it is important to count on a methodology that allows to make a diagnosis in situ of the state of the catalyst. This diagnosis involves aspects such as: the determination of the active sites, and loads and degradation that the catalyst can suffer during the operation of the cell. The present work consists of the development of a mathematical model that fed with the rate constants and the phenomena involved in hydrogen evolution reaction, produces like output data, the polarization curves (E vs I) and electrochemical impedance spectroscopy for this reaction. The monocrystalline Pt(111) and Pt(100) were considered like catalyst and diverse acids were used like electrolytes. The curves obtained with the mathematical algorithm show a correlation between the influence of the type and concentration of acids used like electrolytes and the current density due to the evolution of H2. Finally, this model leaves an open possibility to explore the effect of different values involved in the reactions of a fuel cell, which will allow us to evaluate in situ the state and behavior of the catalyst.
Key words: fuel cells, catalyst, platinum, polarization curves, electrochemical impedance
INTRODUCCIÓN
La generación de electricidad a partir de derivados del petróleo ha contribuido en mucho a la contaminación en las grandes metrópolis, así como a los cambios climáticos, al efecto invernadero y la pérdida de la biodiversidad, entre otros problemas ambientales (Verde 2003).
Es por ello la creciente preocupación mundial por la búsqueda de tecnologías de producción de energía renovable y ambientalmente más amigable.
Dentro de estas tecnologías se encuentran las celdas de combustible que representan una opción limpia en la generación de energía, pues al ser puestas en operación, en la mayoría de las veces su principal producto es agua pura y no involucran la utilización directa de recursos no renovables (como los combustibles a base de fósiles), ya que utilizan uno de los elementos más abundantes de nuestro planeta: el hidrógeno.
Sin embargo la utilización de esta tecnología para la producción de electricidad en forma comercial se encuentra aún en una etapa de desarrollo. El costo de producción de energía a partir de celdas de combustible aún no logra competir con los costos de producción de electricidad por métodos convencionales (Verde 2003, Baird et al. 2003).
El uso de materiales y procesos de fabricación caros y la necesidad de crear una nueva infraestructura para la generación, transporte y distribución del hidrógeno, son algunos de los aspectos principales por los cuales no se ha logrado implementar el uso de esta tecnología de manera amplia. Todos estos obstáculos están siendo objeto de arduas investigaciones con el fin de hacerles frente.
Sin embargo, existen otros aspectos considerados puntos importantes de estudio. Uno de ellos se refiere a las técnicas empleadas para verificar la eficiencia del catalizador utilizado para el funcionamiento de la celda de combustible.
Las técnicas analíticas convencionales pueden caracterizar las propiedades del catalizador en forma ex situ, pero una vez que dicho catalizador ha sido aplicado sobre el electrodo y fabricado el ensamble, es necesaria la utilización de técnicas electroquímicas para su caracterización in situ, e. g. las curvas corriente – potencial (Bender et al. 2003), voltametría cíclica (Pozio et al. 2002), espectroscopia de impedancia electroquímica (EIS) (Ciureanu et al. 2003), entre otras.
La reacción de evolución del hidrógeno (HER, por sus siglas en inglés) y la adsorción del mismo, son dos de los procesos más ampliamente estudiados. En las celdas de combustible basadas en H2, la comprensión del estado químico y electrónico de las especies adsorbidas sobre la superficie del electrocatalizador es de vital importancia ya que es la interacción entre el substrato y el hidrógeno la que determina la eficiencia de la reducción del oxígeno.
Por otro lado en la electrólisis del agua, uno de los procesos electroquímicos más antiguos utilizado para producir gas hidrógeno de alta pureza, los estados químico y electrónico del hidrógeno electroadsorbido afectan ambos el mecanismo y la cinética de la reacción, dando lugar a una densidad de corriente de intercambio y a una pendiente de Tafel, las cuales son características del material del electrodo (Jerkiewicz 1998).
Diversos estudios se han llevado a cabo para la simulación de la evolución del H2 en platino monocristalino y policristalino (Bai et al. 1987), o en varios metales (Conway y Jerkiewicz 2002); sin embargo es poco lo encontrado en platino soportado en carbón (Wang et al. 2001). Los modelos obtenidos con EIS relacionan las reacciones que se llevan a cabo con elementos de circuitos electrónicos (Harrington y Van Den Driessche 1999), pero este enfoque puede oscurecer el significado real de ciertos fenómenos presentes en el proceso.
Existen otros estudios de la reacción HER sobre distintos metales (Pd, Pt, Ni, Re, Au, Ir) y aleaciones (Pt– Rh) (Chung et al. 2002–2006) en donde se hace una caracterización de dichos sistemas de manera empírica a través de EIS, mas no haciendo una comprobación fundamentada en argumentos electroquímicos (Lasia 2005), es decir, se establece una relación cualitativa entre ciertas variables, basándose exclusivamente en resultados experimentales, sin hacer consideraciones teóricas o numéricas.
El presente trabajo propone el desarrollo de una metodología para la caracterización del comportamiento del o los catalizadores soportados en carbón que pueden ser utilizados en una celda de combustible de membrana polimérica de intercambio iónico, empleando para ello una modelación matemática de los fenómenos involucrados en la reacción de evolución del hidrógeno. Los datos de entrada del modelo son alimentados a partir de datos teóricos y experimentales de otros autores.
MATERIALES Y MÉTODOS
Caracterización de Pt/C por medio de rayos X
Se analizó una muestra comercial de Pt/C al 20 % marca ETEK, en un difractómetro de rayos X, marca Philips modelo X'Pert. El difractómetro fue operado en el modo "step" de 10 segundos con un paso de 0.05 en el rango de 15 a 90° (2θ).
Posteriormente se utilizó el método de Rietveld para refinar los datos obtenidos, empleando el paquete computacional FullProf, con el cual se determinaron las orientaciones cristalográficas de los planos preferenciales, el tamaño de cristalita de Pt, así como la composición de Pt/C expresada en porciento en peso.
Condiciones del modelo
Debido a la gran disponibilidad de software que actualmente existe en el mercado, la técnica de simulación es una herramienta cada vez más empleada en el análisis de sistemas. Entre las ventajas que presenta la modelación, es que permite estudiar el efecto de cambios internos y externos del sistema y observar los efectos de estas alteraciones, dando la posibilidad de un mejoramiento de éste (Coss 1986). Puede detectar las variables más importantes y sus interrelaciones y ayudar a entender mejor la operación del sistema. Además permite la inclusión de fenómenos complejos dentro de un esquema más simplificado.
Dentro de las consideraciones que se establecieron en el planteamiento inicial de este trabajo, está la difusión de los iones hidrógeno desde la solución hacia el electrodo, seguida por su adsorción en los sitios activos del catalizador (Harrington y Van den Driessche 2001), es decir, se supone que los iones hidrógeno son la única especie adsorbida. Posteriormente, hay una recombinación de los iones H+, los electrones provenientes del ánodo y los átomos de hidrógeno, para formar así moléculas de hidrógeno, las cuales son difundidas finalmente desde el electrodo hacia la solución (Harrington 1996).
La inclusión de la difusión de los iones hidrógeno desde la solución hacia el electrodo es un planteamiento novedoso de este trabajo, ya que permite manejar concentraciones diluidas del electrolito y no se ha encontrado evidencia de simulaciones que tomen en cuenta este punto.
Adicionalmente se lleva a cabo la simulación de la reacción HER desde la óptica de dos técnicas electroquímicas distintas como son las curvas de polarización (E vs I) e impedancia electroquímica (Harrington y Conway 1987, Bai et al. 1987). Se consideran como electrolitos al ácido perclórico y al ácido sulfúrico. Éste último ha sido utilizado como electrolito en estudios electroquímicos, pero se ha encontrado que existe una coadsorción de los iones HSO4 en la superficie del platino (Zolfaghari y Jerkiewicz 1999, Conway y Jerkiewicz 2002, Blum et al. 2003, Lasia 2004), por lo cual se plantea la necesidad del uso de soluciones más diluidas de este ácido, o bien la posibilidad de utilizar ácido perclórico, cuyo ión perclorato no se adsorbe tan fuertemente al platino en la región del potencial de interés.
Por ultimo, se consideró a la espectroscopía de impedancia electroquímica como la técnica electroquímica principal a ser utilizada en la simulación teórica, ya que la técnica es capaz de relacionar propiedades físicas, químicas y mecánicas con las propiedades eléctricas de los materiales, así como caracterizar su comportamiento y predecir su vida útil, ayudando al mejoramiento de los procesos de fabricación de dichos materiales. EIS es una técnica no destructiva, que se puede utilizar bajo condiciones de operación.
Los valores utilizados en la simulación de la reacción HER para las curvas E vs I e impedancia se muestran en el cuadro I cuando se usa el ácido perclórico como electrolito y en el cuadro II para el ácido sulfúrico. En ambos tipos de ácido la simulación se llevó a cabo variando la frecuencia desde 0.1 Hz hasta 30 kHz.
Los modelos matemáticos fueron programados a través de los paquetes computacionales MAPLE y MATLAB.


Reacción de evolución del hidrógeno
El mecanismo generalmente propuesto para la reacción de evolución del hidrógeno (Harrington y Conway 1987, Lasia 2002), consta de tres pasos. El primero de ellos se muestra en la ecuación 1, que es la adsorción del protón en la superficie del electrodo (en nuestro caso en la superficie del catalizador); el segundo paso es una desorción electroquímica del hidrógeno, llamada reacción de Heyrovsky mostrada en la ecuación 2; y el tercer paso puede llevarse a cabo o no ya que representa una desorción química (sin transferencia de electrones) del mismo hidrógeno (ecuación 3).



DESARROLLO
Se calculan primeramente las velocidades de reacción de los pasos de Volmer, Heyrovsky y Tafel mostradas en las ecuaciones 1, 2 y 3, incluyendo la fracción de superficie cubierta por el hidrógeno. Posteriormente se hace un balance de corriente producida por la transferencia de electrones, un balance de superficie cubierta por el ion hidrógeno y un balance de masa de las especies difundida para llegar finalmente a las funciones de la corriente–potencial e impedancia, todo esto haciendo uso del modelo matemático propuesto.
Desarrollo matemático
De acuerdo al trabajo desarrollado por Lasia (2002), pero con la diferencia de considerar un medio ácido (por la aplicación que se pretende en las celdas tipo PEM), las velocidades de reacción para las reacciones expresadas en las ecuaciones 1, 2 y 3, se muestran en las ecuaciones 4, 5 y 6, respectivamente:



En donde:
ki00 es la constante de velocidad estándar de la reacción i
CH+ y CH2 son las concentraciones de iones hidrógeno e hidrógeno molecular respectivamente, en mol l –1
E0i potenciales de electrodo estándar de la reacción i, en volts
ΓH concentración de H adsorbido en la superficie del electrodo
Γs sitios libres, en mol cm–2
αi, coeficiente de simetría de la reacción i
También se definen las siguientes ecuaciones:



En donde:
θ es la fracción de superficie cubierta por el hidrógeno adsorbido
ΓH,max es la máxima concentración de hidrógeno adsorbido en la superficie
E es el potencial aplicado, en volts
Eeq es el potencial de equilibrio, en volts
η es el sobrepotencial, en volts
Las concentraciones del H+ y del H2 que aparecen en las ecuaciones de velocidad (ecuaciones 4, 5 y 6) son las correspondientes a la superficie del electrodo, las cuales se suponen diferentes a las concentraciones en la solución para las mismas especies.
Si suponemos condiciones de equilibrio, en el potencial de equilibrio Eeq, las velocidades netas de las reacciones son nulas y las siguientes relaciones son obtenidas (Lasia 2002):
v1 = v2 = 3= 0
Tomando en cuenta que:
E–E0i = E– Eea+Eea–E0i= η + Eea– E0i
Sustituyendo en las ecuaciones 4, 5 y 6 y simplificando, se obtienen las ecuaciones 10, 11 y 12:



Se tomó en cuenta la concentración de hidrógeno adsorbido en la superficie del electrodo dentro del valor de las constantes k01, k02, y k03
Agrupando los pasos de reacción de acuerdo a los distintos fenómenos que se relacionan con la corriente generada tendremos:
1. Las ecuaciones que relacionan la corriente generada debido a la transferencia de electrones en función de las constantes de velocidad, agrupadas en una nueva función que llamaremos r0 (podríamos definirla como una velocidad total de transferencia de electrones) mostrada en la ecuación 13:

2. Las ecuaciones que relacionan la superficie cubierta por el ión hidrógeno adsorbido, agrupadas en la función r1 (velocidad total de adsorción del ion hidrógeno) definida en la ecuación 14:

3. Las ecuaciones que relacionan la corriente generada debido a los flujos de las especies difundidas en función de las concentraciones de dichas especies, se agrupan en dos funciones, una para el hidrógeno molecular r2, y la otra para los iones hidrógeno (r3 = –r0) las cuales se muestran en las ecuaciones 15 y 16 respectivamente:


Para la velocidad total de transferencia de electrones tenemos en la ecuación 17:

donde F es la constante de Faraday.
Derivando parcialmente cada una de las ecuaciones 13 – 17 con respecto a q, CH+, CH2 y h y haciendo lineales las ecuaciones resultantes, obtenemos las ecuaciones 18, 19, 21 y 23

En el balance de masa del ión hidrógeno adsorbido:
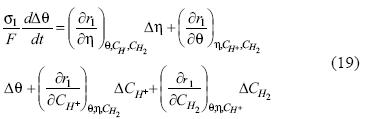
En donde S1 es la carga necesaria para lograr la cobertura de una monocapa por el hidrógeno adsorbido.
Para la corriente en función de los flujos de las especies difundidas, en el caso del hidrógeno molecular se tiene que:
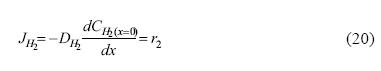
Donde JH2 es el flujo de hidrógeno disuelto y DH2 es el coeficiente de difusión del hidrógeno molecular.

Para el ión hidrógeno:
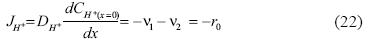
Donde JH+ es el flujo del ion hidrógeno y DH+es el coeficiente de difusión del mismo.

Utilizando fasores y siguiendo el procedimiento de Lasia (2002), para cada una de las variables consideradas, se sustituyen en las ecuaciones 18 y 19. Simplificando se obtienen las ecuaciones 24 y 25:

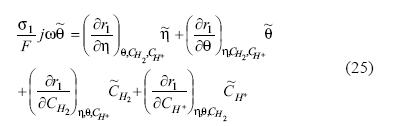
El flujo difusional para el hidrógeno molecular, para el electrodo de disco rotatorio, considerando difusión de longitud finita y condiciones transmisivas (Lasia 1999), se define en forma de fasores con la relación mostrada en la ecuación 26:
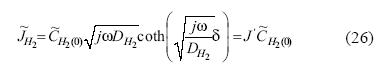
donde  H2(0) es el fasor de concentración para el hidrógeno molecular en la superficie del electrodo.
H2(0) es el fasor de concentración para el hidrógeno molecular en la superficie del electrodo.
De la misma manera se muestra en la ecuación 27 el flujo difusional para el ion hidrógeno H+:
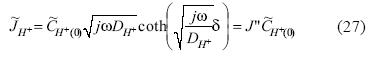
Sustituyendo 26 y 27 en 21 y 23 respectivamente:


Dividiendo cada ecuación entre 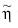 tendremos el siguiente sistema de ecuaciones:
tendremos el siguiente sistema de ecuaciones:


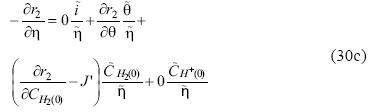
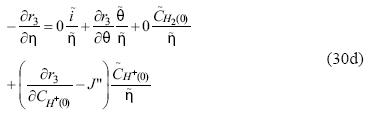
Resolviendo el sistema de ecuaciones 30a – 30d para la primera incógnita obtenemos la admitancia faradaica dada por la ecuación 31

cuya inversa representa la impedancia faradaica mostrada en la ecuación 32

Simulación de las curvas corriente–potencial
Para la simulación de las curvas corriente–potencial (E vs I) se consideran únicamente los pasos que involucran transferencia de electrones (Volmer y Heyrovsky) mostrada en las ecuaciones 1 y 2 y la ecuación 13, separando la corriente producida en cátodo (ecuaciones 33 y 34) y ánodo (ecuaciones 35 y 36) respectivamente como:
Corriente catódica

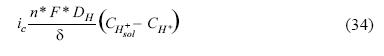
Corriente anódica

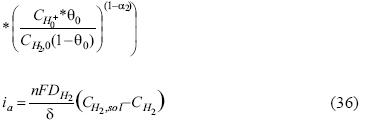
Resolviendo simultáneamente las ecuaciones 33 y 34, así como 35 y 36 se obtienen los valores correspondientes a las corrientes catódica, anódica (ic e ia ), y las concentraciones de ión hidrógeno e hidrógeno molecular (CH+ y CH2), las cuales se podrán alimentar al modelo propuesto para obtener las gráficas de E vs I.
Simulación de los espectros de impedancia (diagrama de Nyquist)
Como se mencionó anteriormente, resolviendo el sistema de ecuaciones diferenciales para la primera incógnita obtenemos la admitancia faradaica cuya inversa es la impedancia faradaica mostrada en la ecuación 37:

Cabe aclarar que solamente se está tomando en cuenta la impedancia faradaica por lo cual se deberá considerar posteriormente la inclusión de la resistencia de la solución (Rs), así como la capacitancia de la doble capa eléctrica (Cdl).
DISCUSIÓN
Para la simulación de la reacción HER se consideraron datos experimentales de fracción de superficie cubierta por el hidrógeno adsorbido, extraídos de isotermas de adsorción determinadas por Lasia (2004) en platino monocristalino Pt(111) y Pt(100) usando ácido perclórico y sulfúrico como electrolito. Consideramos adecuada la utilización de estos datos ya que al hacer el análisis de la muestra de Pt/C al 20 %, se encontró al Pt(111) como plano preferencial, con cristalitas de Pt de tamaño promedio aparente de 13.91 angstroms.
En la figura 1 se observa de izquierda a derecha un primer pico ancho a aproximadamente 25°, el cual se asocia al carbón Vulcan que es el material soporte del platino. El segundo pico a 39.8° corresponde al Pt(1 11), observándose que es el que presenta mayor altura. Los otros tres picos son característicos del Pt(200) a 46°, Pt(220) a 67.5°, Pt(311) a 81.3° y Pt(222) casi imperceptible, a 85.7°, concordando estos resultados con lo obtenido por Pozio et al. (2002).

Además se verificó la composición de la muestra dando valores de 79.57 % de carbón y 20.43 % de platino.
La figura 2 muestra la simulación obtenida para una curva de polarización (E vs I), utilizando los valores obtenidos por Harrington y Conway (1987) y Lasia (2004), considerando ácido perclórico 0.1 M como electrolito y suponiendo una adsorción preferencial en el plano cristalino Pt(111). La forma de dicha figura es similar a las encontradas en otras simulaciones para la reacción HER (Bai et al. 1987).
Esta curva nos proporciona los datos de potenciales asociados a densidades de corriente, como muestra el punto a un sobrepotencial de 140 mV y una densidad de corriente de 0.01118 A en la figura 2, los cuales fueron obtenidos al resolver simultáneamente las ecuaciones 33 a 36, calculando adicionalmente las concentraciones CH+ y CH2.

La figura 3 muestra la simulación obtenida para una curva E vs I utilizando los valores obtenidos también de Harrington y Conway (1987) y Lasia (2004), considerando ácido sulfúrico 0.5 M como electrolito y tomando los datos para el plano cristalográfico Pt(100). Como ya se mencionó, se sabe que al utilizar H2SO4 como electrolito, la región de potencial correspondiente a la adsorción del hidrógeno sobre el Pt(111) se traslapa con la región de adsorción del ión sulfato, haciendo por lo tanto imposible separar la contribución de cada especie (Lasia 2004). En cambio, sí es posible obtener las isotermas correspondientes al Pt(111) en ácido perclórico ya que el anión ClO4– es mucho mas débilmente adsorbido en el Pt que el ión H+ y los voltamogramas resultantes muestran claramente las contribuciones de cada una de las especies. Esta es la razón por la cual se utilizan las isotermas de adsorción en ácido perclórico y no en sulfúrico para el plano Pt(111), que como ya se mencionó de acuerdo a estudios de rayos X, resulta ser el plano preferencial en el diagrama de difracción de Pt/C.
También se ha encontrado que la región de potencial correspondiente a la adsorción del hidrógeno se separa de la región característica del anión si se utilizan concentraciones muy bajas de H2SO4 aun para Pt(111) (Zolfaghari y Jerkiewicks 1999), haciendo que el fenómeno de difusión de protones sea de considerable importancia. Esta última observación resulta interesante ya que nuestra modelación tiene la posibilidad de manipular distintas concentraciones de electrolito.
Al igual que en la figura 2, la curva de la figura 3 nos muestra la relación entre los potenciales y las correspondientes densidades de corriente (ver el punto en el sobrepotencial de 366 mV y 0.2314 A en la figura 3).
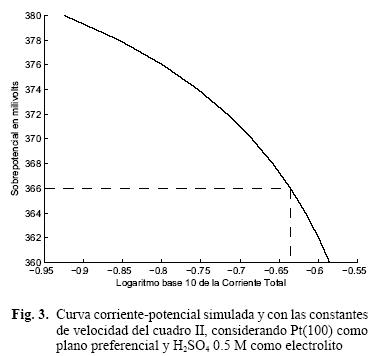
Según Lasia (2004) existen distintas interacciones entre los protones adyacentes adsorbidos en la superficie del platino, cuando se utiliza ácido perclórico y ácido sulfúrico, mostrando interacciones repulsivas entre los H+ para el HClO4 y atractivas para el H2SO4.
Esto explica en parte, las diferencias en la tendencia de las curvas así como en las densidades de corriente mostradas en la figura 2 y la figura 3, siendo superior la densidad de corriente para el ácido sulfúrico.
La figura 4 muestra la simulación obtenida para la impedancia faradaica, utilizando el sobrepotencial η =140 mV, tomando los valores calculados para la curva de la figura 2. En tanto que la figura 5 representa el espectro de impedancia resultante de aplicar un sobrepotencial de η = 366 mV tomando los datos obtenidos para la curva de la figura 3.


Las curvas de impedancia simuladas (diagramas de Nyquist), permiten obtener los principales parámetros eléctricos, asociados a los fenómenos electroquímicos que se quieren modelar, de tal forma que pueden ser comparados posteriormente con datos experimentales, produciéndose un proceso iterativo de prueba y error. Estos parámetros son la resistencia de la solución (Rs), la resistencia a la polarización (Rp), la capacitancia correspondiente a esta última resistencia (C) y el ángulo máximo de desfasamiento (θmax) (ver figura 4 y figura 5).
Los valores de la impedancia real (eje x) en el espectro de impedancia de la figura 4 (para HClO4) son superiores a los observados en la figura 5 (para H2SO4) mostrando un resultado lógico debido a la menor densidad de corriente obtenida con el ácido perclórico.
CONCLUSIONES
Se llevó a cabo la modelación matemática de los fenómenos involucrados en la reacción de evolución del hidrógeno, utilizando los programas computacionales MAPLE y MATLAB; los modelos fueron alimentados con datos experimentales tomados de trabajos previos. Se obtuvieron simulaciones de gráficas E vs I e impedancia electroquímica (diagramas de Nyquist). Las condiciones utilizadas para la corrida del modelo fue usando como electrolitos al ácido perclórico 0.1 M y al ácido sulfúrico 0.5 M. Para el ácido perclórico se consideró el Pt(1 11) como el plano cristalográfico preferencial para la adsorción del hidrógeno, mientras que en el caso del ácido sulfúrico se tomó el Pt(100).
No se encontró diferencia entre los resultados obtenidos al correr el modelo en ambos programas, siendo mucho más fácil la alimentación de los datos en MATLAB y menor el tiempo de cómputo.
Debido a que la difusión de los iones H+ hacia el electrodo no es tomada en cuenta en ninguna de las referencias bibliográficas en las cuales nos basamos, no hemos encontrado simulaciones que consideren este proceso, lo cual hace novedoso este modelo.
La curva de polarización para el ácido sulfúrico muestra una mayor densidad de corriente (eje X) que la correspondiente al ácido perclórico, así como una tendencia diferente en cada ácido, resultado que se atribuye en parte a las diferentes interacciones de los protones adsorbidos en el Pt al ser sometidos a distintos electrolitos. De igual manera el valor de la impedancia real (eje X) en el diagrama de impedancia se observa mayor para el ácido perclórico que para el ácido sulfúrico, lo cual es congruente con la menor densidad de corriente obtenida para el primer ácido.
Los resultados anteriores muestran que la metodología desarrollada permite la manipulación de variables como son la concentración de catalizador, el potencial aplicado y distintos tipos y concentración de electrolitos, con lo cual se abre la posibilidad de caracterizar distintos catalizadores obteniendo importantes parámetros electroquímicos necesarios para el desarrollo de uno de los aspectos tecnológicos clave en las celdas de combustible.
AGRADECIMIENTOS
Queremos mostrar nuestro agradecimiento al Instituto Tecnológico de Chihuahua II, al Consejo Nacional de Ciencia y Tecnología (CONACyT) y al Gobierno del Estado de Puebla por el Proyecto bajo registro No. PUE–2004–CO2–13.
REFERENCIAS
Bai L., Harrington D.A. y Conway B.E. (1987). Behavior of overpotential–Deposited Species in Faradaic Reactions– II. ac Impedance Measurements on H2 Evolution Kinetics at Activated and Unactivated Pt Cathodes. Electrochim. Acta. 32, 1713–1731. [ Links ]
Baird D.G. Huang J. y McGrath J. E. (2003). Polymer Electrolyte Membrane Fuel Cells: Opportunities for Polymers and Composites. Plastics Eng. 59, 46–55 [ Links ]
Bender G., Wilson M. S. y Zawodzinski T.A. (2003). Further refinements in the segmented cell approach to diagnosing performance in polymer electrolyte fuel cells. J. Power Sources. 123, 163–171. [ Links ]
Blum L., Marzari N. y Car R. (2003). On the mechanism of the hydrogen/platinum (111) fuel cell. http://preprint.chemweb.com/physchem/0305011. [ Links ]
Chung J.H., Ra K.H. y Kim N.Y. (2002). Qualitative Analysis of the Frumkin Adsorption Isotherm of the Over–Potentially Deposited Hydrogen at the Poly–Ni/ KOH Aqueous Electrolyte Interface Using the Phase–Shift Method. J. Electrochem. Soc. 149, E325–E330. [ Links ]
Chung J.H. y Jeon S.K. (2003). Determination of equilibrium constant and standard free energy of the over–potentially deposited hydrogen for the cathodic H2 evolution reaction at the Pt–Rh alloy electrode interface using the phase–shift method. Int. J. Hydrogen Energy 28, 1333–1343. [ Links ]
Chung J. H., Ra K. H. y Kim N. Y. (2003). Langmuir Adsorption Isotherms of Overpotentially Deposited Hydrogen at Poly–Au and Rh/H2SO4 Aqueous Electrolyte Interfaces. J. Electrochem. Soc. 150, E207–E217. [ Links ]
Chung J.H., Jeon S.K., Kim B.K. y Chun J.Y. (2005). Determination of the Langmuir adsorption isotherms of under– and over–potentially deposited hydrogen for the cathodic H2 evolution reaction at poly–Ir/aqueous electrolyte interfaces using the phase–shift method. Int. J. Hydrogen Energy. 30, 247–259. [ Links ]
Chung J.H. y Kim N.Y. (2006). The phase–shift method for determining adsorption isotherms of hydrogen in electrochemical systems. Int. J. Hydrogen Energy. 31, 277–283. [ Links ]
Ciureanu M., Mikhailenko S.D. y Kaliaguine S. (2003). PEM fuel cells as membrane reactors: kinetic analysis by impedance spectroscopy. Cat. Today. 82, 195–206. [ Links ]
Conway B.E. y Jerkiewicz G. (2002). Nature of electrosorbed H and its relation to metal dependence of catalysis in cathodic H2 evolution. Solid State ionic 150, 93–103. [ Links ]
Coss R. (1986). Simulación: Un enfoque práctico. Limusa, México, 11p. [ Links ]
Costamagna P. y Srinivasan S. (2001). Quantum jumps in the PEMFC science and technology from the 1960 to the year 2000. Part I. Fundamental scientific aspects. J Power Sources. 102, 242–252. [ Links ]
Harrington D.A. y Conway B.E. (1987). ac Impedance of Faradaic Reactions Involving Electrosorbed Intermediates– I. Kinetic Theory. Electrochim Acta. 32, 1703–1712. [ Links ]
Harrington D.A. (1996). Electrochemical impedance of multistep mechanisms: mechanisms with diffusing species. J. Electroanal. Chem. 403, 11–24. [ Links ]
Harrington D. A., Van den Driessche P. (1999). Impedance of multistep mechanisms: equivalent circuits at equilibrium. Electrochim. Acta. 44, 4321–4329. [ Links ]
Harrington D.A. y Van den Driessche P. (2001). Stability and electrochemical impedance of mechanisms with a single adsorbed species. J. Electroanal. Chem. 501, 222–234. [ Links ]
Jerkiewicz G. (1998). Hydrogen sorption at/in electrodes. Progress in Surface Science, 57, 137–186. [ Links ]
Lasia A. (1999). Electrochemical Impedance Spectroscopy and Its Applications. En: Modern Aspects of Electrochemistry. (B. E. Conway, J. Bockris, R.E. White Edts.). Kluwer Academic/Plenum Publishers, New York, Vol. 32, pp. 143–248. [ Links ]
Lasia A. (2002). Applications of the Electrochemical Impedance Spectroscopy to Hydrogen Adsorption, Evolution and Absorption into Metals. En: Modern Aspects of Electrochemistry. (B. E. Conway y R.E. White, Edts.). Kluwer/Plenum, New York, vol. 35, pp. 1–49. [ Links ]
Lasia A. (2004). Modeling of hydrogen upd isotherms. J. Electroanal. Chem. 562, 23–31 [ Links ]
Lasia A. (2005). Comments on: The phase–shift method for determining Langmuir adsorption isotherms of over–potentially deposited hydrogen for the cathodic H2 evolution reaction at poly–Re/aqueous electrolyte interfaces [Hydrogen Energy 30 (2005) 485–499]. Int. J. Hydrogen Energy. 30, 913–917. [ Links ]
Pozio A., De Francesco M., Cemmi A., Cardellini F. y Giorgi L. (2002). Comparison of high surface Pt/C catalysts by cyclic voltammetry. J. Power Sources 105, 13–19 [ Links ]
Verde Y. (2003). Electrocatalizadores de Pt/C y RuS2 para la oxidación de hidrógeno en las Celdas de Combustible de Polímero intercambiador de Protones. Tesis doctoral, CIMAV Chih. 1–5. [ Links ]
Wang X. Hsing I.M., Leng Y.J. y Yue P.L. (2001). Model interpretation of electrochemical impedance spectroscopy and polarization behaviour of H2/CO mixture oxidation in polymer electrolyte fuell cells. Electrochim. Acta 46, 4397–4405. [ Links ]
Wilson M. S. y Gottesfeld S. (1992). Thin film catalyst layers for polymer electrolyte fuel cell electrodes. J. App. Electrochem. 22, 1. [ Links ]
Zolfaghari A. y Jerkiewicz G. (1999). Temperature–dependent research on Pt (111) and Pt(100) electrodes in aqueous H2SO4. J. Electroanal. Chem. 467, 177–185. [ Links ]














