Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.23 no.3 Ciudad de México jul./sep. 2007
Revisiones
CONTAMINACIÓN DE MANGLARES POR HIDROCARBUROS Y ESTRATEGIAS DE BIORREMEDIACIÓN, FITORREMEDIACIÓN Y RESTAURACIÓN
Hydrocarbon mangroves pollution and bioremediation, phytoremediation and restoration strategies
Eugenia J. OLGUÍN*, María Elizabeth HERNÁNDEZ y Gloria SÁNCHEZ–GALVÁN
Unidad de Biotecnología Ambiental. Instituto de Ecología, A.C. (INECOL), Km 2.5 carretera antigua a Coatepec No. 351, Congregación El Haya. Xalapa, Veracruz., 91070. México. Tel +52 (228) 842 1848 Fax +52 (228) 818 7809. *e–mail: eugenia.olguin@inecol.edu.mx
(Recibido enero 2007, aceptado agosto 2007)
RESUMEN
Los bosques de manglar son ecosistemas muy complejos con múltiples funciones ecológicas y alto valor económico. Son también ecosistemas que están sujetos a diversos impactos negativos, lo que está ocasionando su desaparición a una tasa anual que oscila entre el 1 y el 5 %. Uno de los impactos más negativos lo genera el derrame de petróleo con su consecuente efecto dañino en varios de sus subsistemas: árboles, fauna asociada, microorganismos (aerobios y anaerobios), suelo y agua. La presente revisión ofrece una discusión de la información más actualizada sobre la contaminación de manglares por derrames de petróleo a nivel mundial y en México. Asimismo, revisa y discute las diversas estrategias de biorremediación, fitorremediación y restauración que permiten dar una respuesta a corto y mediano plazo. La mayoría de los suelos contaminados con hidrocarburos, contienen microorganismos capaces de degradarlos observándose que la atenuación natural ocurre en la mayoría de los casos. Con el objeto de acelerar este proceso, se han investigado las estrategias de bioestimulación (adición de nutrientes o compuestos estimuladores de la degradación) y de bioaumentación (adición de cepas microbianas con atributos especiales para degradar los contaminantes). Otro factor limitante para que ocurra la degradación de hidrocarburos en los sedimentos de manglares, es la falta de oxígeno. La información más actual indica que la estrategia de bioestimulación, complementada con aireación, es una de las mejores opciones de tratamiento. Finalmente, se señala la necesidad de realizar estudios integrales de biorremediación, fitorremediación y restauración de manglares impactados por hidrocarburos que incluyan los diferentes subsistemas de dichos ecosistemas.
Palabras clave: hidrocarburos, bioestimulación, bioaumentación, atenuación natural, biodegradación, derrames de petróleo, manglares
ABSTRACT
Mangroves are complex ecosystems with multiple functions and high economic value. However, they are exposed to several negative impacts and are disappearing at a high annual rate (1 to 5 %). Oil spills are one of the most negative impacts causing damage to all the ecosystem's sub–systems: plants, associated fauna, microorganisms (aerobic and anaerobic), soil and water. Considering the relevance of these ecological disasters, the current revision offers a discussion of updated information on oil pollution of mangroves. Furthermore, various strategies related to bioremediation, phytoremediation and restoration, are also reviewed and discussed as solutions for the short and medium term. An autochthonous microbial flora capable of degrading hydrocarbons is usually present in polluted soils and it has been observed that natural attenuation generally occurs. The strategies of biostimulation (addition of nutrients or degrading stimulation compounds) and bioaugmentation (addition of microbial strains with special attributes for pollutant degradation), have been investigated as tools for acceleration of such natural process. Another limiting factor under natural conditions is the lack of oxygen in the mangroves' sediments. Current information indicates that biostimulation complemented with aereation, is the most suitable strategy for hydrocarbon degradation. Finally, the need of integrated studies of bioremediation, phytoremediation and restoration of mangroves impacted by oil spills, in which most of the sub–systems of this complex ecosystem are investigated in parallel, is highlighted.
Key words: hydrocarbons, biostimulation, bioaugmentation, natural attenuation, biodegradation, oil spills, mangroves
INTRODUCCIÓN
El manglar es un ecosistema complejo formado principalmente por vegetación arbórea, la fauna y la flora interrelacionadas, así como el medio físico sobre el cual se establece (Hoff et al. 2002). Se denomina mangle a las especies de árboles y arbustos que han evolucionado para adaptarse al ambiente de las zonas intermareales de las costas tropicales y subtropicales del planeta, para lo cual han desarrollado tolerancia a suelos anegados y con alta salinidad. Este ecosistema se encuentra en áreas aledañas a los litorales, lagunas costeras, desembocaduras de ríos, esteros y humedales. Su importancia ecológica reside en las funciones que desempeña en la estabilización y protección de las líneas costeras, proporcionando un área de cría y alimentación de numerosas especies de peces y crustáceos y hábitat para cangrejos y moluscos y lugares de anidamiento de aves costeras. Por otra parte, el manglar tiene un valor económico derivado de su papel como criadero de especies para la pesca, así como por la extracción de taninos de la corteza del mangle, y la extracción de madera para diversos usos artesanales y comerciales (IPIECA 1993, Lewis 2005)
En el transcurso del tiempo y por diversas razones, el área de manglares ha sido impactada negativamente con una concomitante reducción de su superficie. A nivel mundial, en el período de 1980 a 1990, dicha área disminuyó de 198,000 km2 a 157,630 km2. Estas pérdidas representaron aproximadamente un 2 % anual, mientras que de 1990 a 2000 fueron del 1 % (Lewis 2005). En 2003, estos ecosistemas cubrían un área de 146,530 km2 de las costas tropicales del mundo (FAO 2003)
En México, se estima que se han perdido aproximadamente 65 % de los manglares, según el World Resources Institute (WRI 2000). También se estima que la tasa de deforestación es del 5 % anual (López–Portillo y Ezcurra 2002). Las estimaciones del área cubierta por manglares presentan grandes variaciones, estableciendo como mínimo una superficie de 5,300 km2 y un máximo de 14,200 km2 lo que representa de un 0.27 al 0.71 % del área total del país. Las especies de mangle más características en México son Rhizophora mangle L. (mangle rojo, Rhizophoraceae), Avicennia germinans L. (mangle negro, madre de sal), Laguncularia racemosa (L.) Gaertn. (mangle blanco, Combretaceae) y Conocarpus erectus L. (mangle botoncillo, Combretaceae) (López–Portillo y Ezcurra 2002).
CARACTERISTICAS BIOGEOQUÍMICAS DE LOS SUELOS DE MANGLARES
Los suelos de manglar se caracterizan por un alto contenido de agua, de sal y sulfuro de hidrógeno, un bajo contenido de oxígeno y una elevada proporción de materia orgánica (Lewis 2005). Los manglares se desarrollan sobre todo en terrenos fangosos y aluviales que por lo general se forman mediante la sedimentación de partículas de suelo transportadas por el agua. A continuación se describen algunas de las principales características de los suelos de manglares.
Salinidad
La salinidad en los sedimentos (salinidad intersticial) de los bosques de manglar depende del tipo de hidrología que prevalezca en ellos. Los manglares en las orillas costeras, reciben constantemente agua de mar. Por otro lado, los manglares ribereños son influenciados por agua salobre ya que reciben agua de los ríos y canales, al igual que agua de mar. La salinidad varía estacionalmente y depende de la altura y amplitud de la marea, de la precipitación pluvial y de las variaciones estacionales en el volumen de agua que les aportan los ríos, canales y escurrimientos de tierras arriba. La salinidad en los suelos de bosques de manglar que se encuentran adyacentes a ríos es menor que la salinidad en el agua de mar. Por otro lado, en los manglares localizados en las orillas de la costa, la salinidad es más alta que la del agua de mar, debido al proceso de evaporación. En general la salinidad aumenta cuando el intercambio con la marea se interrumpe (Mitsch y Gosselink 2000).
Oxigenación
La penetración de oxígeno y consecuentemente la descomposición aeróbica en los suelos de ecosistemas costeros están limitados a unos cuantos milímetros de profundidad (Holmboe et al. 2001). Más abajo, los suelos de bosques de manglar presentan condiciones reducidas con potenciales de oxido–reducción en el rango de –100 a –400 mV, ésto como consecuencia de las condiciones de inundación que prevalecen en ellos (Mitsch y Gosselink 2000). En las zonas anaeróbicas, la respiración bacteriana utiliza NO3–, MnO2, FeOH, SO4= y CO2 como aceptores finales de electrones (Holmboe et al. 2001). El grado de reducción depende de la duración de la inundación y de la apertura del ecosistema a flujos de agua dulce y salada. El oxígeno puede ser transportado a la zona de la rizosfera a través del tejido aerenquimal que poseen los árboles de mangle, creando micro–sitios aeróbicos en esa zona. Asimismo, los flujos superficiales de agua en los suelos de manglares, ayudan a disminuir las condiciones reducidas en ellos, porque dichas aguas contienen oxígeno disuelto que es difundido hacia los suelos (Mitsch y Gosselink 2000).
Acidez
Los suelos de los bosques de manglares son generalmente ácidos (Suprayogi y Murray 1999). Las altas condiciones reducidas de los suelos y la consecuente acumulación de sulfitos causan condiciones de acidez extrema. Se ha reportado que los sedimentos de manglares pueden acumular hasta 0.1 kg S m–3 año–1 (Dent 1992). Si los suelos de manglares son drenados, removidos o dragados, los depósitos de azufre (en forma de pirita) son liberados y por tanto, oxidados a ácido sulfúrico, causando más acidez.
Materia orgánica
La alta productividad primaria neta y la baja tasa de respiración del ecosistema de manglar, lo hace un sistema muy eficiente para la secuestración de carbono (Jennerjahn y Ittekkot 2002). Adicionalmente, los sedimentos marinos o los de ríos también son fuente de materia orgánica para los suelos de bosques de manglar. La acumulación de materia orgánica en esta clase de suelos está influenciada por el tipo de hidrología, por las condiciones climáticas y de inundación, así como por las especies de vegetación que lo constituyen.
En los manglares que se encuentran en cuencas bajo condiciones de inundación permanente, la materia orgánica puede exportarse en forma disuelta. En contraste, si los manglares se encuentran en zonas de flujo constante de agua, como en las orillas, la materia orgánica se exporta en forma de partículas suspendidas (López–Portillo y Ezcurra 2002). Bouillon et al. (2003), estudiaron la acumulación de materia orgánica en suelos de tres bosques de mangle, dos de ellos localizados en la India y uno en el sureste de Sri Lanka. Los tres bosques estaban conformados por las especies de mangle Rhizophora spp, Exoecaria agallocha y Avicennia officinalis. Cuando se tomaron muestras de suelo de cada bosque, encontraron que en suelos con Rhizophora spp, el contenido de carbono orgánico fue más alto que los suelos colonizados con E. agallocha o A. officinalis.
CARACTERÍSTICAS FÍSICOQUÍMICAS DE LOS HIDROCARBUROS
Los hidrocarburos son compuestos orgánicos que contienen carbono e hidrógeno. El número de carbonos y su estructura química determina su clasificación. Los hidrocarburos alifáticos son de cadena lineal o ramificada y pueden ser saturados (aléanos) o insaturados (alquenos y alquinos). Los hidrocarburos de cadenas cíclicas, pueden ser saturados (cicloalcanos) o con uno o más anillos bencénicos (aromáticos) (Morrison y Boyd 1985). Los hidrocarburos constituyen del 50–98 % de la composición total del petróleo, están formados por alcanos, cicloalcanos y compuestos aromáticos (Fig.1), con al menos un anillo bencénico en su estructura (Botello 2005). La gasolina está constituida aproximadamente por 70 % de compuestos alifáticos saturados y 30 % de hidrocarburos aromáticos como el benceno, tolueno e isómeros del xileno (conocidos en su conjunto como BTX) (Hartley y Englande 1992, Phelps y Young 2001, Coates et al. 2002).
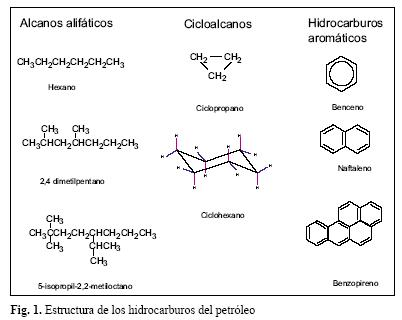
Los alcanos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Los alcanos líquidos son miscibles entre sí y generalmente se disuelven en disolventes de baja polaridad como el benceno, tetracloruro de carbono, cloroformo y otros alcanos. Su densidad incrementa con el tamaño de la molécula, siendo en todos lo casos menos densos que el agua (Morrison y Boyd 1985, Botello 2005).
Los cicloalcanos presentan puntos de ebullición y de fusión mayores a los que se observan en los alcanos y también poseen densidades mayores, lo cual probablemente se deba a que sus moléculas son más rígidas y simétricas, lo que les permite tener fuerzas de atracción intramolecular muy efectivas (Morrison y Boyd 1985).
Los hidrocarburos aromáticos son líquidos o sólidos a temperatura ambiente y sus puntos de ebullición están cercanos a los de los cicloalcanos correspondientes. Al igual que los hidrocarburos descritos anteriormente, los compuestos aromáticos son poco polares o no polares y por lo mismo, no se disuelven en agua. Los electrones de los anillos aromáticos pueden tener una débil atracción con enlaces polares de otras moléculas, lo cual los hace excelentes solventes orgánicos. La unión de dos anillos bencénicos produce hidrocarburos poliaromáticos (HPA). Dichos compuestos son de interés ambiental y de salud pública en relación con sus propiedades carcinogénicas como es el caso del 3–4 benzopireno (Botello 2005).
CONTAMINACIÓN DE MANGLARES POR HIDROCARBUROS
Los derrames de petróleo representan un grave problema de contaminación en diversas partes del mundo. Estos accidentes han contribuido en gran manera al aumento en la contaminación por hidrocarburos en zonas costeras, afectando negativamente áreas de manglar, la flora, la fauna y la salud humana. Los hidrocarburos del petróleo se adhieren a las branquias de los peces, afectando su respiración. También se adhieren y destruyen las algas y el fitoplancton y afectan la alimentación y reproducción de la vida acuática en general (plantas, insectos y peces) (Reeves 2005). Causan la muerte o inducen mutaciones de los mangles como se describe en detalle más adelante.
Los hidrocarburos se pueden encontrar en el agua flotando libremente, en emulsión, disueltos o adsorbidos a sólidos suspendidos. Los hidrocarburos con mayor número de carbonos tienden a flotar y están en forma libre. Por el contrario, las moléculas más pequeñas tienden a formar emulsiones con el agua y son más difíciles de remover (Reeves 2005).
Diversos procesos relacionados con el clima contribuyen a la atenuación natural de descargas de petróleo en agua de mar, tales como evaporación, foto–oxidación, emulsión, dispersión y biodegradación (Brakstad y Bonaunet 2006). Sin embargo, en la mayoría de los derrames de petróleo, dicha capacidad de autodepuración no es suficiente para remediar los sitios contaminados e incluso los productos de la foto–oxidación son compuestos ácidos y fenólicos, los cuales en alguno de los casos, son más tóxicos que los hidrocarburos originales (Kingston 2002). Además, a medida que transcurre el tiempo, los hidrocarburos derramados en ambientes marinos o acuáticos se adhieren fuertemente a los sedimentos o debido a su baja solubilidad en agua y a su carácter hidrofóbico (Ke et al. 2002).
En el caso de los manglares, su alta productividad y su abundante detritus orgánico, los hacen un sitio preferencial para la acumulación de hidrocarburos (Suprayogi y Murray 1999, Zhang et al. 2004). Se ha reportado que la concentración de HPA en suelos de manglar en China, mostró una fuerte correlación con el contenido de carbono orgánico (Zhang et al. 2004). En Queensland, Australia, se investigó la contaminación por hidrocarburos en suelos de manglar, en cuyas zonas aledañas fueron depositados desechos de aceite. Se encontró una zona contaminada de 15–30 m de ancho y 200 m de largo, conteniendo concentraciones de hidrocarburos hasta en un 17 % del peso seco de los suelos superficiales. Los hidrocarburos también fueron detectados en los sedimentos de un arroyo aledaño como consecuencia del lavado periódico de los sedimentos contaminados de los bosques del manglar. El análisis del perfil de los sedimentos indicó que los hidrocarburos penetraron a una profundidad de 40 cm (Burns et al. 1998).
Estudios recientes en manglares de Hong Kong, indicaron que los suelos superficiales (2–3 cm) presentaron concentraciones de HPA en el rango de 66 a 3758 ng g–1 del peso seco del suelo y se observaron 16 HPA incluidos en la lista de contaminantes prioritarios de la Agencia de Protección Ambiental de los Estados Unidos (USEPA). Los perfiles de sedimentos revelaron que la capa superficial presentó concentraciones de HPA más bajas que las capas más profundas (15– 20 cm) y la composición de HPA también cambió en las diferentes profundidades (Ke et al. 2005). Otro estudio también en Hong Kong, encontró concentraciones entre 60–80 µg g–1 de hidrocarburos totales de petróleo (HTP) y de 60–70 µg g–1 de mezclas de hidrocarburos no separadas (MHNS) en los suelos de los bosques de manglares de Sheung Park Nai Swamp (Tam et al. 2005).
En relación con México, se ha estimado que el estado de Veracruz cuenta con 460.47 km2 de manglar, lo que representa un 14 % de los manglares del Golfo de México (Moreno et al. 2002). Sin embargo, dada su ubicación geográfica, una de las mayores amenazas sobre este ecosistema, son los accidentes relacionados a la industria petrolera que se desarrolla a lo largo de la zona costera. Según datos del Instituto Nacional de Estadística, Geografía e Informática existen más de 3,000 km de ductos que transportan diariamente, a diversos puntos de la República Mexicana, más de 1,073 millones de barriles de petróleo y 2,622 millones de pies cúbicos de gas. Los accidentes más comunes son la ruptura de ductos, los derrames de plataformas y accidentes de buques tanque (Moreno et al. 2002). Sin embargo, aunque hace algunas décadas se realizaron estudios sobre la contaminación por metales pesados y por hidrocarburos en algunos sistemas costeros del Golfo de México (Botello et al. 2005) y se determinaron algunos sitios de contaminación con hidrocarburos por rupturas de ductos principalmente en el occidente del estado de Tabasco (Adams et al. 1999), se requiere actualizar el conocimiento sobre el nivel de impacto que causan actualmente los derrames de petróleo sobre los manglares más importantes de la costa de Veracruz y en general, del Golfo de México. Uno de los pocos estudios actuales (García–López et al. 2006), se realizó también en el estado de Tabasco y localizó 52 derrames de petróleo, la mayoría sobre histosoles y manglar, principalmente en el núcleo del campo La Venta, en donde el 75 % de la superficie estudiada registró niveles de contaminación por hidrocarburos de ligera a moderada.
EFECTOS DE LA CONTAMINACIÓN POR HIDROCARBUROS EN MANGLARES
Es importante mencionar que en un estudio donde se investigue el impacto de hidrocarburos en un ecosistema tan complejo como lo es un bosque de manglar, se debe considerar por lo menos seis subsistemas: 1) árboles de mangle, 2) microorganismos diversos del suelo (aerobios y anaerobios), 3) suelo (sedimentos orgánicos), 4) agua (hidrología y calidad del agua), 5) fauna y 6) condiciones climáticas.
La investigación de los efectos de la contaminación por hidrocarburos en manglares se ha intensificado en los últimos 15 años. Sin embargo, la mayoría de las investigaciones se han enfocado al efecto de los hidrocarburos en los subsistemas de árboles y fauna de manglar y aún no existen suficientes datos para poder elaborar conclusiones generales sobre los efectos en todo el ecosistema. Los efectos de corto plazo sobre plántulas y árboles de mangle están relacionados a la asfixia y muerte cuando el petróleo pesado o viscoso cubre los pneumatóforos, sistema de raíces aéreas mediante las cuales se realiza el intercambio de gases con la atmósfera circundante al sustrato del manglar. Asimismo, la vegetación de manglar puede morir por intoxicación directa con los compuestos aromáticos de bajo peso molecular cuando estos dañan las membranas celulares de las raíces y se impide el proceso normal de exclusión de la sal (IPIECA 1993). Hasta ahora, los efectos de largo plazo parecen ser particulares para las diferentes especies de plantas y animales asociadas al ecosistema de manglar, dependiendo de la concentración y el tipo de hidrocarburo, así como de la intensidad de la contaminación.
En la costa de Paraná, Brasil, donde ocurrieron derrames graves de petróleo hace más de 20 años y en donde la contaminación menor por hidrocarburos ha sido crónica, se ha observado una alta proporción de raíces muertas de los árboles de Rhizophora spp. (Burnas et al. 1994).
Suprayogi y Murray (1999), investigaron el efecto de cinco concentraciones de dos tipos de petróleo (crudo de y condensado) sobre algunas características fisicoquímicas de los sedimentos y en el crecimiento de cuatro especies de plántulas de mangle (Rhizophora stylosa, Rhizophora mucronata, Ceriops tagal y Avicennia marina). El tipo crudo fue más persistente en los sedimentos de manglar que el condensado, lo cual probablemente se debió a una mayor velocidad de evaporación del último. Ambos tipos de petróleo ocasionaron condiciones anaeróbicas en los suelos del manglar, ya que se formaron películas oleosas. La concentración de hidrocarburos en las hojas aumentó conforme se incrementó la concentración de hidrocarburos en el suelo. A. marina fue la especie que más altas concentraciones de hidrocarburos acumuló y consecuentemente su crecimiento fue inhibido más que el de las otras especies. Los autores discutieron que la razón de las diferentes respuestas de las especies de mangle a los hidrocarburos no es clara y que pudiera deberse a diversos factores tales como diferentes rutas bioquímicas de degradación de los hidrocarburos, así como diferencias en la tolerancia a condiciones anaeróbicas en las raíces cuando los sedimentos y los pneumatóforos están cubiertos por las capas grasosas del petróleo.
Estudios más recientes realizados en Queensland, Australia, indicaron una fuerte correlación entre la concentración de hidrocarburos en los sedimentos de manglar con predominancia del género Avicennia y la aparición de imitantes deficientes en clorofila a, las cuales fueron llamadas mutantes albinas. Dichas mutantes presentaron color rojo o amarillo y murieron a los pocos meses de haber germinado. Asimismo, las mutantes albinas han sido observadas en manglares con predominancia del género Rhizophora en la zona costera del mar Caribe y su presencia también fue correlacionada con la concentración de hidrocarburos en los sedimentos (Duke y Watkinson 2002).
Por otro lado, Proffitt y Devlin (1998), investigaron el potencial de los efectos acumulativos y sinérgicos de eventos de derrames múltiples. Estos autores llegaron a la conclusión de que no hubo diferencias significativas en diversos parámetros relacionados al crecimiento de Rhizophora mangle después de varios tratamientos consecutivos con petróleo crudo de Lousiana.
La discusión anterior, pone de manifiesto que el tema de las respuestas de los mangles al contacto con hidrocarburos es complejo y controversial, dado que depende de múltiples factores, tales como la especie de mangle, del sustrato en el que ésta se encuentre, de las corrientes, dirección del viento y patrones de las mareas, de la temperatura ambiental, de la geomorfología y de las características físico–químicas de los hidrocarburos involucrados (relacionadas a toxicidad, bioacumulación y persistencia). La discusión a profundidad de esta temática está fuera del alcance de la presente revisión, dado que se enfoca principalmente a discutir las diversas estrategias de biorremediación descritas en la literatura actual.
ESTRATEGIAS DE BIORREMEDIACIÓN DE MANGLARES CONTAMINADOS CON HIDROCARBUROS
Los derrames por petróleo a nivel global han ocurrido desde hace muchas décadas, lo que ha generado una diversidad de tecnologías para la contención y limpieza de los suelos impactados. En el caso del agua, se pueden utilizar procesos físicos, químicos y biológicos para recuperar y remover petróleo. La National Oceanic and Atmospheric Administration (NOAA) de Estados Unidos, ha discutido el uso de la mayor parte de las tecnologías no biológicas (Hoff et al. 2002). Sin embargo, existen evidencias de que algunas de estas tecnologías pueden causar daños a la biota e impedir la recuperación de ciertos habitats (Dutrieux et al. 1990). Por lo anterior, los nuevos esfuerzos se han enfocado hacia el uso de tecnologías que promuevan los procesos naturales de remoción de contaminantes. La biorremediación y la fitorremediación son dos de estas tecnologías emergentes y ambientalmente pertinentes (Fig. 2).

La biorremediación es un proceso biológico en donde diversos microorganismos (m.o.) degradan diversos contaminantes hasta compuestos no tóxicos presentes en suelo, agua o aire, trabajando de manera individual o coordinadamente (mediante sinergias), dentro de un consorcio microbiano.
La mayoría de los suelos contaminados con hidrocarburos, contienen microorganismos capaces de degradarlos. Sin embargo, el crecimiento de dichos m.o. está limitado en el ambiente natural por diversos factores, tales como la baja solubilidad en agua de los HPA, su baja biodisponibilidad, la limitación de algunos nutrientes, especialmente nitrógeno (N), la presencia de otros contaminantes que pueden inhibir la degradación de los HPA (por ejemplo el pentaclorofenol) y otros diversos. Por lo anterior, se han utilizado dos estrategias para contrarrestar dichas limitaciones y fomentar la actividad degradadora de la flora microbiana nativa: a) la bioestimulación (adición de nutrientes o compuestos estimuladores de la degradación) y b) la bioaumentación (adición de cepas microbianas con atributos especiales para degradar los contaminantes).
Por otro lado, existe la remediación intrínseca en donde sólo la flora microbiana nativa es la responsable de la degradación o transformación de los contaminantes. Actualmente se realiza un gran número de investigaciones sobre la estrategia llamada "monitoreo de la atenuación natural", que consiste en tener un seguimiento analítico de la degradación y transformación de los contaminantes por parte de la flora microbiana autóctona. En México, estudios preliminares a nivel de laboratorio, mostraron un aumento en la respiración de la flora microbiana nativa de suelos de manglar fuertemente contaminados con petróleo crudo o con lodos de perforación en el estado de Tabasco (Adams et al. 1999). Otros estudios también realizados en Tabasco, indicaron que la destoxificación de suelos contaminados con residuos de petróleo, ocurrió por atenuación natural o biodegradación pasiva (Ferrer 1997).
En relación a la biorremediación de suelos impactados con hidrocarburos, se han realizado diversas investigaciones, aunque un mínimo de ellas se refieren a suelos de manglar (Burns et al. 1999). En este último caso, diversos estudios sugirieron que siendo los sedimentos de manglar predominantemente anaeróbicos, la velocidad de degradación de los hidrocarburos estaba muy probablemente limitada por las concentraciones de oxígeno y de nutrientes. En virtud de lo anterior, se realizaron estudios de campo en manglares con comunidades maduras de Rhizophora stylosa en Gladstone, Australia, en donde la estrategia de biorremediación de parcelas contaminadas con petróleo crudo fue tanto la aireación de los sedimentos como la adición de un fertilizante de liberación lenta (Ramsay et al. 2000). Se encontró que la aireación activa y la adición de nutrientes estimularon significativamente (en tres órdenes de magnitud) el crecimiento de los m.o. degradadores de alcanos y en menor proporción la población de los m.o. degradadores de hidrocarburos aromáticos. Estos resultados son similares a los encontrados en un estudio de simulación a nivel mesocosmos, en el cual se realizó un tratamiento factorial de cinco vías en donde las variables fueron: dos substratos (orgánico e inorgánico), dos tipos de regímenes de nutrientes (fertilizado y no fertilizado), dos niveles de aireación (aireado y no aireado), tres concentraciones de petróleo (0, 5 y 10 litros de petróleo/m2) y cuatro especies de plantas vasculares (Alternanthera philoxeroides, Panicum hemitomon, Phragmites australis, Sagitaria lancifolia y un tratamiento sin plantas). Se encontró que la concentración de petróleo después de 18 meses, fue menor en los mesocosmos aireados y fertilizados conteniendo P. hemitomon o S. lancifolia y substratos o matrices con baja concentración de materia orgánica (Dowty et al. 2001).
En otro estudio de campo realizado en manglares de Nigeria donde se encontraban presentes especies de los géneros Rhizopora, Laguncularia y Avicennia y los suelos estaban contaminados con petróleo crudo, se evaluó el uso combinado de tres estrategias de biorremediación: a) bioestimulación con fertilizante, b) bioaumentación con inoculación de 100 kg (base húmeda) ha–1 de cultivos de una población autóctona mixta de bacterias degradadoras de hidrocarburos aislada y producida localmente y c) prácticas de labranza (Odokuma y Dickson 2003). Se encontró que la mejor combinación para la degradación de los hidrocarburos totales fue la adición de nutrientes (bioestimulación), junto con prácticas de labranza manual para estimular la aireación y la adecuada distribución de nutrientes. En otros estudios a nivel de microcosmos, suelos contaminados con HPA, fueron bioestimulados (con adición de cascarilla de arroz y de sangre seca como fuente de liberación lenta de N) y bioaumentados (con adición de Pseudomonas aeruginosa cepa 64, un productor de biosurfactantes). El mejor resultado se obtuvo en el microcosmos que recibió ambos tratamientos, en comparación al que recibió sólo bioestimulación. Cuando los experimentos se realizaron a mayor escala, se logró una remoción del 87 % de los HPA en las parcelas que recibieron ambos tratamientos y una de 86 % en las parcelas que sólo recibieron bioestimulación, después de 16 meses (Straube et al. 2003). Puesto que el m.o. utilizado no es degradador de HPA, se concluyó que la bioestimulación de la flora microbiana autóctona fue la mejor opción. Esta importante conclusión ha sido confirmada en otros estudios a nivel de laboratorio (Araujo et al. 2006), en donde se trataron suelos contaminados con gasoil y se logró la mayor remoción de hidrocarburos en 150 días (90 %), cuando se utilizó una mezcla conteniendo cepas microbianas autóctonas (15 %) y lodos estabilizados (ricos en materia orgánica y nutrientes), en comparación con otros tratamientos.
La atenuación natural también ha sido demostrada como la mejor opción en el caso de estudios realizados con sedimentos de manglar contaminados con una mezcla de HPA, fluoreno y fenantreno. Se requirió bioestimulación para degradar pireno. Sin embargo, la bioaumentación con un consorcio microbiano aislado por enriquecimiento de los propios sedimentos, no demostró ningún aumento en la capacidad de degradación de los HPA (Yu et al. 2005).
Más recientemente, se realizaron estudios en dos suelos contaminados con diesel (colectados en California y Hong Kong) en donde se compararon los tres tipos de tecnologías de biorremediación: monitoreo de la atenuación natural, bioestimulación y bioaumentación. Además, se cuantificó el número de m.o. degradadores de diesel y la actividad microbiana medida como actividad de deshidrogenasa presente (Bento et al. 2005). Se encontró que la atenuación natural fue más efectiva que la bioestimulación especialmente en el caso de suelos colectados en Hong Kong. La mayor actividad microbiana (medida como actividad de deshidrogenasa) se observó con bioaumentación en los suelos de California (3.3 veces más) y en suelos de Hong Kong donde sólo se realizó monitoreo de la atenuación natural (4.0 veces más). El número de m.o. heterótrofos degradadores de diesel no fue afectado por el tipo de tratamiento. Se concluyó que las propiedades del suelo y el tipo de microflora autóctona afectan el grado de degradación, por lo que se recomendó realizar una caracterización detallada de los suelos del sitio de trabajo, antes de decidir el tipo de tratamiento.
Otro ejemplo de la importancia de la caracterización de los suelos que se intentan biorremediar, es el relacionado con la interferencia de los ácidos húmicos en la degradación natural de pireno. Ke et al. (2003), demostraron que la adición de este tipo de ácidos a microcosmos de manglar disminuyó la degradación de pireno después de seis meses. En los microcosmos con ácidos húmicos y sin plantas, el porcentaje de remoción de pireno fue de 45 % en los sedimentos superficiales y de 43 % en los sedimentos anaeróbicos más profundos, mientras que en los microcosmos sin la adición de ácidos húmicos, la remoción fue de 76 % en sedimentos superficiales y de 46 % en los sedimentos más profundos. Los microcosmos con plántulas de Kandelia candel y sin la adición de ácidos húmicos, presentaron porcentajes de remoción más altos (70.9 %) que los microcosmos sin plantas ni ácidos húmicos (61.4 %). Sin embargo, cuando se adicionaron ácidos húmicos a los microcosmos con o sin plantas, la remoción de pireno fue aproximadamente del 40 % en ambos casos. Considerando que los ácidos húmicos son componentes naturales de los suelos de los humedales (Collins y Kuehl, 2000, Hernández y Mitsch 2007), es posible que la degradación de pireno en los suelos de manglares pudiera ser afectada por la presencia de este tipo de compuestos.
Los resultados discutidos anteriormente se complementan con otros estudios recientes (Thompson et al. 2005) en donde se concluyó que cuando se utiliza bioaumentación, el aspecto clave de éxito reside en la selección de la cepa, utilizando no sólo los criterios convencionales relacionados al uso de m.o. competentes desde el punto de vista catabólico, sino también utilizando criterios modernos de biología molecular y química analítica. Otros estudios realizados utilizando técnicas de biología molecular en suelos contaminados con metales pesados e hidrocarburos por décadas (Joynt et al. 2006), señalaron cambios en la composición de la comunidad microbiana, pero que aún persistían grupos bacterianos filogenéticamente diversos (incluyendo algunos nuevos filotipos).
Por último, cabe destacar que se ha demostrado el éxito de la estrategia de bioaumentación para la degradación de suelos contaminados con hidrocarburos en otros ambientes naturales diferentes al ambiente de manglar. El sitio ACNA en Italia, reúne características muy peculiares debido a que constituyó por más de 100 años, un lugar de producción a gran escala de diversos compuestos hasta que fue cerrado en 1994. Se caracteriza por la presencia simultánea de hidrocarburos aromáticos (incluyendo clorados), poli–aromáticos y de metales pesados. Un grupo amplio de investigadores italianos (D'annibale et al. 2005) decidieron utilizar la estrategia de bioaumentación utilizando hongos degradadores de lignina (white–rot fungi) debido a que ya se había reportado que la estrategia de bioestimulación no había tenido éxito en este sitio (Berselli et al. 2004). De hecho, demostraron que dos hongos de este tipo, Phanerochaete chrysosporium y Pleurotus pulmonarius realizaron una remoción total de naftaleno, tetraclorobenceno y dicloroanilina, además de haber logrado crecer en estos suelos tan contaminados, producir oxidasas modificadoras de lignina y de haber destoxificado en una gran proporción los suelos de sitio ACNA (D'annibale et al. 2005). Otro ejemplo de un caso exitoso de bioaumentación fue el reportado por Ruberto y colaboradores, quienes utilizaron una cepa tolerante a bajas temperaturas a nivel de estudios de microcosmos para remediar suelos de la Antártica contaminados con petróleo (Ruberto et al. 2003).
De la revisión de los estudios anteriormente citados, se puede concluir que en general, la estrategia de bioestimulación, mediante la adición de nutrientes y de aireación, favorece la degradación de los hidrocarburos del petróleo por parte de la flora microbiana autóctona, lo que indica que esta estrategia y el monitoreo de la atenuación natural, son las mejores opciones para remediar suelos de manglar y suelos en general, impactados por hidrocarburos del petróleo. Sin embargo, no se descarta la posibilidad de que ciertas cepas aisladas de suelos de manglar o suelos tropicales puedan coadyuvar a que la flora microbiana autóctona degrade los hidrocarburos presentes. Más aún, es importante mencionar que además de los procesos de degradación microbiana de los hidrocarburos contaminantes de ambientes de manglar y otros habitats salinos, se ha demostrado que los procesos físico–químicos tales como la evaporación y disolución de los hidrocarburos, juegan un papel importante (Burns et al. 2000)
Por otro lado, aún no existen estudios que especifiquen claramente las ventajas de las diversas opciones de biorremediación en términos de costos. Sin embargo, es posible prever que la opción de aireación a gran escala puede ser muy costosa y que prácticamente es preferible la opción de labranza manual para favorecer la aireación de capas poco profundas del suelo de manglar.
ESTRATEGIAS DE FITORREMEDIACIÓN DE MANGLARES IMPACTADOS POR HIDROCARBUROS
La fitorremediación se define como el uso de plantas verdes para remover contaminantes del ambiente o transformarlos en compuestos menos tóxicos (Cunningham y Berti 1993). En el caso de los contaminantes orgánicos, la fitorremediación tiene la ventaja de que las plantas llevan a cabo reacciones químicas, utilizando luz solar, para metabolizar o mineralizar las moléculas orgánicas. Las plantas y microorganismos asociados a su rizosfera pueden degradar estos contaminantes o al menos limitar su distribución en el medio (Raskin et al. 1997).
Sin embargo, en el caso de derrames con hidrocarburos, no es fácil aplicar tecnologías de fitorremediación utilizando plantas vivas, dado que las plantas también son sensibles a estos compuestos tóxicos. Por ejemplo, se ha demostrado que ciertas plantas costeras de pantano son sensibles al petróleo crudo. Especies tales como Panicum hemitomon y Spartina alterniflora presentaron efectos adversos en su crecimiento, aunque éstos fueron más severos en Spartina patens, cuya muerte ocurrió después de un mes de iniciado el tratamiento. Sin embargo, al utilizar la biomasa seca, dichos efectos tóxicos fueron eliminados (DeLaune et al. 2003). Por lo anterior, la fitorremediación dirigida a la adsorción de hidrocarburos disueltos en la columna de agua o adheridos a partículas suspendidas en el agua de ambientes de manglar, utiliza biomasa muerta no sensible a los efectos tóxicos de estos compuestos.
Siguiendo esta estrategia, se han estudiado ciertas propiedades de la biomasa seca que pueden utilizarse como bioadsorbentes de hidrocarburos. Se ha descrito que la hidrofobicidad, la superficie específica y la capilaridad de los adsorbentes son los factores determinantes involucrados en la remoción de petróleo y otros hidrocarburos (Ribeiro et al. 2003). Sin embargo, algunos materiales usualmente hidrofílicos y por lo tanto con baja capacidad de adsorción de hidrocarburos han sido utilizados sometiéndolos a un tratamiento previo para mejorar su capacidad de adsorción. Mysore et al. (2005) adicionaron cera a la vermiculita para volverla hidrofóbica y así incrementar la adsorción de hidrocarburos flotantes en agua. Otros materiales como la fibra de algodón y corteza de árbol fueron sometidos a tratamientos químicos tales como la acilación de la celulosa y la saturación con iones metálicos de transición, respectivamente, para lograr mayor hidrofobicidad (Haussard et al. 2003, Deschamps et al. 2003).
La biomasa de algunas plantas acuáticas representa una buena opción como adsorbente, dado que sus características fisicoquímicas la hacen un excelente adsorbente no sólo de hidrocarburos sino también de iones metálicos. Algunas de las que se han utilizado son Salvinia sp., Salvinia molesta, Salvinia cucullata, Typha dominguensis y Pistia stratiotes.
Las características fisicoquímicas de Salvinia minima tales como su gran superficie específica (264 m2 g–1) y contenido de grupos carboxilo (0.95 mmol H+ g–1 biomasa) le confieren excelentes propiedades como bioadsorbente de iones metálicos (Sánchez–Galván et al. 2005). Esta planta ha demostrado ser muy eficiente en la remoción de iones metálicos y ser capaz de acumular grandes cantidades en su tejido, por lo que se le ha descrito como hiperacumuladora de plomo y cadmio (Olguín et al. 2002). Estudios más recientes, mostraron que la adsorción a su superficie es el principal mecanismo de remoción de plomo en sistemas por lote, mediante un análisis de compartimentos que utiliza lavados con EDTA (Olguín et al. 2005). También se ha descrito que S. minima es capaz de adsorber la mayor cantidad de Pb en tan sólo 30 minutos, cuando es expuesta a un medio con concentraciones iniciales del metal desde 1 hasta 30 mg Pb L–1 (Sánchez–Galván et al. 2006). En relación a su uso como biomasa seca, se ha demostrado su gran capacidad de adsorber Pb en sistemas por lote y en continuo al trabajar con concentraciones del metal tan altas como 250 mg L–1 (González–Portela et al. 2005a, b).
Por otro lado, se ha reportado que el género Salvinia tiene una alta hidrofobicidad (96 %) y excelentes características capilares que la hacen un muy eficiente bioadsorbente de compuestos no polares. Cuando la biomasa seca de Salvinia fue comparada con una turba comercial para evaluar su capacidad de adsorción de petróleo crudo, se demostró que esta biomasa vegetal tiene una mayor capacidad de adsorción (4.8 g vs 2.7 g de petróleo g–1 biomasa) (Ribeiro et al. 2000).
Salvinia sp. también ha sido probada como un filtro para la adsorción de emulsiones acuosas de petróleo crudo y otros hidrocarburos como vaselina. Los resultados mostraron que la biomasa de Salvinia adsorbió de 2 a 3 veces más petróleo y vaselina en comparación con una turba comercial (peat sorb) (11.8 vs 4.8 g de petróleo g–1 de biomasa y 7.3 vs 3.0 g de vaselina g–1 de biomasa). Esta superioridad de Salvinia sp., parece deberse principalmente a su hidrofobicidad y a los filamentos presentes en su superficie (Ribeiro et al. 2003).
La biomasa de Typha dominguensis y de Salvinia sp. también ha sido probada y comparada en relación con su capacidad de remoción de gasolina respecto a un adsorbente sintético comercial como fibra de poliéster y otros adsorbentes tales como madera, cáscara de arroz, de coco y bagazo. Se encontró que más del 70 % de la gasolina presente fue removida por todos los adsorbentes, excepto por la cáscara de coco y el bagazo (32 y 20 %, respectivamente) . La cantidad de gasolina adsorbida fue relativamente semejante con biomasa de T. dominguensis, de Salvinia sp. y con fibra sintética (1107, 944 y 1108 mg g–1, respectivamente). Sin embargo, en las pruebas de desorción, se observó que una mayor cantidad del hidrocarburo fue liberado en el adsorbente comercial en relación a los demás adsorbentes (4 vs <1.5 %) (Khan et al. 2004).
Finalmente, se sabe que el lirio acuático (Eicchornia crassipes) contiene una gran cantidad de fibra (55 % b.s.) (Ly et al. 2002) y existen algunas empresas que ya lo utilizan para remover compuestos orgánicos no polares, tales como los hidrocarburos.
En resumen, el uso de biomasa seca de ciertas plantas acuáticas con capacidad adsorbente de hidrocarburos, es una opción que aún debe explorarse a nivel piloto en manglares impactados por derrames de petróleo. De hecho, nuestro grupo de trabajo tiene un proyecto en marcha en donde se incluye la evaluación de biomasa seca de S. minima para este propósito.
ESTRATEGIAS DE RESTAURACIÓN DE ÁREAS DE MANGLAR IMPACTADAS POR HIDROCARBUROS
La restauración ecológica es el proceso de coadyuvar a la recuperación de un ecosistema que ha sido dragado, dañado o destruido (SER 2004). Este tipo de acción es recomendable cuando los ecosistemas han sido alterados hasta el grado que no pueden recuperarse o renovarse por sí mismos. Bajo dichas circunstancias, la homeostasis y el proceso de sucesión secundaria de los ecosistemas se ha interrumpido permanentemente o la recuperación del ecosistema es inhibida en alguna forma (Lewis 2005).
La meta final de la restauración es crear un ecosistema autosuficiente que sea de alguna manera capaz de recuperarse de perturbaciones futuras sin la necesidad de ayuda. La evaluación del éxito de un proyecto de restauración es complicada y en muchas ocasiones no existen consensos para su medición. La Sociedad Internacional de Restauración Ecológica ha propuesto una lista de nueve atributos como guía para medir el éxito de un proceso de restauración. Sin embargo, en la práctica, la mayoría de las evaluaciones del éxito de un proyecto de restauración miden atributos que se pueden agrupar bajo tres principales condiciones: 1) diversidad, 2) estructura de la vegetación y 3) procesos ecológicos (Ruiz–Jaen y Aide 2005).
Puesto que la recuperación natural de la vegetación de manglar toma entre 20 y 30 años después de un impacto severo por derrame de petróleo, los proyectos de restauración de esta vegetación tienen el objetivo de acelerar dicho proceso (Hoff et al. 2002). Por consiguiente, las acciones a realizar son a corto, mediano y largo plazo (Fig. 3). Los puntos clave a incluir en dichos proyectos de restauración son:
a) Restauración y manejo de las características del hábitat físico. En esta etapa se debe evaluar y reestablecer la topografía del área, la hidrología (intercambio de agua con la marea, drenado, aportaciones de agua dulce, etc.) y las condiciones fisicoquímicas y biológicas de los suelos (acidez, exceso de azufre, eliminación de contaminantes, etc.).
b) Restablecimiento de la estructura del manglar. Esta etapa consiste en la reforestación del bosque y en ella se deben considerar las especies de mangle que se van a restablecer, si es necesario asistir la restauración mediante la plantación de las especies nativas o si la colonización natural puede llevarse a cabo. Existen algunas técnicas para ayudar a la supervivencia de las plántulas de mangle en los procesos de restauración (Chandra et al. 1999).
La evaluación de áreas de manglar restauradas es difícil porque este tipo de ecosistemas puede requerir de varios años para alcanzar la madurez estructural y porque la evaluación de sus funciones podría requerir aun más tiempo. De hecho, es muy raro encontrar estudios de seguimiento a largo plazo de la recuperación de manglares más allá de uno o dos años después de que el derrame de petróleo ocurrió (Hoff et al. 2002). En consideración a lo anterior, la evaluación del éxito de un proceso de restauración de áreas de manglar, generalmente se enfoca a la supervivencia de las especies utilizadas o al restablecimiento de la estructura del manglar. Sin embargo, la producción de materia orgánica, establecimiento de cadenas tróficas y movimiento de carbono y energía, así como el ciclaje de los nutrientes son todos aspectos funcionales importantes de los manglares. Para que un manglar pueda considerarse como restaurado, debe cumplir al menos dos requisitos: a) tener una estructura semejante al manglar previo al disturbio, b) debe proveer funciones similares (McKee y Faulkner 2000).
La restauración de áreas de manglar empezó aproximadamente hace tres décadas, por lo que es más reciente que la restauración de ecosistemas terrestres. Dicha situación posiblemente obedezca a la distribución geográfica de los manglares, los cuales en su mayoría ocurren en países en vías de desarrollo, por lo tanto los esfuerzos de restauración no han contado con suficiente atención, fondos económicos ni investigación (Thourhaug 1990). Los primeros proyectos de restauración se realizaron en el Caribe y en Florida, posteriormente en el sureste asiático y más recientemente en Australia, África y Latinoamérica (Lewis 1980, Toledo y Castillo 1999, Ellison 2000, Burns et al. 2000, Díaz et al. 2002).Es importante mencionar que existen algunas evaluaciones científicas sobre el éxito de los proyectos de restauración de manglares que han sido sobre–explotados o impactados por industrias camaroneras (Das et al. 1997, Kairo et al. 2002). Sin embargo, en el caso de los manglares que han sido impactados por hidrocarburos, existen pocos datos disponibles en la literatura sobre la evaluación del proceso de restauración. Esto pudiera obedecer a la complejidad del impacto que causan los hidrocarburos en estos ecosistemas y al tiempo necesario que requieren los manglares para alcanzar la madurez. Como ya se mencionó anteriormente, los hidrocarburos se acumulan en los sedimentos y no son fácilmente degradables. Por lo anterior, el proceso de restauración de manglares impactados por hidrocarburos debe incluir dos fases principales: 1) destoxificación de los sedimentos mediante estrategias de biorremediación o fitorremediación y 2) restablecimiento de la vegetación. Es importante destacar que mucha de la investigación se ha enfocado al estudio de la primera fase, experimentado diferentes estrategias de biorremediación. En esos casos, el éxito se mide en función de la disminución de la concentración de hidrocarburos en los sedimentos. Sin embargo, poco se conoce sobre el desarrollo de los mangles en los suelos que han sido remediados y existe aún menos información sobre las demás funciones biogeoquímicas de los sedimentos remediados.
Entre los pocos estudios disponibles, destaca uno realizado en el Delta de Mahakam en Indonesia, en el cual se evaluó el desarrollo de mangles en los sedimentos de manglares contaminados por petróleo. Los sedimentos fueron tratados con fertilizantes o con dispersantes y se sembraron con Sonneratia casiolaris. Se observó que el petróleo afectó negativamente el crecimiento de los árboles plantados y que el dispersante causó incluso más daño a los mismos. Por lo tanto los autores no recomiendan usar dispersantes en los manglares contaminados y sugieren esperar un tiempo para que ocurra una atenuación natural del petróleo antes de plantar árboles (Dutrieux et al. 1990).
Otro proyecto de restauración se llevó a cabo en manglares que habían estado crónicamente contaminados con efluentes de una refinería petrolera al norte de la ciudad de Balikpapan en la isla de Borneo. En el sitio contaminado, originalmente existían especies de mangle del género Avicennia, las cuales murieron después de la contaminación crónica por hidrocarburos. El trabajo de restauración consistió en eliminar las fuentes de contaminación y manejar la hidrología de tal manera que el sitio recibiera agua limpia para ayudar al proceso natural de detoxification. Con esas medidas, se observó una rápida propagación natural de Aviccenia después de tres meses de haber iniciado los trabajos de restauración. El crecimiento de las plantas pareció estar más influenciado por el tipo de substrato, que por la concentración de hidrocarburos. Los resultados de este proyecto indicaron que fue el petróleo recién derramado el que causó mortandad de plantas juveniles, más que el petróleo añejado en los sedimentos (Martin et al. 1990).
CONSIDERACIONES FINALES
Los estudios ya reportados y discutidos anteriormente, se enfocan principalmente a la investigación de uno o cuando más dos de los subsistemas de los bosques de manglar, destacando los dirigidos al conocimiento de la flora microbiana de los sedimentos y al efecto de diversas estrategias de biorremediación sobre ellos. Debido a la complejidad del ecosistema de manglar, existe la necesidad de realizar proyectos integrales que contemplen las interacciones entre los distintos subsistemas que lo constituyen.
Asimismo, es importante destacar que la mayoría de los estudios de biorremediación de suelos o de fitorremediación de agua de manglares impactados por hidrocarburos, se han llevado a cabo en el laboratorio o en microcosmos. En consecuencia a lo anterior, poco conocimiento se tiene sobre la eficiencia de este tipo de tecnologías a nivel de ecosistema. Por lo tanto, existe la necesidad de realizar estudios que contemplen la implementación de estas tecnologías en parcelas experimentales de manglares impactados por hidrocarburos, para definir si el tratamiento in situ es viable o si es necesario llevar a cabo tratamientos ex situ. Paralelamente, se debe realizar un estudio de viabilidad técnica y económica que permita duplicar las experiencias que ofrezcan mayor beneficio al menor costo.
Finalmente, es esencial realizar estudios de seguimiento a largo plazo después de haber implementado un proyecto de biorremediación y restauración de manglares impactados por hidrocarburos. En México, aún no se documenta ninguna experiencia de este tipo.
REFERENCIAS
Adams R.H., Domínguez V., García L. (1999). Potencial de la biorremediación de suelo y agua impactados por petróleo en el trópico mexicano. Terra. 17, 159–174. [ Links ]
Araujo I., Montilla M., Cárdenas M., Herrera L., Angulo N. y Morillo G. (2006). Lodos estabilizados y cepas bacterianas en la biorremediación de suelos contaminados con hidrocarburos. Interciencia 31, 268–275. [ Links ]
Bento B., Camargo F., Okeke B., y Frankenberger W. (2005). Comparative bioremediation of soils contaminated with diesel oil by natural attenuation, biostimulation and bioaugmentation. Bioresource Technol. 96,1049–1055. [ Links ]
Berselli S., Milone G., Canepa P., Di Gioia D. y Fava F. (2004). Effect of cyclodextrins, humic substances and rhamnolipids on the washing of a historically contaminated soil and on the aerobic bioremediation of the resulting effluents. Biotechnol. Bioeng. 88, 111–120. [ Links ]
Botello A.V. (2005) Características composición y propiedades fisicoquímicas del petróleo. En: Golfo de México Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. (A.V. Botello, J. Rendón von Osten, G. Gold–Bouchot, C. Agraz–Hernández, Eds.) 2ª ed. Universidad Autónoma de Campeche, Universidad Nacional Autónoma de México, Instituto Nacional de Ecología. Campeche, México. pp. 261–268. [ Links ]
Botello A.V., Rendón von Osten J, Gold–Bouchot G., Agraz–Hernández C. (2005). Golfo de México Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. Universidad Autónoma de Campeche, Universidad Nacional Autónoma de México, Instituto Nacional de Ecología. Campeche, México. 695 p. [ Links ]
Bouillon S., Dahdouh–Guebas F., Rao A. V.S., Koedam N., Dehairs F. (2003). Sources of organic carbon in mangrove sediments: variability and possible ecological implications. Hydrobiologia 495, 33–39. [ Links ]
Brakstad O.G. y Bonaunet K. (2006). Biodegradation of petroleum hydrocarbons in seawater at low temperatures (0–5 °C) and bacterial communities associated with degradation. Biodegradation 17, 71–82. [ Links ]
Burns K.A., Garrity S.D, Jorissen D., MacPherson J., Stoelting M., Tierney J., Yelle–Simmons L. (1994). The Galeta Oil Spill. II. Unexpected persistence of oil trapped in mangrove sediments. Estuar Coast Shelf S. 38, 349–364. [ Links ]
Burns K.A. y Codi S. (1998). Contrasting impacts of localized versus catastrophic oil spills in mangrove sediments. Mangrove and Salt Marshes 2, 63–74. [ Links ]
Burns K., Codi S., Duke N. (2000). Gladstone, Australia field studies: weathering and degradation of hydrocarbons in oiled mangrove and salt marsh sediments with and without the application of an experimental bioremediation protocol. Mar. Pollut. Bull. 41, 392–402. [ Links ]
Coates J.D., Chakraborty R., McInerney J. (2002). Anaerobic benzene biodegradation–a new era. Resources in Microbiology 153, 621–628. [ Links ]
Collins M.E. y Kuehl R.J. (2000). Organic matter accumulation and organic soils. En: Wetland soils: Genesis, hydrology, landscapes and classification.(J.L. Richardson, M.J. Vepraskas, Eds.). Lewis Publishers, Boca Raton, EUA. pp. 137–162. [ Links ]
Cunningham S.D., Berti W. (1993). Remediation of contaminated soils with green plants: An overview. In Vitro Cell Dev. B. 29, 207–212. [ Links ]
Chandra P., Salgado K. y Lin J. (1999). A comparison of Riley encased methodology and traditional techniques for planting red mangroves (Rhizophora mangle). Mangroves and Salt Marshes 3, 215–225. [ Links ]
D'annibale A., Ricci M., Leonardi V., Quaratino D., Mincione E. y Petruccioli M. (2005). Degradation of aromatic hydrocarbons by white–rot fungi in a historically contaminated soil. Biotechnol. Bioeng. 90, 723–731. [ Links ]
Das P., Basak U.C. y Das A.B. (1997). Restoration of mangrove vegetation delta, Orissa, India. Mangrove and Salt Marshes 1, 155–161. [ Links ]
Díaz P.M., Boyd K.G., Grigson S.J.W. y Grant J. (2002). Biodegradation of crude oil across a wide range of salinities by an extremely halotolerant bacterial consortium MPD–M, immobilized on polypropylene fibers. Biotechnol. Bioeng. 79, 145–153 [ Links ]
DeLaune R.D., Pezeshki S.R., Jugsujinda A. y Lindau C.W. (2003). Sensitivity of US Gulf of Mexico coastal marsh vegetation to crude oil: Comparison of greenhouse and field responses. Aquat. Ecol. 37, 351–360. [ Links ]
Dent D.L. (1992). Reclamation of acid sulfate soils. En: Soil restoration. (R. Lal, B.A. Stewart, Eds). Springer Verlag. Nueva York. Vol. 17. pp. 29–122 [ Links ]
Deschamps G., Caruel H., Borredon M.E., Bonnin C. y Vignoles C. (2003). Oil removal from water by selective sorption on hydrophobic cotton fibers. 1. Study of sorption properties and comparison with other cotton fiber–based sorbents. Environ. Sci. Technol. 37, 1013–1015. [ Links ]
Dowty R., Shaffer G., Hester M., Childers G., Campo F. y Greene M. (2001). Phytoremediation of small–scale oil spills in fresh marsh environments: a mesocosm simulation. Mar. Environ. Res. 52, 195–211. [ Links ]
Duke N.C. y Watkinson A. J. (2002). Chlorophyll–deficient propagules of Avicennia marina and apparent longer term deterioration of mangrove fitness in oil polluted sediments. Mar. Poll. Bull. 44, 1269–1276. [ Links ]
Dutrieux E., Martin F. y Debray A. (1990). Growth and mortality of Sonnerratia caseolaris planted on an experimentally oil–polluted soil. Mar. Poll. Bull. 21, 62–68. [ Links ]
Ellison A.M. (2000). Mangrove restoration: Do we know enough? Restor. Ecol. 8, 219–229. [ Links ]
Ferrer M.I. (1997). Selección de tecnologías de restauración biológica para lodos de perforación en tres campos petroleros. Tesis de Maestría. Instituto Politécnico Nacional. México, D.F. [ Links ]
FAO (2003). New global mangrove estimate. Food and Agricultural Organization. http://www.fao.org/english/newsroom/news/2003/15020–en.html, 23 de abril de 2006. [ Links ]
García–López E., Zavala–Cruz J. y Palma–López D. (2006). Caracterización de las comunidades vegetales en un área afectada por derrames de hidrocarburos. Terra 24, 17–26. [ Links ]
González–Portela E.R., Sánchez–Galván G., Pérez–Orozco A. y Olguín E.J. (2005a). Remoción de Pb(II) por Salvinia minima no viable en sistemas por lote. En: Memorias del XI Congreso Nacional de Biotecnología y Bioingeniería. Mérida, Yucatán, México. [ Links ]
González–Portela E.R., Sánchez–Galván G., Pérez–Orozco A., Olguín E.J. (2005b). Influencia del tiempo de retención hidráulico sobre la remoción de Pb(II) por biomasa no viable de Salvinia minima en sistemas continuos. En: Memorias del XI Congreso Nacional de Biotecnología y Bioingeniería. Mérida, Yucatán, México. [ Links ]
Hartley W.R. y Englande A. J. (1992). Health risk assessment of the migration of unleaded gasoline: a model for petroleum products. Water Sci. Technol. 25, 65–72. [ Links ]
Haussard M., Gaballah I., Kanari N., de Donato P., Barres O., Villieras F. (2003). Separation of hydrocarbons and lipid from water using treated bark. Water Res. 37, 362–374. [ Links ]
Hernández M.E. y Mitsch W.J. (2007). Denitrification potential and organic matter as affected by vegetation community, wetland age, and plant introduction in created wetlands. J. Environ. Qual. 36, 333–342 [ Links ]
Hoff R., Hensel P., Proffitt E., Delgado P., Shigenaka G., Yender R. y Mearns A.J. (2002). Oil Spills in mangroves. Planning & Response Considerations. National Oceanic and Atmospheric Administration (NOAA). EUA. Technical Report. 69 p. [ Links ]
Holmboe N., Kristensen E. y Andersen F.O. (2001). Anoxic decomposition in sediments from a tropical mangrove forest and the temperate wadden sea: implications of N and P additions. Estuar. Cost. Shelf S. 53, 125–140. [ Links ]
IPIECA (1993). Impactos biológicos de la contaminación por hidrocarburos de manglares. International Petroleum Industry Environmental Conservation Association. Londres, 20 p. [ Links ]
Jennerjahn T.C. y Ittekkot V. (2002). Relevance of mangroves for the production and deposition of organic matter along tropical continental margins. Naturewissenchafen 89, 23–30 [ Links ]
Joynt J., Bischoff M., Turco R., Konopka A. y Nakatsu C. (2006). Microbial community analysis of soils contaminated with lead, chromium and petroleum hydrocarbons. Microbial Ecol. 51, 209–219. [ Links ]
Kairo J.G., Dahdouh–Guebas P., Gwada P.P., Ochieng C. y Koedam N. (2002). Regeneration status of mangrove forest in mida creek, Kenya: A compromised or secured future? Ambio 31, 562–568 [ Links ]
Ke L., Wong T., Wong Y. y Tam N. (2002). Fate of polycyclic aromatic hydrocarbon (PAH) contamination in a mangrove swamp in Hong Kong following an oil spill. Mar. Pollut. Bull. 45, 339–347. [ Links ]
Ke L., Wong T.W.Y., Wong A.H.Y., Wong Y.S., Tam N.F.Y. (2003). Negative effects of humics acid addition on phytoremediation of pyrene–contaminated sediments by mangrove seedlings. Chemosphere 52, 1581–1591. [ Links ]
Ke L., Yu K.S.H., Wong Y.S., Tam N.F.Y. (2005). Spatial and vertical distribution of poly cyclic aromatic hydrocarbons in mangrove sediments. Sci. Tot. Environ. 340, 177–187. [ Links ]
Kingston, P.F. 2002. Long–term Environmental Impact of Oil Spills. Spill Science & Technology Bulletin 7, 53–61. [ Links ]
Khan E., Virojnagud W. y Ratpukdi T. (2004). Use of biomass sorbents for oil removal from gas station runoff. Chemosphere 57, 681–689. [ Links ]
Lewis R.R. (1980). Techniques for restorating mangroves. En: Proceedings of Wetland Restoration Conference. (R.R. Lewis, Ed.) Hillsborough Jr. College, Tampa, FL. [ Links ]
Lewis R.R. (2005). Ecological engineering for successful management and restoration of mangrove forests. Ecol. Eng. 24, 403–418. [ Links ]
López–Portillo J., Ezcurra E. (2002). Los manglares de México: Una revisión. Madera y Bosques. Número especial, 27–51. [ Links ]
Ly J., Samkol P. y Preston T.R. (2002) Nutritional evaluation of aquatic plants for pigs: Pepsin/pancreatin digestibility of six plant species. Livestock Research for Rural Development 14(1). http://www.cipav.org.co/lrrd/lrrd14/1/ly141a.htm, 28 de abril de 2006. [ Links ]
McKee K.L. y Faulkner P.L. (2000). Restoration of biogeochemical function in mangrove forest. Restor. Ecol. 8, 247–259 [ Links ]
Martin F., Dutrieux E. y Debry E. (1990). Natural recolonization of a chronically oil–polluted mangrove soil after a de–pollution process. Ocean Shore. Manage. 14, 173–190. [ Links ]
Mitsch W.J. y Gosselink J. (2000). Wetlands. 3a ed., Wiley, Nueva York. 918 p. [ Links ]
Moreno P., Rojas J., Zárate D., Ortiz M., Lara A. y Saavedra T. (2002). Diagnóstico de los manglares de Veracruz: distribución, vínculo con los recursos pesqueros y su problemática. Madera y Bosques. Número especial, 61–68. [ Links ]
Morrison R.T. y Boyd R.N (1985). Química Orgánica. 2a ed. Fondo Educativo Interamericano. México D.F. 1376 p. [ Links ]
Mysore D., Viraraghavan T. y Jin Y.C. (2005). Treatment of oily waters using vermiculite. Water Res. 39, 2643–2653. [ Links ]
Odokuma L. y Dickson A. (2003). Bioremediation of a crude–oil polluted tropical mangrove environment. J. App. Sci. & Environ. Manag. 7, 23–29. [ Links ]
Olguín E.J., Hernández E. y Ramos I. (2002). The effect of both different light conditions and the pH value on the capacity of Salvinia minima Baker for removing cadmium, lead and chromium. Acta Biotechnol. 22, 121–131. [ Links ]
Olguín, E.J., Sánchez–Galván G., Pérez–Pérez T., y Pérez–Orozco A. (2005). Surface adsorption, intracellular accumulation and compartmentalization of Pb(II) in batch operated lagoons with Salvinia minima as affected by environmental conditions, EDTA and nutrients. J. Ind. Microbiol. Biot. 32, 577–586. [ Links ]
Phelps C.D. y Young L.Y.(2001). Biodegradation of BTEX under anaerobic conditions: a Review. Adv. Agron 70, 329–357. [ Links ]
Proffitt E.C. y Devlin D.J. (1998). Are there cumulative effects in red mangroves from oil spill during seedling and sapling stages. Ecol. Appl. 8, 121–127 [ Links ]
Ramsay M.R., Swannell N., Duke L.Y. y Hill R (2000). Effect of bioremediation on the microbial community in oiled mangrove sediments. Mar. Pollut. Bull. 41, 413–419. [ Links ]
Raskin I., Smith R.D. y Salt D.E. (1997). Phytoremediation of metals: using plants to remove pollutants from the environment. Curr. Opin. Biotechnol. 8, 221–226. [ Links ]
Reeves G. (2005). Understanding and monitoring hydrocarbons in water. Oakville, Ontario, Canada: Arjay Engineering LTD. [ Links ]
Reinhard M., Shang S., Kitanidis P.K., Orwin E., Hopkins G.D. y Lebron C.A. (1997). In situ BTEX biotransformation under enhanced nitrate– and sulfate–reducing conditions. Environ. Sci. & Tech. 31, 28–36. [ Links ]
Ribeiro T.H., Smith R. y Rubio J. (2000). Sorption of oils by the non–living biomass of a Salvinia sp. Environ. Sci. & Tech. 34, 5201–5205. [ Links ]
Ribeiro, T.H., Rubio J. y Smith R.W. (2003). A dried hydrophobic aquaphyte as an oil filter for oil/water emulsions. Spill Sci. & Tech. B. 8, 483–489. [ Links ]
Ruberto L., Vazquez S. y Mac Cormack W. (2003). Effectiveness of the natural bacterial flora, biostimulation and bioaugmentation on the bioremediation of a hydrocarbon contaminated antartic soil. Int. Biodeter. Biodegrad. 52, 115–125. [ Links ]
Ruiz–Jaen M.C. y Aide M.T. (2005). Restoration success: How is it being measured? Restor. Ecol. 13, 569–577. [ Links ]
Sánchez–Galván G., González–Portela E.R y Olguín E.J. (2005). Características físico–químicas de la biomasa de Salvinia minima y su uso en la remoción de metales. En: Memorias del XI Congreso Nacional de Biotecnología y Bioingeniería. Mérida, Yucatán, México. [ Links ]
Sánchez–Galván G., Monroy O., Gómez J. y Olguín E.J. (2006). Kinetics of Pb adsorption and intracellular accumulation by Salvinia minima in batch systems. En: VIII International Symposium on Environmental Biotechnology. Leipzig, Alemania. [ Links ]
SER (2004). The SER International Primer on Ecological Restoration (disponible en http://www.ser.org). Society for Ecological Restoration International. Tucson, Arizona, 10 de octubre de 2006. [ Links ]
Straube W., Nestler C., Hansen L., Ringleberg D., Pritchard P. y Jones–Meehan J. (2003). Remediation of polyaromatic hydrocarbons (PAHs) through land farming with bio stimulation and bioaugmentation. Acta Biotechnol. 23, 179–196. [ Links ]
Suprayogi B. y Murray F. (1999). A field experiment of the physical and chemical effects of two oils on mangroves. Environ. Exp. Bot. 42, 221–229. [ Links ]
Tam N.Y., Wong W.Y.T. y Wong Y.S. (2005). A case study on fuel oil contamination in a mangrove swamp in Hong Kong. Mar. Pollut. Bull. 51, 1092–1100 [ Links ]
Thompson I., van der Gast C., Ciric L. y Singer A. (2005). Bioaugmentation for bioremediation: The challenge of strain selection. Environ. Microbiol. 7, 909–915. [ Links ]
Throrhaug A. (1990). Restoration of mangroves and seagrasses–economic benefits for fisheries and mariculture. En: Restoration science and strategies for restoring the Earth. (J.J. Berger, Ed.) Environmental Island Press. Washington DC. pp. 265–282 [ Links ]
Toledo V. M. y Castillo A. (1999). La ecología en Latinoamérica: siete tesis para una ciencia pertinente en una región de crisis. Interciencia. 24, 157–168 [ Links ]
WRI (2000). World Resource 2000–2001: people and ecosystems: the frying web of life. United Nations Development Programme, United Nations Environment Programme, World Bank, World Resources Institute. Nueva York. [ Links ]
Yu K.W., Yau A.K., Wong Y., Tam N. (2005). Natural attenuation, biostimulation and bioaugmentation on biodegradation of polycyclic aromatic hydrocarbons (PAHs) in mangrove sediments. Mar. Pollut. Bull. 51, 1071–1077. [ Links ]
Zhang J., Cai L., Yuan D. y Chen M. (2004). Distribution and sources of polynuclear aromatic hydrocarbons in mangrove superficial sediments of Deep Bay, China. Mar. Pollut. Bull. 49, 479–486. [ Links ]














