Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista internacional de contaminación ambiental
versão impressa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.23 no.2 Ciudad de México Abr./Jun. 2007
Reducción de percloroetileno y cromo hexavalente mediante FE(0) y bioestimulación de microorganismos anaerobios
Reduction of perchloretylene and hexavalent chromium by means of FE (O) and bioestimulation of anaerobic microorganism
Alethia VÁZQUEZ MORILLAS1, Mabel VACA MIER1, Margarita BELTRÁN VILLAVICENCIO1, Raymundo LÓPEZ CALLEJAS1 y Pedro J. ÁLVAREZ2
1 Universidad Autónoma Metropolitana–Azcapotzalco, Av. San Pablo No. 180, Col. Reynosa–Tamaulipas, México, D. F. E–mail: mvm@correo.azc.uam.mx
2 Rice University, 6100 Main St. MS 317, Houston, TX 77005
Recibido septiembre 2006
Aceptado abril 2007
RESUMEN
En este trabajo se estudiaron las interacciones Fe–microorganismos simulando el entorno de una barrera reactiva permeable (BRP), para la reducción de percloroetileno (PCE) y cromo hexavalente en acuíferos contaminados. La bioestimulación de los microorganismos se llevó a cabo mediante la adición de un cosustrato para el desarrollo de las comunidades microbianas presentes de manera natural en el suelo. Se empleó un compuesto comercial que libera hidrógeno (HRC, por sus siglas en inglés) a tasas moderadas al contacto con el agua. Los resultados indican que la adición del cosustrato a reactores que contienen hierro y percloroetileno (PCE) aumenta en más del 100 % el porcentaje del contaminante reducido. Sin embargo, la descloración reductora no se lleva a cabo completamente y se generan metabolitos tóxicos como el tricloroetileno. En el caso del Cr(VI), la adición del HRC incrementó en 20% la capacidad reductora del sistema; aquí el efecto sinérgico no se debe necesariamente a la estimulación de microorganismos reductores de Cr(VI), sino a la generación de condiciones redox favorables al proceso.
Palabras clave: percloroetileno, cromo hexavalente, compuesto liberador de oxígeno, hierro de valencia cero, barreras reactivas permeables.
ABSTRACT
Fe–microorganisms interactions in and around permeable reactive barriers, for reduction of perchloroethylene and hexavalent chromium in polluted aquifers were examined. Biostimulation was done by the addition of a co–substrate for microbial communities already present in the soil. An hydrogen release compound (HRC), a commercial co–substrate which releases lactic acid at slow rates in presence of water was selected. Results show that HRC addition increases (>100 %) the reduction of PCE in iron–containing systems. Nevertheless, reductive dechlorination was not complete and caused accumulation of toxic metabolites such as trichloroethylene. For chromium reduction, bioestimulation enhanced reduction capability of the systems by 20 %. In this case, the effect was not stimulation of Cr–reducers, but the improvement of redox conditions.
Key words: perchloroethylene, hexavalent chromium, hydrogen release compound, zero–valent iron, permeable reactive barriers.
INTRODUCCIÓN
La contaminación de acuíferos es uno de los problemas ambientales graves que ocurre en muchas partes del mundo. Entre las tecnologías que se han utilizado para mitigar el fenómeno se encuentran las barreras reactoras permeables (BRP), que se construyen al colocar un material reactivo en el flujo subterráneo de contaminantes originado por el gradiente del terreno (DOE 1998, Scherer et al. 2000). En la mayoría de las BRP se emplea Fe(0), dada la disponibilidad y la capacidad de este material para eliminar o transformar una gama amplia de contaminantes reducibles. El proceso mediante el cual la barrera provoca la reducción en las concentraciones de los contaminantes involucra uno o más fenómenos químicos tales como la deshalogenación reductora, la oxidación–reducción y la sorción (ITRC 2003). Las barreras se han aplicado exitosamente, aunque presentan problemas operativos de mediano y largo plazo, como las disminuciones de reactividad y conductividad hidráulica originadas por la precipitación de minerales en su superficie (Gu et al. 1999, Phillips et al. 2003, Wilkin et al. 2003). Esta pérdida de efectividad podría mitigarse mediante la bioestimulación de especies endógenas, que favorecería las interacciones Fe–microorganismos para la reducción más efectiva de contaminantes en torno a una BRP.
En cuanto al proceso de degradación de solventes clorados, es común que la bioestimulación se lleve a cabo mediante la adición de donadores de electrones, tales como glucosa, acetato, formato, sacarosa, propionato y etanol, entre otros (Carr y Hughes 1998, Yang y McCarty 2002, Koenigsberg y Vigue 2003). Adicionalmente la biodegradación de los solventes clorados se puede favorecer mediante la adición de un compuesto liberador de hidrógeno (HRC®, por sus siglas en inglés que corresponden al término hydrogen releasing compound) a tasas controladas en los sitios contaminados (Jurgens y Linn 2003). El HRC es un polímero estérico de lactato y fosfato de magnesio grado alimenticio (Regenesis 2003), que se disocia lentamente en agua para producir ácido láctico. Éste sirve como fuente de hidrógeno (y por lo tanto de electrones) para los microorganismos (Koenigsberg y Vigue 2003). El HRC genera condiciones reductoras favorables para la descloración reductora y se ha aplicado con éxito en muchos proyectos de restauración de acuíferos (Adamson et al. 2003, FRTR 2006). Si bien este compuesto presenta efectividad similar a los lactatos y a las melazas en términos de producción de hidrógeno, sus propiedades físicas originan menos dispersión, lo que favorece su estabilidad en las zonas contaminadas; únicamente el lactato producido se desplaza, lo que redunda en una mayor eficiencia global del proceso (Farone y Palmer 2001). Además de bioestimular poblaciones descloradoras, permite acelerar la reducción del perclorato (Logan et al. 2000), del Cr(VI) (Hazen et al. 2004) y de explosivos (Barnes et al. 2001).
Un requerimiento esencial para el éxito en la aplicación del HRC en sitios contaminados con solventes clorados es la existencia de un cultivo competente –deshalorrespirador– en el medio tal como Dehalococcoides ethenogenes (Maymó–Gatell et al. 1997, Adamson et al. 2003). La actividad de este compuesto generalmente requiere de un periodo de adaptación de los microorganismos, durante el cual se cambian las condiciones de aerobias a anaerobias. Aunque el HRC estimulará todas las especies anaerobias presentes en el medio, el aumento en la actividad metanogénica no inhibe el proceso de descloración (Adamson et al. 2003).
En este trabajo se llevaron a cabo pruebas de bioestimulación con el objeto de evaluar el efecto de la adición de un sustrato orgánico comercial (HRC®) a un sistema Fe(0)–suelo–agua, en términos de tasa de reducción de contaminantes y formación de subproductos. Aunque ambas tecnologías se han estudiado por separado, resulta de interés analizar si la combinación de ambas puede generar efectos sinérgicos al mejorar la eficiencia del proceso de reducción, al potenciar favorablemente los efectos biológicos de los microorganismos endógenos que pueden encontrarse en el entorno de la BRP. Con ello, la adición del HRC serviría como una etapa de pretratamiento antes de la barrera, lo que permitiría reducir sus dimensiones – y por lo tanto el costo – al tiempo que se mejora la eficiencia. Se seleccionaron dos contaminantes comúnmente encontrados en episodios de contaminación de acuíferos y de los más frecuentemente tratados con este tipo de tecnología: el Cr(VI) y el percloroetileno (PCE) (Ellis et al. 2000, Powell et al. 1998).
MATERIALES Y MÉTODOS
La bioestimulación de sistemas Fe(0)–suelo–agua para la reducción de Cr(VI) se evaluó mediante experimentos por lotes, que se desarrollaron en frascos serológicos de 125 mL. Las proporciones de Fe, suelo y HRC se determinaron con base en los procedimientos sugeridos por la empresa Regenesis, la fabricante del compuesto estimulador (Anderson et al. 2006). La cantidad de Fe(0) se seleccionó de modo que la masa combinada de hierro y HRC se mantuviera constante. Se agregó Fe(0) marca Connelly y HRC en las proporciones indicadas en el cuadro I.

A cada reactor se le adicionaron 5 g de suelo obtenido de la UAM–Azcapotzalco, México (con un contenido de 1.78 % de materia orgánica) y 100 mL de agua subterránea sintética. El agua subterránea sintética se preparó con los ingredientes que se enlistan en el cuadro II y se burbujeó 30 minutos con N2 para eliminar el oxígeno disuelto.

Finalmente los reactores se contaminaron con 50 mg/L de Cr(VI) en forma de dicromato de potasio. Todas las series se prepararon por triplicado. Durante el experimento se monitoreó la concentración de Cr(VI) remanente en solución y el pH, mediante la extracción de muestras líquidas de 2 mL.
Para evaluar la degradación de PCE mediante la bioestimulación de microorganismos presentes en el suelo, en sistemas Fe(0)–suelo agua se montaron 3 series de reactores por lotes. Se evaluaron 3 diferentes arreglos de medios reactivos: Fe(0), Fe(0) combinado con HRC y reactores sin agentes reactivos, empleados como testigos. Los reactores se prepararon en botellas serológicas de vidrio de 35 mL con sello de hule y tapa de aluminio, a las que se adicionaron 30 mL del agua subterránea sintética descrita anteriormente, 2.3 g de suelo con un contenido de 1.5% de materia orgánica y 0.4 g de medio reactivo (Fe, o la combinación Fe–HRC), tal como se indica en el cuadro III. Las proporciones de Fe(0) y HRC se determinaron con base en los experimentos que realiza la compañía fabricante del HRC para evaluar la factibilidad de su aplicación en un sitio determinado (Anderson et al. 2006). No se prepararon reactores que contuvieran únicamente HRC dado que el objetivo de este experimento fue evaluar los efectos positivos de la adición de dicho compuesto a un sistema de reducción basado en el Fe(0).

Todas las series se prepararon por triplicado, y se purgaron con N2 para garantizar condiciones anóxicas. Los reactores se contaminaron con 80 (imol de PCE al inicio del experimento y con la misma concentración 80 días después, una vez que los sistemas se estabilizaron. Durante el transcurso del experimento se monitoreó la concentración de PCE y sus metabolitos clorados, metano, eteno y etano. Se midió también el pH.
Métodos analíticos
El percloroetileno y sus posibles productos de degradación se midieron mediante el análisis de la fase gaseosa de las muestras, en un cromatógrafo de gases HP5890, con detector de inductividad electrolítica, y columna DB–5 de 30 m de longitud y 0.35 mm de diámetro (marca J&W Scientific). En los experimentos por lotes las muestras se extrajeron directamente de la fase gaseosa, que fueron inyectadas manualmente al cromatógrafo, con una jeringa Hamilton Gastight Samplelock,
La presencia de metano, etano y eteno se midió en un cromatógrafo HP 5890 Serie II, con columna DB–5 de 30 m de longitud y 0.35 mm de diámetro (marca J&W Scientific), y detector de fotoionización. Para el análisis de gases se tomaron muestras de 30µL de la fase gaseosa de los microcosmos, empleando el mismo tipo de jeringa mencionado anteriormente. La concentración de hidrógeno en fase gaseosa se midió también por análisis del "headspace" en un cromatógrafo de gases con detector de conductividad térmica HP 5890 Serie II y columna Hayesep Q 80/100 de 8 x 1/8 x 0.85".
Los contenidos totales de hierro y cromo se evaluaron en un espectroscopio de absorción atómica de flama Varían Spectraa 200. El Cr(VI) se midió en un espectrómetro UV–visible Varian Cary 50 a 540 nm, de acuerdo con el método de la difenilcarbazida (Clesceri et al. 1999). El Cr(III) se calculó como la diferencia entre Cr total y hexavalente, debido a que las especies de Cr(V) y Cr(IV) son inestables y se reducen fácilmente a la forma trivalente (Cotton et al. 1999).
Reactivos y soluciones
Todas las soluciones se prepararon utilizando agua desionizada. En los experimentos se emplearon compuestos químicos grado reactivo (Sigma–Aldrich, St. Louis, MO). Los recortes de Fe(0) se adquirieron en Connelly GPM, Inc. (Chicago, IL) y se tamizaron para separar la fracción de 18 –3 5 mallas. Esta fracción presentó un área superficial específica de 1.68 ±0.10 m2/g, con una desviación estándar <10 % (datos no mostrados).
El HRC fue proporcionado por la empresa Regenesis (San Clemente, CA), junto con la información sobre la metodología experimental que utiliza para realizar las pruebas de factibilidad (Anderson et al. 2006). Los gases N2 y N2/CO2 (80/20 %) se adquirieron en INFRA S. A. de C. V.
Métodos estadísticos
Se llevó cabo un análisis de varianza para cada uno de los experimentos de bioestimulación. Esto permitió establecer la existencia de diferencias estadísticas significativas entre los diferentes tratamientos. Se utilizó el método de Dunnett que permite la comparación de cada tratamiento con un control, mediante la comparación de la diferencia de las medias contra la t determinada por el intervalo de confianza y el tamaño de las poblaciones. El análisis se realizó con el programa Minitab®.
RESULTADOS Y DISCUSIÓN
Los resultados del experimento en el que se combinó el Fe(0) con HRC en sistemas que contenían suelo y Cr(VI) se muestran en la figura 1.
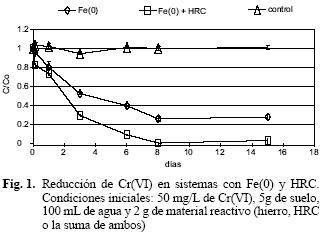
Se observa claramente que la adición de HRC favoreció hasta 30% más la reducción del Cr(VI), que en los casos en que sólo estaba presente el Fe(0) como agente reductor. En este último caso, la reducción del contaminante se lleva a cabo mediante la coprecipitación de Fe(III) y Cr(III) en la superficie del hierro (Blowes et al. 1997), por lo que es factible llegar a la saturación del mismo, lo cual tuvo lugar a partir del día 8 del experimento. La reacción que tiene lugar es:

En experimentos previos se observó que más del 90 % del cromo que se elimina de la solución se transforma en un oxihidróxido estable, que no es afectado por lavados sucesivos, mientras que un porcentaje menor al 10 % se encuentra adsorbido en la superficie (Vázquez 2005). Los resultados de los dos tratamientos son significativamente diferentes a los del testigo (F=22.15, p=0.000), y también entre sí. El HRC no fue diseñado específicamente para estimular reductores de cromo, sin embargo funciona como un sustrato general que favorecerá el desarrollo de cualquier especie anaerobia. En aplicaciones de campo, se ha encontrado que puede dar origen a condiciones de óxido–reducción en el medio que favorecen la reducción de Cr(VI) (Hazen et al. 2004). En el caso en que se adicionó HRC, se logró la reducción completa en el mismo periodo, con una masa total de Fe(0) menor. Este fenómeno puede explicarse mediante el cambio de condiciones redox del medio, lo que favorece la precipitación–reducción del cromo en las partículas de suelo. Es posible, también, que se haya estimulado a poblaciones bacterianas que llevasen a cabo la reducción biológica.
Reducción de PCE
Los primeros 80 días del experimento se utilizaron como periodo de estabilización, dado que en ese intervalo temporal el HRC alcanza su eficiencia óptima de estimulación (Koenigsberg y Vigue 2003). Al final de los 80 días, todos los sistemas presentaron concentraciones similares de PCE. Entonces se re–contaminaron con PCE y una semana después se evaluó el proceso de degradación.
Evolución del pH
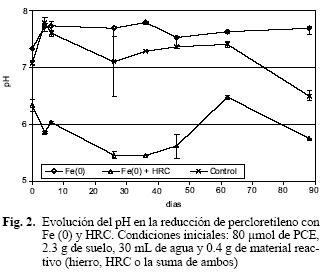
La oxidación anaerobia del Fe(0) produjo aumento en el pH, hasta valores fuera del intervalo que favorece la actividad de los microorganismos presentes en el suelo (Madigan et al. 2000). El incremento fue ligeramente mayor al producido en sistemas que contenían únicamente suelo y agua. La adición de HRC (que libera ácido láctico) contrarrestó ese efecto y mantuvo el pH en valores cercanos a 6, más apropiados para la actividad biológica (Fig. 2). En este experimento la adición de Fe(0) ó Fe(0) combinado con HRC impactó notablemente el pH de los reactores; sin embargo, sería de esperarse que dicho efecto fuera menos drástico en un acuífero, dadas las propiedades amortiguadoras del material sólido del mismo.
Producción de metano
La mezcla Fe(0)–HRC generó condiciones apropiadas para el metabolismo microbiano. Sin embargo, un exceso en la producción de hidrógeno por la oxidación de Fe(0) e hidrólisis del HRC en los sistemas combinados favoreció la actividad de microorganismos metanógenos, tal como se observa en la figura 3. Tradicionalmente se ha considerado que los microorganismos capaces de llevar a cabo la descloración reductiva tienen un desarrollo óptimo a concentraciones bajas de hidrógeno. De ser así, estos pudieron verse superados por una amplia gama de metanógenos (Yang y McCarty 1998), y originar un gasto excesivo de donador de electrones (Yang y McCarty 2002).

Producción de eteno y etano
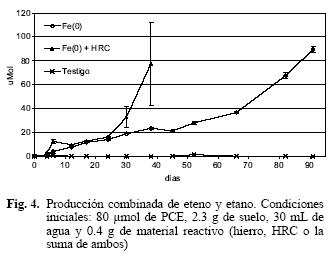
Los productos finales de la descloración del PCE, tanto por la vía abiótica como por el mecanismo biológico, son eteno y etano, por lo que es común utilizarlos como indicadores de que la reducción del contaminante se está llevando a cabo (Lee y Batchelor 2003). En este experimento se detectó su producción en los reactores que contenían Fe(0) y Fe(0) en combinación con HRC. En los primeros 20 días la tasa de generación de etano y eteno fue prácticamente la misma (Fig. 4), lo cual puede atribuirse a la acción del Fe(0). A partir de entonces, se observó una producción masiva de gas en los reactores que incluían el HRC. Ello puede atribuirse al inicio de la actividad del cosustrato, que elevó considerablemente la tasa de generación de gases, principalmente un exceso de metano. La presencia excesiva de este último impidió la medición diferenciada de eteno y etano en los reactores con HRC y dichos gases no se detectaron en los reactores al concluir el experimento.
Reducción de PCE
Durante los primeros 80 días del experimento, el Fe(0) redujo una proporción ligeramente mayor de PCE que el resto de los sistemas (con una diferencia < 20 %), y se generaron eteno y etano como metabolitos. Las diferencias fueron estadísticamente significativas (F= 65.38, p=0.00). En dicho periodo sólo se había detectado tricloroetileno (TCE) en los reactores combinados. Después de 90 días, una vez que los reactores fueron recontaminados, el Fe(0) redujo 20 % del PCE a eteno, mientras que el tratamiento combinado redujo 40 % a TCE, tal como se observa en la figura 5. Cabe aclarar que en el bloque de sorción y volatilización se incluyen el eteno y el etano no detectados. Los reactores que se utilizaron como testigo no produjeron metabolitos.

En el caso del hierro, la reducción se llevó a cabo a partir de la disolución anódica del metal, que genera electrones para la reducción, que puede ocurrir como

Para el HRC, se lleva a cabo un proceso de reducción similar a partir del hidrógeno que se libera durante la hidrólisis del compuesto.
El Fe(0), tal como se esperaba, redujo abióticamente al contaminante. La adición de HRC incrementó notablemente la tasa de desaparición del PCE; si bien no se logró la descloración completa. En todos los casos, la suma del PCE remanente y los metabolitos detectados se encuentran por debajo de la concentración inicial del contaminante. La diferencia se atribuyó a los procesos de sorción y volatilización que pueden ocurrir en los sistemas, aunque no se realizó un análisis detallado de dichos procesos.
La adición de HRC a sistemas reductores basados en el Fe(0) mantendría el pH y posiblemente el potencial redox en intervalos que potencialmente favorecerían tanto reacciones químicas como biológicas. Sin embargo, debido al riesgo de acumulación de metabolitos clorados, el empleo de dicho sistema de bioestimulación requeriría que se confirmase la presencia de bacterias capaces de desclorar completamente el PCE a etano, tales como Dehalococcoides ethenogenes (Maymó–Gatell et al. 1997).
Una segunda opción sería la implementación de un sistema secuencial que incluyera una zona de pretratamiento con HRC, previo a la barrera de Fe(0); en donde se llevaría a cabo la descloración de PCE a TCE. Esto prolongaría la capacidad reactiva del Fe (0), tal como se ha demostrado en sistemas análogos que incluyen un tratamiento previo a la BRP (Kenneke y Mccutcheon 2003). El sistema propuesto se esquematiza en la figura 6.

Este estudio se demostró que es posible aprovechar los efectos sinérgicos Fe–microorganismos, promovidos por la adición de un bioestimulante comercial, el HRC, para la reducción más efectiva de contaminantes como el PCE y el Cr(VI), como los que podrían generarse alrededor de una BRP. Si bien la bioestimulación es poco específica, su facilidad de implementación la hace especialmente atractiva en países en desarrollo, como México. Esta técnica permitiría modificar positivamente la capacidad reductoras global de una barrera y su entorno.
AGRADECIMIENTOS
Los autores agradecen el apoyo otorgado por el Fondo Sectorial de Investigación Ambiental del Consejo Nacional de Ciencia y Tecnología, proyecto CO1–0373/A para la realización de este trabajo.
REFERENCIAS
Adamson D.T., McDade J.M. y Hughes J.B. (2003). Inoculation of a DNAPL source zone to initiate reductive dechlorination of PCE. Environ. Sci. Technol. 37, 2525–2533. [ Links ]
Anderson D., Ochsner M., Sandefur y Koenigsberg S. (2006). Remedial action using HRC under a state dry cleaning program (en línea), Regenesis (citado 2006), disponible en http://www.regenesis.com//library/2000publications. [ Links ]
Barnes P. W., Heaston M. S. y Compton J.C. (2001). Treatment of explosives–contaminated groundwater by in situ cometabolic reduction. En: Sixth Annual in–situ and on–site bioremediation conference (P.C. Johnson, R.E. Hinchee, L. Semprini, V.S. Magar, B.M. Peyton, J.L. Means, Eds.). San Diego, CA. pp. 25–39. [ Links ]
Blowes D.W., Ptacek C.J. y Jambor J.J. (1997). In–situ remediation of Cr(VI)–contaminated groundwater using permeable reactive walls: laboratory studies. Environ. Sci. Technol. 31, 3348–3357. [ Links ]
Carr C. S. y Hughes J.B. (1998). Enrichment of high–rate PCE dechlorination and comparative study of lactate, methanol and hydrogen as electron donors to sustain activity. Environ. Sci. Technol. 32, 1817–1824. [ Links ]
Clesceri L.S., Greenberg A.E. y Eaton A.D. (1999). Standard methods for examination of water & wastewater. American Public Health Association, Washington, D. C., 1220 p. [ Links ]
Cotton F.A., Wilkinson G., Murillo C.A. y Bochmann, M. (1999). Advanced inorganic chemistry. Wiley, Nueva York, 1355 p. [ Links ]
DOE (1998). Research and application of permeable reactive barriers. Department of Energy, Washington, D. C., 50 p. [ Links ]
Ellis D.E., Lutz E.J., Odom J.M., Buchanan R.J.J., Bartlett C.L., Lee M.D., Harkness M.R. y Deweerd K. A. (2000). Bioaugmentation for accelerated in situ anaerobic bioremediation. Environ. Sci. Technol. 34, 2254–2260. [ Links ]
Farone W. y Palmer T. (2001). Comparison of reducing agents for dechlorination in a simulated aquifer. En: Anaerobic degradation of chlorinated solvents: The Sixth International in Situ and On–Site Bioremediation Symposium, San Diego, California, (V.S. Magar, D. Fennell, J. Morse, B.C. Alleman, A. Leeson, Eds.). Battelle Press, Columbus, OH pp 103–108. [ Links ]
FRTR (Federal Remediation Technologies Roundtable) (2004). Abstract of remediation case studies, Volume 8 (en línea), (citado 2004), disponible en http://www.frtr.gov/publib.htm. [ Links ]
Gu B., Phelps T.J., Liang L., Dickey M.J., Roh Y., Kinsall B.L., Palumbo A.V. y Jacobs G.K. (1999). Bio–geochemical dynamics in zero–valent iron columns: implications for permeable reactive barriers. Environ. Sci. Technol. 33, 2170–2177. [ Links ]
Hazen T.C., Faybishenko B., Wan J., Tokunaga T.K., Hubbard S., Firestone M.K., Long P.E. y Koenigsberg S.S. (2004). Field investigations of lactate–stimulated bioreduction of Cr(VI) to Cr(III) at Hanford 100H (en línea), Regenesis, DOE, NABIR (citado 2004), disponible en http://esd.lbl.gov/ERT/hanford100h. [ Links ]
ITRC (Interstate Technology & Regulatory Council) (2003). Permeable reactive barriers: lessons learned/ new directions. PRB–4, (en línea). Permeable reactive barriers team (citado 2006), disponible en www.itrcweb.org. [ Links ]
Jurgens B. y Linn W. (2003). Drycleaner site assessment & remediation – A technology snapshot (en línea), Kansas Department of Health & Environment, (citado 2004), disponible en www.drycleancoalition.org. [ Links ]
Kenneke J.F. y Mccutcheon S.C. (2003). Use of pretreat–ment zones and zero–valent iron for the remediation of chloroalkenes in an oxic aquifer. Environ. Sci. Technol. 37, 2829–2835. [ Links ]
Koenigsberg S.S. y Vigue B.W. (2003). Time release–electron donors for accelerated bioremediation – The technology and lessons learned. Pollut. Eng. 35, 12–17. [ Links ]
Lee W. y Batchelor B. (2003). Abiotic reductive dechlorination of chlorinated ethylenes by iron–bearing soil minerals. 2. Green rust. Environ. Sci. Technol. 36, 5348–5354. [ Links ]
Logan B.E., Zhang H., Wu J., Unz R. y Koenigsberg S.S. (2000). The potential for in situ perchlorate degradation. En: Case studies in the remediation of chlorinated and recalcitrant compounds (G. B. Wickramanayake, A. R. Gavaskar, J. T. Gibbs y J. L. Means, Eds.) Battelle Press, Columbus, OH. pp. 87–92. [ Links ]
Madigan M.T., Martinko J.M. y Parker J. (2000). Brock biology of microorganisms. Prentice–Hall, Nueva Jersey. 991 p. 1. [ Links ]
Maymó–Gatell X., Chien Y.–T., Gossett J.M. y Zinder S.H. (1997). Isolation of a bacterium that reductively dechlorinates tetrachloroethene to ethene. Science, 276, 1568–1571. [ Links ]
Phillips D.H., Watson D.B., Roh Y. y Gu B. (2003). Mineralogical characteristics and transformations during long–term operation of a zerovalent iron reactive barrier. J. Environ. Qual. 32, 1299–1305. [ Links ]
Powell R.M., Blowes D.W., Gillham R.W., Schultz D., Sivavec T., Puls R. W., Vogan J.L., Powell P.D. y Landis R. (1998). Permeable reactive barrier technologies for contaminant remediation. United States Environmental Protection Agency. Washington, D.C., 114 p. [ Links ]
Regenesis (2003). HRC Technical Bulletin # 1.1.3 (en línea), Regenesis (citado 2004), disponible en http://www.regenesis.com/HRCtech/hrctb131.htm. [ Links ]
Scherer M.M., Richter S., Valentine R.L. y Álvarez P.J. J. (2000). Chemistry and microbiology of permeable reactive barriers for in situ groundwater clean up. Crit. Rev. Microbiol. 26, 221–264. [ Links ]
Vazquez Morillas A. (2005). Degradación de hidrocarburos totales del petróleo presentes en acuíferos mediante el uso de barreras bioaumentadas de Fe(0).Tesis de Doctorado en Ciencias e Ingeniería, Universidad Autónoma Metropolitana Azcapotzalco. México, D.F. 143 p. [ Links ]
Yang Y. y McCarty P.L. (1998). Competition for hydrogen within a chlorinated solvent dehalogenating anaerobic mixed culture. Environ. Sci. Technol. 32, 3591–3597. [ Links ]
Yang Y. y McCarty P.L. (2002). Comparison between donor substrates for biologically enhanced tetrachloroethene DNAPL dissolution. Environ. Sci. Technol. 36, 3400–3404. [ Links ]














