Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de cardiología
versão impressa ISSN 0188-2198
Rev. Mex. Cardiol vol.23 no.3 México Jul./Set. 2012
CASO CLÍNICO
Tamponamiento cardiaco y lupus eritematoso sistémico. Reporte de un caso
Systemic lupus erythematosus and cardiac tamponada. Case report
José Antonio Villalobos Silva,* Salvador Facundo Bazaldua,**
Juan Ramón Hernández Cázares,*** Adriana Campos Martínez***
* Jefe Unidad de Cuidados Intensivos del Hospital Regional de Alta Especialidad de Cd. Victoria, Tamaulipas y adscrito a la Unidad de Cuidados Intensivos del Hospital General ''Dr. Norberto Treviño Zapata''.
** Cardiólogo Intervencionista adscrito a la Unidad de Cuidados Coronarios del Hospital General ''Dr. Norberto Treviño Zapata''.
*** Residente segundo año de Medicina Interna del Hospital General ''Dr. Norberto Treviño Zapata''.
Dirección para correspondencia:
Dr. José Antonio Villalobos Silva.
Hospital Regional de Alta Especialidad
Ciudad Victoria
Libramiento Guadalupe Victoria S/N,
Área de Pajaritos, 87087, Ciudad Victoria, Tamaulipas.
Tel. (834) 153 6100
RESUMEN
El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria que tiene repercusión en múltiples sistemas, se ha observado en múltiples estudios que la afectación cardiaca se presenta en 15% de los pacientes, en algún momento de su historia natural de la enfermedad se observa pericarditis hasta en 23% además de miocarditis y endocarditis; sin duda secundario a esto suele observarse derrame pericárdico, y a pesar de mostrar porcentajes no despreciables de afección cardiaca, es muy infrecuente que se ocasione taponamiento cardiaco. El taponamiento cardiaco es un proceso en el que aumenta la presión del espacio pericárdico, debido en mayor frecuencia a acumulación de líquido, que puede ser un exudado hemático, seroso o purulento, y con menor frecuencia gas, dadas las complicaciones el diagnóstico oportuno y su tratamiento se deben realizar de manera rápida. Por tal motivo describimos el caso de una paciente en la sexta década de la vida, la cual no presenta antecedentes de importancia que ingresa a urgencias con cuadro caracterizado por disnea progresiva y dolor precordial, en base a clínica, estudios de gabinete y evolución, se llega al diagnóstico de taponamiento cardiaco, el cual posteriormente en base a estudios complementarios se corrobora que es secundario a lupus eritematoso sistémico.
Palabras clave: Tamponade cardiaco, lupus eritematoso sistémico, repercusión sistémica.
ABSTRACT
Systemic lupus erythematosus (SLE) is an inflammatory disease that has an impact on multiple systems, is observed in multiple studies to the cardiac involvement occurs in 15% of patients, at some point in their natural history of disease is observed pericarditis by up to 23% in addition to myocarditis and endocarditis, no doubt this is often seen secondary to pericardial effusion, despite showing despite non-negligible percentage of heart disease is very uncommon to cause cardiac tamponade. Cardiac tamponade is a process in which increased pressure in the pericardial space, most often due to fluid accumulation, which can be an exudate hematic, serous or purulent, and less frequently gas, given the complications and timely diagnosis treatment have to be done quickly. For this reason we describe a case of a female in the sixth decade of life, which no previous medical history was admitted to the emergency room with a condition characterized by progressive dyspnea and chest pain based on clinical, radiologic and evolution she reach the diagnosis of cardiac tamponade, which subsequently based on additional studies corroborate that is secondary to lupus erythematosus.
Key words: Cardiac tamponade, systemic lupus erythematosus, cardiac tamponade, systemic repercussion.
Introducción
El lupus eritematoso sistémico (LES), en una enfermedad crónica, inflamatoria, multisistémica, autoinmune, potencialmente fatal, ya que los pacientes con LES tienen una mortalidad tres veces mayor que la población general. Es de etiología desconocida, pero se caracteriza por la presencia de inmunocomplejos y anticuerpos antinucleares (ANA), y es más común en mujeres en edad reproductiva. El curso de la enfermedad se caracteriza por remisiones y exacerbaciones, los pacientes presentan artritis, diferentes tipos de rash, serositis, citopenias, síntomas neurológicos y nefritis; puede afectar diversos órganos, entre ellos la afección cardiaca en 15% de los casos. Dentro de las manifestaciones cardiacas de LES, se reportan pericarditis, miocarditis, endocarditis y alteraciones de la conducción. La pericarditis es común en LES de inicio tardío, con una incidencia de 23 a 27%; sin embargo, es poco usual la presentación de derrame pericárdico que desarrolle taponamiento cardiaco, presentándose sólo en 6% de los casos de pericarditis.1,2 La baja incidencia de taponamiento cardiaco a pesar de la alta prevalencia de pericarditis en pacientes con LES, se debe al uso de terapia esteroidea y con antiinflamatorios no esteroideos (AINES), quienes reducen de manera efectiva la inflamación pericárdica.3-5 Se desarrolla el taponamiento cardiaco cuando se acumula el líquido de manera crítica en el espacio pericárdico, con compresión de las cavidades cardiacas. Desarrollando inestabilidad hemodinámica cuando la acumulación es de manera rápida, poniendo en peligro la vida, al contrario de cuando la acumulación es de manera lenta que permita la activación de mecanismos compensatorios como la acción adrenérgica y estimulación neurohormonal que estabilizan el gasto cardiaco. Clínicamente se manifiesta por disnea, ortopnea, ingurgitación yugular, dolor precordial, pulso paradójico, aumento de la presión venosa central, hipotensión y ruidos cardiacos apagados.6-8
Ante la sospecha clínica de un derrame pericárdico, y un electrocardiograma que muestre alternancia eléctrica con ondas QRS de bajo voltaje, deben realizarse estudios complementarios como ecocardiograma Doppler, el cual es el principal método diagnóstico utilizado, también se utiliza la resonancia magnética y la tomografía computarizada, sin embargo estos últimos menos accesibles y más caros; todo esto con la finalidad de evidenciar el volumen del derrame y la localización del mismo. El tratamiento se enfoca principalmente a disminuir la compresión de las cámaras cardiacas, drenando el contenido del espacio pericárdico, la inestabilidad hemodinámica es una indicación absoluta de drenaje, la pericardiocentesis es el método más frecuente de drenaje; los procedimientos quirúrgicos, como la realización de ventana pericárdica se reservan cuando existe un derrame crónico, recurrente en donde se han realizado múltiples pericardiocentesis y cuando por la localización del derrame, como en los posteriores no son accesibles a la pericardiocentesis. Siendo esta complicación algo infrecuente pero que puede poner en peligro la vida del paciente, describimos el caso de un paciente femenino sin antecedentes importantes, quien debuta con un cuadro de taponamiento cardiaco, que amerita el uso de inotrópicos y drenaje mediante ventana pericárdica; y que dentro del diagnóstico diferencial se solicitan estudios complementarios, llegando finalmente a un diagnóstico de LES.9-12
Caso clínico
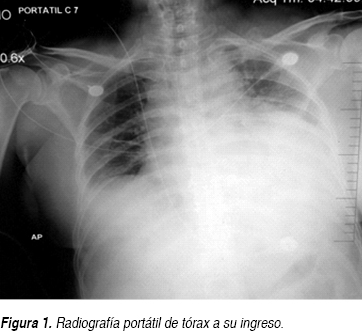
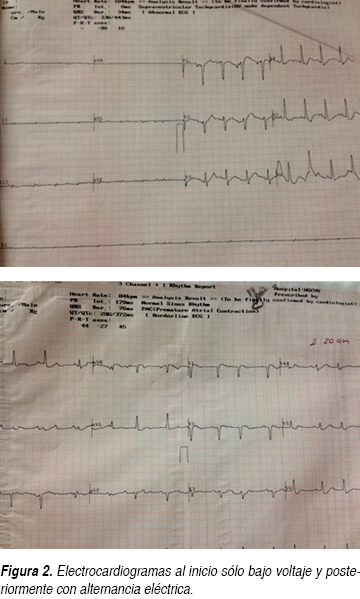
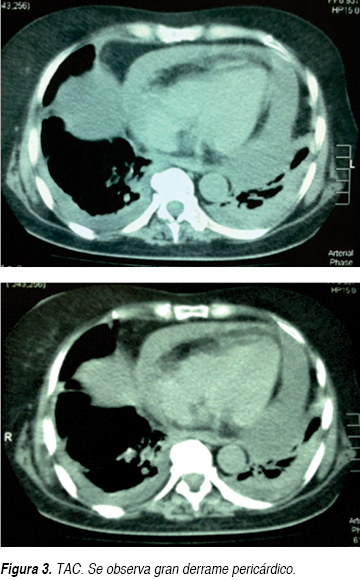
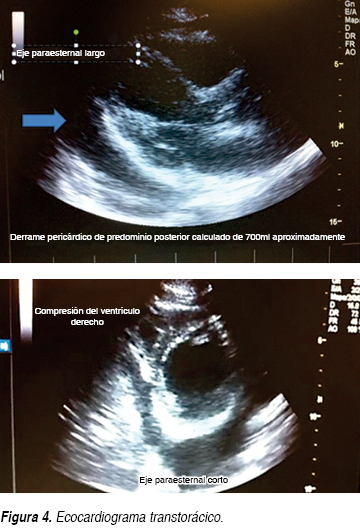
Se trata de paciente femenino 61 años de edad que ingresa al Servicio de Urgencias por un cuadro de disnea y dolor opresivo; negando en su interrogatorio directo antecedentes de tabaquismo o etilismo, sin antecedentes cronicodegenerativos, no antecedentes neurológicos ni psiquiátricos, niega también intervenciones quirúrgicas, así como historial de hemotransfusiones o alérgicos, sólo dos ingresos previos por proceso infeccioso en los últimos dos meses. En esta ocasión, una semana previa a su ingreso, inicia nuevamente con tos con expectoración hialina escasa, acompañada de escalofríos y fiebre no cuantificada sin predominio de horario, agregándose disnea de medianos esfuerzos de carácter progresivo hasta disnea de reposo y ortopnea con dolor torácico opresivo sin irradiaciones, además de sensación de palpitaciones. A la exploración física, encontramos a la paciente consciente, orientada, sin alteraciones cognitivas, ni déficit neurológico focal, con intolerancia al decúbito, palidez mucocutánea generalizada, diaforesis, con una presión arterial de 100/80 mmHg, cuello con ingurgitación yugular grado II, en tórax se observa taquipnea, amplexión y amplexación simétricas, campos pulmonares con estertores crepitantes en hemitórax izquierdo y disminución de ruidos respiratorios del mismo lado, ruidos cardiacos rítmicos de baja intensidad, frecuencia cardiaca de 128 lpm, con frote pericárdico, el abdomen blando, depresible, no se palpan visceromegalias, peristalsis presente, extremidades con edema pretibial leve bilateral, con cambios tróficos. Se solicitan estudios paraclínicos los cuales reportaron anemia moderada normocítica normocrómica con una hemoglobina de 9.4 g, sin leucocitosis ni alteraciones en recuento plaquetario. Presenta hipocalemia de 2.5 mEq/L, así como hipocloremia de 82 mEq/L, e hiponatremia 124 mEq/L; pruebas de función hepática sólo con hipoalbuminemia de 2.6 g/dL, aumento de la deshidrogenasa láctica (DHL) en 764 mg/dL, elevación de transaminasa glutámica oxalacética (TGO) en 63 U/L, sin hiperbilirrubinemia; con una función renal sólo urea de 67 mg/dL y BUN 31.3 mg/dL, con creatinina de 0.5; resto dentro de parámetros normales; gasometría arterial de inicio con alcalosis respiratoria con pCO2 de 27.9, HCO3: 26.9; con pruebas de función tiroidea documentando hipotiroidismo con los siguientes valores TSH 4.2 mcU/mL, T4 libre 0.33 ng/dL. Además se realizaron estudios de gabinete complementarios, en la radiográfica de tórax se observa cardiomegalia grado IV, silueta cardiaca con bordes mal definidos (Figura 1), el electrocardiograma (ECG) inicial con ritmo sinusal, FVM: 100 x min, bajo voltaje en derivaciones bipolares, sin alternancia eléctrica, sin embargo en las primeras horas de evolución descendió paulatinamente su ritmo 75 min con datos iniciales de alternancia eléctrica (Figura 2). Dado los resultados anteriores, se decide solicitar tomografía axial computarizada (TAC) simple de tórax en donde en la ventana mediastinal observamos ocupación alveolar del segmento posterior del hemitórax izquierdo y cardiomegalia, con imagen en doble contorno, con mediciones de densidades correspondientes a líquido, en área intrapericárdica (Figura 3) se decide evaluar dinámicamente al miocardio mediante la realización de ecocardiograma transtorácico (ECOTT) el cual confirmó derrame pericárdico de aproximadamente 700 mL, con compromiso mecánico y hemodinámico de predominio posterior, hipocinesia severa del ventrículo izquierdo. Fracción de eyección del ventrículo izquierdo (FEVI) de 40%, insuficiencia tricuspídea leve e hipertensión arterial pulmonar leve (Figura 4). Debido a que la paciente, mostró exacerbación de la sintomatología, con inestabilidad hemodinámica caracterizada por pulso paradójico, hipotensión arterial la cual ameritó apoyo con aminas vasoactivas, presión venosa central elevada (PVC); dada a la localización del derrame pericárdico, y ante la imposibilidad de realizar pericardiocentesis, se solicita valoración por cirugía cardiovascular, quien decide intervención quirúrgica de urgencia para drenaje, mediante ventana pericárdica peritoneal, obteniendo líquido aproximadamente 600 mL, de color café oscuro, el cual se envía a laboratorio así como toma de biopsia. La paciente en su postoperatorio inmediato se pasa a Unidad de Cuidados Intensivos con respiración espontánea, hemodinámicamente estable, en donde presenta mejoría clínica importante, con disminución del esfuerzo respiratorio y normalización de sus cifras tensionales, aunque con apoyo de dobutamina a 5 μg/kg/min, se toma electrocardiograma y se observa voltaje adecuado en todas las derivaciones. Se recaba reporte de citoquímico de muestra de líquido pericárdico, aspecto xantocrómico ligeramente turbio, glucosa de 84 mg/dL, proteínas totales de 4.7 g, conteo de células totales de 5,100, de las cuales 87% fueron segmentadas, tinción Gram con escasos cocos Gram positivos y abundante polimorfonucleares, se solicitaron además tinción Ziehl Neelsen la cual fue negativa y adenosin desaminasa (ADA) con un resultado de 61.2 U/L. El reporte de biopsia de pericardio: pericarditis crónica linfocítica inespecífica con actividad leve. Ante estos resultados, solicitamos determinaciones inmunológicas pensando como diagnóstico diferencial principal lupus eritematoso sistémico. Se realiza ventana ecocardiográfica de control observando derrame pericárdico mínimo menor a 50 mL, con pericardio hiperrefringente de 8 mm con FEVI de 44% y movimiento septal paradójico. La paciente evoluciona dentro de la UCI de manera favorable sin datos de falla cardiaca aguda y patrón ventilatorio normal, además de retiro de aminas vasoactivas debido a estabilidad hemodinámica; por lo que se decide continuar su manejo en área de hospitalización. En donde se reciben resultados de anticuerpos antinucleares positivos de 1:2,560 con patrón homogéneo, complemento C3 en 76 mg/dL, anticuerpos antiDNA de doble cadena positiva con 107.8 U/L, beta 2 microglobulina sérica: 5,233 ng/dL. Se decide iniciar manejo con pulsos de esteroides intravenosos, con una buena respuesta, mejorando su sintomatología, continuando manejo con esteroides orales; además de hormonas tiroideas, digitálico.
Discusión
La presentación de un tamponade cardiaco puede ser secundaria a una amplia variedad de situaciones clínicas, globalmente podemos afirmar que estos derrames son secundarios a uremia en un 22.6%, a neoplasias en un 14.5%, a pericarditis bacteriana en un 11.3%, a pericarditis aguda idiopática en un 10.3% y en el 40.3% restante a otras causas. Según un estudio publicado en 2002 por Oliver Navarrete y colaboradores desde la perspectiva del taponamiento cardiaco, cuando éste sucede, la etiología más frecuente es neoplásica en 52.1%, idiopática en 14.6%, urémica en 12.5%, iatrogénica en el 7.3%, mecánica en 4.2%, tuberculosa en un 2.1% y debido a otras causas menores en el restante 7.3% dentro de este rubro se encuentra el tamponade como manifestación hemodinámica de la enfermedad de lupus eritematoso sistémico (LES). La paciente de este estudio no se identificaron factores de riesgo para sospechar inicialmente en un padecimiento inmunológico. El taponamiento cardiaco de cualquier paciente es el resultado de un espectro de alteraciones hemodinámicas, la condición obligada es la compresión de las cavidades cardiacas, puede ser leve hasta una compresión crítica con una marcada reducción de la función cardiaca; el paciente crítico por tamponade puede producirse a partir de 150 mL de sangre si es agudamente introducido en el espacio pericárdico o puede requerir sustancialmente más de un litro de líquido si éste se acumula lentamente.13,14
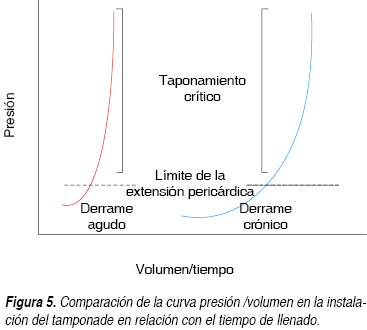
Sin duda en el caso presentado se observaron 700 mL de líquido libre en la parte posterior del saco pericárdico, este hallazgo inclina seguramente a un padecimiento subagudo no identificado. La importancia de la cantidad de volumen tolerado por el saco pericárdico está en relación a la rapidez de formación de dicho líquido, la curva presión volumen ejemplifica gráficamente este fenómeno fisiopatológico (Figura 5). Inicialmente se llenan los huecos de los senos del pericardio parietal incrementando la presión lentamente sobre la parte plana de la curva, en este punto, los incrementos adicionales de volumen añadido aumentarán la presión intrapericárdica exponencialmente afectando las paredes más delgadas del corazón derecho. La reducción en el volumen sistólico da inicio a los mecanismos de compensación neurohumoral incrementando el tono adrenérgico principalmente la taquicardia que ayudará a mantener el gasto cardiaco y la vasoconstricción que sostendrá una presión arterial media mayor a 70 mmHg. La activación del sistema renina-angiotensina-aldosterona se produce relativamente tarde, esto contribuye a disminución de la excreción urinaria de sodio y retención de agua en un esfuerzo para mantener la presión arterial. La disnea y taquipnea que presentó la paciente del caso a su ingreso fueron datos principales que se correlacionan con una evolución lenta hacia el taponamiento cardiaco, estos pacientes casi siempre se sienten más cómodos sentados en posición vertical en lugar de en posición supina, a diferencia la anorexia, la profunda debilidad y el edema de las extremidades inferiores puede ocurrir pero son síntomas que se presentan con menos frecuencia, el compromiso hemodinámico progresa y los pacientes se vuelven ansiosos con diaforesis, taquicardia y la presión de pulso disminuye paulatinamente hasta llegar al colapso cardiovascular. En la fase avanzada de taponamiento, independientemente de la velocidad de desarrollo, los pacientes experimentan disminución progresiva del estado de alerta hasta el estupor acompañado de extremidades frías y húmedas, son manifestaciones de estado de choque, en estos casos los pacientes pueden presentar la tríada de Beck que consiste en los ruidos cardiacos apagados, hipotensión e incremento de la presión venosa yugular. El pulso paradójico observado en el monitor de la paciente, corroborado a la exploración física y que se define como una disminución en la inspiración arterial sistólica presión por más de 10 mmHg, está presente en la mayoría de los pacientes siendo en nuestro caso también un dato indirecto que dio la pauta al ECOTT.15-18
Durante la inspiración, la presión intratorácica disminuye, observando también la disminución de la presión intrapericárdica e intracavitaria de la aurícula y ventrículo derecho; al igual que en los sujetos sanos, la disminución de la presión del corazón derecho provoca un incremento en el retorno venoso hacia las cavidades derechas del corazón, con un respectivo incremento del volumen ventricular derecho. Durante el taponamiento cardiaco, las cámaras cardiacas se encuentran con una misma presión intracavitaria y un volumen total fijo, el incremento del volumen ventricular derecho durante la inspiración reduce aún más el espacio de ventrículo izquierdo por un desplazamiento del septum, esta pérdida de precarga ventricular izquierda hace disminuir el flujo aórtico y la presión arterial durante la fase de inspiración (Figura 6). Los hallazgos electrocardiográficos en el taponamiento cardiaco son inespecíficos, sin embargo la alternancia eléctrica del complejo QRS observada en algunos pacientes demuestra un derrame pericárdico altamente sugestivo de taponamiento cardiaco. La radiografía de tórax no distingue el derrame pericárdico del taponamiento cardiaco, pero puede demostrar patología pulmonar agregada; sin embargo actualmente la ecocardiografía es la prueba más sensible y específica para el diagnóstico de taponamiento cardiaco; proporciona información acerca de la cantidad y ubicación del líquido pericárdico y su repercusión hemodinámica por compresión de las cavidades cardiacas. El colapso de la aurícula derecha en la teledíastole se considera el signo más sensible, descrito en l 90%, de ahí el siguiente signo observado hasta en 30% es el colapso ventricular, como se describe en el caso clínico y sólo en menores ocasiones se puede observar la dilatación de la vena cava inferior.19,20

El drenaje del líquido pericárdico es el único tratamiento eficaz, generalmente se realiza de forma urgente, dependiendo de las circunstancias individuales. Cuando es necesario la eliminación de pequeñas cantidades de fluidos (incluso 50 a 100 mL) da lugar generalmente a una disminución sustancial de la presión intrapericárdica y mejoría parcial en su estado hemodinámico para tener mayor tiempo de elección acerca de cuál será el mejor tratamiento resolutivo. En nuestro caso la paciente cursaba con un derrame pericárdico posterior que impedía una realización de pericardiocentesis exitosa por tener amplio riesgo de perforar el miocardio, observando que la distancia desde la piel hasta el espacio pericárdico y su trayectoria de la aguja era imposible la extracción de líquido. En aquellos pacientes donde el derrame pericárdico permite una adecuada separación entre el pericardio y la pared libre del ventrículo se utiliza anestesia local, una Intracath teflón-enfundado (16-18 de calibre 5.1 a 8.3 cm) se realiza punción a 1 cm por debajo del apéndice xifoides en dirección al hombro izquierdo con una angulación de 45 grados y a una profundidad de 2.5-3 cm, generalmente se logra alcanzar el pericardio, al introducir la guja siempre se realiza presión negativa del émbolo y se monitoriza con un electrocardiógrafo. La presión intrapericárdica se puede medir en este punto con un manómetro unido al intracath. Un alambre guía de punta blanda se puede avanzar en el espacio pericardio y un angiocatéter se inserta en el espacio pericárdico para drenaje continuo hacia una botella de succión, también puede drenarse de forma manual con una llave de 3 vías. Sin embargo, en aquellos pacientes con un derrame complicado, recurrente o con un gran problema hemodinámico y la imposibilidad de la realización de una pericardiocentesis será necesario la pericardiotomía quirúrgica o la realización de una ventana pericárdica, que por lo general es el procedimiento de elección de los derrames recurrentes y es siempre el procedimiento de elección si no hay médico disponible con experiencia en la pericardiocentesis cerrada. En relación al caso se realizó de urgencia una ventana pericárdica, con colocación de un drenaje por 24 h, observando la salida total del líquido rojizo no coagulable. El líquido extraído de los pacientes necesariamente tiene que ser analizado para su orientación diagnóstica, y además debe ser apoyado con pruebas séricas especiales para la realización del diagnóstico diferencial:
• Electrólitos anormalidades metabólicas (por ejemplo, insuficiencia renal).
• Conteo sanguíneo completo (CBC) con diferencial - Leucocitosis para detectar la infección, así como citopenias, como signos de la enfermedad de base crónica (por ejemplo, cáncer, VIH).
• Enzimas cardiacas.
• Hormona estimulante del tiroides - Estimulante de la tiroides pantalla de la hormona para el hipotiroidismo.
• Anticuerpos Rickettsia - Si hay un alto índice de sospecha de enfermedad transmitida por garrapatas.
• El factor reumatoide, los complejos de inmunoglobulina, la prueba de anticuerpos antinucleares (ANA), y los niveles de complemento (que se vería disminuida) - En supuestas causas reumatológicas.
• PPD.
• Los marcadores tumorales elevados - Antígeno carcinoembrionario (CEA) en los niveles de líquido pericárdico tiene una alta especificidad para los derrames malignos.
• El análisis del líquido pericárdico: Estas pruebas (que debe ser considerado como parte del análisis del líquido pericárdico estándar) son los siguientes:
- Láctico (ácido) deshidrogenasa (LDH), proteínas totales - Los criterios de Light que se encuentran de ser lo más fiable para distinguir entre exudados y trasudados: (1) las proteínas totales de líquido de suero-ratio> 0.5, (2 ) LDH líquido-a-suero relación > 0.6, (3) el nivel de LDH líquido superior a dos tercios de límite superior del nivel de suero normal.
- Otros indicadores que sugieren exudado - Gravedad específica > 1.015, proteínas totales > 3.0 mg/dL, LDH > 300 U/dL, glucosa en el líquido a razón de suero < 1.
- El conteo celular - Leucocitos elevados (es decir > 10,000), con predominio de neutrófilos sugiere causa bacteriana o reumática, aunque poco fiable.
- Tinción de Gram - Específica (pero insensible) indicador de infección bacteriana.
- Hematócrito de líquidos para los aspirados con sangre.
- Pruebas especiales.
•Éstos deben ser considerados de forma individual sobre la base de la probabilidad pretest. Incluyen los siguientes:
•Los cultivos virales.
•La adenosina deaminasa (ADA), la reacción en cadena de polimerasa (PCR), frotis para bacilos ácido alcohol resistentes en la infección por sospecha de tuberculosis, especialmente en pacientes con VIH.
La pericarditis tuberculosa se basa en la prueba de la tuberculosis en otros lugares en un paciente con pericarditis de otro modo inexplicable, un exudado linfocitario pericárdico con niveles elevados de adenosina deaminasa, y/o respuesta adecuada a un ensayo de quimioterapia antituberculosa.
Los hallazgos en la radiografía de tórax en estos pacientes incluyen silueta cardiaca aumentada (la llamada botella de agua del corazón) y banda de grasa pericárdica. Un tercio de los pacientes tienen coexistencia de derrame pleural y la radiografía no es confiable para establecer o refutar el diagnóstico de derrame pericárdico; debido a la poca sensibilidad y especificidad que tiene el estudio es necesario la realización de ECO, TAC y en algunos casos RM ya que puede ser capaz de distinguir los líquidos hemorrágico y no hemorrágico, como fluidos hemorrágicos tienen una alta intensidad de señal en la T-1 imágenes ponderadas, mientras que los líquidos no hemorrágicos tienen una baja intensidad de señal. Nódulos o irregularidades del pericardio visto en la RM puede ser indicativo de un derrame pleural maligno. Sin embargo, la RM es más difícil de realizar que la TAC en un proceso agudo debido al tiempo que el paciente debe permanecer en el escáner.21,22
Conclusión
Sin duda este caso ejemplifica lo complejo que puede ser llegar al diagnóstico definitivo para su manejo específico, por lo que podemos resumir que:
Los pacientes con derrame pericárdico que se presentan con síntomas significativos o taponamiento cardiaco requieren tratamiento de urgencia y admisión a la Unidad de Cuidados Intensivos (UCI) para colocación de un catéter pericárdico y realizar descompresión intrapericárdica o en su defecto pasar inmediatamente a cirugía de pericardiectomía o ventana pericárdica, para mejorar su estado hemodinámico colapsado y posteriormente realizar los estudios pertinentes hasta el tratamiento definitivo.
REFERENCIAS
1. Gill JM, Quisel AN, Rocca PV, Walters DT. Diagnosis of systemic lupus erythematosus. Am Fam Phys 2003; 68: 2179-2182. [ Links ]
2. Pérez AF, Villagómez OA, Castro AM, Hernández SS. Taponamiento cardiaco como complicación de tuberculosis pericárdica. Reporte de un caso y revisión bibliográfica. Med Inter Méx 2009; 25: 81-88. [ Links ]
3. Jaume SS, Juan A, Antonia SG, Permayer-Miralda G. Hemodynamic effects of volume expansion in patients with cardiac tamponade. Circulation 2008; 117: 1545-1549. [ Links ]
4. Maisch B, Seferovic P, Ristic A, Erbel R. Guidelines on the diagnosis and management of pericardial diseases, executive summary. Eur Heart J 2004; 25: 587-610. [ Links ]
5. Gladman DD, Esdaile JM, Hahn BH, Klippel J. Guidelines for referral and management of systemic lupus erythematosus in adults. Arthrit Rheum 1999; 42: 1785-1796. [ Links ]
6. Spodick DH. Acute cardiac tamponade. N Engl J Med 2003; 349: 684-690. [ Links ]
7. Collins D. A etiology and management of acute cardiac tamponade. Crit Care Resuscit 2004; 6: 54-58. [ Links ]
8. Manresa JM, Gutiérrez L, Viedma P, Alfani O. Taponamiento cardiaco como presentación clínica de lupus eritematoso sistémico. Rev Esp Cardiol 1997; 50: 600-602. [ Links ]
9. Rosales US, Castellanos CL, Galindo UJ. Alteraciones cardiacas en pacientes con lupus eritematoso sistémico y sospecha clínica de miocarditis: diagnóstico por resonancia magnética cardiovascular. Rev Mex Cardiol 2011; 22: 167-174. [ Links ]
10. Roy CL, Minor MA, Brookhart MA, Choidhry NK. Does this patient with a pericardial have cardiac tamponade? JAMA 2007; 297: 1810-1818. [ Links ]
11. Madhok R, Wu O. Systemic lupus erythematosus. Am Fam Phys 2007; 76: 1351-1353. [ Links ]
12. Schoenfeld MR, Messeloff CR. Cardiac tamponade in systemic lupus erythematosus. Circulation 1963; 27: 98-99. [ Links ]
13. Maisch B, Risti AD. The classification of pericardial disease in the age of modern medicine. Curr Cardiol Rep 2002; 4: 13-21. [ Links ]
14. Maisch B, Risti AD, Pankuweit S. Intrapericardial treatment of autoreactive pericardial effusion with triamcinolone: the way to avoid side effects of systemic corticosteroid therapy. Eur Heart J 2002; 23: 1503-1508. [ Links ]
15. Reydel B, Spodick DH. Frequency and significance of chamber collapses during cardiac tamponade. Am Heart J 1990; 119: 1160-1163. [ Links ]
16. Kochar GS, Jacobs LE, Kotler MN. Right atrial compression in postoperative cardiac patients: detection by transesophageal echocardiography. J Am Coll Cardiol 1990; 16: 511-516. [ Links ]
17. Torelli J, Marwick TH, Salcedo EE. Left atrial tamponade: diagnosis by transesophageal echocardiography. J Am Soc Echocardiogr 1991; 4: 413-414. [ Links ]
18. Garcia LW, Ducatman BS, Wang HH. The value of multiple fluid specimens in the cytological diagnosis of malignancy. Mod Pathol 1994; 7: 665-668. [ Links ]
19. Burgess LJ, Reuter H, Carstens ME, Taljaard JJ, Doubell AF. The use of adenosine deaminase and interferon-gamma as diagnostic tools for tuberculous pericarditis. Chest 2002; 122: 900-905. [ Links ]
20. Seo T, Ikeda Y, Onaka H et al. Usefulness of serum CA125 measurement for monitoring pericardial effusion. Jpn Circ J 1993; 57: 489-494. [ Links ]
21. Fijalkowska A, Szturmowicz M, Tomkowski W et al. The value of measuring adenosine deaminase activity in pericardial effusion fluid for diagnosing the etiology of pericardial effusion. Pneumonol Alergol Pol 1996; 64(Suppl 2): 174-179. [ Links ]
22. Koh KK, Kim EJ, Cho CH et al. Adenosine deaminase and carcinoembryonic antigen in pericardial effusion diagnosis, especially in suspected tuberculous pericarditis. Circulation 1994; 89: 2728-2735. [ Links ]














