Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de cardiología
versión impresa ISSN 0188-2198
Rev. Mex. Cardiol vol.23 no.3 México jul./sep. 2012
TRABAJO DE REVISIÓN
La cardioversión eléctrica en fibrilación auricular
Electrical cardioversion in atrial fibrillation
Enrique Velázquez-Rodríguez*
* Servicio de Electrofisiología, UMAE Hospital de Cardiología, Centro Médico Nacional Siglo XXI, IMSS. Unidad de Cuidados Intensivos Cardiológicos, Hospital Central Norte, PEMEX.
Dirección para correspondencia:
Enrique Velázquez-Rodríguez
Cuauhtémoc 330, Col. Doctores
06725, México, D.F.
Tel: 5627 6900 ext. 22076 Fax: 5761 4867
E-mail: enve@prodigy.net.mx
RESUMEN
La cardioversión eléctrica para el tratamiento de la fibrilación auricular (FA) se introdujo en la década de los 60 y se mantiene actualmente como el tratamiento más efectivo y seguro para la conversión a ritmo sinusal. El método óptimo para la cardioversión eléctrica de la FA incluye tanto la selección del paciente adecuado como una técnica de cardioversión eléctrica apropiada. Los factores que han sido implicados en el éxito de la cardioversión eléctrica transtorácica incluyen aquéllos relacionados con: 1) la presencia de cardiopatía; 2) el habitus corporal del paciente; 3) la energía proporcionada; 4) la forma de onda eléctrica proporcionada, y 5) misceláneas. En vista de las consecuencias hemodinámicas y tromboembólicas, la conversión a ritmo sinusal puede esperarse que reduzca o suprima los síntomas y morbimortalidad asociadas con la FA. El éxito de la cardioversión eléctrica es alto de acuerdo al paciente seleccionado y la frecuencia de recurrencia inmediata o tardía postcardioversión puede ser alta y se requiere el uso de antiarrítmicos especialmente en presencia de comorbilidad como insuficiencia cardiaca o hipertensión descontrolada. El objetivo del tratamiento antiarrítmico concomitante es aumentar la posibilidad de éxito y prevenir las recurrencias, el cual debe considerarse de manera individual tomando en cuenta sobre todo el tiempo de evolución de la FA y la presencia y severidad de la cardiopatía. La posibilidad de cardioversión eléctrica exitosa en más probable en FA de corta duración y ausencia de cardiopatía.
Palabras clave: Cardioversión eléctrica, fibrilación auricular, impedancia transtorácica, desfibrilación de onda monofásica, desfibrilación de onda bifásica, corriente directa.
ABSTRACT
Electrical cardioversion for treatment of atrial fibrillation (AF) was introduced in the early 1960s and remains today as the most effective and safe treatment for conversion to sinus rhythm. The optimal method for electrical cardioversion of AF includes appropriate patient selection as well as an appropriate electrical cardioversion technique. Factors that have been implicated in the success of transthoracic electrical cardioversion include those associated with: 1) the presence of heart disease; 2) the patient body habitus; 3) the energy applied; 4) the electrical waveform supplied and 5) miscellaneous. In view of the hemodynamic and thromboembolic consequences, conversion to sinus rhythm can be expected to reduce or abolish symptoms and morbidity associated with AF. The success of electrical cardioversion is high according to selected patient and the frequency of immediate or delayed recurrence post-cardioversion may be high and require the use of antiarrhythmics, especially in the presence of co-morbidities like heart failure or uncontrolled hypertension. The objective of concomitant antiarrhythmic therapy is to increase the likelihood of success and prevent recurrences, which must be considered individually taking into account especially the duration of AF and the presence and severity of heart disease. The possibility of successful electrical cardioversion is more likely in AF of short duration and absence of heart disease.
Key words: Electrical cardioversion, atrial fibrillation, transthoracic impedance, monophasic defibrillation, biphasic defibrillation, direct current.
Introducción
La fibrilación auricular (FA) altera la función hemodinámica del corazón por dos mecanismos principales: la pérdida de la función sistólica auricular y la respuesta ventricular rápida e irregular con la consecuente disminución del volumen latido y gasto cardiaco que explican los principales síntomas de FA: palpitaciones y disnea, y puede precipitar angina de pecho en presencia de cardiopatía isquémica o agravar la insuficiencia cardiaca.
En vista de las consecuencias hemodinámicas y tromboembólicas, la conversión a ritmo sinusal puede esperarse que reduzca o suprima los síntomas y morbimortalidad asociadas con la FA. Después de la cardioversión, la función sistólica auricular regresa en algunas semanas y se hace evidente por un retorno gradual de la onda A en el Doppler transmitral.
Desde la primera experiencia clínica en humanos en un caso de fibrilación ventricular en 1956,1 la desfibrilación eléctrica transtorácica ha sido objeto de múltiples estudios experimentales y clínicos.
La cardioversión eléctrica para el tratamiento de la fibrilación auricular se introdujo en la década de los 60 y se mantiene actualmente como el tratamiento más efectivo y seguro para la conversión a ritmo sinusal2 (Cuadro I).
Mecanismo de la cardioversión en fibrilación auricular
El método óptimo para la cardioversión eléctrica de la FA incluye tanto la selección del paciente como una técnica de cardioversión eléctrica apropiadas. La importancia relativa de los diferentes factores que determinan la tasa de éxito, así como los requerimientos de energía para la cardioversión no ha sido establecida de manera definitiva.
Los factores que han sido implicados en el éxito de la cardioversión eléctrica transtorácica incluyen aquéllos relacionados con 1) la presencia de cardiopatía: la duración de la FA, el diámetro de la aurícula izquierda, la presión auricular izquierda, la velocidad del flujo sanguíneo en la orejuela izquierda y en las venas pulmonares;3-5 2) aquéllos relacionados con el habitus corporal del paciente: el peso total en kg o el índice de masa corporal, la amplitud del tórax;6,7 3) los relacionados con la energía proporcionada: el tamaño, tipo (palas metálicas o parches adhesivos), posición (antero-lateral vs antero-posterior) y presión de contacto de las palas-electrodos, la selección del nivel inicial de energía y el número de choques consecutivos con energía creciente;8,9 4) los relacionados con la forma de onda eléctrica proporcionada: pulsos de onda monofásica,10 vs bifásica,11-14 y 5) misceláneas: la influencia de la fase respiratoria y en algunos casos la edad del paciente15,16 (Cuadro II).
Todos estos factores finalmente tendrán influencia en la aplicación de un flujo de corriente eléctrica suficiente; se sabe que el flujo de corriente a través del tórax describe de manera más precisa el umbral de desfibrilación.17 Entonces, el flujo de corriente estará determinado por la energía real emitida (no la energía seleccionada o acumulada). A su vez, el principal determinante del flujo de corriente es la resistencia o impedancia transtorácica (ITT). Por lo tanto, una densidad de corriente eléctrica suficiente que atraviese la masa auricular es el factor crítico más importante para que la cardioversión sea eficaz. La cardioversión eléctrica puede indicarse electivamente para restablecer el ritmo sinusal o en forma urgente, usualmente en pacientes hemodinámicamente comprometidos.
Formas de onda y niveles de energía
Los cardiodesfibriladores son clasificados de acuerdo a dos tipos de formas de onda: monofásica y bifásica. La primera en utilizarse fue la forma de onda monofásica, y la forma de onda bifásica se está usando cada vez más en la mayoría de los cardiodesfibriladores externos automáticos y manuales. Los niveles de energía varían según el tipo de cardiodesfibrilador (Figura 1).

Desfibriladores de onda monofásica
Las formas de onda monofásica aplican corriente de una sola polaridad (en la dirección del flujo de corriente). La onda monofásica puede ser caracterizada por la rapidez a la cual el pulso de corriente disminuye al valor cero. La onda monofásica sinusoidal amortiguada tipo Edmark18 regresa al valor de base gradualmente. Este tipo de onda es muy sensible a cambios en la impedancia transtorácica.
Desfibriladores de onda bifásica
Estos cardiodesfibriladores usan corriente de dos polaridades, que pueden ser: onda bifásica exponencial truncada tipo Gurvich19 u onda bifásica rectilínea. En contraste con la onda monofásica, la onda bifásica es relativamente insensible a cambios en la impedancia transtorácica debido a su capacidad de compensación (adaptación automática) lo que asegura una corriente constante en la primera fase. El resultado es una disminución de aproximadamente un tercio del umbral de desfibrilación.
Ambos equipos proporcionan un tiempo de carga para energía máxima de 5 s con alimentación por corriente alterna o 10 segundos con batería y proporcionan una frecuencia máxima de carga/descarga de 3 ciclos por minuto y con una precisión de energía de ± 2 joules (J) o el 15% del valor de ajuste, (para impedancias entre 25 y 100 Ohms (Ω) en los desfibriladores de onda bifásica. Los choques son aplicados con un retardo en la transferencia de aproximadamente 40 y 60 ms con onda monofásica y bifásica respectivamente después del impulso disparado con el pico de la onda R y a 25 ms del impulso de sincronización externo.
Técnica de cardioversión eléctrica
En la cardioversión, la sincronización de los choques se realiza con la señal ventricular (pico de la onda R) seleccionando cualquier derivación ECG filtrada que tenga una amplitud mínima de 0.50 mV para lograr la aplicación segura de los choques disparados por la onda R y que elimine la detección de las ondas T de gran amplitud (≥ 1 mV) evitando así la aplicación durante el periodo refractario relativo del ciclo cardiaco, en donde un choque podría producir fibrilación ventricular. Previo consentimiento informado y en ayuno de al menos 6 horas (excepto casos urgentes) los pacientes recibirán anestesia-sedación endovenosa con asistencia ventilatoria no invasiva. El desfibrilador debe ser evaluado antes de la cardioversión con un choque de prueba (carga/descarga) dentro del resistor fijo del mismo equipo. Se recomienda en caso de fallo del primer choque o subsecuentes un intervalo mínimo de un minuto entre cada choque. Aunque la cardioversión con corriente directa está entre los tratamientos disponibles más simples, un equipo cardiodesfibrilador adecuado y funcional así como un grupo médico y de enfermería entrenado que incluya un anestesiólogo debe estar siempre disponible.
La tasa de éxito global de la cardioversión eléctrica es de 90 a 95% en FA de menos de 48 horas de evolución y disminuye entre 72 a 78% si está presente durante un año.20
Colocación de los electrodos
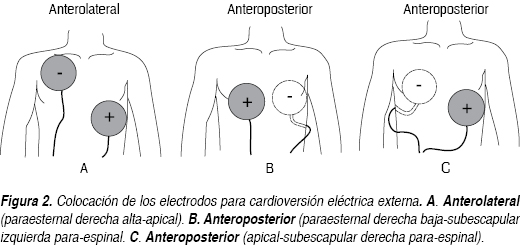
Un factor que puede influir en la eficacia de la cardioversión es la posición de los electrodos. Éstos se colocan en el pecho del paciente en la posición convencional anterolateral (esternal-apical). El electrodo de la base se coloca en la línea media anterior y paraesternal alta (infraclavicular) y el electrodo apical en la región inferolateral izquierda. En la mujer, la colocación del electrodo apical en el pecho condiciona alta impedancia transtorácica, lo que reduce el flujo de corriente, por lo que se recomienda la colocación del electrodo apical en la región axilar anterior o bajo el seno.21 Otra variante ampliamente aceptada es la posición anteroposterior, con los electrodos en la posición del borde esternal derecho bajo y la región infraescapular izquierda cerca del borde paraespinal. Otra posición anteroposterior incluye, la región apical y subescapular derecha paraespinal, (Figura 2). En teoría la posición anteroposterior coloca una masa auricular más grande entre los electrodos que la posición convencional, sin embargo, estudios al azar comparativos han mostrado resultados diferentes.22-24
Un estudio reciente comparativo al azar encontró una impedancia transtorácica significativamente menor en la posición anteroposterior, sin embargo, el éxito acumulado con cada nivel de energía fue similar en las dos posiciones: 66 vs 74% con 200 J y 84.6 vs 83.9% con 360 J con onda monofásica.25 Sugiriendo que más que la posición de los electrodos, la impedancia transtorácica es el único factor que afecta significativamente el éxito de la cardioversión y se correlaciona con los requerimientos de energía.
Comparando la influencia de las diferentes posiciones de los electrodos sobre la eficacia e incidencia de recurrencia temprana en la cardioversión de FA con choques bifásicos, ambas posiciones fueron similares con respecto al éxito agudo y recurrencia temprana de FA, también, el número de choques necesarios y la aplicación de energía son comparables con ambas configuraciones.26
Independientemente de la falta de consenso, en casos en que la cardioversión ha fallado con cualquiera de las dos posiciones, se sugiere considerar un intento final en la posición alternativa antes de admitir la falla.
En un paciente hombre con abundante vello en el pecho, el contacto electrodo-pecho puede ser malo, y el vello puede causar retención eléctrica entre el electrodo y la piel y puede resultar en alta impedancia y ocasionalmente arcos de corriente por lo que se recomienda afeitar el área en donde se colocarán los electrodos. Cuando se usan electrodos de palas metálicas, deberán aplicarse firmemente a la pared torácica, evitando el contacto con las derivaciones del ECG. El uso de electrodos autoadhesivos reducirá el riesgo de arcos eléctricos y son en general igualmente efectivos, pueden remplazar a las palas metálicas y resultan más prácticos en la posición anteroposterior. Cuando se utilizan palas metálicas de mano debe asegurarse que estén en contacto total con la piel con una presión sobre el tórax de alrededor de 10 kg por pala. En algunos equipos un indicador luminoso en color señala la calidad del contacto pala-tórax asegurando una baja impedancia (100 Ω máximo). Las palas deberán estar ampliamente separadas entre sí, y el gel conductor utilizado para la interfase entre las palas y la piel no deberá disiparse sobre el pecho, esto puede favorecer que el gel conductor haga que el flujo de corriente siga un camino superficial (arco eléctrico) a lo largo de la pared torácica, desviando el flujo de corriente.
Cuando un dispositivo médico implantado está localizado en el área donde un electrodo sería normalmente posicionado, no coloque los electrodos (palas metálicas o parches autoadhesivos) sobre o cerca del generador, porque puede bloquear algo del flujo de corriente al miocardio resultando en una aplicación de energía subóptima, pero sobre todo, el choque puede causar disfunción temporal o eventualmente una disfunción permanente del dispositivo implantado (marcapaso, cardiodesfibrilador automático o resincronizador).
Colocar el electrodo lo más alejado posible del generador, al menos 10 cm del dispositivo. Una estrategia es la aplicación del choque con la técnica anteroposterior (paraesternal derecho bajo y subescapular izquierdo). El dispositivo implantado deberá ser evaluado después del choque. Los electrodos no deberán colocarse directamente sobre cualquier tipo de medicación en parches cutáneos (parches de nitroglicerina, de reemplazo hormonal, nicotina o analgésicos) debido a que el parche puede bloquear la aplicación de energía desde el electrodo y puede causar pequeñas quemaduras de la piel. Remueva el parche y limpie el área antes de colocar la pala electrodos.27 En el paciente muy diaforético limpiar y secar el pecho antes de colocar los electrodos.
Tipos y tamaño de los electrodos
Además de la posición de las palas, las diferencias en el tipo de electrodo (incluyendo el tamaño y el uso de electrodos autoadhesivos versus electrodos metálicos) puede ser relevante, debido a que la impedancia transtorácica puede ser minimizada por electrodos más grandes y con mejor contacto cutáneo.
Kirchhof y colaboradores28 evaluaron un estudio comparativo al azar entre electrodos de parches autoadhesivos y electrodos de palas metálicas para cardioversión de FA con choques de onda monofásica o bifásica. Los electrodos de palas metálicas alcanzaron un éxito total de 96 vs 88% con electrodos autoadhesivos (p = 0.04). Este efecto fue comparable con la eficacia de los choques bifásicos versus los choques monofásicos, 98 vs 86%, p = 0.001 respectivamente.
El efecto favorable de los electrodos de palas metálicas se observó para ambas formas de choque. Después de cruzar un choque monofásico ineficaz a choque bifásico la cardioversión tuvo un éxito general del 98.5%. Concluyendo que la combinación de choques bifásicos, electrodos de palas metálicas y una posición anteroposterior aseguran una cardioversión casi siempre exitosa. El éxito de la cardioversión electiva y los requerimientos de energía de dos posiciones (anterolateral vs anteroposterior) y diferentes tamaños de electrodos de palas metálicas fueron evaluados prospectivamente por Kerber y colaboradores.29 Electrodos anterolaterales de tamaño convencional (8.5 cm de diámetro) o un electrodo anterior más grande (13 cm) y uno lateral convencional se compararon contra la posición anteroposterior con electrodos de 13 cm. El éxito global de la cardioversión con cualquier posición fue similar, > 90% y los electrodos más largos redujeron aunque no de manera significativa los requerimientos de energía. Los autores concluyen que las palas en posición anterolateral son tan efectivas como las palas anteroposteriores y que no hay una ventaja demostrable para utilizar palas de mayor tamaño que el tamaño convencional en cualquier posición.29
Por lo tanto para la cardioversión en adultos, tanto los electrodos de palas metálicas de mano como electrodos de parche autoadhesivos de 8 a 12 cm de diámetro resultan útiles. Por otro lado, electrodos pequeños (4.3 cm) pueden ser peligrosos (por concentrar una mayor densidad de corriente por área de superficie) y pueden causar necrosis miocárdica.6,29-31
Selección de energía de corriente directa
Tradicionalmente, y como sugirieron previamente las guías de apoyo vital cardiaco avanzado (ACLS) un método con dosis de energía progresivamente crecientes iniciando con 100 J ha sido utilizado para la cardioversión eléctrica de la FA alcanzado un éxito de 40 a 67% dependiendo del grado de impedancia transtorácica y del 21 a 62% aún con un choque inicial de 200 J en casos de FA de larga duración.9,32,33
En otra publicación se examinó si el uso inicial de alta energía con choques monofásicos de 360 J en pacientes con FA persistente podría ser más efectivo, comparado con choques iniciales de baja energía, 200 J. El éxito fue significativamente más alto en el grupo con 360 J (96.0 vs 75.4%, p = 0.003). El número promedio de choques aplicados (1.84 vs 2.56, p = 0.006) fue menor con 360 J que con 200 J, aunque los requerimientos de energía total fueron similares para los dos grupos s (662.4 vs 762.4 J, p = 0.67).34,35
Derivada de la intensa y creciente investigación en la desfibrilación ventricular interna, en los últimos años se demostró que los choques de onda bifásica están asociados con una mayor eficacia cuando se comparan con los choques de onda monofásica.12 La eficacia del primer choque de onda bifásica de 70 J fue del 68 versus 100 J con onda monofásica de sólo 21%. La eficacia acumulada después de varios choques fue de 94 vs 79% respectivamente.12
Ricard y cols.14 encontraron que al mismo nivel de energía de 150 J, los choques de onda bifásica que compensa la impedancia son superiores a los choques monofásicos para cardioversión de la FA.
En un estudio internacional, multicéntrico, aleatorizado y doble ciego los pacientes recibieron hasta cinco choques, los necesarios para la cardioversión: 100, 150, 200 J, un cuarto choque con energía máxima (200 J bifásico, 360 J monofásico) y un último choque de cruzamiento a energía máxima con la forma de onda contraria. El éxito fue mayor para los choques bifásicos que monofásicos a cada uno de los tres niveles de energía (100 J: 60 vs 22%, p < 0.0001; 150 J: 77 vs 44%, p < 0.0001; 200 J: 90 vs 53%, p < 0.001). Cuando se requirió un cuarto choque, a un máximo de 200 J, el éxito con onda bifásica fue similar que con onda monofásica a 360 J (91 vs 85%, p = 0.29). Se requirieron menos choques bifásicos (1.7 ± 1.0 vs 2.8 ± 1.2, p < 0.0001) y una menor energía acumulada (217 ± 176 J vs 548 ± 331 J, p < 0.001).36
Con un mayor número de casos, el mismo grupo confirmó los mismos resultados, pero, se resalta que los choques bifásicos convirtieron la FA con una eficacia de 80% cuando la FA tuvo un tiempo de evolución menor de 48 horas, pero la conversión en FA presente por más de 48 horas y más de un año el éxito fue de 63 y 20% respectivamente.37
Tanto los choques monofásicos iniciales de alta energía (300 J, 360 J) como los choques bifásicos de baja energía se asocian con una menor frecuencia de lesión cutánea.
Cardioversión eléctrica en niños
En los niños la impedancia transtorácica es significativamente alta, pero, mal relacionada con el peso o el área de superficie corporal por lo que las correlaciones no son lo suficientemente altas para ser consideradas clínicamente útiles.
En lactantes de seis semanas a nueve meses de edad usando electrodos de palas metálicas pediátricas (16 ó 21 cm2), Atkins y colaboradores38 encontraron una impedancia transtorácica de 94 ± 17 Ohms (límites 74 a 124 Ω) y en niños de 1.5 a 15 años de 108 ± 24 Ohms (límites 61 ± 212 Ω). En este último grupo con las palas de adulto (83 cm2) la impedancia transtorácica fue significativamente menor en un 47%, 57 ± 11 Ohms (límites 29 a 101 Ω, p < 0.05). Estos datos indican que las palas electrodos tamaño adulto disminuyen la impedancia transtorácica y deberían ser usadas cuando el tórax del niño es suficientemente largo para permitir un buen contacto de toda la superficie de la pala sobre el pecho. Habitualmente con un peso corporal aproximado mayor de 10 kg.38
Las palas electrodos deberán aplicarse firmemente con una fuerza mínima de 3 kg con palas de tamaño pediátrico y al menos 5 kg en niños mayores cuando se usan palas tamaño adulto.39 La dosis de energía más baja para cardioversión efectiva en infantes y niños no está bien establecida. El límite superior de seguridad tampoco se conoce, pero dosis de > 4 J/kg (incluso hasta 9 J/kg) han dado resultados efectivos sin efectos adversos significativos. Los choques bifásicos parecen ser al menos tan efectivos como los monofásicos y más seguros. La dosis clínicamente recomendada (monofásica o bifásica) son 2 J/kg para el primer choque y 4 J/kg para intentos subsecuentes.40-47
Anestesia y sedación
La cardioversión electiva es un procedimiento rápido que se realiza bajo anestesia general o sedación. La selección del agente es importante ya que se requiere asegurar un efecto de corta duración y al mismo tiempo estabilidad hemodinámica.
En la actualidad aún no hay consenso sobre la forma óptima para la anestesia o sedación del paciente que será sometido a cardioversión eléctrica. No obstante, diversos agentes han demostrado eficacia y seguridad.
Cuarenta y cuatro pacientes fueron asignados en forma aleatoria para recibir uno de cuatro agentes anestésicos. Tres mg/kg de tiopental sódico; 0.15 mg/kg de etomidato; 1.5 mg/kg de propofol; 0.15 mg/kg de midazolam. Todos los pacientes recibieron 1.5 µg/kg de fentanil 3 minutos antes de la inducción.
Los cuatro agentes proporcionaron anestesia satisfactoria y sin complicaciones mayores, aunque sus diferencias farmacológicas hacen que la elección sea específica para el paciente individual.48
Otro estudio comparó la eficacia, efectos adversos y el tiempo de recuperación con propofol, etomidato y midazolam (con o sin flumazenil) para cardioversión en un departamento de urgencias. Una sedación profunda y cardioversión exitosa se logró en todos los casos. La evaluación hemodinámica al inicio, después de la inducción, después de la cardioversión y en la recuperación, no demostró diferencias significativas entre los cuatro grupos.
El tiempo de inducción fue rápido en todos los grupos y el tiempo para despertar de la anestesia fue más largo con midazolam (media 21 min), pero se acortó (media 3 min) con flumazenil; etomidato (media 9.5 min); propofol (media 8 min) y lo mismo ocurrió con el tiempo de recuperación total. Se concluye que los cuatro regímenes son uniformemente efectivos para facilitar la cardioversión eléctrica en pacientes hemodinámicamente estables.49
Uno de los efectos adversos más frecuentes de la inducción es una disminución transitoria y generalmente leve de la presión sanguínea sistólica. Pero también puede verse un aumento transitorio después de la cardioversión, posiblemente relacionada con el aumento de la actividad adrenérgica que sigue a la cardioversión. Midazolam produce duración más prolongada del efecto y mayor variabilidad individual. Propofol se asocia con una incidencia más elevada de apnea y el etomidato produce mioclono.
Debido que el efecto anestésico o sedante de los agentes disponibles tienen características similares en eficacia y seguridad, la frecuencia y tipo de efectos adversos puede ser el principal factor cuando se elige el fármaco para el procedimiento de cardioversión eléctrica en un paciente individual.
No debe pasarse por alto que en todos los casos deberá estar disponible un monitoreo ECG, oximetría de pulso, equipo para ventilación asistida y flumazenil (para la reversión rápida de la depresión respiratoria inducida por benzodiacepinas), además de la invaluable presencia del anestesiólogo en el sitio en que se realizará el procedimiento.
Fármacos antiarrítmicos pre y postcardioversión eléctrica
En algunos casos, hay una falla total de la cardioversión eléctrica. En otros, la FA recurre minutos u horas después de un periodo de RS (recurrencia inmediata); en otros, la recurrencia se retarda de 1 día a 2 semanas (recurrencia temprana) y en ocasiones ocurre después de 2 semanas (recurrencia tardía). El fracaso de la cardioversión eléctrica inmediata o tardía se estima que ocurre aproximadamente en el 25% de los casos.50
En algunos pacientes el procedimiento de cardioversión eléctrica repetido puede aumentar la tasa de éxito general y mantener el ritmo sinusal, especialmente si se aplica con tratamiento antiarrítmico concomitante, el cual puede aumentar el éxito inmediato y suprimir las recurrencias tempranas. Una de las explicaciones de las diferencias en el porcentaje de éxito de la cardioversión eléctrica en FA podría ser el uso de fármacos antiarrítmicos antes o en el momento de la cardioversión (premedicación) (Cuadro III).
Varios fármacos antiarrítmicos han demostrado mejorar el éxito de la cardioversión eléctrica, así como el mantenimiento del ritmo sinusal postcardioversión. En general, se utilizan los mismos fármacos para la cardioversión farmacológica y para el mantenimiento del ritmo sinusal
Remodelación eléctrica de la aurícula
Las observaciones clínicas sugieren que la FA paroxística puede progresar a FA permanente y que la incidencia de restauración exitosa y el mantenimiento del ritmo sinusal es más alta en pacientes con FA de reciente inicio, estas observaciones han sugerido que la FA puede ser autosostenida. Varios estudios recientes, realizados en animales y humanos, han demostrado que la FA condiciona FA, y que esto se debe a un remodelamiento eléctrico de la aurícula, que consiste en acortamiento de los periodos refractarios, a una pérdida de la adaptación fisiológica dependiente de frecuencia de los periodos refractarios y al acortamiento en la duración del potencial de acción.51-57 Aunque los mecanismos exactos de estos cambios electrofisiológicos no se conocen, este remodelamiento eléctrico parece deberse a sobrecarga intracelular de calcio. La disminución del proceso de remodelación eléctrica puede evitar o disminuir los efectos negativos de la duración de la FA sobre el éxito de la cardioversión y puede reducir las recurrencias tempranas postcardioversión exitosa. De Simone y cols.58 Evaluaron en forma prospectiva y al azar la eficacia del pretratamiento con verapamil tres días antes para disminuir recurrencias de FA en pacientes con FA persistente después de cardioversión eléctrica externa o interna.
Durante un periodo de 3 meses de seguimiento, 23 de 107 pacientes (23.7%) tuvieron recurrencia de FA. Significativamente, 65.2% de las recurrencias ocurrieron durante la primera semana postcardioversión con la incidencia más alta en el grupo con pretratamiento con propafenona sola, 900 mg/día VO (30.3%) que el grupo con propafenona + verapamil, 240 mg/día VO (5.9%, p = 0.01) y el grupo solo con verapamil (10%, p = 0.04).58
En otra publicación reciente se investigó si el tiempo e incidencia de recurrencias de FA durante el primer mes postcardioversión indicaba la presencia de remodelación eléctrica y si esto podría ser influenciado evitando la carga intracelular de calcio con calcios antagonistas (verapamil, diltiazem) y un betabloqueador (sotalol).
Durante un mes de seguimiento, 57% tuvo recurrencia de FA, con una incidencia pico durante los primeros 5 días postcardioversión. El análisis de variables múltiples reveló que el uso de fármacos calcio-antagonistas durante FA fue la única variable significativa relacionada con el mantenimiento de RS postcardioversión (p = 0.03).59
El efecto sinérgico del pretratamiento con verapamil se debe posiblemente a los efectos favorables sobre la remodelación auricular más que a la modificación de las propiedades electrofisiológicas de la arritmia per se.
En el estudio VEPARAF en un seguimiento a tres meses y en el análisis de variable única, el verapamil (240 mg/día tres días antes) disminuyó la recurrencia primaria de FA cuando se adicionó con antiarrítmico clase III (amiodarona, 400 mg/día 4 semanas antes) o clase IC (flecainida, 200 mg/día tres días antes) de 35 al 20%, p = 0.004, aumentando significativamente la posibilidad de permanecer en ritmo sinusal postcardioversión eléctrica, así como la recurrencia secundaria de FA.60 Sin embargo, en el estudio VERDICT, sólo el 47% del grupo tratado con verapamil y 53% del grupo con digoxina permanecieron libres de recurrencia durante el primer mes postcardioversión eléctrica.61
Los estudios con respecto a los efectos benéficos con diltiazem en la cardioversión eléctrica no son concluyentes. La eficacia de diltiazem, un mes antes y un mes postcardioversión de FA persistente se comparó contra amiodarona y digoxina.
La conversión tuvo más éxito con amiodarona (91%) comparado con diltiazem (76%) y digoxina (67%), amiodarona vs diltiazem/digoxina, p < 0.05), pero sin diferencias en el umbral eléctrico para la cardioversión efectiva, p = NS.62
Fármacos antiarrítmicos clase III (amiodarona y sotalol) aumentan la posibilidad de cardioversión eléctrica exitosa en comparación con antiarrítmicos control. La amiodarona, al prolongar la refractariedad auricular puede revertir el efecto electrofisiológico de la remodelación eléctrica, afectando, por lo tanto la eficacia de la cardioversión eléctrica.
En un estudio controlado, al azar y prospectivo, el pretratamiento con dosis bajas de amiodarona, 400 mg/día VO un mes antes y 200 mg/día durante dos meses postcardioversión comparado con diltiazem, 180 mg/día VO, más solución polarizante (glucosa-insulina-potasio) o diltiazem solo, provocó un porcentaje significativamente más alto de conversión espontánea (25, 6 y 3% respectivamente, p < 0.005), de cardioversión eléctrica eficaz (88, 56 y 65% respectivamente p < 0.05) y de menor recurrencia (32, 56 y 52% respectivamente, p < 0.01).63
La amiodarona al prolongar el ciclo fibrilatorio y el periodo refractario auricular, mantiene el ritmo sinusal postcardioversión en FA persistente suprimiendo las extrasístoles auriculares que disparan FA.64
La eficacia de la disopiramida, antiarrítmico clase IA para prevenir la recurrencia de FA como otras clases de antiarrítmicos, dependen de la duración previa de los episodios de FA. Con disopiramida (300 mg/día) inmediatamente después de cardioversión eléctrica o farmacológica, la frecuencia actuarial para mantener el ritmo sinusal a 1, 6, 18 y 24 meses fue 88.6, 57, 42.9 y 37% respectivamente en FA de menos de 48 h de evolución vs 72, 28, 12 y 8% respectivamente en FA mayor de 48 h de evolución.65
El antiarrítmico clase IC, propafenona (750 mg/día VO) dos días antes de la cardioversión eléctrica para FA permanente (crónica) en este estudio no afectó el umbral medio de desfibrilación o la frecuencia de conversión exitosa. La eficacia del choque (82.4 vs 84.4%) y la eficacia de energía acumulada (395 ± 258 vs 421 ± 236 J) no fueron diferentes comparado con placebo, pero, disminuyó la recurrencia inmediata de FA postcardioversión (73.5 vs 52.9%, p < 0.05).66 En otro estudio, en un seguimiento de 15 meses, la propafenona pareció ser superior a placebo para mantener ritmo sinusal en casos de FA paroxística (reciente inicio) o persistente, 39 vs 65% respectivamente (p = 0.015). En análisis de subgrupos, la recurrencia de FA fue significativamente menor con propafenona sólo en pacientes con FA de reciente inicio con conversión espontánea (21 vs 61%, p = 0.001).67
Sin embargo, las recurrencias fueron similares en FA persistente y FA de reciente inicio después de cardioversión eléctrica o farmacológica. Los efectos adversos fueron similares.67 La eficacia y seguridad de propafenona (900 mg/día) y disopiramida (750 mg/día) para mantener el ritmo sinusal postcardioversión eléctrica fueron comparados en pacientes con FA permanente (duración media, 5 meses). Con propafenona, 66 y 55% permanecieron en ritmo sinusal a tres y seis meses respectivamente. Resultados similares con disopiramida 71 y 67% a tres y seis meses respectivamente (p = NS). Pero, la propafenona fue mejor tolerada y no hubo efectos proarrítmicos con ningún fármaco.68
Los reportes clínicos con el uso de flecainida como tratamiento precardioversión son limitados y contradictorios y se refieren más a la administración intravenosa (no disponible en nuestro medio). Cincuenta y cuatro pacientes consecutivos con FA persistente, duración media ocho semanas (intervalos 3-18), fueron aleatorizados a flecainida en infusión IV vs placebo) antes de cardioversión eléctrica.
No hubo diferencia estadística entre los dos grupos: flecainida 73% versus placebo 82% con relación a la eficacia aguda de conversión o en aumentar el éxito de cardioversión eléctrica y sin diferencias con relación a la energía media o máxima o el número de choques requeridos. Después de un seguimiento de 30 días, 54% de los pacientes estuvieron en RS sin diferencias entre los dos grupos. En este reporte el pretratamiento con flecainida IV antes de la cardioversión eléctrica no resultó útil, sin embargo, no disminuyó la eficacia de la cardioversión eléctrica.69 Por otro lado, la flecainida mejoró su acción antiarrítmica postcardioversión de FA cuando se administró dentro de las 10 h después del inicio de FA y el tiempo en RS fue mayor de cuatro días con un éxito de 58%.70
Estudios experimentales en animales han mostrado el posible papel de los inhibidores de la angiotensina II en la prevención de la remodelación eléctrica auricular.71,72 Madrid y cols.73 Realizaron un estudio prospectivo para probar la hipótesis de que la incidencia de recurrencias de FA postcardioversión podría ser influenciada con el pretratamiento con irbesartan (150 a 300 mg/día) más amiodarona (400 mg/día VO) vs amiodarona sola. El análisis del tiempo a la primera recurrencia durante un seguimiento medio de 254 días mostró que los pacientes tratados con irbesartan tuvieron mayor posibilidad de permanecer sin recurrencias de FA (79.52 vs 55.91%, p = 0.007).
Antiarrítmicos y umbral de desfibrilación
Por otro lado, un fármaco antiarrítmico aun cuando potencialmente útil en la prevención de recurrencias tempranas (inmediata o mediata) en teoría podría aumentar adversamente el umbral de desfibrilación y reduciría el éxito de la cardioversión.
Bianconi y colaboradores66 evaluaron los beneficios y riesgos de la administración de propafenona (750 mg/día VO) vs placebo 48 horas antes de la cardioversión eléctrica de FA permanente. Antes de la cardioversión 6% pasaron a ritmo sinusal. La eficacia del choque (82.4 vs 84.4%) y la energía efectiva acumulada (395 ± 258 vs 421 ± 236 J) no fueron diferentes entre los grupos placebo y propafenona. Con propafenona en el 22% de los casos la FA pasó a flúter auricular y los que siguieron en FA al momento de la cardioversión tuvieron una tendencia a mayores requerimientos de energía vs placebo, pero sin significado estadístico (p < 0.10).
Dos días postcardioversión, más pacientes con propafenona (73.5 vs 52.9%, p < 0.05) fueron egresados en RS.66 Resultados similares se han obtenido con amiodarona, diltiazem y digoxina con relación al umbral de desfibrilación.62,69
Después de la cardioversión eléctrica es frecuente la presencia de extrasístoles, con relación a las extrasístoles auriculares, los reportes confirman la frecuencia de recurrencia inmediata de FA en 10 a 30% de los casos, usualmente dentro del 1 minuto postcardioversión exitosa.74,75 y 91% de los episodios son iniciados por extrasístoles auriculares con un intervalo de acoplamiento corto y 9% ocurre después de un periodo corto de bradicardia.76 Otro grupo informó la presencia de extrasístoles auriculares en 61% de los casos postcardioversión, de éstos 62% tuvieron recurrencia de FA.
La sola presencia o número de extrasístoles auriculares parecería no influir en el tiempo de la eventual recurrencia, sin embargo, otra vez, hay una correlación significativa entre las extrasístoles con intervalos de acoplamiento cortos y el tiempo de recurrencia.74 En resumen, estudios clínicos indican que la frecuencia de recurrencia inmediata a tardía postcardioversión es alta y se requiere el uso de antiarrítmicos, aunque, la recurrencia a un año es hasta del 50%, especialmente en presencia de comorbilidad como insuficiencia cardiaca o hipertensión descontrolada.77
El objetivo principal del tratamiento antiarrítmico concomitante es aumentar la posibilidad de éxito y prevenir las recurrencias, el cual debe considerarse de manera individual tomando en cuenta sobre todo el tiempo de evolución de la FA y la presencia y severidad de la cardiopatía. La posibilidad de cardioversión eléctrica exitosa es más probable en FA de corta duración y ausencia de cardiopatía. El efecto sinérgico con antiarrítmicos precardioversión eléctrica puede deberse a prolongación del periodo refractario efectivo, conversión de FA a un ritmo auricular más organizado y a la supresión de extrasístoles auriculares inmediatamente después de restablecer el RS. Sin embargo, debe tenerse precaución en el pretratamiento con antiarrítmicos en presencia conocida o alta sospecha de disfunción del nodo sinusal ya que pueden favorecerse bradiarritmias significativas o proarritmia ventricular en casos de cardiopatía con fracción de expulsión baja.
El pretratamiento es más apropiado en la falla total y en la recurrencia inmediata o temprana. En la recurrencia tardía y en aquellos que serán llevados a cardioversión eléctrica por primera vez por FA persistente el pretratamiento es opcional.
El tratamiento profiláctico no es usualmente necesario en casos de un primer episodio detectado de FA, especialmente si la FA es secundaria a factores precipitantes que han sido corregidos. Por tanto, no se considera apropiado recomendar antiarrítmicos de rutina para la cardioversión eléctrica, aunque pueden ser benéficos en casos en los que se anticipa una posibilidad alta de cardioversión eléctrica no exitosa.
El tratamiento precardioversión se sugiere en conjunto con un segundo intento, notablemente cuando se ha presentado una recurrencia temprana. La cardioversión eléctrica repetida es de valor limitado y deberá reservarse para pacientes seleccionados.
Con respecto a los efectos benéficos de los calcio-antagonistas en la cardioversión eléctrica hay datos inconclusos, no obstante, combinados con antiarrítmicos clase I parece favorable. La amiodarona es el antiarrítmico que ha demostrado el mayor beneficio y es superior al sotalol y agentes clase IA y IC tanto como pretratamiento como para mantener el RS a mediano y largo plazo, aunque es limitado por sus efectos secundarios con el uso prolongado. La dronedarona, un nuevo derivado de la amiodarona con un menor perfil de efectos secundarios, puede ser una alternativa potencial a la amiodarona.
Derivado de los datos disponibles en un número limitado de pacientes la evidencia apoya que el uso de antiarrítmicos clase IC (propafenona, flecainida) son en general más efectivos y mejor tolerados que los agentes clase IA (quinidina y disopiramida). Finalmente, la necesidad de fármacos antiarrítmicos tiene que ser balanceada contra los efectos secundarios y la mortalidad más alta en algunos pacientes.78,79
Complicaciones y efectos de la cardioversión
Las complicaciones asociadas con la cardioversión eléctrica están relacionadas principalmente con eventos tromboembólicos y sus efectos por trastornos del ritmo.
Riesgo tromboembólico
El RS y las ondas P en el ECG aparecen inmediatamente postcardioversión exitosa, no obstante, la función mecánica de la aurícula puede no regresar inmediatamente, sobre todo, en los casos de FA persistente de larga evolución notablemente en la forma permanente. Usando ecocardiografía Doppler se ha demostrado que la función sistólica de la aurícula puede recuperarse hasta después de tres semanas, el llamado ''aturdimiento'' auricular.
Aunque este fenómeno parece estar relacionado más con la duración de la FA que con el procedimiento de cardioversión per se y parece deberse a la remodelación eléctrica.80
Un estudio reportó una serie de 437 pacientes tratados con cardioversión eléctrica: 228 pacientes recibieron anticoagulación oral tiempo prolongado, mientras 209 no la recibieron. En el grupo con cardioversión exitosa y anticoagulados sólo dos de 186 pacientes (1.1%) tuvieron eventos tromboembólicos, comparados con 11 de 162 pacientes (6.8%) de los que no recibieron anticoagulantes. En otros dos estudios clínicos más recientes se mantiene la misma frecuencia de tromboembolismo (1.3 vs 8%) entre los pacientes anticoagulados vs no anticoagulados, enfatizando el riesgo aún con un tiempo de duración relativamente corto de la FA.81-83
Es posible que el tromboembolismo sea el resultado del retorno de la función mecánica auricular y la liberación de trombos preformados en la aurícula y la orejuela. En otros casos se ha documentado un estado protrombótico condicionado por la misma FA84 o favorecido por padecimientos comórbidos (diabetes, tabaquismo).
Para minimizar el riesgo de tromboembolismo, la anticoagulación es recomendada convencionalmente por un mínimo de tres semanas antes, durante y por un mínimo de cuatro semanas postcardioversión en pacientes con FA de más de 48 h de evolución.
Una estrategia es la cardioversión guiada con ecocardiografía transesofágica (ETE) en pacientes con FA de más de 48 horas de duración. En ausencia de trombos, la heparina es usualmente indicada y se procede con la cardioversión. Subsecuentemente se continúa la anticoagulación oral durante al menos 4 semanas. Aun cuando la ETE no demuestre trombos en la aurícula izquierda, algunos pacientes pueden tener tromboembolia postcardioversión (especialmente si no se continúa la anticoagulación)85 (Cuadro IV).

Otros trastornos del ritmo
En el instante que sigue a la cardioversión eléctrica inmediata aparece frecuentemente una respuesta ventricular irregular, que incluye bradiarritmias (bradicardia sinusal, o periodos cortos de ritmo de la unión AV o paro sinusal) que pueden traducir disfunción sinusal extrínseca por la inhibición competitiva que ocasiona la FA sobre el nodo sinusal o relacionadas con el efecto depresor del nodo sinusal o del nodo AV por los fármacos utilizados como pretratamiento pero que son usualmente transitorias y no requieren tratamiento específico. Aun cuando, en casos de FA de larga duración y en ausencia de fármacos con efecto sobre el sistema de conducción los trastornos del ritmo pueden traducir disfunción intrínseca del nodo sinusal.
Es relativamente frecuente la presencia de extrasístoles auriculares o periodos cortos de taquiarritmias auriculares no sostenidas y que frecuentemente precipitan recurrencias. Arritmias ventriculares pueden verse en casos con cardiopatía estructural significativa, o favorecidas por desequilibrio electrolítico (hipokalemia, hipomagnesemia) o en los casos de intoxicación digitálica. Aunque dosis y niveles terapéuticos de digoxina no excluyen toxicidad, en general, el procedimiento de cardioversión no se contraindica.
En pacientes con marcapasos antibradicardia, cardiodesfibrilador implantable o terapia de resincronización, la cardioversión eléctrica puede resultar en incremento del umbral de estimulación o bloqueo de salida con pérdida de captura, además del posible daño directo del generador. Los equipos implantables siempre requerirán de revisión después de procedimientos de cardioversión eléctrica y en su defecto la reprogramación.
Efectos diversos
Se pueden observar cambios ECGs que incluyen elevación ocasional y transitoria del segmento ST que no están asociados con daño miocárdico87 (Figura 3).

Después de cardioversión con corriente directa puede encontrarse un incremento en la creatinakinasa (CK) total en aproximadamente la mitad de los pacientes, así como un incremento moderado de la isoenzima CK-MB.
La CK-MB representa menos de 1 a 3% de la actividad de la CK total del músculo normal, entonces, después de una lesión muscular, la CK-MB puede alcanzar hasta 15 a 20% de la actividad de la CK total. Por lo tanto, la asociación del incremento de CK total y CK-MB que aumentan después de cardioversión con alta energía es consistente con lesión del músculo esquelético y sobre todo está estrechamente relacionada con la energía total acumulada (choques múltiples repetidos). La troponina T cardiaca (cTnT) es un componente proteico cardioespecífico del complejo troponina/tropomiosina. Un incremento en la concentración de troponina T sería específico de daño miocárdico. La troponina I (cTnI) nunca está expresada en el músculo esquelético, su cardioespecificidad se mantiene en casos de lesión muscular.
No se han demostrado aumentos en los niveles de cTnT o cTnI, por lo que no hay evidencia de lesión miocárdica aún después de cardioversión con choques de alta energía.87-95
Una situación común postcardioversión eléctrica es el eritema cutáneo en el sitio de contacto de los electrodos que no tiene ningún significado, sin embargo, puede ocasionarse lesión dérmica moderada de primer grado que puede ser más intensa en casos de cardioversión de alta energía o después de choques múltiples repetidos. Las lesiones cutáneas se minimizan con la aplicación suficiente de gel entre los electrodos y el tórax96 o el uso de electrodos autoadhesivos.
Fibrilación auricular refractaria a la cardioversión eléctrica
Como se ha mencionado, los predictores de refractariedad a la cardioversión eléctrica convencional incluyen principalmente a la FA de larga evolución (generalmente mayor de tres meses), presencia de cardiomiopatía e insuficiencia cardiaca, enfermedad valvular (mitral, aórtica) significativa. Los efectos del tamaño de la aurícula izquierda (AI) son menos claros.
En un estudio con pocos pacientes, el diámetro de la AI de > 45 mm se consideró que tuvo un valor predictivo positivo; sin embargo, otros estudios puntualizan que el tamaño de la aurícula está relacionado más bien con la duración de la FA y este último es el predictor más importante. Por lo tanto, se considera que el tamaño de la AI no influye fuertemente sobre la cardioversión y los pacientes no deberían ser excluidos sólo por este parámetro ya que se ha demostrado éxito y mantenimiento de RS aun con AI dilatada con diámetros < 65 mm86,97-99 (Cuadro V).

La impedancia transtorácica
Por otro lado, se ha mencionado de manera sobresaliente a la resistencia transtorácica (impedancia) y que junto con los otros factores pueden relacionarse con fallas totales en 8 a 33% de los pacientes.3,6,8,32,100,101
La impedancia transtorácica normal en el hombre adulto es de 70 a 80 Ω. Cuando la impedancia es demasiado alta, un choque de baja energía o aun de alta energía (300-360 J) no generará la corriente suficiente para desfibrilar.
En el estudio de Mittal y cols.12 la eficacia de la cardioversión fue afectada de manera significativa por la impedancia transtorácica de base. En pacientes con una impedancia ≥ 70 Ohms la eficacia acumulada con choques de onda monofásica fue del 68%; p = 0.004. Comparado con pacientes con una impedancia ≤ 70 Ohms (60 ± 8 Ω), los pacientes con impedancia ≥ 70 Ohms (86 ± 12 Ω) tuvieron un mayor peso corporal (98 ± 24 contra 78 ± 12 kg, p < 0.0001). Otros reportes encuentran una relación lineal significativa de la impedancia transtorácica con el área de superficie corporal.6,102
Cardioversión eléctrica externa de alta energía
Para reducir el efecto de la impedancia transtorácica se recomienda desde el uso adecuado del gel conductor en la interfase electrodo-tórax, una presión de contacto suficiente y posiblemente una configuración anteroposterior de los electrodos.
Aun así, existen casos bien documentados de FA refractaria en cuyo caso estará indicado el uso de cardioversión eléctrica con choques de alta energía con la hipótesis de favorecer y asegurar la penetración adecuada del flujo de corriente a la aurícula. Cuando múltiples choques convencionales fallan para restaurar el RS el doble choque secuencial transtorácico puede ser una alternativa. Veintiún pacientes consecutivos con fibrilación auricular paroxística o persistente refractaria al menos a tres choques monofásicos convencionales con energías progresivas de 200 J, 300 J y 360 J, o al menos a dos intentos consecutivos con energía máxima de 300-360 J recibieron choques secuenciales con 720 J aplicados mediante dos desfibriladores. Edad media 64 ± 11 años y peso medio 97 ± 19 kg (intervalos, 49 a 112). La evolución de la fibrilación auricular fue ≤ 3 meses en el 76%. El diámetro medio de la aurícula izquierda fue 4.5 ± 0.7 cm (intervalos, 3.5 a 6.0).
El ritmo sinusal se alcanzó en 19 (90.4%), incluyendo 2 casos refractarios a choques bifásicos con una mediana de 1,050 J (intervalos, 660 a 1,440 J) sin complicaciones.
El análisis de variables múltiples identificó a la duración de la fibrilación auricular, > 90 días (RR 0.98, IC 0.95-0.98 p = 0.02) y al peso corporal, 101 ± 11 kg (RR 0.64, IC 0.46-0.90 p = 0.01) como variables independientes asociadas con el fracaso de la cardioversión.
El peso corporal, p = 0.002 fue el mejor predictor univariable de cardioversión no exitosa. La cardioversión de alta energía no causa daño miocárdico evidenciado por estimación con cTnT.103
Bjerregaard y colaboradores,104 publicaron la primera serie de 15 pacientes con éxito de 67% usando doble choque. Saliba y colaboradores,105 y Marrouche y colaboradores106 confirmaron la seguridad y eficacia del método de cardioversión eléctrica externa con choques sincronizados de alta energía con éxitos de 74 y 84%, respectivamente. Otros autores confirman la misma frecuencia de éxito.107
El mecanismo de la eficacia es múltiple, a saber, se asegura el paso de un flujo de corriente óptimo superando la limitación que impone la impedancia transtorácica y se disminuye el umbral de desfibrilación a través de la aplicación secuencial facilitadora.108-112
Los resultados indican que para la fibrilación auricular refractaria la cardioversión eléctrica con onda monofásica el doble choque secuencial transtorácico representa una alternativa segura y altamente eficaz y puede tener una aplicabilidad general. Si no se cuenta con choques de onda bifásica, este procedimiento debería ser realizado antes que la cardioversión eléctrica interna.
Cardioversión eléctrica interna
El método que se ha estudiado más ampliamente para el tratamiento de la FA resistente a la cardioversión eléctrica externa es la cardioversión eléctrica interna con choques de alta o baja energía con éxito de 78 a 91% por las diferencias entre la selección de los pacientes.113-115 Los riesgos relacionados son el barotrauma y arritmias, no obstante, son mínimos cuando se utiliza baja energía por lo que la técnica representa una alternativa eficaz en pacientes con FA persistente o permanente (crónica), obesos, enfermedad pulmonar obstructiva severa y probablemente aquéllos con cardiodesfibriladores. En nuestro medio sólo centros especializados la han realizado.116
En la cardioversión interna la configuración de los catéteres electrodos transvenosos pueden ser aurícula derecha-sinus coronario o aurícula derecha-arteria pulmonar izquierda. El nivel de energía usualmente requerido está entre dos a seis J.
Conclusión
La FA es la arritmia sostenida más común y la estrategia para su tratamiento puede ser motivo de controversia. La cardioversión eléctrica es ampliamente usada para restablecer el ritmo sinusal y ha demostrado ser la estrategia más segura y efectiva para restablecer el ritmo sinusal.
REFERENCIAS
1. Zoll PM, Linenhtal AJ, Gibson W, Paul MH, Norman LR. Termination of ventricular fibrillation in man by externally applied electric countershock. N Engl J Med 1956; 254: 727-732. [ Links ]
2. Lown B. Electrical reversion of cardiac arrhythmias. Br Heart J 1967; 29: 469-489. [ Links ]
3. Valencia SJS, Arriaga NR, Navarro RJR, Martínez EA. Indicadores ecocardiográficos de la cardioversión eléctrica en pacientes con fibrilación auricular. Arch Inst Cardiol Mex 2001; 71: 28-33. [ Links ]
4. Mattioli AV, Bonatti S, Bonetti L, Matiolli G. Left atrial size after cardioversion for atrial fibrillation: effect of external direct current shock. J Am Soc Echocardiogr 2003; 16: 271-276. [ Links ]
5. Mattioli AV, Castelli A, Sternieri S, Mattioli G. Doppler sonographic evaluation of left atrial function after cardioversion of atrial fibrillation. J Ultrasound Med 1999; 18: 289-294. [ Links ]
6. Kerber RE, Grayzel J, Hoyt R, Marcus M, Kennedy J. Transthoracic resistance in human defibrillation. Influence of body weight, chest size, serial shocks, paddle size and paddle contact pressure. Circulation 1981; 63: 676-682. [ Links ]
7. Zhang Y, Clark CB, Davies LR et al. Body weight is a predictor of biphasic shock success for low energy transthoracic defibrillation. Resuscitation 2002; 54: 281-287. [ Links ]
8. Dalzell GW, Cunningham SR, Anderson J, Adgey AA. Electrode pad size, transthoracic impedance and success of external ventricular defibrillation. Am J Cardiol 1989; 64: 741-744. [ Links ]
9. Ricard P, Levy S, Trigano J et al. Prospective assessment of the minimum energy needed for external electrical cardioversion of atrial fibrillation. Am J Cardiol 1997; 79: 815-816. [ Links ]
10. Lown B, Amarasingham R, Neuman J. New method for terminating cardiac arrhythmias. Use of synchronized capacitor discharge. JAMA 1962; 182: 548-555. [ Links ]
11. Greene HL, DiMarco JP, Kudenchuk PJ et al. Comparison of monophasic and biphasic defibrillating pulse waveforms for transthoracic cardioversion. Biphasic Waveform Defibrillation Investigators. Am J Cardiol 1995; 75: 1135-1139. [ Links ]
12. Mittal S, Ayati S, Stein KM et al. Transthoracic cardioversion of atrial fibrillation: comparison of rectilinear biphasic versus damped sine wave monophasic shocks. Circulation 2000; 101: 1282-1287. [ Links ]
13. Krasteva V, Trendafilova E, Cansell A, Daskalov I. Assessment of balanced biphasic defibrillation waveforms in transthoracic atrial cardioversion. J Med Eng Technol 2001; 25: 68-73. [ Links ]
14. Ricard P, Levy S, Boccara, G, Lakhal E, Bardy G. External cardioversion of atrial fibrillation: comparison of biphasic vs monophasic waveform shocks. Europace 2001; 3: 96-99. [ Links ]
15. Ewy GA, Hellman DA, McClung S, Taren D. Influence of ventilation phase on transthoracic impedance and defibrillation effectiveness. Crit Care Med 1980; 8: 164-166. [ Links ]
16. Fumagalli S, Boncinelli L, Bondi E et al. Does advanced age affect the immediate and log-term results of direct-current external cardioversion of atrial fibrillation? J Am Geriatr Soc 2002; 50: 1192-1197. [ Links ]
17. Lerman BB, DiMarco JP, Haines DE. Current-based versus energy-based ventricular defibrillation: a prospective study. J Am Coll Cardiol 1988; 12: 1259-1264. [ Links ]
18. Edmark KW, Thomas GI, Jones TW. DC pulse fibrillation. J Thorac Cardiovasc Surg 1966; 51: 326-333. [ Links ]
19. Gurvich NL, Yuniev GS. Restoration of heart rhythm during fibrillation by a condenser discharge. Am Rev Soviet Med 1947; 4: 252-256. [ Links ]
20. Elhendy G, Gentile F, Khanderia BK et al. Predictors of unsuccessful electrical cardioversion in atrial fibrillation. Am J Cardiol 2002; 89: 83-86. [ Links ]
21. Pagan-Carlo LA, Spencer KT, Robertson CE et al. Transthoracic defibrillation: Importance of avoiding electrode placement directly on the female breast. J Am Coll Cardiol 1996; 27: 449-452. [ Links ]
22. Mathew TP, Moore A, McIntyre M et al. Randomized comparison of electrode positions for cardioversion of atrial fibrillation. Heart 1999; 81: 576-579. [ Links ]
23. Botto GL, Politi A, Bonini W, Broffoni T, Bonatti R. External cardioversion of atrial fibrillation: role of paddle position on technical efficacy and energy requirements. Heart 1999; 82: 726-730. [ Links ]
24. Alp NJ, Rahman S, Bell JA, Shahi M. Randomized comparison of antero-lateral versus antero-posterior paddle position for DC cardioversion of persistent atrial fibrillation. Int J Cardiol 2000; 75: 211-216. [ Links ]
25. Chen CJ, Guo GB. External cardioversion in patients with persistent atrial fibrillation: a reappraisal of the effects of electrode pad position and transthoracic impedance on cardioversion success. Jpn Heart J 2003; 44: 921-932. [ Links ]
26. Siaplaouras S, Buob A, Rötter C, Böhm M, Jung J. Randomized comparison of anterolateral versus anteroposterior electrode position for biphasic external cardioversion of atrial fibrillation. Am Heart J 2005; 150: 150-152. [ Links ]
27. Panacek EA, Munger MA, Rutherford WF, Gardner SF. Report of nitropatch explosions complicating defibrillation. Am J Emerg Med 1992; 10: 128-129. [ Links ]
28. Kirchhof P, Monnig G, Wasmer K et al. A trial of self-adhesive patch electrodes and hand-held paddle electrodes for external cardioversion of atrial fibrillation (MOBIPAPA). Eur Heart J 2005; 26: 1292-1297. [ Links ]
29. Kerber RE, Jensen SR, Grayzel J, Kennedy J, Hoyt R. Elective cardioversion: influence of paddle electrode location and size on success rates and energy requirements. N Engl J Med 1981; 305: 658-662. [ Links ]
30. Stults KR, Brown DD, Cooley F, Kerber RE. Self-adhesive monitor/defibrillation pads improve prehospital defibrillation success. Ann Emerg Med 1987; 16: 872-877. [ Links ]
31. Dhal CF, Ewy GA, Warner ED, Thomas ED. Myocardial necrosis from direct current countershock: effect of paddle electrode size and time interval between discharges. Circulation 1974; 60: 380-382. [ Links ]
32. Kerber RE, Martins JB, Kienzle MG et al. Energy, current, and success in defibrillation and cardioversion: clinical studies using an automated impedance-based method of energy adjustment. Circulation 1988; 77: 1038-1046. [ Links ]
33. Dalzell GW, Anderson J, Adgey AA et al. Factors determining success and energy requirements for cardioversion in atrial fibrillation. Q J Med 1990; 76: 903-913. [ Links ]
34. Boos C, Thomas MD, Jones A et al. Higher energy monophasic DC cardioversion for persistent atrial fibrillation: is it time to start at 360 joules? Ann Noninvasive Electrocardiol 2003; 8: 121-126. [ Links ]
35. Juglar JA, Hamdam MH, Ramaswamy K et al. Initial energy for elective external cardioversion of persistent atrial fibrillation. Am J Cardiol 2000; 86: 348-350. [ Links ]
36. Page RL, Kerber RE, Russell JK et al. For the BiCard Investigators: Biphasic versus monophasic shock waveform for conversion of atrial fibrillation. J Am Coll Cardiol 2002; 39: 1956-1963. [ Links ]
37. Rho RW, Page RL. Biphasic versus monophasic shock waveform for conversion of atrial fibrillation. Card Electrophysiol Rev 2003; 7: 290-291. [ Links ]
38. Atkins DL, Sirna S, Kieso R, Charbonnier F, Kerber RE. Pediatric defibrillation: importance of paddle size in determining transthoracic impedance. Pediatrics 1988; 82: 914-918. [ Links ]
39. Deakin CD, Benetts SH, Petley GW, Clewlow F. What is the optimal paddle force during paediatric external defibrillation? Resuscitation 2003; 59: 83-88. [ Links ]
40. Gurnett CA, Atkins DL. Successful use of a biphasic waveform automated external defibrillator in a high-risk child. Am J Cardiol 2000; 86: 1051-1053. [ Links ]
41. Atkins D, Jorgenson D. Attenuated pediatric electrode pads for automated external defibrillator use in children. Resuscitation 2005; 66: 31-37. [ Links ]
42. Berg RA, Chapman FW, Berg MD et al. Attenuated adult biphasic shocks compared with weight-based monophasic shocks in a swine model of prolonged pediatric ventricular fibrillation. Resuscitation 2004; 61: 189-197. [ Links ]
43. Tang W, Weil MH, Jorgenson D et al. Fixed-energy biphasic waveform defibrillation in a pediatric model of cardiac arrest and resuscitation. Crit Care Med 2002; 30: 2736-2741. [ Links ]
44. Clark CB, Zhang Y, Davies LR, Karlsson G, Kerber RE. Pediatric transthoracic defibrillation: biphasic versus monophasic waveforms in an experimental model. Resuscitation 2001; 51: 159-163. [ Links ]
45. Gutgesell HP, Tacker WA, Geddes LA et al. Energy dose for ventricular defibrillation of children. Pediatrics 1976; 58: 898-901. [ Links ]
46. Samson RA, Berg RA, Bingham R et al. Use of automated external defibrillators for children: an update: an advisory statement from the pediatric advanced life support task force, International Liaison Committee on Resuscitation. Circulation 2003; 107: 3250-3255. [ Links ]
47. Jorgenson D, Morgan C, Snyder D et al. Energy attenuator for pediatric application of an automated external defibrillator. Crit Care Med 2002; 30: S145-S147. [ Links ]
48. Canessa R, Lema G, Urzúa J, Dagnino J, Concha M. Anesthesia for elective cardioversion: a comparison of four anesthetic agents. J Cardiothorac Vasc Anesth 1991; 5: 566-568. [ Links ]
49. Coll-Vinent B, Sala X, Fernández C et al. Sedation for cardioversion in the emergency department: analysis of effectiveness in four protocols. Ann Emerg Med 2003; 42: 767-772. [ Links ]
50. Van Gelder IC, Tuinenburg AE, Schoonderwoerd BS, Tieleman RG, Crijns HJ. Pharmacologic versus direct-current electrical cardioversion of atrial flutter and fibrillation. Am J Cardiol 1999; 84: 147R-151R. [ Links ]
51. Wijffels MC, Kirchof CJ, Dorland R, Alessie MA. AF begets AF: a study in awake chronically instrumented goats. Circulation 1995; 92: 1954-1968. [ Links ]
52. Zipes DP. Electrophysiologic remodeling of the heart owing to rate. Circulation 1997; 95: 1745-1748. [ Links ]
53. Goette A, Honeycutt G, Langberg JJ. Electrical remodeling in atrial fibrillation: time course and mechanisms. Circulation 1996; 94: 2968-2974. [ Links ]
54. Yu WC, Chen SA, Lee SH et al. Tachycardia-induced change of atrial refractory periods in humans. Rate dependency and effects of antiarrhythmic drugs. Circulation 1998; 97: 2331-2337. [ Links ]
55. Tieleman RG, Van Gelder IC, Crijins HJGM et al. Early recurrence of atrial fibrillation after electrical cardioversion: a result of fibrillation induced electrical remodeling of the atria? J Am Coll Cardiol 1998; 31: 167-173. [ Links ]
56. Morillo CA, Klein GJ, Jones DL, Guiraudon CM. Chronic rapid atrial pacing: structural, functional and electrophysiologic characteristics of new model of sustained AF. Circulation 1995; 91: 1588-1595. [ Links ]
57. Daoud EG, Bogun F, Goyal R et al. Effects of atrial fibrillation on atrial refractoriness in humans. Circulation 1996; 94: 1600-1606. [ Links ]
58. De Simone A, Stabile G, Vitale DF et al. Pretreatment with verapamil in patients with persistent or chronic atrial fibrillation who underwent electrical cardioversion. J Am Coll Cardiol 1999; 34: 810-814. [ Links ]
59. Tieleman GR, C Van Gelder ID, Crijns HJ et al. Early recurrences of atrial fibrillation after electrical cardioversion: A result of fibrillation-induced electrical remodeling of the atrial? J Am Coll Cardiol 1998; 31: 167-173. [ Links ]
60. De Simone A, De Pasquale M, De Matteis C et al. Verapamil plus antiarrhythmic drugs reduce atrial fibrillation recurrences after an electrical cardioversion (VEPARAF Study). Eur Heart J 2003; 24: 1425-1429. [ Links ]
61. Van Noord T, Van Gelder IC, Tieleman RG et al. VERDICT: The verapamil versus digoxin cardioversion trial: A randomized study on the role of calcium lowering for maintenance of sinus rhythm after cardioversion of persistent atrial fibrillation. J Cardiovasc Electrophysiol 2001; 12: 766-769. [ Links ]
62. Villani GQ, Piepoli MF, Terracciano C, Capucci A. Effects of diltiazem pretreatment on direct-current cardioversion in patients with persistent atrial fibrillation: a single-blind, randomized, controlled study. Am Heart J 2000; 140: 437-443. [ Links ]
63. Capucci A, Villani GQ, Aschieri D, Rosi A, Piepoli MF. Oral amiodarone increases the efficacy of direct-current cardioversion in restoration of sinus rhythm in patients with chronic atrial fibrillation. Eur Heart J 2000; 21: 66-73. [ Links ]
64. Manios EG, Mavrakis HE, Kanoupakis EM et al. Effects of amiodarone and diltiazem on persistent atrial fibrillation conversion and recurrence rates: a randomized controlled study. Cardiovasc Drugs Ther 2003; 17: 31-39. [ Links ]
65. Komatsu T, Yomogida K, Nakamura S et al. Relationship between duration of arrhythmia and subsequent preventive effect of disopyramide after cardioversion in patients with symptomatic paroxysmal and persistent atrial fibrillation. J Cardiol 2003; 42: 111-117. [ Links ]
66. Bianconi L, Mennuni M, Lukic V et al. Effects of oral propafenone administration before electrical cardioversion of chronic atrial fibrillation: a placebo-controlled study. J Am Coll Cardiol 1996; 28: 700-706. [ Links ]
67. Dogan A, Ergene O, Nazli C et al. Efficacy of propafenone for maintaining sinus rhythm in patients with recent onset or persistent atrial fibrillation after conversion: a randomized, placebo-controlled study. Acta Cardiol 2004; 59: 255-261. [ Links ]
68. Crijns HJ, Gosselink AT, Lie KI. Propafenone versus disopyramide for maintenance of sinus rhythm after electrical cardioversion of chronic atrial fibrillation: a randomized, double-blind study. PRODIS Study Group. Cardiovasc Drugs Ther 1996; 10: 145-152. [ Links ]
69. Climent VE, Marin F, Mainar L et al. Effects of pretreatment with intravenous flecainide on efficacy of external cardioversion of persistent atrial fibrillation. Pacing Clin Electrophysiol 2004; 27: 368-372. [ Links ]
70. Tieleman RG, Van Gelder IC, Bosker HA et al. Does flecainide regain its antiarrhythmic activity after electrical cardioversion of persistent atrial fibrillation? Heart Rhythm 2005; 2: 223-230. [ Links ]
71. Pedersen OD, Bagger H, Kober L, Torp-Pedersen C. Trandolapril reduces the incidence of atrial fibrillation after acute myocardial infarction in patients with left ventricular dysfunction. Circulation. 1999; 100: 376-380. [ Links ]
72. Nakashima H, Kumagai K, Urata H et al. Angiotensin II antagonist prevents electrical remodeling in atrial fibrillation. Circulation 2000; 101: 2612-2617. [ Links ]
73. Madrid HA, Bueno GM, Rebollo JM.G et al. Persistent atrial fibrillation: a prospective and randomized study use of irbesartan to maintain sinus rhythm in patients with long-lasting. Circulation 2002; 106: 331-336. [ Links ]
74. Yu WC, Lin YK, Tai CT et al. Early recurrence of atrial fibrillation after external cardioversion. Pacing Clin Electrophysiol 1999; 22:1614-1619. [ Links ]
75. Timmermans C, Rodríguez LM, Smeets JL, Wellens HJ. Immediate reinitiation of atrial fibrillation following internal defibrillation. J Cardiovasc Electrophysiol 1998; 9: 122-128. [ Links ]
76. Tse HF, Lau CP, Ayers GM. Atrial pacing for suppression of early reinitiation of atrial fibrillation after successful internal cardioversion. Eur Heart J 2000; 21: 1167-1176. [ Links ]
77. Iqbal MB, Taneja AK, Lip GYP, Flather M. Recent developments in atrial fibrillation. Br Med J 2005; 330: 238-243. [ Links ]
78. Fuster V, Rydén LE, Cannom DS et al. ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation. Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines. Circulation 2006; 114: e257-e354. [ Links ]
79. Sulke N, Sayers F, Lip GYH. Rhythm control and cardioversion. Heart 2007; 93: 29-34. [ Links ]
80. Manning WJ, Silverman DI, Katz SE et al. Impaired left atrial mechanical function after cardioversion: relation to the duration of atrial fibrillation. J Am Coll Cardiol 1994; 23: 1535-1540. [ Links ]
81. Bjerkelund CJ, Orning OM. The efficacy of anticoagulant therapy in preventing embolism related to DC electrical cardioversion of atrial fibrillation. Am J Cardiol 1969; 23: 208-216. [ Links ]
82. Weingberg DM, Mancini J. Anticoagulation for cardioversion of atrial fibrillation. Am J Cardiol 1989; 63: 745-746. [ Links ]
83. Arnold AZ, Mick MJ, Mazurek RP, Loop FD, Trohman RG. Role of prophylactic anticoagulation for direct current cardioversion in patients with atrial fibrillation or atrial flutter. J Am Coll Cardiol 1992; 19: 851-855. [ Links ]
84. Lip GYH. Does atrial fibrillation confer a hypercoagulable state? Lancet 1995; 346: 1313-1314. [ Links ]
85. Lip GYH. Cardioversion of atrial fibrillation. Postgrad Med J 1995; 71: 457-465. [ Links ]
86. Metcalfe MJ, Smith F, Jennings K, Paterson N. Does cardioversion of atrial fibrillation result in myocardial damage? Br Med J 1988; 296: 1364. [ Links ]
87. Eshani A, Gordon AE, Sobel BE. Effects of electrical countershock on serum creatine phosphokinase (total CPK), isoenzyme activity. Am J Cardiol 1976; 37: 12-18. [ Links ]
88. Jacobson J, Odmansson I, Nordlander R. Enzyme release after electrical cardioversion. Eur J Cardiol 1990; 11: 749-752. [ Links ]
89. Garre L, Álvarez A, Rubio M et al. Use of cardiac troponin T rapid assay in the diagnosis of a myocardial injury secondary to electrical cardioversion. Clin Cardiol 1997; 20: 619-621. [ Links ]
90. Neumayr G, Hagn C, Gänzer H et al. Plasma levels of troponin T after electrical cardioversion of atrial fibrillation and flutter. Am J Cardiol 1997; 80: 1367-1369. [ Links ]
91. Rao ACR, Naeem N, John C et al. Direct current cardioversion does not cause cardiac damage: evidence form cardiac troponin T estimation. Heart 1998; 80: 229-230. [ Links ]
92. Bonnefoy E, Chevalier P, Kirkorian G et al. Cardiac troponin I does not increase after cardioversion. CHEST 1997; 111: 15-18. [ Links ]
93. Grubb NR, Cuthbert D, Cawood P, Flapan AD, Fox KA. Effect of DC shock on serum levels of total creatine kinase, MB-creatine kinase mass and troponin T. Resuscitation 1998; 36: 193-199. [ Links ]
94. Vikenes K, Omvik P, Farstad M, Nordrehaug JE. Cardiac biochemical markers after cardioversion of atrial fibrillation or atrial flutter. Am Heart J 2000; 140: 690-696. [ Links ]
95. del Rey S JM, Hernández MA, González R JM y cols. Cardioversión eléctrica externa y sistemas de cardioversión interna: evaluación prospectiva y comparativa del daño muscular con troponina I. Rev Esp Cardiol 2002; 55: 227-234. [ Links ]
96. Pagan-Carlo LA, Stone MS, Kerber RE. Nature and determinants of skin ''burns'' after transthoracic cardioversion. Am J Cardiol 1997; 79: 689-691. [ Links ]
97. Verhorst PM, Kamp O, Welling RC, Van Eenige MJ, Visser CA. Transesophageal echocardiographic predictors for maintenance of sinus rhythm after electrical cardioversion of atrial fibrillation. Am J Cardiol 1997; 79: 1355-1359. [ Links ]
98. Van Gelder IC, Crijns HJ, Tieleman RG et al. Chronic atrial fibrillation: success of serial cardioversion therapy and safety of oral anticoagulation. Arch Intern Med 1996; 156: 2585-2592. [ Links ]
99. Volgman AS, Soble JS, Neumann A et al. Effect of left atrial size on recurrence of atrial fibrillation after electrical cardioversion: atrial dimension versus volume. Am J Card Imaging 1996; 10: 261-265. [ Links ]
100. Dorian P, Wang MJ. Defibrillation current and impedance are determinants of defibrillation energy requirements. Pacing Clin Electrophsysiol 1988; 11(11 Pt 2): 1996-2001. [ Links ]
101. Bertaglia E, D'Este D, Zerbo F et al. Success of serial external electrical cardioversion of persistent atrial fibrillation in maintaining sinus rhythm; a randomized study. Eur Heart J 2002; 23: 1522-1528. [ Links ]
102. Garcia LA, Kerber RE. Transthoracic defibrillation: does electrode adhesive pad position alter transthoracic impedance? Resuscitation 1998; 37: 139-143. [ Links ]
103. Velázquez RE, Martínez EA, Cancino RC y cols. Doble choque eléctrico secuencial transtorácico para la fibrilación auricular refractaria. Arch Cardiol Mex 2005; 75(S3): 69-80. [ Links ]
104. Bjerregaard P, El-Shafei A, Janosik DL, Schiller L, Quattromani A. Double external direct-current shocks for refractory atrial fibrillation. Am J Cardiol 1999; 83: 972-974. [ Links ]
105. Saliba W, Juratli N, Chung MK et al. Higher energy synchronized external direct current cardioversion for refractory atrial fibrillation. J Am Coll Cardiol 1999; 34: 2031-2034. [ Links ]
106. Marrouche NF, Bardy GH, Frielitz HJ, Günther J, Brachmann J. Quadruple pads approach for external cardioversion of atrial fibrillation. Pacing Clin Electrophysiol 2001; 24 (Pt 1): 1321-1324. [ Links ]
107. Kabukcu M, Demircioglu F, Yanik E, Minareci K, Ersel-Tüzüner F. Simultaneous double external DC shock technique for refractory atrial fibrillation in concomitant heart disease. Jpn Heart J 2004; 45: 929-936. [ Links ]
108. Chang M-S, Inoue H, Kallok M, Zipes DP. Double and triple shocks reduce ventricular defibrillation threshold in dogs with and without myocardial infarction. J Am Coll Cardiol 1986; 8: 1393-1405. [ Links ]
109. Jones DL, Klein GJ, Guiraudon GM et al. Internal cardiac defibrillation in man: pronounced improvement with sequential pulse delivery to two different lead orientations. Circulation 1986; 73: 484-491. [ Links ]
110. Jones DL, Klein GJ, Rattes MF, Sohla A, Sharma AD. Internal cardiac defibrillation: single and sequential pulses and a variety of lead orientation. Pacing Clin Electrophysiol 1988; 11: 583-591. [ Links ]
111. Bardy GH, Ivey TD, Allen MD, Johnson G, Greene HL. Prospective comparison of sequential pulse and single pulse defibrillation with use of two different clinically available systems. J Am Coll Cardiol 1989; 14: 165-171. [ Links ]
112. Johnson EE, Alfermess CA, Wolf PD, Smith WM, Ideker RE. Effect of pulse separation between two sequential biphasic shocks given over different lead configurations on ventricular defibrillation efficacy. Circulation 1992; 85: 2267-2274. [ Links ]
113. Levy S, Lauribe P, Dolla E et al. A randomized comparison of external and internal cardioversion of chronic atrial fibrillation. Circulation 1992; 86: 1415-1420. [ Links ]
114. García GJ, Almendral J, Arenal A y cols. Cardioversión interna con choques de baja energía en fibrilación auricular resistente a cardioversión eléctrica externa. Rev Esp Cardiol 1999; 52: 105-112. [ Links ]
115. Friberg J, Gadsboll N. Intracardiac low-energy versus transthoracic high-energy direct-current cardioversion of atrial fibrillation: A randomized comparison. Cardiology 2003; 99: 72-77. [ Links ]
116. Mendoza GC, Iturralde TP, Guevara VM y cols. Cardioversión interna en fibrilación auricular crónica. Arch Cardiol Mex 2000; 72: 138-144. [ Links ]














