Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de cardiología
versión impresa ISSN 0188-2198
Rev. Mex. Cardiol vol.23 no.1 México ene./mar. 2012
CASO CLÍNICO
Espasmo coronario dinámico.
¿Nueva entidad o presencia de un viejo problema?
Dynamic coronary spasm.
New entity or presence of an old problem?
Héctor Alejandro Galeano-Ricaño*
*Cardiólogo. UMAE Hospital de Cardiología. Centro Médico Nacional Siglo XXI, IMSS, México, D.F.
Dirección para correspondencia:
Dr. Héctor Alejandro Galeano-Ricaño
Avenida México-Coyoacán Núm. 259 D #301,
Col. Xoco, México, D.F. 03330.
E-mail: hector4819@yahoo.com.mx
RESUMEN
Es bien conocido el hecho de que la angioplastia coronaria transluminal percutánea (ACTP) y el implante de stent provocan daño endotelial. En ocasiones es tan severo que se manifiesta por vasoconstricción coronaria persistente, condicionando isquemia miocárdica (clínica, eléctrica y/o enzimática). Sin embargo, es posible que se manifieste de otra forma: espasmo coronario dinámico. Se presentan dos casos con varias similitudes entre sí: evolución tórpida con sospecha de oclusión del stent; intervencionismo con agresión endotelial (ultrasonido intracoronario e implante de stent); imagen angiográfica de espasmo arterial coronario dinámico, confundido con puente muscular. El espasmo coronario dinámico se puede definir como la vasoconstricción oclusiva dinámica de un segmento coronario epicárdico, en una arteria que ha sido sometida a intervencionismo. Habría que diferenciarlo del no reflujo, provocado por la oclusión total de la arteria intervenida del espasmo inducido por catéter, pero sobre todo, del puente muscular. En ambos casos se reportó como puente muscular, sin embargo, en el estudio diagnóstico no se observaba esta imagen. El motivo del presente trabajo es llamar la atención a la comunidad médica, específicamente al médico intervencionista, sobre una imagen que puede ser un factor pronóstico y terapéutico (tratamiento con calcio-antagonistas y nitratos, uso de marcadores séricos o seguimiento más estrecho), en la evolución de los pacientes sometidos a intervencionismo coronario.
Palabras clave: Angioplastia coronaria, stent, espasmo coronario dinámico, puente muscular.
ABSTRACT
The fact is that percutaneus transluminal coronary angioplasty (ACTP) and implants of stent induce vascular endothelial dysfunction. So severe that it is pronounced by persistent coronary vasoconstriction, conditioning ischemic complications (clinical, electrical and/or enzymatic). Nevertheless, it is possible that it is pronounced of another form: dynamic coronary vasospasm . We present two cases with several similarities: adverse outcome with suspicion of occlusion of stent; interventionism with endothelial aggression (intracoronary ultrasound and implant of stent); and angiographic image of dynamic coronary spasm, confused with muscular bridge. The dynamic coronary spasm can be defined as the dynamic occlusive vasoconstriction, of a epicardial coronary segment, in an artery that it has been put under interventionism. It would have to differentiate it from the no-reflow, caused by the total occlusion of the artery and persistent spasm induced by catheter. In both cases it was reported like muscular bridge, nevertheless, in the study diagnosis was not observed this image. Reason for the present work is to call the attention to the medical community, specifically to the interventionist doctor, on an image that can have a therapeutic and prognosis interest (treatment with calcium antagonists and nitrates, use of cardiac enzyme leves, and closer follow-up), in the evolution of the patient put under coronary interventionism.
Key words: Coronary angioplasty, stent, dynamic coronary spasm, muscular bridge.
Introducción
Durante el cateterismo cardiaco, ya sea diagnóstico o intervencionista, es común enfrentarse con el espasmo coronario que se manifiesta de diferentes formas: oclusión del ostium de la coronaria derecha, cuando el catéter es atrapado por el vasoespasmo; aunque se confunde con lesión ateromatosa, se resuelve retirando el catéter. No-reflow , en el que desaparece el flujo coronario; es necesaria la instalación de vasodilatadores intracoronarios (adenosina y nitratos). En ocasiones, el espasmo es tan prolongado, que puede tener consecuencias desastrosas: angina con cambios electrocardiográficos, infarto del miocardio, inclusive la muerte. Sin embargo, hay una imagen hemodinámica que puede ser ocasionada por un espasmo coronario dinámico, definido como la vasoconstricción oclusiva dinámica de un segmento coronario epicárdico en una arteria que ha sido sometida a intervencionismo. Mal diagnosticado como puente muscular, no se le ha dado la importancia debida a este hecho, sobre todo para el tratamiento y seguimiento de estos pacientes. El presente trabajo trata de llamar la atención sobre el espasmo coronario dinámico que tiene mal pronóstico a corto y largo plazo. Se presentan dos casos con ciertas similitudes que confirman lo anterior.
Caso uno
Masculino de 61 años de edad, pensionado. Portador de hipertensión arterial sistémica (15 años, manejada con captopril 25 mg cada 12 h); diabetes mellitus tipo 2 (7 años, tratada con glibenclamida 5 mg cada 12 h); dislipidemia (6 meses, sin tratamiento). El día 30-V-11 a las 19 h, sin causa aparente presentó opresión retroesternal 8/10, con irradiación a espalda y brazo izquierdo, duró menos de 20 minutos y se acompañó de descarga adrenérgica. Acudió a Urgencias del HGZ, siendo egresado a las 3 h por ECG normal y desaparición del dolor. No se comenta resultado de marcadores séricos. El día 31-V-11 a las 5 am, repite el dolor con idénticas características. En urgencias lo encontraron con TA 159/90, FC 88X', FR 24X', T 36° C. EF esencialmente normal. El ECG mostró desnivel positivo de 0.4mV en DI, aVL, V1 a V6 con QS en V2 a V4, por lo que decidieron trombolizarlo a las 6:40 h de iniciado el cuadro (35 mg de tenecteplase en bolo). Las enzimas iniciales con CPK 172, CK-MB 30, DHL 372, TGO 22.3. Trasladado a Urgencias del HC CMN, IMSS, donde consideraron que no tuvo criterios de reperfusión, por lo que fue presentado a hemodinamia para realización de ICP de rescate. El día 1-VI-11 encuentran el tronco de la coronaria izquierda sin lesiones. Descendente anterior (DA) con placa proximal de 95%, otra placa al final del segmento proximal de 95%; resto del vaso con enfermedad difusa. Circunfleja (Cx) no dominante que se agota como posterolateral con placa proximal de 75%; primera marginal obtusa (MO) bifurcada con placa proximal de 75%. Coronaria derecha (CD) sin lesiones (Figura 1). No se realizó ventriculograma. Considerando la DA como arteria responsable, realizaron varias dilataciones notando enlentecimiento del flujo, por lo que instalaron el sistema de aspiración manual Pronto V3; después de múltiples aspiraciones y lavados con adenosina y habiendo mejorando el flujo, colocan un stent Active DES 3.0 x 36 mm que se liberó a 8 y se impactó a 11 atmósferas. Ya con el stent impactado y aún con la guía, se observa la imagen de espasmo coronario dinámico, segmentario y distal al stent (Figura 2). El día 4-VI-11 a las 3:00 h presenta angina acompañada de disnea y diaforesis, con duración de una hora y elevación del segmento ST en V5-6; cuadro que revirtió con la administración de NTG intravenosa. Pensando en la posibilidad de estenosis del stent, ingresa de nuevo a sala de hemodinamia. Encuentran stent permeable con flujo TIMI 3 y persiste la imagen de contracción arterial inconstante (se describió como puente muscular coronario, a pesar de que en el estudio diagnóstico no se observaba) (Figura 3). Implantaron stent Xience V 3.5 x 18 mm en tercio proximal de la MO. Evolución: ECO (6-VI-11) AQ anteroseptal y apical con hipercontractilidad compensatoria posterior y lateral. Disfunción diastólica por trastornos de la relajación. Derrame pericárdico escaso (100 mL aproximadamente), fracción de expulsión (FE) 35%, PSAP 36 mmHg. Un estudio de talio/dipiridamol (7-VI-11) reportó necrosis anteroseptal, apical y anterolateral con viabilidad residual significativa. Isquemia inferior moderada. FE 31%. Se cuantificó una extensión de 58% de la masa ventricular afectada. Egresado el día 9-VI-11 con tratamiento a base de clopidogrel 75 mg al día, enalapril 10 mg dos veces diarias, metoprolol 50 mg cada 12 h, ácido acetilsalicílico (AAS) 150 mg diarios, pravastatina 40 mg al día, bezafibrato 400 mg diario y espironolactona 25 mg por las mañanas. Toleró el programa de rehabilitación.



Caso dos
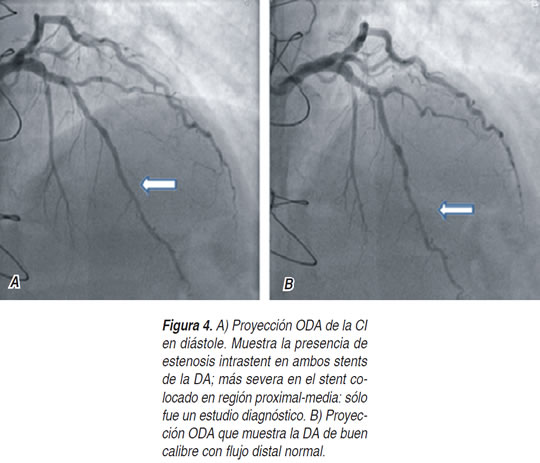
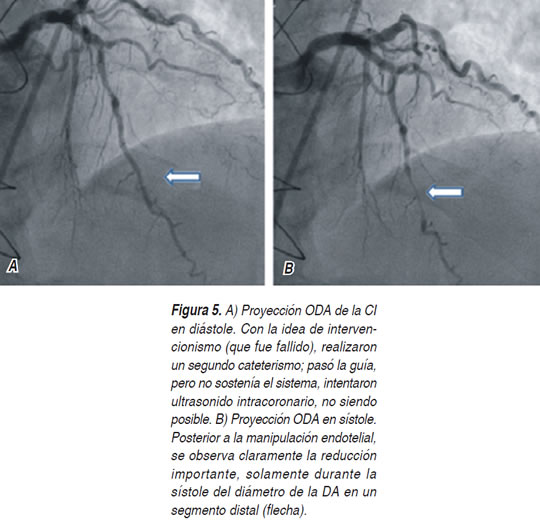
Masculino de 54 años, fumador, con diagnóstico de HAS (enalapril 20 mg cada 12 h), dislipidemia mixta (pravastatina 10 mg diario) y diabetes mellitus 2 de reciente detección. Tatuaje en brazo derecho. Infarto del miocardio posteroinferior y lateral bajo en diciembre de 2010; un estudio con talio/dipiridamol reportó infarto inferior y lateral bajo sin isquemia residual; isquemia anterior leve; FE 69%, por lo que fue egresado a su HGZ; tratamiento a base de ranitidina, enalapril 10 x 2, metoprolol 50 x 2, isosorbide 10 x 3, AAS 150 x 1, clopidogrel 75 x 1, pravastatina 40 mg diario. En marzo de 2011 ingresó al hospital por cuadro de angina inestable de alto riesgo; el cateterismo mostró enfermedad trivascular, por lo que fue intervenido quirúrgicamente el 12-IV-10, con puentes a la descendente anterior, diagonal y descendente posterior. Completó el programa de rehabilitación con tres pruebas de esfuerzo negativas en junio de 2011. Nuevamente ingresado el 19-IX-11 por angina inestable de patrón cambiante. Un estudio de talio/dipiridamol mostró infarto inferolateral con isquemia leve, isquemia anteroapical moderada y FE 53%. Es decir, deterioro de la función ventricular y agravamiento de la isquemia de la región anterior. El cateterismo del 24-IX-11 evidenció dos puentes ocluidos (descendente anterior y diagonal), el puente de la descendente posterior permeable. Implantaron dos stents Nobori, en región proximal y proximal/media de la DA. Alta el 29-IX-11. Acudió a urgencias el 12-XII-11 por dolor torácico (catalogado como pleurítico), y realizaron estudio de medicina nuclear (Tetrofosmin/esfuerzo) el 16-XII-11, con resultado similar al previo. El tratamiento a base de enalapril 20 x 2, atorvastatina 40 mg al día, AAS 150 x 1, clopidogrel 75 x 1 y parches de nitroglicerina. Con este resultado y cuadro doloroso torácico acudió a Urgencias el 27-XII-11. Pensando en oclusión del stent fue cateterizado el día 28-XII-11 (Figura 4); efectivamente se encontró estenosis intrastent tipo 3, pero sólo fue estudio diagnóstico. Se programó para nuevo cateterismo con la idea de nueva ACTP (Figura 5); pasó la guía, pero no sostenía el equipo, inclusive trataron de realizar ultrasonido intracoronario que no fue posible, dando por terminado el estudio. En el segundo cateterismo, no así en el primero, se observa la imagen de contracción dinámica de la descendente anterior. Posteriormente desarrolló déficit neurológico relacionado a isquemia cerebral transitoria.
Discusión
En tiempos de la angioplastia percutánea transluminal coronaria (ACTP)
Lincofft y Topol definieron el cierre vascular repentino, como la oclusión súbita del segmento blanco o adyacente de un vaso coronario durante o después de angioplastia coronaria.1 Dependiendo de la definición empleada, varios estudios reportaron una incidencia de 2.0 al 13.5%. El momento de la presentación se traslapa. Para algunos autores de 53 al 90% de los casos ocurrió estando el paciente en sala de hemodinamia;2-6 pero otros consideraron que 57 al 84% ocurrió fuera de la sala, pero dentro de las primeras 6 h.3,7,8 Entre los principales factores pronósticos se mencionaron: la disfunción ventricular, enfermedad de múltiples vasos, infarto previo y edad avanzada.1 La elevación del segmento ST se relacionó directamente con la oclusión del vaso9,10 y, por ende, con las complicaciones mayores (muerte, infarto o cirugía, en 92% de los casos); cuando solamente referían dolor (que mostró poca significancia estadística), las complicaciones se presentaban solamente entre el 2 y 8% de los pacientes.11
Como consecuencia del cierre vascular repentino se encontró la restenosis;12 sobre todo en pacientes sometidos a ACTP durante un infarto agudo del miocardio. En este grupo de pacientes, el pronóstico a largo plazo (dos años) no era mejor, con incremento de las tasas de mortalidad, cirugía de revascularización e infartos tardíos.6,12 Estos resultados adversos a largo plazo estaban más relacionados a necrosis miocárdica durante el evento de oclusión, manifestada por elevación de las enzimas cardiacas.13 Conociendo el hecho de que entre el 8 y 20% de los pacientes sometidos a ACTP mostraban elevación de CPK o CK-MB, no todos desarrollaban IAM, se consideró que el riesgo era proporcional con el grado de elevación enzimático,14,15 aunque de hecho, no comentaban un umbral seguro de elevación enzimática. Jennferadgme piensa que niveles mayores a tres veces del valor normal se deberían considerar como un ataque cardiaco.16
Dentro de los mecanismos propuestos se mencionaba que la dilatación coronaria con globo producía una denudación endotelial y fisura de la íntima; la penetración hasta la capa media solía ser localizada, pero la lesión extensa de esta capa producía formación de colgajos de disección obstructivos o hematomas intramurales. La exposición de los componentes subendoteliales provocaba el depósito y activación de plaquetas con formación de trombina; ocurriendo trombosis oclusiva de manera aislada o en combinación con la estasis sanguínea, consecuencia de los colgajos de la media. Por último, se observaba de manera sistemática cierto grado de vasoconstricción coronaria local, debida a una combinación de liberación de factores vasoactivos derivados de plaquetas y del endotelio y pérdida de factores relajantes derivados del endotelio. Es decir, básicamente había dos mecanismos: trombosis y espasmo coronario. Otros mecanismos propuestos fueron el resultado subóptimo que favorecía el cierre repentino (la estenosis > 35% o gradiente translesión > 20 mmHg, después del procedimiento, se acompañaban de un riego incrementado de cierre agudo de 1.9 a 4.2 veces), la disección aórtica, que se relacionaba directamente con la longitud (disecciones > 15 mm = 57% de cierre), diámetro del vaso, cierre transitorio en el laboratorio y el medio de contraste no iónico (este último favoreciendo la trombosis).
Los estudios que se utilizaban para el diagnóstico directo tenían limitantes de sensibilidad y especificidad para valorar la morfología de la pared arterial.17 Mediante la angiografía se podía ver la disección (35-80%),2,4,6 trombo (44%),2,4,18 espasmo coronario (la respuesta a la administración de NTG o Ca-antagonistas era una prueba indirecta de la presencia de espasmo). Topol comentaba que con el refinamiento de las técnicas de ACTP había disminuido la prevalencia de espasmo coronario de 5% (de 1977 a 1981) hasta 1.3% (de 1985 a 1986).19
En tiempos del stent
Con el advenimiento del stent, disminuyó la incidencia de oclusión temprana, pero no desapareció. Como mecanismos productores de la oclusión temprana con el stent se mencionó la hiperplasia neointimal, por lo que se dieron a la tarea de mejorar el tipo y calidad de los mismos (de metal desnudo; de polímero o derivado polimérico, y liberador de fármacos: sirolimus, paclitaxel). El stent trajo como consecuencia otros problemas: trombosis temprana y tardía, reacciones de hipersensibilidad, aneurismas en el sitio de implante, etc. Estudios recientes han demostrado la presencia de disfunción endotelial, posterior al implante de stent liberadores de fármacos (Taxus y Cypher).20-26 Mediante pruebas inductoras (acetilcolina o ergonovina), se ha provocado espasmo coronario con una prevalencia muy amplia, pero elevada: 33.8% (pacientes con angina de esfuerzo), 49% (pacientes con angina de reposo y/o esfuerzo);27 44% (pacientes sometidos a stent); 40.9% (pacientes con angina de pecho sometidos a ACTP).28 Shigenori Ito realizó un test provocador con acetilcolina en 3 vasos; el test dio positivo en 36/55 (65.4%) de las arterias coronarias y en 30/42 (71.4%) de arterias con stent. Observó que el espasmo coronario fue exagerado en la porción distal al stent y que estaba relacionado con la mayor longitud del mismo.29 Togni, utilizando ejercicio en bicicleta, demostró la disfunción endotelial en stent liberadores de medicamentos (sirolimus, paclitaxel), manifestada como vasoconstricción paradójica, inducida por ejercicio en bicicleta, que respondía al uso de nitroglicerina y además de tener un retraso en la recuperación de la función endotelial en el seguimiento.16 En un estudio con seguimiento a un año, se mostró vasoconstricción inducida con esfuerzo en los segmentos arteriales adyacentes al stent; que respondía al uso de nitroglicerina; cuando al año aparecían estas alteraciones, indicaba un retraso en la recuperación vascular.25
Comentarios
Caso uno. Se trata de angina inestable que culmina en infarto del miocardio. A pesar de tener criterios de reperfusión: lavado enzimático rápido (CPK el 31-V de 4964 y el 1-VI en 826), disminución del dolor y disminución del ST, fue sometido a ACTP de rescate a la DA. El primer estudio muestra una arteria descendente anterior enferma y con hipoflujo distal. Posterior al intervencionismo se hace evidente el espasmo coronario dinámico, segmentario. Tres días después desarrolla angina con supradesnivel del segmento ST (¿angina de Prinzmetal?), y por la sospecha de trombosis aguda (que fue descartada) se realiza el segundo cateterismo, donde persiste la imagen antes comentada. Es posible que el evento correspondiera a isquemia miocárdica secundaria al espasmo coronario dinámico, intermitente, no sostenido, lo suficiente para provocar un infarto (no hubo elevación enzimática). Se diagnosticó como puente muscular coronario, pero éste no aparece en forma espontánea y no se observaba en el estudio diagnóstico. Durante su estancia hospitalaria y al egreso no se administraron vasodilatadores coronarios (nitratos o calcio-antagonistas).
Caso dos. Paciente con varios métodos de revascularización, no del todo satisfactorios. Un año y siete meses después de la revascularización quirúrgica, con dos de tres puentes tapados, hubo la necesidad de implantarle dos stents y dos meses y medio después ya tenía oclusión de los mismos. En ningún momento el paciente estuvo con manejo calcio-antagonista, aunque sí con nitratos y clopidogrel. En esta ocasión, el primer estudio hemodinámico fue diagnóstico, sin complicaciones y sin apreciarse espasmo coronario. En el segundo, el intervencionismo fue fallido, inclusive intentaron ultrasonido intracoronario. En este estudio se aprecia la imagen de espasmo coronario dinámico. Posteriormente el paciente desarrolló isquemia cerebral transitoria, lo que sugiere espasmo arterial a nivel cerebral.
Posterior al intervencionismo coronario, con implante de stents, con relativa frecuencia el paciente desarrolla isquemia miocárdica que requiere nuevo estudio hemodinámico y para sorpresa de los médicos, los stents están permeables. Bajo esta situación, es posible que se trate de espasmo coronario dinámico. Por otro lado, aunque el puente muscular es una entidad fisiológica bien definida, daría la impresión de que la estamos sobrediagnosticando y, por lo tanto, minimizamos la presencia del espasmo dinámico, sobre todo, en aquellos pacientes sometidos a intervencionismo.
Como común denominador de ambos casos tenemos: evolución tórpida posterior al intervencionismo coronario, no administración de vasodilatadores coronarios (calcio-antagonistas o nitratos) y la presencia de espasmo coronario dinámico, junto con la posibilidad de espasmo arterial en otros territorios. Es importante el acucioso análisis de los estudios hemodinámicos, sobre todo cuando se observen imágenes sugestivas de puente muscular, posterior al intervencionismo coronario. Esto debe poner en alerta al médico intervencionista para un ajuste de medicamentos y un control más estrecho de estos pacientes, tanto a corto (curva enzimática y ECG seriados, tratamiento vasodilatador) como a largo plazo (tratamiento con calcio-antagonistas y nitratos, además de otras medidas protectoras de endotelio, así como pruebas de esfuerzo seriadas).
REFERENCIAS
1. Topol EJ. Cardiología Intervencionista. Tercera edición, México: McGraw-Hill Interamericana. 2000: 193-221. [ Links ]
2. Sinclair IN, McCabe CH, Sipperly ME. Predictors, therapeutic options, and long-term outcome of abrupt reclosure. Am J Cardiol 1988; 61: 61G. [ Links ]
3. de Feyter PJ, van den Brand M, Jaarman GJ et al. Acute coronary artery occlusion during and after percutaneous transluminal coronary angioplasty: Frequency, prediction, clinical course, management, and follow-up. Circulation 1991; 83: 927-936. [ Links ]
4. Lincoff AM, Popma JJ, Ellis SG et al. Abrupt vessel closure complicating coronary angioplasty: Clinical, angiographic, and therapeutic profile. J Am Coll Cardiol 1992; 19: 926-935. [ Links ]
5. Ellis SG, Roubin GS, King SB et al. Angiopraphic and clinical predictor of acute closure after native vessel coronary angioplasty. Circulation 1988; 77: 372-379. [ Links ]
6. Detre KM, Holmes DR, Holubkov R et al. Incidence and consequences of periprocedural occlusion. The 1985-1986 National, Heart, Lung, and Blood Institute percutaneous transluminal coronary angioplasty registry. Circulation 1990; 82: 739-750. [ Links ]
7. Simpfendorfer C, Belardi J, Bellamy G et al. Frequency management and follow-up of patients with acute coronary occlusions after percutaneous transluminal coronary angioplasty. Am J Cardiol 1987; 59: 267. [ Links ]
8. Goldbaum T, DeSciascio G, Cowley MJ, Vetrovec GW. Early occlusion following successful coronary angioplasty: Clinical and angiographic observations. Cathet Cardiovasc Diagn 1989; 17: 22. [ Links ]
9. Krucoff MW, Parente AR, Bottner RK et al. Stability of multilead ST-segment ''fingerprints'' over time after percutaneous transluminal coronary angioplasty and its usefulness in detecting reocclusion. Am J Cardiol 1988; 61: 1232-1237. [ Links ]
10. Bush HS, Ferguson JJ, Angelini P, Willerson JE. Twelve-lead electrocardiographic evaluation of ischemia during percutaneous transluminal coronary angioplasty and its correlation with acute reocclusion. Am Heart J 1991; 121: 1591-1599. [ Links ]
11. Krucoff MW, Jackxon YR, Kehoe KM, Kent MK. Quantitative and qualitative ST segment monitoring during and after percutaneous transluminal coronary angioplasty. Circulation 1990; 81: IV-20-IV-26. [ Links ]
12. Tenaglia AN, Fortin DF, Frid DJ et al. Long-term outcome following successful reopening of abrupt closure after coronary angioplasty. Am J Cardiol 1993; 72: 21-25. [ Links ]
13. Abdelmeguid AE, Whitlow PL, Sapp SK et al. Long-term outcome of transient uncomplicated in-laboratory coronary artery closure. Circulation 1995; 91: 2733-2741. [ Links ]
14. Topol EJ, Ferguson JJ, Weisman HE et al. Long-term protection from myocardial ischemic events in a randomized trial of brief integrin b, blockade with percutaneous coronary intervention. JAMA 1997; 278: 479-484. [ Links ]
15. Abdelmeguid AE, Ellis SG, Sapp SK et al. Defining the appropriate thershold of creatine kinase elevation after percutaneous intervention. Am Heart J 1996; 131: 1097-1105. [ Links ]
16. Jennferadgme AA, Athewm TPM, Arbinson DMTH. Periprocedural Creatine Kinase-MB Elevations: Long-term impact and clinical implications. Clin Cardiol 1999; 22: 257-265. [ Links ]
17. Sherman CT, Litvack F, Grundfest W et al. Coronary angioscopy in patients with unstable angina pectoris. N Eng J Med 1986; 315: 913-919. [ Links ]
18. Mabin TA, Holmes DR, Smith HC. Intracoronary thrombus: Role in coronary occlusion complicating percutaneous transluminal coronary angioplasty. J Am Coll Cardiol 1985; 5: 198. [ Links ]
19. Holmes DRJ, Holubkov R, Vlietstra RE et al. Comparison of complications during percutaneous transluminal coronary angioplasty from 1977 to 1981 and from 1985 to 1986: The National Heart Lung, and Blood Institute Percutaneous Transluminal Coronary Angioplasty Registry. J Am Coll Cardiol 1988; 12: 1149-1155. [ Links ]
20. Togni M, Windecker S, Cocchia R et al. Sirolimus-eluting stents associated with paradoxic coronary vasoconstriction. J Am Coll Cardiol 2005; 46: 231-236. [ Links ]
21. Hofma SH, van der Giessen WJ, van Dalen BM et al. Indication of long-term endothelial dysfunction after sirolimus-eluting stent implantation. Eur Heart J 2006; 27: 166-170. [ Links ]
22. Fuke S, Maekawa K, Kawamoto K et al. Impaired endothelial vasomotor function after sirolimus-eluting stent implantation. Circ J 2007; 71: 220-225. [ Links ]
23. Obata J, Kitta Y, Takano H et al. Sirolimus-eluting stent implantation aggravates endothelial vasomotor dysfunction in the infarct-related coronary artery in patients with acute myocardial infarction. J Am Coll Cardiol 2007; 50: 1305-1309. [ Links ]
24. Shin DI, Kim PJ, Seung KB et al. Drug-eluting stent implantation could be associated with long-term coronary endothelial dysfunction. Comparison between sirolimus-eluting stent and paclitaxel-eluting stent. Int Heart J 2007; 48: 553-567. [ Links ]
25. Togni M, Raber L, Cocchia R et al. Local vascular dysfunction after coronary paclitaxel-eluting stent implantation. Int J Cardiol 2007; 120: 212-220. [ Links ]
26. Hamilos MI, Ostojic M, Beleslin B et al., on behalf of the NOBORI Investigators. Differential effects of drug-eluting stents on local endothelium-dependent coronary vasomotion. J Am Coll Cardiol 2008; 51: 2123-2129. [ Links ]
27. Yasue H, Nakagawa H, Itoh T et al. Coronary artery spasm-clinical features, diagnosis, pathogenesis, and treatment. J Cardiol 2008; 51: 2-517. [ Links ]
28. Sueda S, Ochi N, Kawada H et al. Frequency of provoked coronary vasospasm in patients undergoing coronary angiography with spasm provocation test of acetylcholine. Am J Cardiol 1999; 83: 1186-1190. [ Links ]
29. Ito S, Nakasuka K, Morimoto K et al. Angiographic and clinical characteristics of patients with acetylcholine-induced coronary vasospasm on follow-up coronary angiography following drug-eluting stent implantation. J Invas Cardiol 2011; 23: 57-64. [ Links ]














