Introducción
Las 2,2’:6’,2’’-terpiridinas se descubrieron en el año de 1932, (Castro Agudelo et al., 2012; G. T. Morgan y Burstall, 1932) y desde ese momento hasta la actualidad han sido de gran interés debido a parámetros estructurales, flexibilidad y orientación, la distribución convergente que tienen sus tres átomos de nitrógeno, ubicados en posición orto con respecto a cada anillo piridínico les confiere una gran capacidad de actuar como ligandos tridentados, capaces de quelar cationes metálicos (Husson y Knorr, 2012; G. Morgan y Burstall, 1932) formando complejos de coordinación con considerable estabilidad térmica y química (Jantunen et al., 2006). Esto último, junto con sus propiedades ópticas y electrónicas (Castro Agudelo et al., 2015; Schubert et al., 2011; Schubert et al., 2018; Sun et al., 2010) permiten que dichos compuestos sean potencialmente usados en ciencia básica y aplicada (Cao et al., 2013) química supramolecular, medicina, catálisis, fotovoltaica orgánica y la optoelectrónica (Ozawa et al., 2015; Zych et al., 2017). La reacción de Kröhnke es la ruta de síntesis más ampliamente usada para obtener derivados de 2,2’:6’,2’’-terpiridinas (Sasaki, 2016; Tu et al., 2007; Zych et al., 2017) como las 4’-aril-2,2’:6’,2’’-terpiridinas. Aun así, este proceso emplea un calentamiento convencional que implica tiempos de reacción muy largos (20 horas) que ambientalmente son desfavorables (Arteaga Fuertes, 2014; Wang y Hanan, 2005). La incorporación de metodologías como la radiación microondas es una alternativa que está en consonancia con su auge en la síntesis orgánica, permite reducir considerablemente los tiempos de reacción, además del uso y volumen de disolventes. En varios casos se observa también un aumento significativo en los rendimientos de reacción frente a procesos convencionales (Bonnet et al., 2001; Palacios et al., 1996; Raghukumar et al., 2003; Shintani et al., 2003; Tu et al., 2005). La incorporación de este tipo de procesos es un referente muy importante para que los estudiantes en ciencias químicas, puedan relacionar los principios de la química verde junto con la sustentabilidad (Anastas et al., 1998) y tomen conciencia del rol fundamental que tienen en la generación de nuevos métodos, con tecnologías cada vez más verdes y que respondan a los actuales retos de nuestra sociedad, tales como los que plantea el desarrollo sustentable respecto a conversión y gestión de los recursos (Ingold et al., 2015). Todo esto, entendiendo que la química verde se encuentra vinculada con la sustentabilidad desde ya hace algunos años (debido principalmente a los grandes sucesos tanto sociales como ambientales que se presentaron a finales de 1960), por lo que es claro que no se debe volver a caer en los errores del pasado, con lo que se hace necesario impartir una enseñanza desde la academia que permita a los estudiantes promover la química y afines como ciencias cada vez más responsables con la sociedad y a su vez con el medio ambiente (Franco y Ordóñez, 2020).
Un aspecto en consonancia y que va de la mano con la química verde es el diseño experimental, en cuanto que, al encontrar las condiciones óptimas de un proceso, generalmente se reducen, por ejemplo, las cantidades de reactivos y disolventes, el tiempo de reacción e incluso se puede determinar la posibilidad de cambiar un disolvente muy tóxico y/o contaminante por uno más amigable con el investigador y por supuesto con el medio ambiente. De esta forma, un diseño experimental es un proceso estadístico en el que se busca la optimización de reacciones a través de variaciones que se realizan al mismo tiempo de múltiples factores para lograr centrar la zona de reacción en un espacio más reducido y por ende llegar a mejorar el factor de respuesta del proceso que se esté llevando a cabo (Murray et al., 2015). Con esto, se hacen evidentes los beneficios que le puede otorgar la realización de un diseño experimental a un proceso de síntesis, ya que es una técnica aplicada mucho más a nivel industrial que académico, es muy común encontrar falencias y falta de experiencia en este último ámbito (Murray et al., 2015), su aplicación se ve reflejada exclusivamente en investigaciones de alto nivel. Y es que más frecuentemente la academia aplica el enfoque OFAT (One-Factor-At-Time, es decir, un factor a la vez), en el cual se evalúan diferentes factores, pero uno por uno, es decir, no se tienen en cuenta las interacciones entre factores ni sus afectaciones a diferentes niveles, por lo que normalmente este método estudia los factores de manera menos exhaustiva (Taylor et al., 2021) puesto que al estudiarse solo un factor a la vez, se hace necesario realizar una gran cantidad de experimentos lo que normalmente no es posible debido a los costos de reactivos y disolventes. Con lo cual, se hacen menos experimentos y como consecuencia se generan resultados que son comúnmente menos valiosos que los obtenidos con un diseño experimental. Por todo lo anterior, se hace necesario cambiar la visión de relegar el uso del diseño experimental exclusivamente a la industria, puesto que en la enseñanza de esta metodología se le puede otorgar al estudiante una base estadística para afrontar sus retos experimentales, que finalmente pueda trascender en su formación integra como académico y científico. Por tanto, el propósito de este documento es brindar herramientas para que los estudiantes, puedan evidenciar la aplicación de un diseño experimental a un proceso real y ampliamente estudiado como es la metodología de Kröhnke y evaluar los beneficios obtenidos al usar el diseño de experimentos.
Así pues, en este trabajo se reporta la síntesis de tres derivados terpiridínicos (8-10) mediante la metodología de ensamblaje de anillos, reacción de Kröhnke, a partir de la condensación de 2-acetilpiridina con aldehídos aromáticos y utilizando radiación microondas como fuente de calentamiento. Las condiciones de reacción fueron parametrizadas con la realización de un Diseño Experimental 3x2 estableciéndose las condiciones óptimas de potencia y tiempo de irradiación, para su posterior síntesis, purificación y caracterización.
Resultados y discusión
La propuesta que se comparte en este documento está encaminada en brindar a nuestros estudiantes de química y carreras afines, un modelo a seguir en el desarrollo de un diseño experimental y su aplicación metódica en diferentes reacciones en las que sea necesario usarlo. Como secuencia didáctica la iremos discutiendo en la medida que avanzamos en la presentación de los resultados alcanzados con nuestra reacción modelo (Kröhnke) para la síntesis de las terpiridinas objetivo (8-10). Se debe dejar en claro que como propuesta no explica de manera profunda los diferentes conceptos del diseño experimental, es tarea de los estudiantes consultar en la literatura definiciones mucho más puntuales, como lo mostrado en el libro ‘Análisis y diseño de experimentos’ (Pulido y Salazar, 2008).
Aun así, esta estrategia pedagógica está diseñada como un mecanismo idóneo para que estudiantes y/o profesores puedan tener una guía, un paso a paso en la elaboración de su diseño experimental, para lo cual se establece una secuencia lógica a seguir (Figura 1).
Hay que determinar el problema de estudio, ¿Cómo hacerlo?
Los estudiantes realizarán una investigación preliminar en la cual deben encontrar referentes previos que definan las condiciones a mejorar como: tiempos de reacción, relación estequiométrica de reactivos, disolventes, etc.
En nuestro trabajo el problema a abordar fue el excesivo tiempo de calentamiento y los bajos rendimientos de metodologías convencionales para la síntesis de terpiridinas mediante la reacción de Kröhnke. Es por esto que la ruta de síntesis usada en el análisis exploratorio y en el diseño experimental propuesto para la obtención de los derivados (8-10) corresponde precisamente a dicha reacción (Sasaki, 2016; Tu et al., 2007; Zych et al., 2017), pero empleando en este caso la IMW como fuente de calentamiento mediante un equipo de Microondas modificado Whirlpool (Esquema 1).
Esto sugiere una disminución de tiempos de reacción y ahorro energético, comparado con el proceso de síntesis convencional que requiere de un calentamiento a reflujo de 20 h (Arteaga Fuertes, 2014; Wang y Hanan, 2005). Este proceso de optimización fue validado posteriormente en un equipo especializado de microondas diseñado para síntesis orgánica (Milestone flexiWAVE). En este caso, la reacción se lleva a cabo en dos etapas: i) En la primera etapa se realiza la adición de 2 equivalentes molares de la 2-acetilpiridina (1) junto con 1 equivalente molar del aldehído aromático adecuado (2-4) en etanol alcalino (con KOH). Este medio permite la formación del ion enolato de 1, que posteriormente se adiciona sobre el carbono carbonilo de (2-4). Posteriormente, un segundo ion enolato de 1, se adiciona sobre uno de los carbonos de la especie anteriormente formada, generando finalmente la respectiva chalcona como intermediario (5-7) lo cual se evidencia por el cambio de coloración de la mezcla de reacción, desde incoloro hasta anaranjado y por la desaparición en cromatografía en capa fina de los precursores de reacción. ii) En una segunda etapa se adiciona a la mezcla anterior hidróxido de amonio en exceso (NH4OH, 30%) conllevando a la transformación de 5-7 hasta 8-10, respectivamente. Esto se lleva a cabo por medio de la adición de la especie NH3 sobre el carbono carbonilo del intermediario, posteriores pérdidas de moléculas de H2O y sustracciones de un protón, todo esto sucediendo gracias al calentamiento por microondas. El mecanismo propuesto se muestra en detalle en el material suplementario (Figura S19).
Análisis exploratorio para la síntesis de 8-10 por IMW
¿Qué se considera para definir la variable de respuesta y los factores a estudiar?
En este punto los estudiantes determinan inicialmente la variable de respuesta. Se espera que aquí ellos determinen cual es la más significativa y que conduzca a los mejores resultados. Sumado a esto, aquí también se escogen todos los factores que puedan influir sobre la respuesta escogida. Lo ideal es que el estudiante logre centrar sus estudios solo con los factores relevantes, puesto que serán los que le brinden información realmente útil.
Es por esta razón que en nuestro análisis exploratorio se realizaron una serie de ensayos en los que se buscó la mejor zona de trabajo para aplicar el diseño experimental, siendo el rendimiento la variable de respuesta porque se pretende incrementar sus valores haciendo uso de la IMW. Se llevaron a cabo dos aproximaciones sintéticas, las variables a evaluar fueron potencia (PMW) y tiempo de irradiación (TI), son las que mayor influencia pueden tener sobre el rendimiento debido a que la variación más importante entre la metodología convencional y la mostrada en este documento, es la fuente de calentamiento, que para este caso es realizada por medio de irradiación con microondas. Con esto, en los ensayos 1-5 se mantuvo constante solamente el tiempo de irradiación, caso contrario a lo experimentado en los ensayos 6-14 donde lo que se mantuvo constante fue la potencia de irradiación (Tabla 1).
Tabla 1 Resultados Análisis Exploratorio realizado para la síntesis de derivados terpiridínicos (8-10).
| Ensayo | Condiciones | Rendimiento Reacción [%] | Ensayo | Condiciones | Rendimiento Reacción [%] | ||
|---|---|---|---|---|---|---|---|
| PMW [W] | TI [min] | PMW [W] | TI [min] | ||||
| 1 | 70 | 1.5 | 47.90 | 8 | 70 | 5.0 | 53.22 |
| 2 | 350 | 1.5 | 39.84 | 9 | 70 | 8.0 | 59.19 |
| 3 | 280 | 1.5 | 39.68 | 10 | 70 | 15.0 | 62.75 |
| 4 | 140 | 1.5 | 48.23 | 11 | 70 | 10.0 | 60.00 |
| 5 | 210 | 1.5 | 37.74 | 12 | 70 | 12.0 | 69.03 |
| 6 | 70 | 2.0 | 50.16 | 13 | 70 | 12.0 | 69.03 |
| 7 | 70 | 4.0 | 52.42 | 14 | 70 | 12.0 | 68.87 |
Teniendo en cuenta estos resultados, se puede apreciar que para los ensayos 1-5, los rendimientos son en general menores a los obtenidos por calentamiento convencional (Tabla 5). Aun así, se debe destacar que los mayores rendimientos en estos cinco ensayos se obtienen cuando la PMW es baja (Ensayos 1, 4). Adicionalmente, se debe indicar que el uso de PMW altas (≥140 W), genera sobrecalentamiento de la mezcla de reacción, por lo que no es adecuado manejar estas potencias, además de que los rendimientos en estos casos son más bajos probablemente por procesos degradativos. De este modo, en los Ensayos 6-14 se decide trabajar con potencias menores, PMW de 70 W. Es evidente que para los ensayos 6-14 los rendimientos tienden a incrementarse cuando los TI son mayores que los usados en los ensayos 1-5. Pero también es necesario indicar que cuando el TI es muy alto (> 12 min), el rendimiento muestra un decrecimiento. Pero en el caso de un TI de 12 min (Ensayo 12), el rendimiento es el más alto de todos los ensayos e incluso es un poco mayor a lo obtenido empleando calentamiento convencional. Los Ensayos 13 y 14 corroboran lo obtenido en el Ensayo 12.
Tabla 2 Análisis de varianza (ANOVA) para el rendimiento de reacción de 8.
| Fuente | Suma Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
|---|---|---|---|---|---|
| A: PMW | 2718.79 | 1 | 2718.79 | 290.14 | 0.0000 |
| B: TI | 189.528 | 1 | 189.528 | 20.23 | 0.0006 |
| AB | 340.8 | 1 | 340.8 | 36.37 | 0.0000 |
| BB | 18.0483 | 1 | 18.0483 | 1.93 | 0.1885 |
| Error total | 121.819 | 13 | 9.37068 | ||
| Total (corr.) | 3388.99 | 17 |
Nota. R-cuadrada = 96.4055 porciento, R-cuadrada (ajustada por g.l.) = 95.2994 porciento, Error estándar del est. = 3.06116, Error absoluto medio = 2.45222, Estadístico Durbin-Watson = 2.39248 (P=0.8206), Autocorrelación residual de Lag 1 = -0.223109.
Tabla 3 Análisis de varianza (ANOVA) para el rendimiento de reacción de 9.
| Fuente | Suma Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
|---|---|---|---|---|---|
| A: PMW | 2736.27 | 1 | 2736.27 | 369.66 | 0.0000 |
| B: TI | 134.402 | 1 | 134.402 | 18.16 | 0.0009 |
| AB | 265.456 | 1 | 265.456 | 35.86 | 0.0000 |
| BB | 29.7388 | 1 | 29.7388 | 4.02 | 0.0663 |
| Error total | 96.2274 | 13 | 7.40211 | ||
| Total (corr.) | 3262.1 | 17 |
Nota. R-cuadrada = 97.0501 porciento, R-cuadrada (ajustada por g.l.) = 96.1425 porciento, Error estándar del est. = 2.72068, Error absoluto medio = 2.17926, Estadístico Durbin-Watson = 2.39589 (P=0.8223), Autocorrelación residual de Lag 1 = -0.223926.
Tabla 4 Análisis de varianza (ANOVA) para el rendimiento de reacción de 10.
| Fuente | Suma Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
|---|---|---|---|---|---|
| A: PMW | 2595.6 | 1 | 2595.6 | 318.21 | 0.0000 |
| B: TI | 89.8174 | 1 | 89.8174 | 11.01 | 0.0055 |
| AB | 216.155 | 1 | 216.155 | 26.50 | 0.0002 |
| BB | 22.043 | 1 | 22.043 | 2.70 | 0.1242 |
| Error total | 106.04 | 13 | 8.15694 | ||
| Total (corr.) | 3029.66 | 17 |
Nota. R-cuadrada = 96.4999 porciento, R-cuadrada (ajustada por g.l.) = 95.423 porciento, Error estándar del est. = 2.85603, Error absoluto medio = 2.28778, Estadístico Durbin-Watson = 2.38406 (P=0.8161), Autocorrelación residual de Lag 1 = -0.220893.
Tabla 5 Rendimientos de reacción obtenidos por IMW, CC y equipo flexiWAVE para 8-10.
| TPY | Irradiación Microondas (IMW) | Calentamiento Convencional (CC) | Equipo flexiWAVE | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rendimiento de Reacción [%] | Prom±DE | Rendimiento de Reacción [%] | Prom±DE | Rendimiento de Reacción [%] | Prom±DE | |||||||
| 8 | 69.03 | 69.02 | 68.87 | 68.97±0.09 | 68.70 | 68.70 | 69.03 | 68.81±0.20 | 70.00 | 69.68 | 70.16 | 68.81±0.20 |
| 9 | 57.21 | 57.35 | 57.21 | 57.26±0.08 | 48.33 | 48.33 | 48.18 | 48.28±0.09 | 57.79 | 57.79 | 57.93 | 48.28±0.09 |
| 10 | 48.82 | 48.97 | 48.93 | 48.91±0.08 | 44.26 | 44.12 | 44.26 | 44.21±0.08 | 49.26 | 49.56 | 49.12 | 44.21±0.08 |
Optimización de la síntesis de 8-10 por IMW
¿Cómo seleccionar los niveles de cada factor?
Es en esta etapa donde los estudiantes evalúan en conjunto con el docente y definen el número de niveles que se van a probar por cada factor, así como, el número de repeticiones a realizar para cada nivel. Este paso es muy valioso para que ellos puedan ser más eficientes en sus procesos y comprendan como evitar gastos innecesarios, tiempo, reactivos, disolventes y entre otros aspectos.
Para nuestra investigación, la definición de los niveles de la PMW y el TI se efectuó teniendo en cuenta los resultados obtenidos en los ensayos 1-14 del análisis exploratorio. Por tanto, para la optimización de la síntesis de 8-10 se llevó a cabo un diseño experimental 3x2, conformado por los 2 factores previamente mencionados, evaluados a 3 (TI) y 2 (PMW) niveles, adicionalmente sobre cada nivel se realizó 2 réplicas con el fin de corroborar los valores obtenidos de rendimiento en cada caso y disminuir así el error experimental.
Es momento de planear la parte experimental
Con los pasos previos, se ha definido el diseño experimental, por tanto, ya los estudiantes pueden definir cómo llevar a cabo su trabajo experimental. Este aspecto tiene gran relevancia, da las pautas para organizar su proceso en el laboratorio, su estudio y así evitar la pérdida de datos y/o resultados importantes.
En nuestro caso, teniendo en cuenta el número de factores, niveles y replicas planteadas, se generaron para cada uno de los compuestos terpiridínicos (8-10) un total de 18 experimentos y/o corridas (Tabla S1, Material Suplementario-MS), es mucho mejor si se implementan de forma aleatoria y por supuesto es recomendable hacerlos todos por separado, es decir, no es correcto realizar experimentos, por ejemplo de 8 mientras también se hacen los de 9.
Tras la experimentación se deben analizar los resultados con métodos estadísticos
Al final del paso anterior, normalmente se tendrán muchos datos, es tarea de los estudiantes manejar la información obtenida por medio de métodos estadísticos como ANOVA que permite analizar la varianza, entre otros parámetros. Es un paso importante, otorgarles un mecanismo de análisis de datos, es necesario que se apropien del conocimiento de estas metodologías y del uso de software estadístico.
Por ende, en este trabajo se introducen los resultados en el software STATGRAPHICS, puesto que tiene facilidad de manejo y genera tanto tablas ANOVA (Tablas 2-4) como diferentes gráficas que permiten analizar lo obtenido de la manera más simple posible.
Ahora se deben interpretar los datos obtenidos
Los estudiantes analizarán detalladamente los resultados alcanzados, identificando las condiciones que generan los mejores valores en cuanto a variable de respuesta, recogerán todas las ganancias respecto a la información que se logra substraer del estudio. Este proceso de análisis se aborda bajo supervisión del docente. Además de esto, ellos abordarán de forma sistemática la caracterización espectroscópica y espectrométrica de los compuestos (si fuere el caso), esto con el fin de corroborar la obtención de estos bajo las condiciones óptimas de reacción. Se espera como un resultado de aprendizaje el manejo de los resultados y la correcta interpretación tras el proceso de caracterización.
De igual forma, a través de las Tablas 2-4 se observa que el factor PMW como TI y su interacción (PMW*TI) son relevantes para la determinación del rendimiento, esto teniendo en cuenta que el Valor P en estos casos es <0.05 con un nivel de confianza del 95.0 %.
Se puede observar que los valores de P para cada una de las variables son más bajas en el siguiente orden: 8, 9 y 10; observándose los rendimientos más altos en el mismo orden. Adicionalmente, se debe indicar que la interacción TI*TI en ninguno de los diseños experimentales tiene gran relevancia, puesto que su Valor P es >0.05 con un nivel de confianza del 95.0 %.
Las ecuaciones de regresión ajustadas obtenidas, se muestran a continuación:
• Para 8:
Rendimiento = 53.005 - 12.2900 * PMW - 3.97417 * TI - 5.32917 * PMW * TI - 2.12417 * TI 2
• Para 9:
Rendimiento = 41.6583 - 12.3294 * PMW - 3.34667 * TI - 4.7033 * PMW * TI - 2.72667 * TI 2
• Para 10:
Rendimiento = 33.4667 - 12.0083 * PMW - 2.73583 * TI - 4.24417 * PMW * TI - 2.3475 * TI 2
Con estas relaciones matemáticas, se puede predecir el rendimiento de reacción, dependiendo de los factores PMW, TI y su interacción PMW*TI. De los diagramas de Pareto (Figura S1, MS) de 8-10 se puede apreciar nuevamente que los factores PMW y TI, junto con su interacción PMW*TI, son relevantes, puesto que superan la línea que representa el valor crítico, mientras que la interacción TI*TI no es relevante, puesto que no la supera. También en este diagrama se observa que en los tres casos las variables PMW, TI y PMW*TI impactan negativamente el rendimiento de reacción a valores muy altos, en especial para el factor PMW. Esto se observa en la Tablas S1 del MS donde se aprecia que, a valores altos de PMW y TI, el rendimiento decae, quizás por procesos degradativos o inhibidores de la reacción por sobrecalentamiento. Los gráficos de Efectos Principales (Figura S2, MS) para 8-10 muestra curvas con pendientes negativas, lo cual se explica por lo previamente indicado, es decir, a valores altos de los factores PMW y TI, menor será el rendimiento de la reacción. Así mismo, de nuevo se ve que en los tres casos es el factor PMW el que su pendiente es más prominente, puesto que es el factor que mayor efecto negativo tiene en el rendimiento de la reacción cuando sus valores son más altos.
Las gráficas de Interacción (Figura S3, MS) muestran, de manera similar, que para los compuestos 8-10 a valores bajos de PMW y TI, los rendimientos son altos; pero para estas mismas variables a valores altos el rendimiento disminuye. Cuando se evalúa la relación a una PMW alta y TI bajo, el rendimiento es bajo, pero no tan notorio como en el caso anterior. De esta forma, se puede decir que es realmente significante la interacción entre PMW y TI.
Para este caso, se utilizan los gráficos de superficies de respuesta (Figura S4, MS) para determinar los valores de PMW y TI que generan el mayor rendimiento de reacción para 8-10. De este modo, las superficies muestran ciertas similitudes, a razón de que indican la zona donde se presenta mayor rendimiento. Es decir, cuando el PMW y el TI tiene valores de 70 W (valor bajo) y 12 min (valor medio), respectivamente. Con lo cual estos valores son los óptimos para obtener el mayor rendimiento de reacción. Una vez empleadas las condiciones óptimas para la síntesis de los compuestos y posterior purificación por recristalización en EtOH, los rendimientos obtenidos para cada derivado de terpiridina, muestran un valor mayor a lo obtenido por la metodología convencional. Se ha reportado por triplicado los rendimientos de reacción, sus promedios y las desviaciones estándar (DE), respectivas (Tabla 5).
Se debe destacar, que los valores obtenidos en cada réplica para 8-10 sintetizados por medio de IMW, presentan una DE baja, lo que indica que la metodología usada permite obtener rendimientos con alta reproducibilidad. Esto es favorable, puesto que siempre se puede saber cuánto se va a obtener del producto esperado bajo condiciones establecidas, como en este caso 12 min de TI y 70 W de PMW. Adicionalmente, con el fin de corroborar los resultados obtenidos bajo las condiciones óptimas estandarizadas en el Microondas Whirlpool modificado, se lleva a cabo la síntesis de 8-10 (por triplicado en cada caso) en un equipo Milestone flexiWAVE diseñado para realizar síntesis orgánica asistida por Microondas logrando obtener mejoras en cuanto a rendimiento (Tabla 5). De este modo, se puede observar que los rendimientos en todos los casos son ligeramente mayores que los obtenidos con el Microondas Whirlpool modificado; por tanto, se considera que el estudio y análisis de estos resultados son válidos en la presente investigación, pues son consistentes con lo obtenido en un equipo diseñado para síntesis asistida por microondas como lo es el equipo de Milestone.
Caracterización por FTIR para (8-10)
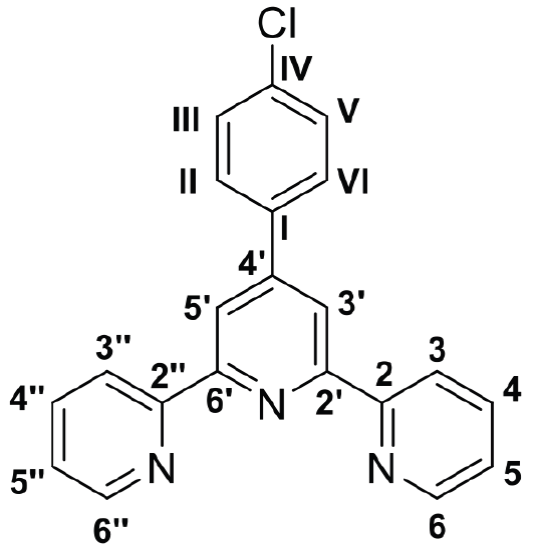
Los espectros IR para 8-10 (Figura S5-7, MS) muestran señales esperadas tales como elongaciones debidas a enlace C-H aromáticos (para 8-10) y C-H alifático (para 10). Se logran identificar elongaciones tanto de enlaces C=C de los anillos bencénicos como C=N de los anillos piridínicos. De manera específica, para 9 se aprecia la flexión C-Cl mientras que para 10 se encuentran señales debidas a la elongación del enlace C-O-C. Se debe indicar, que una interpretación espectral más detallada para 8-10 se encuentra disponible en el Material Suplementario (MS).
Estudio por UV-Vis para (8-10)
Los espectros UV-Vis para 8 y 9 (Figura S8, MS), tienen una gran similitud en cuanto a sus bandas de absorción máxima con longitudes de onda de 277.5 nm y 276.5 nm, respectivamente. Adicionalmente, cuentan con una segunda banda de menor absorbancia, que también coincide en cuanto a la longitud de onda a la que se produce (311.5 nm para 8 y 311.0 nm para 9). Aun así, el espectro UV-Vis para 10 (Figura S8, MS) si presenta diferencias en cuanto a su banda de mayor absorbancia, puesto que muestra un desplazamiento batocrómico comparado con 8 y 9, ya que se observa a una longitud de onda de 290.0 nm debido a la presencia del átomo de O del grupo -OCH3 que permite una mayor estabilidad electrónica. En adición, para 10 se alcanza a observar una segunda banda de absorción a aproximadamente 316.0 nm, aunque no tan definida como en los derivados 8 y 9. En general, la banda de mayor absorbancia para los tres ligandos es debida a la transición π-π* gracias a la presencia de los anillos aromáticos. Las bandas de menor absorbancia son atribuidas a una transición de transferencia de carga ligando-ligando, entre orbitales π de las terpiridinas (Mukherjee et al., 2018).
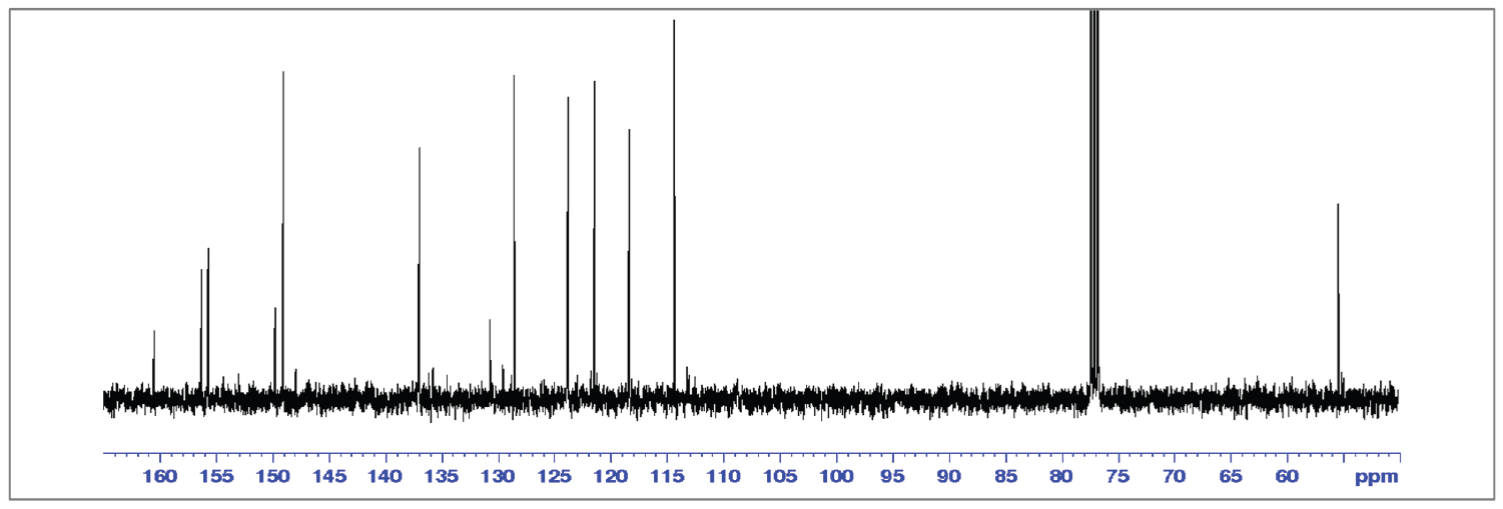
Caracterización por RMN 1H y 13C para (8-10)
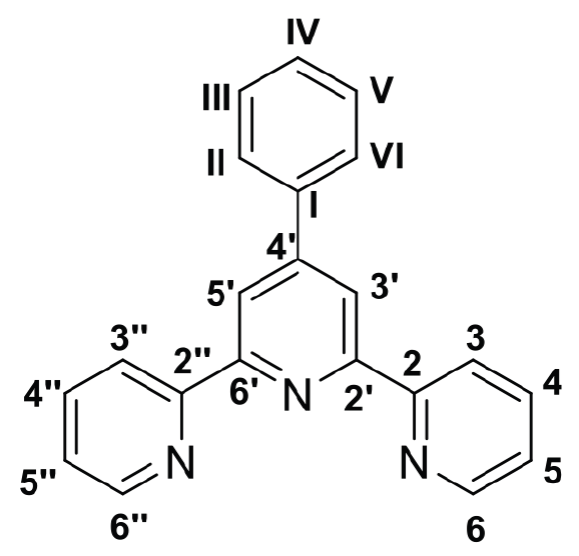
Los espectros de RMN para los tres compuestos terpiridínicos sintetizados (Figuras S9-14, MS), muestran señales que coinciden con lo esperado respecto a los acoplamientos teóricos entre Hs (para RMN 1H) y Cs (para RMN 13C). De este modo, a continuación, se muestra la asignación de las señales de RMN 1H y 13C para 8 (Tablas 6-7), la numeración de anillos aromáticos y asignación de señales para 9 y 10, se puede encontrar en el material suplementario y las Tablas S2-5.
Tabla 6 Asignación de desplazamientos químicos (δ) en espectro RMN 1H de 8.
| Identificación | [ppm] | Multiplicidad | Cantidad 1H |
|---|---|---|---|
| 3’, 5’ | 8.750 | s | 2 |
| 3, 3’’ | 8.734 | d | 2 |
| 6,6’’ | 8.684 | d | 2 |
| 4, 4’’, II, VI | 7.923-7.854 | m | 4 |
| III, IV, V | 7.533-7.449 | m | 3 |
| 5, 5’’ | 7.350 | dd | 2 |
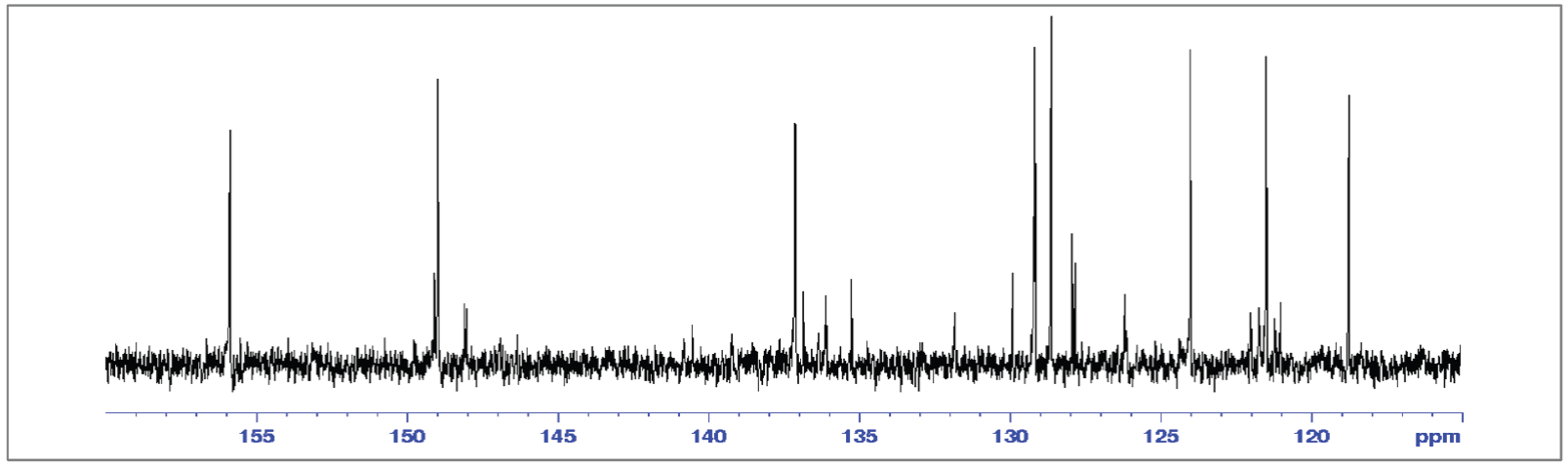
Tabla 7 Asignación de desplazamientos químicos (δ) en espectro RMN 13C de 8.
| Identificación | [ppm] | Identificación | [ppm] |
|---|---|---|---|
| 2’, 6’ | 156.15 | II, VI | 128.98 |
| 2, 2’’ | 155.80 | III, IV, V | 128.88 |
| 4’ | 150.31 | 5, 5’’ | 127.30 |
| 6, 6’’ | 149.03 | 3, 3’’ | 121.35 |
| I | 138.41 | 3’, 5’ | 118.93 |
| 4, 4’’ | 136.89 |
Así mismo, al comparar las señales de los espectros obtenidos en este trabajo y lo mostrado por Karimi y colaboradores (Karimi et al., 2020) o por Kharadi (Kharadi et al., 2015) se logra apreciar grandes similitudes espectrales. Esto indica la correcta síntesis de los compuestos 8-10 bajo la metodología planteada en este trabajo.
Caracterización por Masas para (8-10)
Los espectros de masas (Figuras S15-17, MS) muestran señales para 8-10 que son las debidas al patrón de fragmentación (Figura S18, MS), y que coinciden con las estructuras de los derivados de terpiridina esperados. Adicionalmente, la relación m/z del ion molecular coincide en los tres casos.
Conclusión
Es importante indicar los alcances logrados
Siempre es relevante exponer los logros conseguidos con el fin de permitir avances en la ciencia y dejar claridad sobre lo alcanzado. Se espera que, en esta etapa final de la elaboración del diseño experimental, los estudiantes aprendan la relevancia de presentar sus resultados, y su apropiación para hacerlo de forma ordenada, concisa y metódica.
Afianzados en nuestra experiencia podemos decir que se ha logrado llevar a cabo la optimización de la síntesis de tres 4’-aril-2,2’:6’,2’’-terpiridinas realizando un diseño experimental 3x2 y haciendo uso de la reacción de Kröhnke mediada por calentamiento por IMW, obteniendo una PMW de 70 W y un TI de 12 min como condiciones óptimas de reacción (corroboradas con un equipo diseñado para síntesis microondas), con las cuales se obtuvieron buenos rendimientos, que son mayores que los obtenidos por CC. Por ende, se logra reducir considerablemente los tiempos de reacción e incrementar los rendimientos, como resultado de la aplicación de un diseño experimental a procesos reales, cuyo enfoque estadístico estimula a los estudiantes a resolver retos experimentales, alcanzando resultados motivantes y alentadores en sus procesos de formación investigativa. Así mismo, estos compuestos, pudieron ser caracterizados por medio de técnicas espectroscópicas: FTIR, UV-Vis, RMN 1H y 13C como también espectrometría de masas, encontrando que la ruta planteada en este trabajo permite la correcta obtención de los compuestos terpiridínicos. Sumado a esto, la propuesta de enseñanza planteada permite a los estudiantes de Química o afines, tener un paso a paso para que ellos mismos puedan plantear su diseño experimental, además de que con esta experiencia de laboratorio se esperan alcanzar diferentes aprendizajes que favorezcan el crecimiento integral del estudiantado en competencias de ciencia y tecnología por medio de metodologías que los ayuden a ser ordenados con su trabajo experimental y los motiven a indagar, cuestionar, analizar sobre situaciones y/o problemas experimentales y la resolución de los mismos.
Experimental
General
Todos los reactivos y disolventes usados fueron de grado analítico de las marcas PanReac AppliChem, Sigma-Aldrich, Macron, Merck o Fischer Scientific. La CCF se realizó en placas de Silica gel 60 F254 adquiridas de Merck. Las placas de CCF se revelaron usando una Lampara UV MiniMAX™ by SPECTROLINE a = 254 nm. La síntesis por irradiación microondas, se llevó a cabo en un microondas Whirlpool WMP07ZD (700 W, 2450 MHz) modificado y en un equipo microondas sofisticado, Milestone flexiWAVE. El análisis de los resultados del Diseño Experimental se desarrolló usando el software STATGRAPHICS Centurion XVI v.16.1.03. Los puntos de fusión fueron determinados haciendo uso de un Fusiómetro OptiMelt MPA100 SRS. Los espectros de IR fueron tomados en un Espectrómetro FTIR Thermo Nicolet iS10 por medio de pastillas de KBr en un rango de 4000.0 a 400.0 cm-1. Los espectros UV-Vis, se obtuvieron en el Espectrofotómetro Thermo Genesys 6 en el rango de 200.0 a 800.0 nm usando acetonitrilo (ACN) acidificado como disolvente y una concentración de 10 mg/L de 8, 9 o 10. Los espectros de RMN 1H y 13C, se obtienen en un Espectrómetro Bruker Ascend™ 400 disolviendo los compuestos en cloroformo deuterado (CDCl3). Los espectros de MS se obtuvieron con un Espectrómetro Shimadzu GC/MS QP-2010, sonda sólidos e ionización por impacto electrónico.
Síntesis de los derivados de terpiridina 8-10 mediante IMW (condiciones óptimas)
En el proceso de síntesis de 8-10, las condiciones usadas de PMW y el TI corresponden a las que se encontraron como óptimas de acuerdo con el diseño experimental realizado, es decir, 70 W y 12 min respectivamente. Adicionalmente, se debe destacar que las cantidades de 2-acetilpiridina (1), y aldehídos aromáticos (2-4) como también las de EtOH, KOH y NH4OH, se dejaron constantes tanto en el análisis exploratorio como en el Diseño Experimental: En un balón de 100 mL que contiene 20 mL de EtOH, se adicionan 0.3961 g (6 mmol) de KOH y se agita hasta completa disolución. Posteriormente, se añaden lentamente 450 µL (4 mmol) de 2-acetilpiridina y el apropiado aldehído aromático (2 mmol), dejando esta mezcla de reacción en agitación a temperatura ambiente por 2 h. Pasado este tiempo, a la mezcla se le adiciona lentamente un exceso de NH4OH al 30 % (5 mL), y se agita por 5 min a temperatura ambiente. El balón se conecta a un sistema de reflujo dentro del equipo microondas, y se irradia por 12 min a una Potencia de 70 W (condiciones óptimas). La mezcla se deja enfriar hasta temperatura ambiente y se añaden 50 mL de agua desionizada fría. El precipitado formado se filtra al vacío y se lava con etanol y agua desionizada. Este sólido se deja secar toda la noche a 70 °C y se purifica por recristalización en EtOH. La CCF, se lleva a cabo usando como fase móvil alcohol isobutílico: acetona: cloroformo (relación 4:3:3) + 2 gotas de ácido acético diluido 1:10.
Síntesis de los derivados de terpiridina 8-10 mediante CC
La síntesis convencional de 8-10 se diferencia de la síntesis por IMW en dos aspectos: 1) El calentamiento es llevado a cabo sobre una plancha calefactora con agitación y 2) El tiempo de calentamiento es llevado a cabo a reflujo durante 20 h (Sasaki, 2016; Tu et al., 2007). La obtención de los derivados terpiridínicos por calentamiento convencional, es importante puesto que permiten ser referencia y comparar el rendimiento de reacción con el obtenido por IMW.











 nueva página del texto (beta)
nueva página del texto (beta)