Introducción
En conjunto de normas o modelos han servido como guía y han sido grandes herramientas para la química orgánica sintética de cierres de anillos, llamadas
“Reglas de Baldwin”, estas se dieron a conocer en un artículo publicado en 1976 con el título “Rules for ring closure” (Baldwin, 1976), siendo el artículo más citado en esos años de historia en la revista Chemical Communications de la Royal Society of Chemistry.
En este artículo, Baldwin presentó una hipótesis para la predicción del cierre de un compuesto acíclico y la obtención de un anillo y si esta reacción era favorable o no. Se basó en la alineación correcta de los orbitales moleculares y superposición geométrica utilizando conocimiento empírico, teórico y evidencia experimental para anunciar a la comunidad maneras correctas de ciclaciones, además de delimitar la nomenclatura precisa para poder describir y clasificar los pasos específicos para el cierre de anillos.
Antes de 1976, los químicos orgánicos confiaban en su intuición y buena suerte al tratar de sintetizar compuestos cíclicos, por lo que las reglas de Baldwin significan uno de los avances más importantes y audaces para la química orgánica. El hecho de que numerosas moléculas que se encuentran en la naturaleza contienen una unidad carbo- y heterocíclica, convirtió en un éxito la metodología de síntesis cíclica de Baldwin de una manera precisa y eficiente, dando coyuntura a un gran conjunto de síntesis cíclicas, y debido a esto aplicaciones importantes y benéficas (Alabugin et al., 2011).
Como consecuencia, las reglas de Baldwin han permitido a la comunidad química mayor comprensión y amplitud de las reacciones sintéticas de ciclación, que después de más de 40 años siguen siendo un instrumento y han dado pauta a una amplia gama de estudios teóricos y experimentales, así como investigaciones que se han basado en estas reglas, modificando y desafiando estas predicciones (Gilmore et al., 2013). No solo se ha obtenido una mayor cantidad de información a partir de la publicación original de Baldwin, con el desarrollo y el avance de métodos computacionales, se ha mejorado la comprensión de temas más complejos como principios estereoelectrónicos involucrados en el proceso de formación y rompimiento de enlaces químicos para iniciar nuevas reacciones y estructuras cíclicas.
Consideraciones generales
Desde 1976 las reglas de Baldwin son un gran ejemplo de éxito mediante la aplicación de conceptos estereoelectrónicos al diseño de reacciones de ciclación. Uno de los principales factores que definió la formulación de las reglas de ciclación fue la predicción del cierre de anillo. Baldwin desarrolló una clasificación para los procesos de ciclación basándose en tres factores. Como se muestra en la Figura 1, la ciclación se caracteriza por 3 prefijos:
El primero proporciona el número de átomos en el anillo.
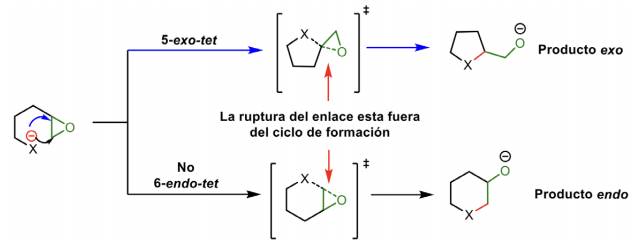
El segundo prefijo, endo versus exo, describe la posición del enlace que tiene que romperse en la ciclación, con respecto al anillo de formación (o también puede ser el más pequeño de los anillos cuando se forman varios anillos de manera simultánea). Exo indica que el vínculo de ruptura esta fuera del anillo formado y endo indica que la ruptura está dentro del anillo formado (exocíclico y endocíclico).
El último prefijo se refiere a la hibridación que tiene el átomo en el lugar del cierre del anillo, tet = tetraédrico (sp3), trig = trigonal (sp2) y dig = digonal (sp) (Gilmore et al., 2016).

Figura 1 Se muestran las reacciones de ciclaciones permitidas para la formación de ciclos de 3, 4, 5 y 6 miembros para un cierre endo y exo, y con sus diferentes hibridaciones. Baldwin predice las reacciones que serán favorables y se encuentran encuadradas, el cierre exo es más favorecedor en hibridaciones sp3 y sp2, a diferencia de los cierres endo que se van a preferir en hibridación sp. En general, casi siempre se va a preferir un cierre exo. (Alabugin et al., 2011).
En la Figura 1, se muestra la representación para la formación de ciclos de 3, 4, 5 y 6 miembros con la clasificación correspondiente. Como se muestra, las predicciones de Baldwin indicaron que se favorecían las reacciones en los modos exo, para cierres de ciclos de 3 y 4 miembros, de manera contraria, los alquinos favorecieron el cierre exo para ciclos de 5 y 6 miembros. Un conocido conjunto de pautas para las reacciones por radicales fue desarrollado por Beckwith quien combinó factores estéricos y estereolectrónicos para ofrecer predicciones generales de modos de ciclaciones favorables. “Un punto significativo de divergencia entre las reglas de Baldwin y Beckwith implica las ciclaciones de alquinos. Las ciclaciones endo-dig son favorecidas por las reglas de Baldwin mientras que las reglas de Beckwith predicen que las ciclaciones exo-dig serán las preferidas” (Gilmore et al., 2016).
En la Tabla 1, se muestran de forma resumida las ciclaciones favorables para el cierre y la formación de anillos de 3, 4, 5 y 6 miembros, representado por las columnas y en las filas nos indica la hibridación, así como si el cierre se lleva a cabo vía endo o exo.
Tabla 1 Ciclaciones favorables para cierre de anillos, ✓: ciclaciones favorables y ✕: ciclaciones desfavorables y a: no se hizo ninguna predicción (Alabugin et al., 2011).
| Tamaño del anillo | |||||
|---|---|---|---|---|---|
| Hibridación | Ciclación | 3 | 4 | 5 | 6 |
| tet | endo | a | a | ✕ | ✕ |
| exo | ✓ | ✓ | ✓ | ✓ | |
| trig | endo | ✕ | ✕ | ✕ | ✕ |
| exo | ✓ | ✓ | ✓ | ✓ | |
| dig | endo | ✓ | ✓ | ✓ | ✓ |
| exo | ✕ | ✕ | ✓ | ✓ | |
Influencia de la geometría en las reacciones de ciclación
Baldwin sugirió tres trayectorias favorables, una para cada uno de los tres estados de hibridación, para las ciclaciones tet (hibridación sp 3 ) y trig (hibridación sp 2 ), propone un ángulo de ataque similar al de una reacción SN2 (sustitución nucleofílica bimolecular), que se da con un ángulo de 180°, publicado en el trabajo cristalográfico de Bürgui y Dunitz, quienes identificaron el ángulo preferido de ataque nucleofílico en un carbonilo. En este caso recomiendan un ángulo de 109° para hibridación trigonal (Bürgui et al., 1974). Para los sistemas digonales, Baldwin propuso que el ángulo de ataque para el cierre del ciclo es 60° en lugar de un ángulo obtuso (120°). Esta propuesta se basó en el trabajo de rayos X de Wegner y Baughman (Wegner, 1971; Baughman, 1972).
Mientras que Kandil y Dessy compararon las reactividades de 3 carbaniones en poca proximidad a grupos acetilénicos en diferentes matrices geométricas, con un ángulo divergente de 60°, paralelo de 0° y convergente de 60°. Como resultado, no se obtuvieron productos cíclicos cuando el ángulo era divergente, y para la disposición orbital paralela, las especies aniónicas ciclaron en forma 5-endo-dig. Al final, cuando se fijó un ángulo de 60°, el anión arilo ciclado se dio exclusivamente en 5-exo-dig (Esquema 1) (Dessy y Kandil, 1965; Kandil, 1966).

Esquema 1 Se muestran tres ejemplos de los ángulos preferentes. En el ejemplo A, con un ángulo divergente de 60° solo se obtiene el producto reducido, en el B, utilizando un ángulo de 0° con una geometría paralela, da un cierre 5-endo-dig del carbanión. Y, por último, el C con un ángulo convergente se produce el producto 5-exo-dig (Gilmore et al., 2016).
Advertencias y posibles violaciones de las reglas de Baldwin
1. Longitudes de unión inusuales
Baldwin dejó claro que los átomos dentro de una estructura cíclica deben ser “Elementos de primera fila” debido a los radios atómicos más grandes y las distancias de enlace de los átomos más pesados. Ya que se ha llegado a concluir que las reacciones que implican la formación de enlaces mucho más cortos con el hidrógeno generalmente no siguen las reglas.
2. Contribuciones termodinámicas
Las preferencias cinéticas que Baldwin describió no se aplican a las transformaciones que se dan bajo un control termodinámico. Si las ciclaciones son reversibles, que se refiere a cuando una reacción puede darse en dos sentidos, el producto puede convertirse en los reactivos y viceversa, encontrándose en un equilibrio químico, las preferencias cinéticas de Baldwin no serán aplicables. Incluso bajo control cinético, los factores termodinámicos pueden modificar la reactividad de dos formas:
a) Primero, las reacciones exotérmicas, tienen un estado de transición de poco tiempo, por lo que necesitan menos distorsión de la geometría del reactivo para alcanzar las trayectorias establecidas de formación de enlaces.
b) Segundo, las aportaciones termodinámicas ayudan a disminuir las barreras de activación de las reacciones de ciclación exotérmicas.
Incluso las reacciones estéreo electrónicamente desfavorables se vuelven competitivas con las demás, después de que se vuelven lo suficientemente exotérmicas. Esto es importante tomarlo en cuenta al utilizar los argumentos estereoelectrónicos de las reglas de Baldwin para la regios electividad.
En la Figura 2 se muestra la comparación entre 5-exo /6-endo, aunque las dos reacciones tienen barreras de activación casi idénticas (con una diferencia de 0.2 kcal/mol1), el cierre de 6-endo es por mucho más exotérmico debido a la estabilización aromática de este producto, también se muestra que la eliminación del componente termodinámico da lugar a que la ciclación 6-endo sería mucho más lenta si ambas ciclaciones tuvieran la misma exotermicidad.
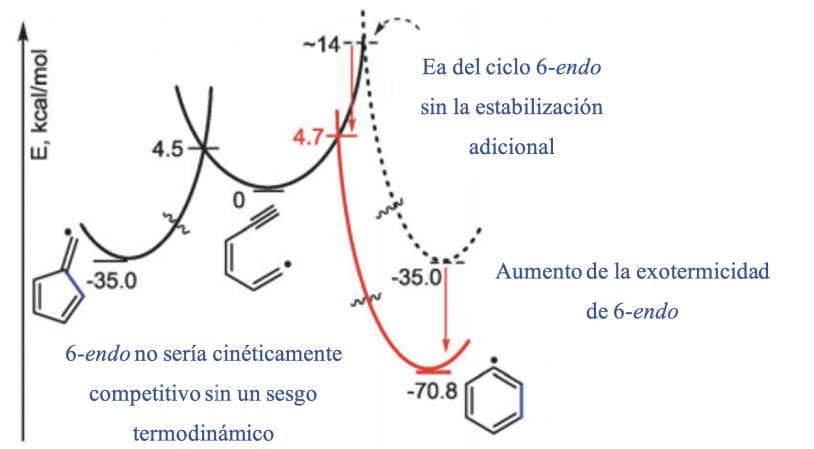
Figura 2 Se muestra que la estabilidad aromática del ciclo 6-endo enmascara la preferencia estereoelectrónica por el cierre de radicales 5-exo (Gilmore et al., 2016).
3. Reglas para los cationes
A pesar de que Baldwin estipuló que sus reglas también se aplican para procesos homolíticos y catiónicos, no es posible que simplemente se cambien las pautas entre las diferentes especies atacantes.
Unos ejemplos de esto son los cambios catiónicos de Wagner, los reordenamientos de Meerwein, que estos son similares al proceso aniónico 3-endo-tet, mientras que los procesos catiónicos son tempranos y oblicuos, las contrapartes aniónicas son desfavorables, como lo indica Wittig y sus reordenamientos aniónicos relacionados (Alabugin et al., 2013).
Cierres exo-digonales de pequeños ciclos
En 2008, se publicó la primera ciclacion 3-exo-dig por Johnston, quien pudo formar de manera exergónica un anillo de tres miembros, que hizo irreversible la formación de un ciclo pequeño (Esquema 3). La estereoelectrónica del cierre de anillo fue apropiado, pero la inestabilidad del producto hace que el proceso sea reversible, esto ejemplifica la rareza de los cierres 3-exo-dig (Gilmore et al., 2016).
En la década de los 90’s, el grupo de Bailey dio a conocer las ciclaciones 4 y 5-exo-dig de carbaniones, donde la estabilización termodinámica es uno de los parámetros importantes para que se pueda llevar a cabo el cierre. Se observó que los alquinos que no contenían sustituyentes estabilizadores de aniones no son reactivos, en este caso no se encontró endo ni exociclación. Mientras que los sustratos que estaban sustituidos con fenilo (Ph) y tetrametilsilano (TMS) proporcionaron el producto 4-exo-dig (Esquema 4) (Gilmore et al., 2016).

Esquema 4 Ciclaciones 4-exo-dig favorecida para alquinos sustituidos con fenilo y sililo (Gilmore et al., 2016).
En 2011, en un estudio publicado por Alabugin y Gilmore se reexaminaron y redefinieron las reglas para ciclaciones radicales y aniónicas, centrándose en el cierre radical de 5-endodig, el cual es favorable de acuerdo con las reglas de Baldwin. Alabugin y Gilmore expresaron “Para nuestra sorpresa, solo se informó de un ejemplo de esta reacción e involucró un radical centrado en Si, no cubierto por las reglas”, y lo que descubrieron sobre los radicales fue lo siguiente: (Gilmore et al., 2016).
Cierres endo por radicales
Alabugin y Gilmore analizaron una variedad de 4-exo-dig y 5-exo-dig de forma computacional, debido a la escasez de estas ciclaciones. Encontraron que la ciclación 4-exo-dig era desfavorable según las reglas de Baldwin, significativamente exotérmico y generalmente su cierre es más rápido que el 5-endo-dig. Su posterior trabajo experimental confirmó esto y estipularon que solo teniendo la presencia de una interacción intermolecular que estabilice el estado de transición de la reacción se podrían obtener buenos rendimientos en los productos 5-endo (Esquema 5). Basándose en las preferencias estereoelectrónicas revisadas, Alabugin y Gilmore sugirieron las reglas para el cierre de estos ciclos (Tabla 2), siendo análogas a las de Beckwith. “Las exociclaciones son generalmente preferidas para ciclaciones tanto nucleofílicas como radicalarias” (Gilmore et al., 2016).

Esquema 5 Cierre radical 5-endo-dig eficiente de un radical centrado en carbono (Gilmore et al., 2016).
Tabla 2 Reglas de Baldwin revisadas para ciclaciones aniónicas y radicales.
| Cierre | Tamaño del anillo | ||||
|---|---|---|---|---|---|
| Ciclación aniónica | 3 | 4 | 5 | 6 | |
| dig | endo | ✕ | ✕ | ✓ | ✓ |
| exo | ✓ | ✓ | ✓✓ | ✓✓ | |
| Ciclación radicálica | 3 | 4 | 5 | 6 | |
| dig | endo | ✕ | ✕ | ✓ | ✓✓ |
| exo | ✓ | ✓ | ✓✓ | ✓✓ | |
En 3,4,5 y 6 se indica el tamaño del anillo, ✕: desfavorable, ✓: favorable y ✓✓: modos favorables para el cierre de anillo. (Gilmore et al., 2016).
Cierres endo nucleofílicos
Los cierres 5-endo-dig y trig presentan ciertas limitaciones, de acuerdo con las reglas Baldwin, las cuales establecen que es posible que las reglas no se apliquen a ciertos procesos electrocíclicos. Estas reacciones son desfavorables, por su dificultad de alcanzar las trayectorias de ataque de acuerdo con los ángulos de Burgui-Dunitz para los cierres de anillo endo.
Alabugin y Gilmore llevaron a cabo un análisis computacional de las ciclaciones aniónicas, el cual reveló que los estados de transición para los cierres de anillo aniónicos de los cierres 5-endo-dig y trig se puede estabilizar por la presencia de una matriz orbital aromática, que involucra el par solitario en el centro nucleofílico. Esta estabilización reduce tanto la activación como las barreras intrínsecas, facilitando estos cierres.
Los productos cíclicos de estas reacciones corresponden a los estados de transición cíclicos de los cambios sigmatrópicos, por ejemplo, el reordenamiento de Wittig. Estas reacciones se pueden clasificar como reacciones pericíclicas abortadas, en lugar de simples ciclaciones. Baldwin sugirió que las reacciones pericíclicas no debían estar cubiertas por sus reglas, porque la naturaleza aromática de sus estados de transición se lleva a cabo por cierres geométricamente desfavorables (Gilmore et al., 2016).
Extensiones a las reglas de cierres de anillo
Las reglas originales de Baldwin se centraron en los centros nucleofílicos, aunque también hay varias declaraciones que aluden a otros tipos de cierres, como procesos homolíticos y catiónicos.
Estas generalizaciones se han aclarado con el paso de los años y hay una variedad de clases de ciclación en las que factores estereolectrónicos afectan el proceso de la reacción, Estos han dado lugar a varias ampliaciones de las reglas originales (Gilmore et al., 2016).
Extensión 1: Dos arreglos orbitales
Enolatos
Baldwin amplió esta terminología para incluir casos en la que dos matrices orbitales deben alinearse para la formación de cierre de anillo, como las ciclaciones de los enolatos. Si el enlace enolato es exocíclico se denomina enolexo, si es endocíclico, se denomina enolendo (Esquema 6). Es importante mencionar que el cierre del enolato puede ocurrir en el carbono como en el oxígeno, y los requisitos estereoelectrónicos van a variar (Alabugin et al., 2011).
Según las reglas de Baldwin, se sugirió que los cierres para los modos exo-tet y exo-tri eran modos de ciclación desfavorables, mientras que 5- y 6- (enolendo) y 3- y 7- (enolexo) fueron considerados favorables (Gilmore et al., 2016).
Otros sistemas π
Las reglas de ciclación de enolatos pueden ser aplicadas en enaminas y otros sistemas/ ciclaciones alílicas y heteroalílicas bajo esta clasificación (C / O / N -alilo, donde C, O N designa el sitio nucleofílico). Estas consideraciones también se pueden extender a las ciclaciones electrofílicas, donde un centro catiónico puede ser estabilizado por la superposición con un par libre de electrones adyacente, por ejemplo, oxicarbenio e iones de iminio (Y = O, N (π-vinilexo y π-vinilendo)) (Alabugin et al., 2011).
Extensión 2: Zona gris de los epóxidos
En el artículo original de Baldwin, el camino para la formación de epóxidos se menciona muy brevemente, “Las reglas para abrir anillos de tres miembros para formar estructuras cíclicas parecen estar entre los sistemas tetraédricos y trigonales, generalmente prefiriendo exomodos”. Sin embargo, debido a sus características únicas, esta clasificación no es suficiente para cierres epoxídicos.
La revisión y actualización de los planteamientos de Baldwin sobre los epóxidos revela las similitudes entre la ruptura de los enlaces flexionados de un epóxido con las trayectorias de los cierres exo-tet y el cruce de planos presentes en ciclaciones endo-trig. Se debe tener en cuenta que los estados de transición para reacciones exotérmicas impulsadas por tensión pueden llevarse a cabo mucho más rápido en epóxidos que en sistemas tet y trig.
Jamison y colaboradores señalaron que el uso de los descriptores endo-tet y exo-tet para cierres epoxídicos es erróneo, porque la ruptura del enlace C-O del epóxido se encuentra fuera del anillo recién formado, en este caso, cada ciclación debe considerarse un proceso exo-tet. Solo si ambos carbonos se consideran un grupo funcional, la clasificación endo/exo es aplicable, pero en la clasificación se debe usar exo-trig y endo-trig (no tet) (Esquema 7) (Gilmore et al., 2016).
Extensión 3: Cierres electrofílicos
Las moléculas con distintos nucleófilos tienen trayectorias favorables basadas en su estereoelectrónica, la misma naturaleza de las interacciones formadoras de enlaces dependen en gran medida del intermedio reactivo. Después de analizar los resultados obtenidos por métodos computacionales de estos ataques, se sugirieron las siguientes reglas para los cierres digonales (Tabla 3). Al igual que con las ciclaciones de intermedios aniónicos/radicales, el cierre 3-endo-dig es una reacción desfavorecida, principalmente por factores termodinámicos, ya que el producto tendría una alta tensión anular. Por estas mismas razones termodinámicas, las ciclaciones 3-exo/4-endo no se pueden llevar a cabo.
Tabla 3 Reglas extendidas para ciclaciones digonales electrofílicas promovidas por nucleófilos y electrófilos ✕: desfavorecido, ✓:favorable (Gilmore et al., 2016).
| Tamaño del anillo | |||||
|---|---|---|---|---|---|
| Hibridación | Ciclación | 3 | 4 | 5 | 6 |
| trig/dig | endo | ✕ | ✓ | ✓ | ✓✓ |
| exo | ✓ | ✓ | ✓ | ✓✓ | |
Por otra parte, los productos cíclicos se pueden formar en las condiciones adecuadas tras el ataque nucleofílico. Los productos correspondientes se pueden obtener de formar regioselectiva. No hay ejemplos de cierres electrófilos 4-exo y 5-endo-dig, se mencionó que estas ciclaciones serían difíciles, pero podían llevarse a cabo con sustituyentes y condiciones adecuadas.
Por último, los productos 5-exo y 6-endo son favorables y sí se puede obtener, dependiendo de la sustitución en el sistema π y el nucleófilo. Todas estas reglas deben de ser válidas para los cierres trigonales, para los cierres tetragonales aún no se han examinado (Gilmore et al., 2016).
Aplicación de las reglas de Baldwin para la síntesis de compuestos orgánicos cíclicos estables de organolitio que llevan grupos β-salientes
Existe un gran interés para el desarrollo de reactivos organometálicos. Estos compuestos, con grupos salientes (RO-, R2N-, halógenos) β en el centro aniónico, son una pieza fundamental para reacciones de eliminación en la síntesis de alquenos (Foubelo et al., 1998).
Las C-litioaziridinas y los compuestos α-aciloxi-β-aminoalquil-litio son los únicos ejemplos estables reportados de los reactivos de β-aminoalquillitio, compuestos que son útiles (Bisseret et al., 1999; Schwerdtfeger et al., 1999). Así, una preparación y una aplicación sintética de estos compuestos, mediante un principio de reversibilidad microscópica, tomando como base y utilizando las reglas de Baldwin (Esquema 8). Estos compuestos son de gran interés desde un punto mecanístico y de gran utilidad, ya que tienen un potencial uso en síntesis orgánica (Calaza et al., 2001).

Esquema 8 Preparación de compuestos orgánicos estables de organolitio que llevan grupos β-salientes mediante ciclación de Baldwin. (Calaza et al., 2001).
Utilización de las reglas de Baldwin para síntesis regio- y diastereoselectiva de 2-arilazetidinas
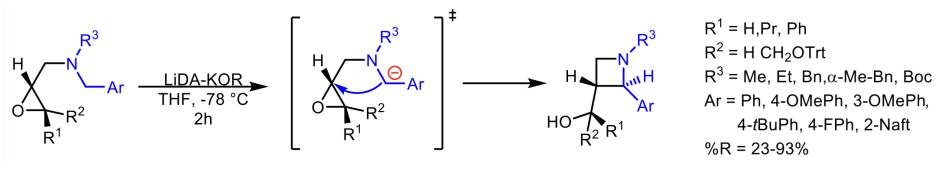
Las 2-arilazetidinas se pueden obtener por medio de aminaciones selectivas intermoleculares sp3 C-H o mediante fotociclación. Las azetidinas son compuestos con muy buena estabilidad metabólica y biodisponibilidad (Yang et al., 2008; Lovering et al., 2009; St. Jean et al., 2012), además tienen una amplia aplicación en la síntesis de antibióticos (Munikumar et al., 2014), como agentes anticancerosos (Cheung et al., 2019; Kahraman et al., 2019), así como un papel importante como bloques de construcción sintéticos (foldámeros y polímeros). También se ha demostrado que la introducción de estos anillos deformados mejora enormemente las propiedades fluorescentes de las rodaminas (Revyakin et al., 2015; Grimm et al., 2017; Gandioso et al., 2018) y cumarinas (Bassolino et al., 2018), entre muchas más aplicaciones como catalizadores, ligandos etc.
Se han publicado metodologías sintéticas eficientes de N-aril-2-cianoazetidinas diversamente sustituidas, basándose en reacciones de cierre de anillo aniónico. Para esta síntesis se utiliza un método regio- y diasteroselectivo para las azetidinas de tipo alcaloide a partir de componentes básicos con buenos rendimientos. Para esto se diseñó un método a partir de las reglas de Baldwin, enriqueciendo la biblioteca química con una trans-3(hidroximetil)-2-arilazetidinas, siendo de gran utilidad para el descubrimiento de fármacos a partir de bencilaminas sustituidas con oxiranilmetilo (Esquema 9) (Kovács et al., 2020).
Aplicación de las reglas de Baldwin para inserciones intramoleculares controladas por metales de transición como Ni, Pd y Pt
Las carbociclaciones de alquenos y alquinos promovidas por metales de transición como níquel, paladio y platino se han investigado computacionalmente para estudiar la facilidad o dificultad con la que pueden ocurrir estos procesos, dependiendo del tamaño del anillo a formar. Se ha supuesto que las reglas de Baldwin, así como las nomenclaturas ya establecidas, son aplicables a reacciones con metales de transición (Lennon et al., 1983), especialmente en el caso de reacciones tipo Heck catalizadas por Pd (Beletskaya et al., 2000). Sin embargo, no se ha informado de un estudio mecanístico sistemático de su validez y selectividad en los sistemas que incluyen metales.
Para ampliar estas reglas y su utilidad, se han estudiado computacionalmente un conjunto de carbometilaciones de derivados de alquenos y alquinos. En este estudio, en todos los casos la esfera de coordinación del metal se satura con ligandos de fosfina; Ph3, PMe3 o PPh3, las carbometilaciones se ven como ciclaciones nucleofílicas promovidas por electrófilos, en este caso en las que el centro electrofílico (el metal) interactúa con el carbanión. Se propuso una extensión de las reglas de Baldwin que puede aplicarse a las metilaciones de alquilo del grupo 10 (níquel, paladio, platino y darmstatio), que muestran tener una reactividad mayor promovidas por metales (Johnson et al., 1993).
Algunas tendencias generales de reactividad son comparables con las de ciclaciones radicálicas o aniónicas, así como la facilidad de formar exociclaciones, la dificultad de los procesos endo en ciclos pequeños (4 y 5), y la energía de activación más baja para el anillo n-exo que para los casos (n+1)-endo.
En los resultados arrojados por Fiser et al. encontraron las barreras de activación extremadamente bajas para los cierres 3-exo-dig y 3-exo-trig (que coincide con lo mencionado anteriormente con los ciclos pequeños mediante las reglas de Baldwin), esto en contraste con la escasez de estos procedimientos, interpretados computacionalmente por la reversibilidad de la formación de anillos ciclopropano/ciclopropeno en presencia de estos metales (Fiser et al., 2017).
En general, la energía exo/endo para los cierres 3-exo-dig y 3-exo-trig es menor que los procesos con Ni, volviéndose mayor para el caso de Pt. En Tabla 4 (Fiser et al., 2017), se muestra el resumen de las ciclaciones que se favorecen o desfavorecen bajo la presencia de ciertos metales.
Tabla 4 Ciclaciones favorables o desfavorables en presencia y ausencia de los metales comparando las predicciones originales de Baldwin y las predicciones corregidas por Alabugin et al.
| Hibridación trig | Hibridación dig | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tamaño del anillo | Tamaño del anillo | ||||||||||||
| Metal | ciclación | 3 | 4 | 5 | 6 | 7 | Metal | ciclación | 3 | 4 | 5 | 6 | 7 |
| Ninguno | exo | ⁕ | ⁕ | ✓ | ✓ | no | Ninguno | exo | ⁕ | ⁕ | ✓ | ✓ | no |
| endo | no | ✕ | ✓ | ✓ | ✓ | endo | no | ✕ | ✓ | ✓ | ✓ | ||
| Ninguno⁺ | exo | ✓ | ✓ | ✓ | ✓ | ✓ | Ninguno⁺ | exo | ✕ | ✕ | ✓ | ✓ | ✓ |
| endo | ✕ | ✕ | ✓ | ✓ | ✓ | endo | ✓ | ✓ | ✓ | ✓ | ✓ | ||
| Ninguno‡ | exo | ■ | ■ | ✓ | ✓ | no | |||||||
| endo | ✕ | ✕ | ■ | ■ | no | ||||||||
| Li | exo | ⁕ | ⁕ | ✓ | ✓ | no | Li | exo | ⁕ | ⁕ | ✓ | ✓ | no |
| endo | no | ✕ | ⁕ | ⁕ | ✓ | endo | no | ✕ | ✓ | ✓ | ✓ | ||
| Ni | exo | ⁕ | ⁕ | ✓ | ✓ | no | Ni | exo | ⁕ | ⁕ | ✓ | ✓ | no |
| endo | no | ✕ | ✓ | ✓ | ✓ | endo | no | ✕ | ✕ | ✓ | ✓ | ||
| Pd | exo | ⁕ | ⁕ | ✓ | ✓ | no | Pd | exo | ⁕ | ⁕ | ✓ | ✓ | no |
| endo | no | ✕ | ⁕ | ✓ | ✓ | endo | no | ✕ | ✕ | ⁕ | ⁕ | ||
| Pt | exo | ⁕ | ⁕ | ✓ | ✓ | no | Pt | exo | ⁕ | ⁕ | ✓ | ✓ | no |
| endo | no | ✕ | ✕ | ⁕ | ⁕ | endo | no | ✕ | ✕ | ✕ | ✓ | ||
✓ = ciclación favorecida, ✕= ciclación desfavorecida, ⁕ = ciclación en el límite, ■ = ciclación en el límite (Albugin et al.), no = ciclación no predicha. ⁺ = predicciones originales por Baldwin, ‡ = predicciones corregidas por Alabugin et al.
Conclusiones
Sin duda alguna, las pautas que Baldwin predijo han establecido una aportación relevante para la síntesis de anillos a través de ciclaciones, generando contribuciones en la ciencia. Es importante poder conocer más a fondo y hacer este tipo de análisis para profundizar en estos acontecimientos predichos. Aun con el paso de los años, sigue siendo más favorable el cierre de anillo exo, así como Baldwin lo dijo, sobre todo para cierres tetraédricos y trigonales, a excepción de los alquinos, en los que se favorece el cierre exo para anillos grandes. Esto, de la mano con la compatibilidad de los factores estéricos y estereoelectrónicos. Asimismo, Baldwin estudió los ángulos de reacción y se basó en autores de trabajos anteriores para saber qué ángulo era propicio para cada hibridación, que es de importancia para que las reacciones y el cierre de anillos se puedan llevar a cabo y de una manera correcta. En este trabajo también se mencionaron las advertencias y posibles violaciones de las ciclaciones de Baldwin, como las contribuciones termodinámicas para situaciones endo y exotérmicas. Se hizo un análisis de nuevas predicciones o revisiones de las reglas de Baldwin así como modalidades en cierres de anillos que no fueron profundizados o tocados por él, como los cierres exo-digonales de ciclos pequeños, cierres radicales endo, cierres endo nucleofílicos y diferentes extensiones como arreglos orbitales en el caso de los enolatos, u otros sistemas π, cierres de anillos para epóxidos, cierres electrofílicos e importantes aplicaciones de cierres de Baldwin con la aplicación de metales, y con cuál de los metales experimentados es más factible llevarse a cabo.











 nueva página del texto (beta)
nueva página del texto (beta)