Introducción
El tratamiento de las masas de agua contaminadas está adquiriendo una atención creciente debido a la escasez y uso inadecuado de los recursos hídricos, requiriendo a su vez una intensificación en la respuesta global para proteger el medio ambiente. En este sentido, la aparición de compuestos farmacéuticos en las corrientes de agua constituye una amenaza creciente por su efecto negativo sobre los sistemas endocrinos de los seres vivos acuáticos (Desbiolles et al., 2018; Kondor et al., 2021; Sifakis et al., 2017; Sousa et al., 2018). Además, los procedimientos de las plantas de tratamiento de aguas residuales convencionales no son suficientes para lograr una eliminación completa de estos compuestos (Deblonde et al., 2011; Martínez-Alcalá et al., 2018). Por ello, en los últimos años se han considerado varias tecnologías avanzadas para la degradación de estos contaminantes, destacando entre ellas la fotocatálisis heterogénea. Esta tecnología consiste en la absorción de luz por parte de un semiconductor (dióxido de titanio, TiO2, como el más investigado y utilizado) con la energía suficiente para superar la energía de banda prohibida (o band gap, Eg) del material. En este caso, la energía absorbida provoca la transferencia de electrones desde la banda de valencia (BV) a la banda de conducción (BC) y da lugar a la separación entre electrones y huecos (como portadores de carga) en el semiconductor (conocido como fotocatalizador). Posteriormente, estos portadores de carga pueden reaccionar en la superficie del fotocatalizador con las moléculas de agua y oxígeno disuelto de la disolución acuosa, permitiendo la generación de especies con un alto potencial oxidante (una explicación más detallada se puede encontrar en el Anexo 1 del Material Complementario (donde se proporciona más información como protocolo de laboratorio para el alumnado). Asimismo, la viabilidad del tratamiento fotocatalítico se ve reforzada por la posibilidad de utilizar la luz solar como fuente de radiación de bajo coste, renovable y respetuosa con el medio ambiente (Belver et al., 2019; Carp et al., 2004). Además de lo anterior, el uso de un fotocatalizador soportado es una opción adecuada para mejorar otros aspectos relevantes desde el punto de vista de potencial aplicación del material como la capacidad de adsorción o incluso su separación y recuperación tras ser utilizado en el tratamiento de disoluciones acuosas (Srikanth et al., 2017).
A nivel académico, también está aumentando la aparición de los conceptos teóricos sobre la fotocatálisis entre las competencias básicas para los cursos de grado universitario, especialmente en los programas de química, ingeniería química o ciencias ambientales. Como ejemplo, la reciente publicación relativa a los conceptos didácticos relacionados con la generación fotocatalítica de hidrógeno (Kremer et al., 2021). Sin embargo, existe una brecha entre la adquisición de esos conceptos y su aprendizaje activo a través del enfoque práctico en el laboratorio (European Association for Quality Assurance in Higher Education (ENQA), 2015). En el caso concreto de la ingeniería química, una disciplina eminentemente práctica, se anima a los estudiantes a integrar la teoría y la práctica a través del desarrollo de herramientas para encontrar soluciones a problemas definidos (Chen et al., 2016). La preparación de fotocatalizadores en el laboratorio debe considerarse como una herramienta fundamental para ampliar los conceptos y habilidades de síntesis de materiales entre los estudiantes de ingeniería química. Sin embargo, y en base al conocimiento en experiencias previas de los autores en este tipo de actividades académicas, existe una carencia en la literatura de experimentos de laboratorio que trate la evaluación del potencial global de un fotocatalizador, incluyendo tanto el rendimiento fotocatalítico -específicamente en contaminantes emergentes como productos farmacéuticos- así como la recuperación del material después del experimento. Una forma de superar esa dificultad es la utilización de diferentes metodologías de enseñanza y aprendizaje en la educación superior. El aprendizaje basado en problemas (ABP) sirve, por ejemplo, como una importante estrategia para aumentar la motivación, la comunicación y las habilidades de trabajo en equipo de los estudiantes, especialmente en los de las etapas iniciales (primer o segundo año) de los programas académicos en el área de las ciencias experimentales (Calvo y Prieto, 2016; Najdanovic-Visak, 2017). En este sentido, la aplicación de esta metodología ha demostrado presentar valoraciones positivas entre el alumnado como consecuencia de la adecuada combinación entre los contenidos teóricos y los aspectos prácticos de la asignatura en la que se desarrolla (Fernández y Aguado, 2017). Cabe destacar que el ABP se ha utilizado de forma exitosa en los grados de química (Ayala Cabrera et al., 2020), ingeniería industrial (Landeta Manzano et al., 2018; Yagüe et al., 2018) e ingeniería química (Cardona Navarrete et al., 2018). Otra metodología diferente, basada en la clase invertida (o flipped classroom) fue positivamente desarrollada por Melo y Sánchez (2017) con objeto de profundizar en la importancia medioambiental de los compuestos farmacéuticos, así como las técnicas analíticas que se precisan para su adecuada identificación y cuantificación.
Por otra parte, se ha observado en bibliografía un número cada vez mayor de experimentos de laboratorio en los que se utiliza la luz solar directa o simulada para múltiples fines. Por ejemplo, Li y sus colaboradores diseñaron un ensayo de laboratorio para la síntesis de fotocatalizadores de sulfuro de cadmio (CdS) para la producción de hidrógeno (Li et al., 2019), mientras Herrera-Melián y sus colegas (Herrera-Melián et al., 2001) describieron un conjunto de experimentos de baja complejidad bajo luz solar directa en presencia y ausencia de TiO2 para remarcar a los y las estudiantes la importancia de usar muestras de control experimentales. Como se puede observar, la mayoría de los experimentos reportados se centran en el estudio de la fotoactividad de semiconductores específicos, dejando al margen otros aspectos fundamentales desde el punto de vista de la posible aplicación de un fotocatalizador como es la recuperación del medio tras reacción, pudiendo evaluar así una posible reutilización del material sintetizado.
En el caso del experimento propuesto -y diseñado en base al aprendizaje cooperativo-, que puede realizarse completamente en un programa de laboratorio de cuatro sesiones (más una sesión final de presentación de resultados), se ha programado su desarrollo en tres etapas secuenciales: a) síntesis solvotermal del TiO2, tanto soportado sobre carbón activo como no soportado; b) caracterización de las propiedades estructurales y ópticas de las muestras preparadas; y c) evaluación del potencial fotocatalizador a través de la degradación de un fármaco común, el acetaminofeno (comercializado en Europa como paracetamol), que se encuentra en las aguas residuales (Kay et al., 2017), utilizando luz solar simulada y una prueba de sedimentación para evaluar la separación del fotocatalizador del medio de reacción. Además, la revalorización de un subproducto fundamental de la biomasa como es la lignina para preparar el carbón activo busca la integración de los principios de la química verde en el currículo de los estudiantes (Haack y Hutchison, 2016), en la educación ambiental como competencia transversal (Martínez Castillo, 2010) y en la educación para la justicia ambiental y social (Carneros et al., 2018). Sin olvidar que este experimento se enmarca dentro de los Objetivos de Desarrollo Sostenible de la Agenda 2030: la ingeniería química, y en este caso la limpieza de aguas a través de la fotocatálisis, se centra en los objetivos para el desarrollo sostenible participando en la lucha contra la presencia de contaminantes en el agua, el cambio climático y la desertificación, así como promoviendo un mundo más solidario donde la redistribución y acceso a los recursos básicos como el agua sean justos y equitativos.
Materiales y montaje experimental
Reactivos necesarios
Los productos químicos utilizados a lo largo del experimento de laboratorio se recogen en la Tabla 1. El uso de estos reactivos debe realizarse siguiendo las medidas necesarias de seguridad, como el empleo de guantes y gafas de protección, así como en una campana extractora. En cuanto a la disolución acuosa que contiene el acetaminofeno (paracetamol) y el fotocatalizador, debe filtrarse convenientemente antes de su eliminación. Los sólidos separados y la fase líquida deben ser recogidos adecuadamente de acuerdo con la guía de eliminación de residuos del laboratorio.
Tabla 1 Productos químicos utilizados en el experimento.
| Material | Número CAS | Compañía | |
|---|---|---|---|
| Etanol (96%) | EtOH | 64-17-5 | Panreac |
| Ácido Clorhídrico (≥37%) | HCl | 7647-01-0 | Sigma Aldrich |
| Lignina | --- | 8068-05-1 | Sigma Aldrich |
| Tricloruro de hierro hidratado (≥97%) | FeCl3·6H2O | 10025-77-1 | Panreac |
| Tetrabutóxido de titanio (≥97%) | Ti(OBu)4 | 5593-70-4 | Sigma Aldrich |
| Acetaminofeno (≥99%) | ACE | 103-90-2 | Sigma Aldrich |
| Nitrógeno (≥99.999%) | N2 | 7727-37-9 | Praxair |
| Agua desionizada | Agua DI | 7732-18-5 | Wasserlab |
Montaje experimental
Preparación del carbón activo (CA)
La realización de esta metodología por parte de los y las estudiantes de ingeniería química pretende conferirles una amplia visión de una posible vía de preparación de un carbón activo. El carbón activo se prepara utilizando lignina como fuente de carbono y FeCl3 como agente activante, utilizando una proporción de masa de 1:3 (lignina:FeCl3) (Peñas-Garzón et al., 2019, 2020). Es importante señalar al alumnado la necesidad de utilizar una mayor cantidad de la sal de hierro (FeCl3·6H2O) como consecuencia de la hidratación del FeCl3 -en este punto, se propone al estudiantado que también calcule la relación de masa real entre la lignina y el FeCl3-6H2O (1:5)-. A continuación, se mezclan físicamente 0,5 g de lignina y 2,5 g de FeCl3·6H2O en un mortero. Seguidamente, la mezcla (colocada en un crisol) se somete a un tratamiento térmico utilizando un horno tubular horizontal de acero inoxidable y siguiendo las siguientes condiciones: atmósfera inerte de N22 (150 cm3 TPE·min-1), rampa de calentamiento de 10 °C·min-1 hasta 800 ºC (manteniendo esta temperatura durante 2 h) y, finalmente, enfriamiento hasta temperatura ambiente. Durante esta parte del experimento, el profesorado debe utilizar el horno tubular de acero inoxidable, situándose el alumnado a una distancia de seguridad. El sólido negro resultante se lava con 100 mL de disolución acuosa de HCl 0,1 M durante 30 min para eliminar el agente activante restante y liberar la porosidad. A continuación, el sólido se filtra y se lava varias veces con agua desionizada hasta alcanzar pH neutro medido en el agua de filtrado. El carbón activo preparado se seca finalmente (105 ºC, 60 min), se almacena y se etiqueta como CA. También se puede utilizar un carbón activo comercial en lugar del carbón activo preparado y, de este modo, reducir significativamente la carga de trabajo de los estudiantes en el laboratorio y permitiendo, de esta manera, que centren su atención en el experimento y el proceso fotocatalítico.
Síntesis de los fotocatalizadores
La preparación de los fotocatalizadores, a través de una síntesis solvotermal (esto es, empleando un disolvente orgánico en lugar de agua), muestra a los y las estudiantes algunos de los pasos más representativos de la síntesis inorgánica, incluyendo las etapas de reacción y purificación del producto. En una síntesis típica -siguiendo una relación de masa TiO2:CA de 4:1- (Peñas-Garzón et al., 2019, 2020), se suspenden 58 mg del CA previamente preparado en 45 mL de EtOH bajo agitación continua. Paralelamente, se diluye 1 mL de Ti(OBu)4 en 15 mL de EtOH y se añade posteriormente a la suspensión anterior. Además, se añade gota a gota a la suspensión otra disolución, consistente en 3 mL de agua destilada en 15 mL de EtOH, permitiendo la hidrolización del precursor de TiO2 y su deposición sobre la superficie del CA. La mezcla se agita durante 5 minutos y se introduce en un reactor autoclave de acero inoxidable-teflón de 125 mL. El reactor se calienta en una estufa a 160 ºC durante 3 h. Después de enfriar a temperatura ambiente, se recupera un sólido gris que se separa por centrifugación (10 min a 5300 rpm) y luego se lava una vez con EtOH y cuatro veces con agua desionizada. Finalmente, el fotocatalizador se seca a 105 ºC durante 60 minutos, se almacena y se etiqueta como TiO2/CA. Con el fin de comparar el desempeño de diferentes materiales, se puede sintetizar una muestra de TiO2 sin soportar siguiendo el mismo procedimiento en ausencia de carbón activo. La sección 4.1 recoge algunas modificaciones que pueden realizarse en la etapa de síntesis para fomentar el aprendizaje cooperativo por medio de la preparación de fotocatalizadores diferentes entre el alumnado.
Procedimiento experimental
Caracterización de las muestras
Para dar una visión más amplia al estudiantado sobre el proceso de caracterización de las muestras, se seleccionan dos técnicas de caracterización diferentes para unir los aspectos teóricos y prácticos más importantes de este experimento. Los patrones de difracción de rayos X (DRX) del material sintetizado, necesarios para verificar las fases cristalinas del TiO2, se obtienen utilizando un difractómetro Bruker D8 (fuente de radiación Cu-Kα, λ = 0,154 nm; intervalo 2θ de 15 a 70°, 5°·min-1). Además, se utiliza un espectrofotómetro UV-vis Shimadzu 2600 (intervalo de longitudes de onda de 250-800 nm, utilizando BaSO4 como referencia) para determinar las propiedades ópticas (intervalo de absorción y estimación del band gap del semiconductor) mediante los espectros de reflectancia difusa (DRS) UV-vis del fotocatalizador.
Degradación fotocatalítica del acetaminofeno
El rendimiento de los fotocatalizadores preparados se evalúa en la degradación del ACE en disolución acuosa utilizando luz solar simulada. Para realizar este experimento, se coloca una disolución de 150 mL de 10 mg·L-1 del ACE en agua destilada en un reactor de vidrio Pyrex por lotes dentro de un simulador solar Suntest XLS+ (Atlas). La luz solar se simula mediante una lámpara de xenón con un filtro “Daylight” (λ > 320 nm, 600 W·m-2). La dosis de fotocatalizador se fija en 250 mg·L-1 y se mantiene bajo agitación constante durante todo el experimento. El reactor discontinuo puede cubrirse -con una tapa de cuarzo o una película transparente como forma más sencilla- para evitar la evaporación de la disolución. Antes de la iluminación, el fotocatalizador se dispersa en la disolución en ausencia de luz durante 60 minutos para lograr el equilibrio de adsorción del contaminante sobre el fotocatalizador. Tras esta etapa, se evalúa el rendimiento fotocatalítico durante 4 h. Se extraen alícuotas de 2 mL de la disolución en diferentes tiempos del experimento, se filtran con filtros de jeringa de politetrafluoroetileno (PTFE) de 0,45 µm (Scharlau) y se colocan en una cubeta de cuarzo. La concentración de ACE se determina utilizando un espectrofotómetro UV-vis Shimadzu 2600 fijando λ = 246 nm (λ de absorción máxima del ACE) y agua DI como blanco (se puede observar una recta de calibrado convencional en la Figura S1 del Anexo 1 del Material Complementario).
Ensayos de decantación de los fotocatalizadores
La experiencia de aprendizaje del alumnado se amplía con una prueba de sedimentación de los fotocatalizadores con el objetivo de remarcar que su potencial aplicación incluye no sólo el rendimiento fotocatalítico, sino también aspectos prácticos como la facilidad de separación del medio de reacción. Para lleva a cabo la prueba, se colocan 2 mL de una suspensión de cada fotocatalizador de 250 mg·L-1 en una cubeta de cuarzo. Se mide la absorbancia a λ = 600 nm (para garantizar que la extinción de la luz se atribuye a la dispersión de las partículas) de forma continua durante 1 h. Para establecer la línea base de referencia (blanco) se utiliza agua desionizada en ausencia del fotocatalizador. Este ensayo de sedimentación puede abordarse mediante otra vía utilizando una probeta graduada, colocando 100 mL de la suspensión de fotocatalizador (250 mg·L-1) y registrando el perfil de sedimentación de las partículas con en el tiempo. En este sentido, nuestra propuesta inicial proporciona una aproximación cuantificable del proceso de sedimentación.
Resultados esperados
Caracterización de los fotocatalizadores
Los patrones de difracción de rayos X (DRX) se utilizan para determinar las fases cristalinas del fotocatalizador. En el caso del TiO2, los diferentes polimorfos son anatasa, rutilo y brookita. Como se puede observar en la Figura 1, los materiales sintetizados presentaban los picos característicos de la fase anatasa (según el Joint Committee on Powder Diffraction Standards, JCPDS 21-1272). Por el contrario, ningún otro pico estaba relacionado con la estructura cristalina del rutilo o de la brookita (o incluso del CA en la muestra de TiO2/CA). En este sentido, la anatasa es la fase cristalina más utilizada para aplicaciones fotocatalíticas, debido a una mayor movilidad de los portadores de carga (pares electrón-hueco), lo que suele traducirse en un incremento de la actividad fotocatalítica (Luttrell et al., 2015; Zhang et al., 2014). Como también se observa en la Figura 1, los patrones de DRX de ambos materiales preparados (TiO2 con y sin soporte) son similares, lo que indica que la presencia de CA en la síntesis solvotermal no causó diferencias importantes en el desarrollo de la estructura cristalina del TiO2.
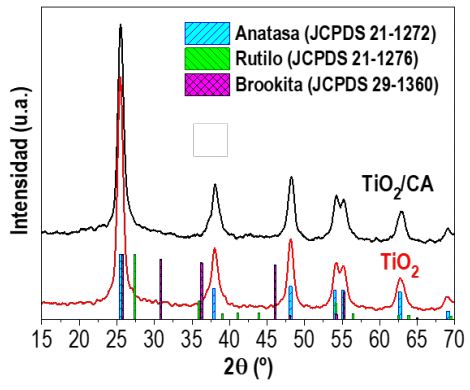
Figura 1 Patrones DRX de los fotocatalizadores sintetizados. Se incluyen los patrones de difracción de las fases anatasa (JCPDS 21-1272), rutilo (JCPDS 21-1276) y brookita (JCPDS 29-1360). Obsérvese que la altura de cada pico de difracción es relativa al pico más intenso de cada patrón de fase cristalina individual.
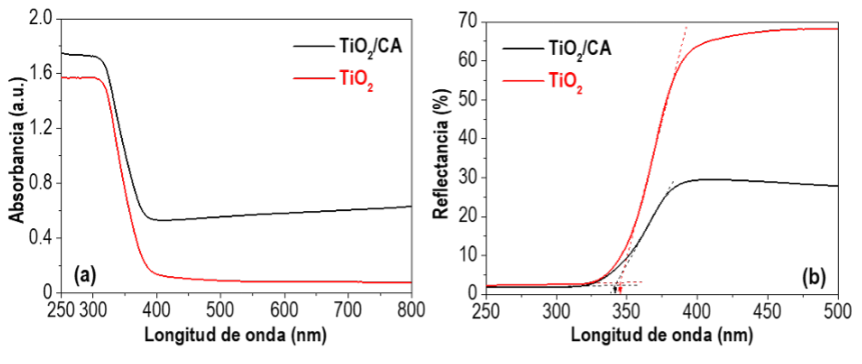
También se investigan las propiedades ópticas de los materiales sintetizados. La absorción de luz en el intervalo de longitudes de onda UV y visible se evalúa mediante espectroscopia de reflectancia difusa UV-vis. Como se muestra en Figura 2a, se puede observar una banda de absorción para ambos fotocatalizadores por debajo de 380 nm (intervalo UV), característica de la absorción de luz del TiO2. Sin embargo, el fotocatalizador TiO2/AC muestra una mayor absorción en el intervalo visible (~400-750 nm) atribuida al color gris de la muestra, indicando que la presencia del CA confiere al fotocatalizador una mayor absorción de luz. Esta diferencia en las propiedades ópticas de los materiales en función del color de las muestras se observa también en los espectros de reflectancia, Figura 2b. Se puede comprobar que la muestra de TiO2/CA muestra una menor reflexión de la luz en el intervalo visible (relacionada con la mayor absorción de luz antes mencionada) en comparación con el TiO2 sin soportar. El espectro de reflectancia también permite una estimación sencilla de la brecha de banda del fotocatalizador. Brevemente, la región lineal de la reflectancia se extrapola a la línea base (Figura 2b). El valor del eje x del punto de corte indica un valor estimado de la longitud de onda necesaria para calcular el band gap por medio de la Ecuación de Planck: E = h·c/λ. Donde, E es el band gap estimado (eV); h es la constante de Planck (4,1357·10-15 eV·s); c es la velocidad de la luz (3·108 m·s-1); y λ es la longitud de onda estimada (10-9 m). Siguiendo esta metodología (como se muestra en la Figura 2b), los valores de band gap estimados son 3,63 y 3,59 eV (341,6 y 345,4 nm) para el TiO2/CA y el TiO2, respectivamente. Un procedimiento más complejo (y preciso), por medio del diagrama de Tauc (Tauc, 1970), conduce a unos valores de band gap de 3,38 y 3,36 eV (TiO2/CA y TiO2, respectivamente), lo que representar alrededor de un 6-7% de desviación con respecto a los valores estimados. En comparación, el band gap de la anatasa en el TiO2 puro presenta un valor alrededor de 3,2 eV (Belver et al., 2019; Carp et al., 2004).
Conversión fotocatalítica de acetaminofeno y recuperación del fotocatalizador
Los rendimientos fotocatalíticos típicos de los materiales sintetizados en la eliminación del ACE bajo luz solar se muestran en la Figura 3. Es importante destacar que, debido a la diferente adsorción de cada fotocatalizador (soportado o no), la concentración inicial del contaminante en la disolución es diferente dependiendo del material utilizado. En este sentido, como se observa en la Figura 3a, se dispersó el TiO2/CA en una disolución de 10 mg·L-1 del ACE antes de la etapa de adsorción. De forma previa al inicio de la irradiación, la concentración del contaminante se cuantificó en torno a 5 mg·L-1, indicando una alta adsorción del contaminante como consecuencia de la presencia del CA en el fotocatalizador soportado (alrededor del 20% en peso). Por el contrario, la adsorción del ACE en el TiO2 sin soportar puede considerarse despreciable. Por tanto, la muestra de TiO2 fue dispersada en una disolución de 5 mg·L-1 del ACE, asegurando de este modo que ambos experimentos fotocatalíticos son llevados a cabo con una concentración del ACE similar tras el equilibrio de adsorción. Este procedimiento permite, por tanto, que los rendimientos fotocatalíticos sean comparados de forma adecuada, como muestra la Figura 3b. Los perfiles de evolución de la concentración relativa del ACE ([ACE]/[ACE0], siendo [ACE0] la concentración inicial y [ACE] la concentración a un determinado tiempo de reacción) indican que el TiO2 sin soportar presentaba un mejor rendimiento fotocatalítico. Los valores similares de los band gaps sugieren que la menor conversión mostrada por el TiO2/CA puede atribuirse a una menor accesibilidad del semiconductor cuando se encuentra soportado (Leary y Westwood, 2011).

Figura 3 (a) Evolución de la concentración de ACE (incluyendo las etapas de adsorción y reacción bajo la luz solar), y (b) perfiles de concentración relativa de ACE considerando solo la etapa de irradiación. (Concentración del ACE tras adsorción: 5 mg·L-1, Dosis de fotocatalizador: 250 mg·L-1).
Considerando solo la información anterior, la muestra TiO2/CA parece presentar una menor utilidad para las aplicaciones fotocatalíticas. Sin embargo, los y las estudiantes deben considerar no solo la fotoactividad, sino que otros aspectos deberían ser tenidos en cuenta cuando se trate de seleccionar un material para una aplicación fotocatalítica específica. En ese sentido, se analizó la separación del medio de reacción de los fotocatalizadores usados. La Figura 4 muestra el perfil de absorbancia relativa, usada como medida indirecta del perfil de decantación de los fotocatalizadores. En este caso, un mayor descenso del perfil de decantación se relaciona con una mayor reducción de la luz dispersada por las partículas a consecuencia de un proceso más rápido de sedimentación. Como puede observarse, el TiO2/CA presenta una decantación más rápida, lo que puede traducirse en una separación más fácil del medio de reacción. Además de lo anterior, la Figura S2 recoge algunas imágenes de la evolución temporal del proceso de sedimentación para ambos materiales sintetizados. Los resultados obtenidos en este experimento de laboratorio, por tanto, señalan que la aplicación potencial de un fotocatalizador debe considerar no sólo el rendimiento fotocatalítico en la eliminación del contaminante, sino también la recuperación/separación de los fotocatalizadores del medio acuoso.

Figura 4 Evolución de la absorbancia (medida a 600 nm) en los ensayos de decantación de los fotocatalizadores (250 mg·L-1).
Como se ha indicado anteriormente, también se pueden analizar las modificaciones de los parámetros seleccionados, como la relación de masa de TiO2:CA de síntesis, la concentración de contaminante o la dosis de fotocatalizador en la degradación del fármaco bajo luz solar (considerando las diferencias en la capacidad de adsorción). Las observaciones y experiencias obtenidas por esta vía pueden promover la adquisición de habilidades integradas de los estudiantes de grado en el campo de la fotocatálisis y el tratamiento de aguas contaminadas.
Metodología y evaluación de la actividad de los y las estudiantes
Aprendizaje cooperativo
Este experimento comprende aspectos multidisciplinares -síntesis inorgánica, química analítica instrumental, ingeniería química e ingeniería medioambiental-, y puede considerarse un ejemplo interesante para la ampliación de las competencias de los y las estudiantes de grado en el contexto de un laboratorio químico común. Además, la intencionalidad de este experimento recoge también competencias transversales que se pueden adquirir gracias al aprendizaje cooperativo. Con objeto de acompañarles durante el proceso de aprendizaje, el Anexo 2 del Material Complementario recoge los fundamentos de la fotocatálisis, así como los aspectos más importantes en la preparación y evaluación de los materiales.
El aprendizaje cooperativo es un método de aprendizaje exitoso en la enseñanza superior y en el ámbito de la ingeniería química, con beneficios tanto a nivel académico como para el desarrollo de habilidades sociales (Azizan et al., 2018; Jauregui et al., 2014; San-Valero et al., 2019; Vergara Rodríguez, 2012). Para utilizar este método en la realización de este experimento, durante el desarrollo en el laboratorio, se procede a la formación de diversos grupos de estudiantes que permanecerán durante todas las sesiones, con el objetivo de promover el intercambio y la discusión de los resultados entre ellos. De este modo, se establecen algunos elementos claves para la discusión a través de las siguientes premisas: pueden modificarse otras condiciones de síntesis y parámetros de reacción a través de i) la utilización de diferentes proporciones de TiO2:CA en masa durante la etapa de síntesis; ii) la variación de la dosis de fotocatalizador en los ensayos de degradación; o iii) el cambio de la concentración del contaminante en el experimento. Los datos y reflexiones fundamentadas por parte de los grupos de estudiantes tendrán que quedar reflejados en el informe de laboratorio, pero será este el espacio físico principal en el que se produzca el intercambio de ideas entre el alumnado para contar durante el desarrollo de la experiencia con el docente como guía (García González et al., 2016). Asimismo, al ser un experimento guiado se facilita tanto el aprendizaje cooperativo como la multidisciplinariedad planteada en las diferentes sesiones (Abril Gallego et al., 2014). La Tabla S1 del Anexo 1 del Material Complementario recoge el cronograma con las principales tareas incluidas en cada sesión y la duración adecuada para cumplir con los principales aspectos de la actividad de aprendizaje.
Evaluación de la actividad de los y las estudiantes
Este experimento forma parte del módulo de Ingeniería de la Reacción Química dentro de la asignatura Experimentación en Ingeniería Química (6 ECTS, 3er curso del grado en Ingeniería Química). Respetando las indicaciones de la memoria de verificación de la titulación se procede a realizar una evaluación y calificación de las tareas tras la realización del experimento de laboratorio que se ajuste a las necesidades formativas de los estudiantes. Esta se compone de tres partes:
i) Actitud del alumno en el laboratorio (15% de la nota final). Incluye la evaluación de la disposición y el comportamiento de cada alumno en el laboratorio. La actitud proactiva a la hora de enfocar el experimento, el comportamiento adecuado o el cumplimiento de los consejos de seguridad son ejemplos de los aspectos evaluados en este ítem. Para ello se realizará una rúbrica consensuada con los estudiantes, con el objetivo de promover y facilitar la retroalimentación (Fernández March, 2010) y de crear un clima democrático y de responsabilidad (Jiménez-Fontana et al., 2015). La rúbrica partirá de una base con el siguiente esquema siendo modificada tras el debate en clase, como se recoge en la Tabla 2.
Tabla 2 Modelo base de la rúbrica de evaluación de la actitud del alumnado.
| Ítem | Sí/No |
|---|---|
| Cumple con las medidas de seguridad | |
| Participa en la evaluación del experimento | |
| Acude al método científico para dar respuestas a las preguntas realizadas en clase |
ii) Informe de resultados del laboratorio (60% de la nota final). Cada grupo de trabajo deberá realizar un informe de diez páginas. Este informe debe incluir las siguientes categorías: introducción, sección experimental, resultados y discusión, conclusiones y referencias. Se añade un apartado de justificación y reflexión para dar respuesta a las preguntas planteadas en el espacio de trabajo cooperativo. Se pueden añadir páginas adicionales para el apéndice. Se recomienda un periodo de 3 semanas entre el final del trabajo de laboratorio y la fecha final de entrega al docente, aunque las fechas son flexibles y siempre se contextualizarán.
iii) Presentación de los resultados en forma de póster (25% de la nota final). Cada grupo presenta los principales resultados del laboratorio en un aula-simulación de presentación de un póster científico, incluyendo como base el formato IMRYD (Introducción, Método, Resultados y Discusión). Cada grupo dispone de 10 minutos para la presentación de los resultados y otros 10 minutos para responder a las preguntas del docente y el resto de los compañeros y las compañeras. Esta sesión se realizará una semana después de la presentación del informe de resultados del laboratorio para que los estudiantes puedan recibir una retroalimentación previa a su exposición. Con esta evaluación se fomenta también la formación de cultura científica, permitiendo hacerles partícipes de la discusión de la ciencia a través de una de las herramientas de discusión más utilizadas (Sánchez Mora y Macías Néstor, 2019).
Conclusiones
El presente experimento de laboratorio está dirigido a estudiantes de grado (especialmente de cursos generales de química, ingeniería química y ciencias ambientales), proporcionándoles conocimientos y habilidades estructuradas en la síntesis de un fotocatalizador TiO2/CA soportado y su aplicación en la eliminación de un fármaco común (acetaminofeno) en agua bajo luz solar. Se establecen tres etapas principales en el laboratorio: i) síntesis solvotermal del fotocatalizador, utilizando un subproducto de la biomasa como fuente de carbono para la preparación del carbón activo utilizado como soporte; ii) caracterización del material sintetizado mediante técnicas analíticas, con el objetivo de evaluar el desarrollo de la fase anatasa del TiO2, la absorción de luz en el intervalo visible y la estimación del band gap del fotocatalizador; iii) eliminación fotocatalítica de un contaminante acuoso y ensayo de decantación para evaluar la recuperación del fotocatalizador. Todas estas etapas constituyen una visión completa y exhaustiva de los conceptos y capacidades fotocatalíticas para el alumnado de grado. Se presenta, asimismo, la posibilidad de utilizar el aprendizaje cooperativo como herramienta que, tras la optimización de las condiciones de síntesis y reacción, aumenta la discusión y reflexión de los resultados entre estudiantes. Todo ello dando respuesta a las necesidades sociales de actuar desde un pensamiento crítico ante los problemas de injusticia ambiental y de la química verde. Es importante resaltar que es esencial la contextualización de este experimento para poder replicarse y que el trabajo interdisciplinar entre docentes permite una mejor adaptación del experimento para dar respuesta a las necesidades formativas del alumnado de la educación superior.











 nueva página del texto (beta)
nueva página del texto (beta)