Introducción
¿Qué es el enfoque 3D en la enseñanza de las ciencias?
Su origen
De acuerdo al Consejo Nacional de Investigación (NRC por sus siglas en inglés, "National Research Council"), los estándares actuales de la educación científica en Estados Unidos (establecidos en 1996) no han logrado que: los estudiantes desarrollen algún tipo de sensibilidad (y curiosidad) hacia la ciencia; que posean conocimientos científicos suficientes para involucrarse en discusiones de esos temas; que sean consumidores críticos de la información científica relacionada a su vida cotidiana; que sean capaces de seguir aprendiendo sobre ciencias fuera del contexto escolar; o que desarrollen las habilidades para acceder a carreras científicas. (NRC, 2012).
El NRC atribuye estas deficiencias a que, antes del 2012, los estándares de la educación científica para la etapa K-12 (que va del Kindergarden "K" hasta el último grado de educación secundaria "12", ver tabla 1): 1) no se encontraban organizados sistemáticamente a lo largo de los múltiples grados que la componen, 2) enfatizaban un gran número de datos factuales con un enfoque superficial en lugar de profundo, 3) no daban oportunidades para que los estudiantes se involucraran en el verdadero quehacer científico.
Tabla 1: Niveles educativos en Estados Unidos.
| Edad (años) | Grado | Etapa del currículo | Tipo de escuela |
|---|---|---|---|
| 4 - 5 | Kindergarden | Kindergarden | Kindergarden |
| 6 | Grade 1 (K-1) | Primaria | Elementary School |
| 7 | Grade 2 (K-2) | ||
| 8 | Grade 3 (K-3) | ||
| 9 | Grade 4 (K-4) | ||
| 10 | Grade 5 (K-5) | ||
| 11 | Grade 6 (K-6) | Secundaria | Middel School |
| 12 | Grade 7 (K-7) | (Junior High School) |
|
| 13 | Grade 8 (K-8) | ||
| 14 | Grade 9 (K-9) | ||
| 15 | Grade 10 (K- 10) | High School | |
| 16 | Grade 11 (K- 11) | (Senior High School) |
|
| 17 | Grade 12 (K- 12) |
Debido a esto, en el año 2012, el NRC presentó su reporte sobre el "marco conceptual de la educación científica para la fase de escolarización K-12", el cual es la primera etapa de un proyecto que (en una segunda etapa) dará pie al establecimiento de la nueva generación de estándares para la educación científica (NGSE, "Next generation of science standards).
Sus componentes
En dicho marco conceptual se establece que la educación científica para la etapa K-12 se debe enfocar en un número limitado de ideas centrales de la disciplina (DCIs, disciplinary core ideas) soportadas e integradas por conceptos transversales (CCCs, crosscutting concepts) y prácticas científicas e ingenieriles (SEPs, science and engineering practices).
De acuerdo con Krajcik, J. (2015) el nuevo enfoque tridimensional (3D) busca que la curiosidad y el asombro sean estelares en el aprendizaje de las ciencias, porque esto puede ayudar a que los estudiantes desarrollen un conocimiento más profundo y práctico sobre los fenómenos científicos. Además de que dicho enfoque permite que los estudiantes desarrollen habilidades importantes para el siglo XXI como son: la resolución de problemas, el pensamiento crítico, la comunicación, la colaboración, así como la autogestión.
Ahora bien, veamos a detalle cada uno de los componentes del enfoque tridimensional:
Ideas centrales de la disciplina (DCIs, Disciplinary core ideas)
En este componente se encuentran los temas disciplinares a cubrir en un ciclo escolar de ciencias.
Si bien tanto en un curso tradicional, como en uno con un enfoque tridimensional, se abordan los mismos temas disciplinares, el enfoque es sustancialmente diferente. El NRC (NRC, 2012) menciona que la instrucción tradicional ha puesto su atención en cubrir múltiples datos inconexos que son memorizados y rápidamente olvidados por los alumnos tras las evaluaciones. Por otra parte, la enseñanza de una idea central supone la construcción de una sólida base de conocimientos y competencias, entendidos con suficiente profundidad para ser utilizados por los estudiantes en contextos escolares y de la vida cotidiana.
En este sentido, una idea central dejará de lado los detalles de una idea (evitando mostrar fragmentos de conocimiento o hechos aislados) pero se enfocará con mayor profundidad en un menor número de ideas más complejas que permitan a los estudiantes entender los mecanismos que subyacen en un fenómeno, los "cómos" y "porqués" (Golan et al., 2015). El NRC considera que la enseñanza de las ideas centrales es medular para desarrollar una comprensión con un nivel de experto (es decir, más afín al pensamiento de un científico en el desarrollo de sus investigaciones) mientras que la instrucción tradicional únicamente genera "novatos" con una visón de datos aislados, y en ocasiones contradictorios, a los que tratan de darles sentido.
El NRC (2012, p. 31) establece que, para que una idea sea considerada como central, habrá de cumplir los siguientes criterios:
1) Tener una gran importancia en múltiples ciencias o disciplinas de ingeniería o ser un principio organizador clave de una sola disciplina.
2) Proporcionar una herramienta clave para comprender o investigar ideas más complejas y resolver problemas.
3) Relacionarse con los intereses y experiencias de la vida de los estudiantes o estar conectado con preocupaciones sociales o personales que requieran conocimiento científico o tecnológico.
4) Ser enseñable y aprendible en múltiples grados con niveles crecientes de profundidad y sofisticación. Es decir, la idea puede ser accesible para los estudiantes más jóvenes, pero es lo suficientemente amplia como para mantener una investigación continua durante años.
El comité del NRC ha agrupado las ideas disciplinares de las ciencias en cuatro dominios principales: las ciencias físicas; las ciencias de la vida; las ciencias de la tierra y el espacio; e ingeniería, tecnología y aplicaciones de la ciencia.
Tabla 2: Dominios de las ideas centrales de la ciencia, establecidas por la NRC (2012).
| Dimensión de la enseñanza 3d |
Dominio de las DCI’s | Ideas centrales (Core ideas) |
|---|---|---|
| Ideas centrales de la disciplina (DCIs) |
Ciencias físicas (CF) |
CF1: Materia y sus interacciones |
| CF2: Movimiento y estabilidad: Fuerzas e interacciones | ||
| CF3: Energía | ||
| CF4: Ondas y sus aplicaciones en tecnologías para la transferencia de información. | ||
| Ciencias de la vida (CV) |
CV1: De moléculas a organismos: Estructuras y procesos | |
| CV2: Ecosistemas: Interacciones, energía y dinámica | ||
| CV3: Herencia: Herencia y variación de rasgos | ||
| CV4: Evolución biológica: unidad y diversidad | ||
| Ciencias de la tierra y del espacio (CTE) |
CTE1: El lugar de la tierra en el universo | |
| CTE2: Sistemas de la tierra | ||
| CTE3: Tierra y actividad humana | ||
| Ingeniería, tecnología y aplicaciones de la ciencia (ITC) |
ITC1: Diseño en ingeniería | |
| ITC2: Enlaces entre ingeniería, tecnología, ciencia y sociedad |
Prácticas científicas e ingenieriles (SEPs, science and engineering practices)
En los años 60's filósofos y sociólogos se plantearon la interesante pregunta de ¿Cómo se crea el conocimiento? (¿Cuándo? ¿Cómo? ¿Dónde?). Tras observar de cerca a científicos en sus laboratorios, durante el desarrollo de sus experimentos, estos filósofos y sociólogos encontraron que no existe un único método científico (Knorr, 2005). Sin embargo en libros de texto (como: Chang, 2002) se hace referencia a una serie de pasos guiados de manera ordenada que constituyen "el método científico"
Para Golan et al. (2015) la construcción del conocimiento es "el corazón de la ciencia". De acuerdo al NRC, dicha construcción requiere de un variado conjunto de prácticas científicas. En las que redes de participantes e instituciones, con una manera de comunicación especializada, desarrollan modelos para representar fenómenos, generan inferencias, crean instrumentos y prueban sus hipótesis mediante la experimentación.
El NRC sostiene que el involucrar a los alumnos en las prácticas científicas les permitirá entender cómo se desarrolla el conocimiento científico, haciendo que la comprensión de los estudiantes sea significativa y se fusione de una manera más profunda en su cosmovisión. El NRC enlista las siguientes prácticas: (Ver tabla 3).
Tabla 3: Practica de las SEPs (NRC, 2012).
| Dimensión | Prácticas |
|---|---|
| Habilidades de pensamiento científico (SEPs) |
Hacer preguntas y definir problemas |
| Desarrollar y usar modelos | |
| Planear y llevar a cabo investigaciones | |
| Analizar e interpretar datos | |
| Usar el pensamiento matemático y computacional | |
| Construir explicaciones y diseñar soluciones | |
| Argumentar con base en evidencias | |
| Obtener, evaluar y comunicar información. |
Golan et al. (2015) menciona que los estudiantes usualmente piensan que existe un único método científico apropiado para llevar a cabo un experimento. Con el fin de superar la visión de la ciencia como un conjunto de conocimientos que reflejan nuestra comprensión actual del mundo, es importante que los alumnos se involucren en el desarrollo de las prácticas científicas, sin pretender que redescubran teorías.
Conceptos transversales (CCs, crosscutting concepts)
Según Rivet y colaboradores (2016) los conceptos transversales son la dimensión más complicada de entender y enseñar. Esto puede deberse a que los conceptos transversales constituyen un "andamiaje" o marco organizacional para conectar el conocimiento, desde varias disciplinas, en una visión coherente del mundo y con base científica (NRC 2012).
En este caso podemos afirmar que los conceptos transversales son abstractos y complejos al pertenecer a la estructura organizacional de los pensamientos. Sin embargo, esta complejidad no limita su acceso sólo a personas brillantes, de hecho el NRC menciona que los seres humanos contamos de manera inhata con dichas estructuras, las cuales nos permiten desarrollar funciones tan básicas y complejas como el habla.
El NRC (NRC, 2012. P. 84) distingue siete conceptos transversales:
1) Patrones: Los patrones observados de formas y eventos guían la organización y clasificación, y generan preguntas sobre las relaciones y los factores que influyen en ellas.
2) Causa y efecto: mecanismo y explicación. Los eventos tienen causas, a veces simples, a veces multifacéticas. Una actividad principal de la ciencia es investigar y explicar las relaciones causales y los mecanismos por los cuales están mediadas. Dichos mecanismos pueden luego probarse en contextos dados y usarse para predecir y explicar eventos en nuevos contextos.
3) Escala, proporción y cantidad: Al considerar los fenómenos, es fundamental reconocer lo que es relevante en diferentes medidas de tamaño, tiempo y energía, y reconocer cómo los cambios en la escala, proporción o cantidad afectan la estructura o el rendimiento de un sistema.
4) Sistemas y modelos de sistemas: La definición del sistema en estudio, especificando sus límites y haciendo explícito un modelo de ese sistema, proporciona herramientas para comprender y probar ideas que son aplicables en toda la ciencia y la ingeniería.
5) Energía y materia: flujos, ciclos y conservación. El seguimiento de los flujos de energía y materia, fuera y dentro de los sistemas, ayuda a comprender las posibilidades y limitaciones de los sistemas.
6) Estructura y función: La forma en que se forma un objeto o un ser vivo y su subestructura determinan muchas de sus propiedades y funciones.
7) Estabilidad y cambio: Tanto para sistemas naturales como construidos, las condiciones de estabilidad y los determinantes de las tasas de cambio o evolución de un sistema son elementos críticos de estudio.

Figura 1: Representación del entrelazado de las tres dimensiones. (NGSS: Three-Dimensional Learning and Assessment, 2018).
De esta manera los conceptos transversales no se limitan al campo de las ciencias, sino que trascienden a cualquier dominio en la manera de adquirir conocimiento. Golan et al. (2015) se refieren a los conceptos transversales como herramientas de pensamiento cuyo objetivo es que los estudiantes puedan hacer uso de ellos para explorar el mundo de una manera parecida a como lo hacen los científicos. Para esto los profesores guiarán a los alumnos para que puedan decidir cuándo y cómo utilizar, uno u otros conceptos transversales. Es importante mencionar que los conceptos transversales no deberán ser enseñados, o evaluados, como temas aislados sino que deberán presentarse asociados a las DCI's y SEP's (Fick, S. 2018).
Desarrollo
Importancia del enfoque 3D
La relevancia del enfoque 3D en la enseñanza de las ciencias va más allá de proponer una nueva forma de presentar el conocimiento en las aulas. Su objetivo primigenio es facilitar la formación de ciudadanos para que desarrollen su máximo potencial como adultos y que puedan hacer frente a los desafíos del futuro. Con habilidades como resolución de problemas, pensamiento crítico, comunicación, colaboración y autogestión, las llamadas: "habilidades del siglo XXI". Las cuales puedan aplicar en diversos contextos académicos, cívicos, laborales o familiares y que según lo reportado por Pellegrino son las habilidades que cada vez más empresarios y líderes políticos le solicitan a las escuelas desarrollar en sus alumnos. (Pellegrino et al., 2012).
De esta manera el enfoque 3D se inclina por una enseñanza en la que los alumnos se involucren de manera activa, en su manera de entender y actuar respecto a temas científicos. Premiando un conocimiento de las ciencias más profundo y práctico (cómo un método de investigación), contra el tradicionalmente presentado de un conocimiento prefabricado de hechos y leyes (a memorizar). Al respecto el filósofo americano John Dewey (1910) menciona que en la educación "el problema de los problemas no es elegir el conocimiento de ciencias a enseñar, sino descubrir la manera de enseñar el "hábito mental de los científicos", es decir pasar de una educación literaria a una científica.
Es así como el enfoque 3D cobra pertinencia, al enseñar a través de las tres dimensiones, para que los alumnos participen en el trabajo de los científicos (prácticas científicas), mientras aplican hábitos mentales científicos (conceptos transversales) y utilizan el conocimiento científico (ideas centrales de la disciplina). Jonhnson (2017) destaca que el enfoque 3D representa un nuevo paradigma para el aprendizaje de las ciencias, al posicionar a los estudiantes como agentes epistémicos que se involucran en prácticas científicas, aplican conceptos transversales y desarrollan y usan ideas centrales disciplinares para explicar (en lugar de sólo aprender) fenómenos en las aulas de ciencias.
Son varios los autores (ver tabla 4) que reconocen que este nuevo enfoque, en la enseñanza de las ciencias, además de permitir la formación de adultos con habilidades para el siglo XXI, regresa la atención hacia la curiosidad, asombro y apreciación por la belleza de las ciencias; permite acceder a nuevos conocimientos que suponen mayor dificultad; reorienta el discurso en el aula (de "aprender sobre un tema a descubrir por qué o cómo sucede algo"); evita una cobertura superficial de una gran cantidad de temas y permite más tiempo para que los estudiantes exploren y examinen ideas con mayor profundidad a la vez que usan esas ideas para comprender fenómenos en ámbitos de la vida cotidiana y se involucran en un método de pensamiento. Golan y col. (2015) aciertan al afirmar que entender las tres dimensiones es esencial como un primer paso en el proceso de convertirse en un profesor de "nueva generación".
Tabla 4 Importancia del enfoque 3D.
| Referencia | Importancia del enfoque 3D en la enseñanza de la ciencias |
|---|---|
| (Krajcik, J. 2015); (NRC, 2012); (Dewey, J. 1910); (Pellegrino et. al., 2012); (Fick, S. 2018); (Johnson, W. 2017); (Krajcik et. al., 2012) |
Facilita la formación de adultos con habilidades para el siglo XXI, como lo son: la resolución de problemas; el pensamiento crítico; la comunicación; la colaboración; así como la autogestión. Necesarias para enfrentar los desafíos del futuro, crear un planeta sostenible y convertirse en científicos exitosos y/o consumidores críticos de información científica en ámbitos cotidianos. |
| (NRC, 2012); (Dewey, J. 1910); (Krajcik et. al., 2012); (Johnson, W. 2017); (Krajcik, J. 2015) |
Prioriza el entendimiento del “porqué” y “cómo” (los alumnos se explican para comprender) los fenómenos científicos operan, sobre la enseñanza del “qué” (el profesor muestra los hechos y leyes de la ciencia prefabricada). Así evita una cobertura superficial de una gran cantidad de temas y se enfoca en algunas ideas centrales comprendidas a mayor profundidad |
| (NRC, 2012); (Johnson, W. 2017); (Dewey, J. 1910); (Krajcik, J. 2015) |
Supone y confía en que los alumnos son intrínsecamente curiosos y que así como el trabajo de los científicos es impulsado por la curiosidad, los alumnos de la misma manera logren desarrollar un genuino asombro y/o apreciación por la belleza de las ciencias. |
| (NRC, 2012); (Johnson, W. 2017); (Krajcik, J. 2015) |
Genera experiencias para usar el conocimiento científico y comprender fenómenos científicos en ámbitos escolares y cotidianos. |
| (NRC, 2012); (Krajcik, J. 2015) |
Desarrolla la capacidad para que los alumnos continúen aprendiendo sobre ciencia y accedan a nuevos conocimientos que suponen mayor dificultad |
Análisis del temario de Química III de la ENP y su relación con el enfoque 3D.
La Escuela Nacional Preparatoria (ENP) de la Universidad Nacional Autónoma de México (UNAM) que en el año 2017 celebró su 150 aniversario, comenzó, en ese mismo año, la modificación de sus currículos. En dicha modificación figura la actualización de los programas de estudio de diversas asignaturas, manteniéndose vigente el último plan de estudios, el creado en 1996.
La actualización de los programas de estudio propone una mejora para facilitar el aprendizaje de los estudiantes: al fomentar el desarrollo de habilidades de lectura y escritura (desde todas las disciplinas y no únicamente desde las asignaturas de español y literatura), tanto en español como en un idioma diferente (frecuentemente inglés); aplicar las TIC (Tecnologías de la Información y la comunicación) en el proceso de enseñanza aprendizaje; así como la contextualización de los temas disciplinares en situaciones cotidianas y cercanas a los estudiantes que den pie a la discusión y la argumentación que conlleve a la formación de valores (Gurrola, A. 2017).
Particularmente, en el temario de la asignatura "Química III" (Clave 1501) de la ENP, donde se espera contribuir a que los estudiantes adquieran una cultura científica, se tiene como propósito general que: el estudiante aplique sus conocimientos sobre química, así como el lenguaje químico para abordar problemáticas actuales. Esto a través de actividades colaborativas de investigación documental, el análisis e interpretación de textos de divulgación científica y experimental, con el fin de promover la formación de un ciudadano consciente del cuidado de su entorno. Para esto, se propone encaminar a los estudiantes a la construcción de sus conocimientos, así como el desarrollo de habilidades y actitudes para tomar decisiones. Todo esto en el marco del enfoque Ciencia, Tecnología, Sociedad y Ambiente (CTSA). (ENP, 2017).
Con base en lo anteriormente expuesto se observa que si bien tanto el enfoque 3D y el temario de la ENP buscan preparar a los ciudadanos del futuro: la ENP continua con un enfoque de enseñanza tradicional en el que los alumnos adquirirán una "cultura científica"; mientras que en el enfoque 3D los alumnos desarrollarán su potencial aprendiendo ciencias como lo haría un científico en su quehacer de investigación (mediante el "hábito mental de los científicos", es decir se plantea un enfoque de indagación, con énfasis no sólo en las prácticas propias de este enfoque, sino también en los conceptos transversales y los centrales del tópico).
Al analizar el temario de la ENP, propuesto en el año 2017, se observa una reducción de los contenidos disciplinares, y un énfasis en el enfoque CTSA. Si bien la reducción de temas disciplinares pareciera tener relación con lo propuesto por el NRC, los temas que se abordan son conceptos y no ideas centrales. Con lo que esta reducción es sólo un recorte del temario tradicional. Es importante mencionar que los conceptos propuestos por la ENP guardan relación con una idea central, pero la ENP no hace referencia a dicha relación y los conceptos a enseñarse tratan de manera factual, sin involucrar prácticas científicas ni conceptos transversales. Por otro lado, el énfasis en el enfoque CTSA, hace que los contenidos conceptuales importantes se diluyan en discusiones de tipo social, sin una reflexión con fundamento científico.
¿Cómo aplicar el enfoque 3D en la enseñanza de la química?
La implementación de un nuevo enfoque nunca es fácil. Ya que implica no sólo reflexionar sobre lo que se va a hacer y cómo se va a hacer, sino también que el docente reflexione sobre lo que reconoce que sabe y no sabe del nuevo enfoque, lo que lleva a tener que salir de su zona de confort. Así pues, implementar un enfoque 3D en la enseñanza de las ciencias es retador, porque requiere entender el enfoque y crear nuevas situaciones de enseñanza en las que se conjuguen las tres dimensiones. Y lo es aún más cuando se parte de un currículo tradicional que no considera las dimensiones del enfoque 3D como en el caso del temario de la ENP.
De esta manera como primer paso para implementar el enfoque 3D en la enseñanza de la química, se requiere partir de un currículo que se base en las ideas centrales de la química (DCI's) propuestas por la NRC.
Existen propuestas de currículo para la asignatura de química que consideran las ideas centrales de la NRC. Por ejemplo: Talanquer (2016) hace una reflexión sobre los conceptos presentados en los cursos de química, su relación con las ideas centrales y la visión actual sobre la disciplina. Indica que es importante pensar la química más allá de un cuerpo de conceptos y entenderla como una forma de pensar y actuar sobre el mundo material. De esta manera Talanquer (2016) hace una fundamentación teórica alrededor de 6 ideas centrales, las cuales son concebidas como "ideas para la práctica" de la química. Por otra parte la ACS (2018) sugiere diferentes conceptos para cada idea central, donde un mismo concepto puede estar ligado a varias ideas centrales. De la misma manera Cooper (2017) propone un currículo con base en las ideas centrales que permita la evaluación de dichas ideas favoreciendo el razonamiento, en lugar de evaluar memorísticamente conceptos y hechos químicos. Cooper indica que tanto el currículo como la evaluación deben presentar los tópicos de tal manera que se evidencie su conexión con la idea central, lo que permitirá a los alumnos reforzar las ideas centrales y construir un marco de conocimientos más parecido al de los científicos.
La propuesta de Cooper parece ser la más pertinente, ya que sugiere conservar la estructura de los tópicos, pero con la particularidad de enfatizar y regresar en diferentes momentos a las ideas centrales con las que guardan relación. La lista sugerida por la ACS (2018) puede servir como base para identificar algunas ideas centrales para cada tópico. Finalmente, la propuesta de Talanquer (2016) está ligada a algunas ideas centrales de la química, que no son necesariamente las mismas que propone la NRC, sino que está más enfocada a la práctica del quehacer científico con base en cuestionamientos clave que permitan generar, no sólo el pensamiento químico, sino también algunos conceptos transversales como la causalidad y los mecanismos.
| Ideas centrales y sus componentes (NRC 2012) |
Conceptos químicos propuesta ACS |
Relación entre ideas centrales y tópicos, propuestos por Cooper |
Ideas centrales en la práctica de la química. Talanquer. |
|---|---|---|---|
| CF1: Materia y sus interacciones CF1.A: Estructura y propiedades de la materia CF1.B: Reacciones químicas CF1.C: Procesos nucleares |
Estados de la materia Soluciones Periodicidad Enlace y fuerzas intermoleculares Cambios físicos Cambios químicos Tipos de reacciones Estequiometria Cinética Equilibrio Química Nuclear |
Tendencias periódicas (Estructura y propiedades atómicas / moleculares: las tendencias que se repiten en las filas y en las columnas surgen de la estructura atómica.) Soluciones (Estructura y propiedades atómicas / moleculares: la solubilidad de una sustancia depende de la estructura a nivel molecular tanto del soluto como del solvente.) Fases y cambios de fase (Estructura y propiedades atómicas / moleculares: el punto de fusión / ebullición de una sustancia depende de su estructura a nivel molecular.) Cinética (Estructura y propiedades atómicas / moleculares: el punto de fusión / ebullición de una sustancia depende de su estructura a nivel molecular.) Termoquímica (Estructura y propiedades atómicas / moleculares: algunos enlaces e interacciones se rompen y se forman otros nuevos en una reacción química. |
¿De qué está hecho este material? (la cuestión de la identidad) ¿Cómo se relacionan las propiedades de un material con su composición y estructura? (la cuestión de las relaciones estructura- propiedad) ¿Cómo predecimos las propiedades de las sustancias? |
| CF2: Movimiento y estabilidad: Fuerzas e interacciones CF2.A: Fuerzas y movimiento CF2.B: Tipos de interacciones CF2.C: Estabilidad e inestabilidad en sistemas físicos |
Periodicidad y estructura atómica Fuerzas de enlace e intermoleculares Enlace iónico Enlace covalente Estructura molecular Tipos de reacciones químicas . Cinética Electroquímica Materiales: propiedades explicadas por la estructura molecular . Ingeniería Química |
Tendencias periódicas (Interacciones electrostáticas y de enlace: las interacciones electrostáticas (que dan lugar a una carga nuclear efectiva) entre partículas subatómicas explican la mayoría de las tendencias periódicas.) Soluciones (Interacciones electrostáticas y de enlace: las interacciones entre el disolvente y el soluto determinan en parte la solubilidad) Fases y cambios de fase (Interacciones electrostáticas y de enlace: los tipos y la fuerza de las interacciones a nivel molecular influyen en los puntos de fusión / ebullición.) Cinética (Interacciones electrostáticas y de enlace: los tipos y la fuerza de las interacciones a nivel molecular influyen en los puntos de fusión / ebullición.) Termoquímica (Interacciones electrostáticas y de enlace: los tipos y la fuerza de los enlaces e interacciones dependen de la estructura y polaridad de las moléculas involucradas. La fuerza de las interacciones se puede predecir a partir de consideraciones electrostáticas.) |
¿Por qué un material sufre cambios? (la cuestión de la causalidad); ¿Cómo ocurren esos cambios? (la cuestión del mecanismo); |
| CF3: Energía CF3.A: Definiciones de energía CF3.B: Conservación de energía y transferencia de energía CF3.C: Energía en procesos químicos y en la vida cotidiana |
Termoquímica Equilibrio termodinámico Fuerzas de enlace e intermoleculares Electroquímica Química nuclear Naturaleza de la ciencia Ingeniería Química Termodinámica |
Tendencias periódicas (Energía: Cuántica: Los patrones en las energías de ionización surgen de la naturaleza cuantificada de los niveles de energía. El blindaje por los electrones del núcleo determina la carga nuclear efectiva experimentada por los electrones de valencia y resulta de la relación entre los niveles de energía cuantificados en los átomos y la estructura de capa asociada.) Tendencias periódicas: (Cambio y estabilidad en los sistemas químicos: el equilibrio entre las fuerzas atractivas y repulsivas determina el tamaño de los átomos) Soluciones (Energía: Macroscópica: los cambios de temperatura que tienen lugar cuando una sustancia se disuelve dependen de la energía necesaria para superar las interacciones y la energía liberada cuando se forman nuevas interacciones.) Soluciones (Cambio y estabilidad en los sistemas químicos: la solubilidad de una sustancia depende del cambio de entropía total cuando una sustancia se disuelve.) Fases y cambios de fase (Energía: Macroscópica: los cambios de energía asociados con los cambios de fase están determinados por los tipos y la fuerza de las interacciones.) Fases y cambios de fase (Cambio y estabilidad en sistemas químicos: las temperaturas de cambio de fase dependen de la transferencia de energía entre el sistema y el entorno y los correspondientes cambios de entropía.) Cinética ( Energía: Macroscópica: los cambios de energía asociados con los cambios de fase están determinados por los tipos y la fuerza de las interacciones.) Cinética (Cambio y estabilidad en sistemas químicos: las temperaturas de cambio de fase dependen de la transferencia de energía entre sistemas y alrededores y los correspondientes cambios de entropía.) Termoquímica Termoquímica Energía: molecular y macroscópica: el cambio de energía en una reacción química es un equilibrio entre la energía necesaria para romper enlaces e interacciones, y la energía liberada cuando se forman nuevos enlaces e interacciones. Cambio y estabilidad en los sistemas químicos: el hecho de que se produzca una reacción química o no depende del cambio de entropía total, que se puede determinar a partir de una consideración de los cambios de entalpía y entropía del sistema. |
¿Cómo se pueden controlar esos cambios? (la cuestión del Control); ¿Cuáles son las consecuencias de tales cambios? (la cuestión de los beneficios-sus-costos- riesgos) |
| CF4: Ondas y sus aplicaciones en tecnologías para la transferencia de información. CF4.A: Propiedades de las ondas CF4.B: Radiación electromagnética CF4.C: Tecnologías de la información e instrumentación |
Estructura atómica Química cuántica Espectro de radiación electromagnética Análisis cuantitativo (e.g. , Beer’s law) |
Con este antecedente, procederemos a hacer una propuesta de enseñanza usando el enfoque 3D. Para ello, decidimos seleccionar el tema general de tabla periódica, porque consideramos que se presta para hacer relaciones 3D de forma clara.
Propuesta de actividad para la enseñanza del tema de tabla periódica y periodicidad con un enfoque 3D
Como primer paso para el desarrollo de la propuesta de enseñanza, se determinan las expectativas de desempeño (resultados esperados de aprendizaje). Dado que la propuesta tiene un enfoque 3D, se tomaron como base las expectativas de desempeño establecidas, para cada dimensión, por la NRC (2012) y que se muestran en la siguiente tabla (Tabla 6).
Tabla 6: Expectativas de desempeño para CF1. A del NRC (2012, página 224-229), al finalizar el grado K12 (equivalente a 6°año de bachillerato).
| Idea central (DCI´s) |
CF1.A: Estructura y propiedades de la materia Cada átomo tiene una subestructura cargada que consiste en un núcleo (hecho de protones y neutrones) rodeado por electrones. La tabla periódica ordena los elementos por el número de protones en el núcleo del átomo y coloca en columnas aquellos con propiedades químicas similares. Los patrones repetidos de esta tabla reflejan patrones de estados de electrones externos. |
| Practica científica e ingenieril (SEP’s) |
Modelado |
| Concepto transversal (CCC’s) |
Estructura y función: Los átomos tienen estructuras que determinan el comportamiento químico del elemento y las propiedades de las sustancias. Patrones, similitud y diversidad: la tabla periódica se puede utilizar para ver los patrones de comportamiento químico basados en patrones de estructura atómica. |
| Tareas (Desempeño esperado de los estudiantes) |
Inicialmente los estudiantes desarrollan modelos que describan un átomo neutro y un ión negativo o positivo. Luego usan estos modelos para describir las similitudes y diferencias entre los átomos de elementos vecinos en la tabla periódica (uno al lado del otro o uno encima del otro). |
| Criterios (por los cuales se evalúa el desempeño) |
Los modelos deben mostrar que el átomo consta de un núcleo interno llamado núcleo, que consta de protones y neutrones; que el número de protones en el núcleo es el número atómico y determina el elemento; que el núcleo es mucho más pequeño que el átomo; que la parte exterior del átomo contiene electrones; que en un átomo neutro, el número de electrones coincide con el número de protones (porque los protones y los electrones tienen una carga eléctrica opuesta); y que los iones tienen un electrón adicional o “faltante”. Los diferentes isótopos de un elemento dado tienen diferentes números de neutrones, pero en todos los casos estables, el número de neutrones no es muy diferente del número de protones. Los electrones ocupan un conjunto de estados “en capas”, con un número dado permitido en cada una de las primeras capas. (No se esperan detalles de los orbitales y las razones detrás del recuento de estados). La posición “más externa” de los electrones corresponde a los electrones menos fuertemente ligados. El nivel de llenado de la capa más externa se puede utilizar para explicar las propiedades químicas y los tipos de iones que se forman con mayor facilidad. Los átomos uno al lado del otro en la tabla periódica están cerca unos de otros en masa y difieren en uno en su número de protones. Tienen diferentes propiedades químicas. Los átomos por encima o por debajo del otro en la tabla periódica tienen propiedades químicas similares pero difieren significativamente en masa y número atómico. |
Como actividad introductoria para la presentación del tema de tabla periódica, se propone una actividad en la que los estudiantes deben encontrar el ordenamiento de tarjetas que representan algunos elementos ficticios (ver esquema A). Para ello, se les plantea la situación en la que el mismo Mendeleyev colocó en tarjetas la información conocida de los elementos, y tras observar, barajear y reacomodar las tarjetas se va a dormir. Los alumnos, como parte del inconsciente de Mendeleyev, deberán ayudarle a dar orden a las tarjetas basándose en él número atómico de los elementos, el esquema de su distribución atómica (que muestra el número de electrones al interior y exterior del átomo. Aunque esta información no se conocía en la época de Mendeléyev, dados los criterios de desempeño consideramos importante incluirlos); y algunas propiedades como su conductividad eléctrica y el número de electrones que ceden o aceptan en una reacción química.
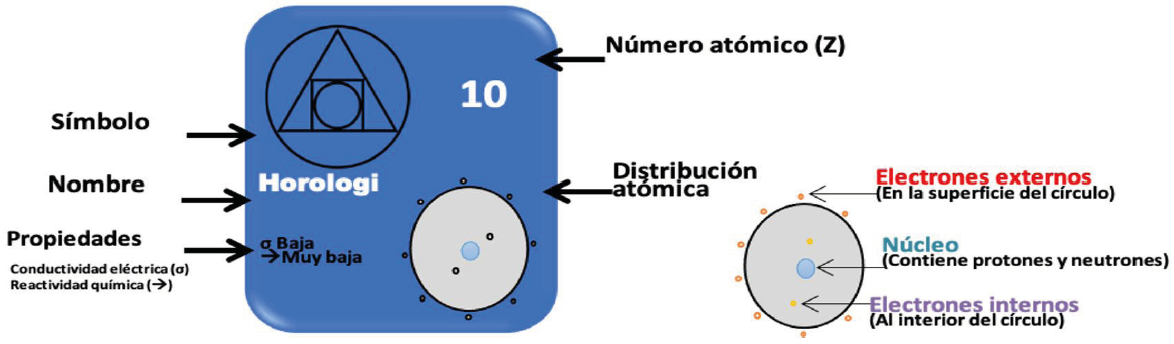
Para la actividad se crearon 24 tarjetas que representan a los elementos de las familias 1, 2, 3, 4, 5, 6 y 7A, de las filas 2, 3, y 4 de la tabla periódica. Como símbolo se propuso, de manera arbitraria, un símbolo alquímico y de la misma manera el nombre de alguna estrella (Se buscaba que los estudiantes no se influenciarán por lo que ya conocen de la tabla periódica). El número atómico y el esquema de distribución atómica (en el que se representa de manera sencilla el núcleo y el número de electrones al interior y exterior del átomo) corresponden con la información conocida de los elementos en la tabla periódica. Y de las 24 tarjetas sólo se les entregan a los estudiantes 17 tarjetas, seleccionadas aleatoriamente procurando que haya al menos un elemento de cada columna (Ver ordenamiento de los elementos en Anexo).
Como primera actividad se pide a los estudiantes que, una vez familiarizados con la información de las tarjetas, recolecten la información que en ellas se muestra sobre el número de electrones, internos y externos, así como el número de protones. Con base en la distribución de los electrones se pide a los alumnos ordenar las tarjetas en filas y columnas. Con esta actividad se espera que los alumnos logren identificar los patrones de repetición para los elementos de las mismas columnas (en las que hay el mismo número de electrones externos) los patrones de repetición de las filas (que tienen el mismo número de electrones al interior del átomo) y que verifiquen que el ordenamiento encontrado corresponde con el número ascendente del número atómico en cada fila. Para lograr este fin, además de organizar los elementos, los alumnos deberán responder preguntas en las que se mencionen las similitudes que observan para cada fila y columna ordenada. Finalmente se pide a los alumnos que predigan la distribución atómica y posición en la tabla para los nuevos elementos que se descubran.
Como segunda actividad, y partiendo del resultado obtenido en la primera, se pide a los alumnos observar y reportar la variación en las propiedades de los elementos ordenados en las mismas columnas. Con base en esta observación se pide a los alumnos reflexionar si conservarían el orden inicialmente propuesto o si lo cambiarían, justificando su respuesta. Nuevamente se pide que propongan las propiedades que tendrían los nuevos elementos a descubrir
De esta manera con la actividad se busca que los alumnos: aprendan que los átomos consisten de subestructuras (protones, electrones y neutrones), que en la tabla periódica los elementos se presentan en filas con orden ascendente de su número de protones, que los elementos en la misma columna tienen propiedades químicas similares y que los patrones repetidos reflejan estados de electrones externos (DCI: Estructura y propiedades de la materia); al mismo tiempo que reconozcan los patrones de comportamiento químico basados en patrones de estructura atómica (CCC's: Patrones, Estructura y función); y usen y desarrollen modelos para describir la estructura del átomo (SEP's: Modelaje). Se incluye una breve rúbrica que puede servir de ejemplo para relacionar los tres niveles. Reconocemos que es perfectible y que puede ser adaptada a las necesidades particulares de cada docente.
Conclusiones
La actividad propuesta es un ejemplo de cómo se puede desarrollar la enseñanza del tema de periodicidad con un enfoque 3D. Crear actividades con dicho enfoque requiere, primeramente, entender los componentes de la enseñanza 3D. Reconocerlos en el programa que se esté enseñando, ya sea que estén de forma explícita o implícita. Pero también reconocer que para cada idea central habrá algunas prácticas científicas y conceptos transversales que se podrán desarrollar de forma más eficiente que otras, y corresponderá seleccionar esas prácticas y esos conceptos transversales y no otros.
Por ahora, la enseñanza de las ciencias con un enfoque 3D está ligada a la aplicación de los temarios actuales, que tienen un enfoque tradicional. Si bien la implementación del enfoque 3D sería más sencilla si se partiera de temarios y libros de texto que estuvieran alineados a este enfoque, esto no es una limitante para su implementación.
Particularmente para el nuevo temario de Química III de la ENP, se observa una reducción del número de temas, pero el enfoque continúa siendo tradicional, presentando algunos conceptos desde la perspectiva CTS. Así, la reducción del temario no basta para que los alumnos desarrollen un conocimiento de las ciencias más profundo y práctico. Salir del enfoque tradicional de la enseñanza de las ciencias requiere un esfuerzo adicional por parte de los docentes, ya que además de familiarizarse con el enfoque 3D se deben desarrollar situaciones en las que las tres dimensiones se presenten de forma amalgamada. Haciendo énfasis en la idea central (DCI's) y valiéndose de las prácticas científicas e ingenieriles (SEP's) y las ideas transversales (CCC's).
La actividad propuesta busca que los estudiantes fijen su atención en los patrones que dan a cada elemento su posición en la tabla periódica. Permitiéndoles una comprensión más profunda (para nivel bachillerato) de la relación que guardan la estructura atómica y las propiedades químicas con la posición de los elementos en la tabla, sin importar el nombre o símbolo que este tenga. Así en lugar de que los alumnos recuerden la ubicación de un elemento de manera memorística se espera que asocien la posición con las características que comparte con los elementos vecinos, pasando de una educación tradicional a una con enfoque 3D. Esta actividad no fue probada con alumnos, se espera que en el futuro sirva como referente para investigadores y docentes.











 nueva página del texto (beta)
nueva página del texto (beta)