Introducción
En una clase universitaria introductoria de Electroquímica, los estudiantes se enfrentan a conceptos y modelos que son intrínsecamente complejos tanto espacial como dinámicamente; además, los procesos más importantes tienen lugar en pequeñas porciones del espacio total, donde la observación y la caracterización son muy difíciles (Faulkner, 2014). Es el caso de las reacciones de óxido reducción que ocurren en la interfase, y que se analizan desde la cinética electródica. Los estudiantes perciben a la electroquímica como una de las asignaturas más difíciles (Rahayu et al, 2021; De Jong y Treagust, 2002), y se han documentado una gran cantidad de concepciones alternativas en esta área (Sanmartín et al, 2014; Sanger y Greenbowe, 1997, 1999). Muchos estudiantes pueden resolver los problemas electroquímicos cuantitativos que aparecen en los exámenes, pero pocos pueden responder preguntas cualitativas que requieren un conocimiento conceptual más profundo (Sanger y Greenbowe, 1997). El principal problema es que se enseña desde lo simbólico y al nivel particulado o nanoscópico. Entonces, los aprendices resuelven los problemas disciplinares a partir de aplicar fórmulas y algoritmos, pero en el nivel conceptual solo tienen ideas desconectadas que reproducen el discurso científico y que no llegan a comprender.
Para tener mejores oportunidades de producir un aprendizaje significativo, se propone no solo un cambio de enfoque, para empezar mejor a partir de lo macroscópico mediante un experimento, sino una didáctica que problematice la experiencia. Por ejemplo, a partir del Aprendizaje Basado en Problemas (ABP) se les puede proponer a los estudiantes la elaboración de una pila que se construya a partir de materiales caseros o de fácil adquisición, y que se aborde el estudio de las interfases de electrodo para cada semirreacción de la celda galvánica. Así, una clase "teórica" se transforma en una teórica-experimental, pero sin la necesidad de una clase ex profeso de laboratorio. Sin embargo, este tipo de propuestas se enfrentan con problemas importantes de implementación instrumental. En particular, si lo que se quiere es que los estudiantes vivan una experiencia profunda del pensamiento fisicoquímico, para que a partir de lo "observable" macroscópica e instrumentalmente puedan ir relacionando con los modelos de interfase, termodinámicos y cinéticos, los instrumentos que se requieren para medir van más allá de un simple multímetro. Los procesos de interfase solo pueden empezar a discutirse a través de métodos electroquímicos, como la voltamperometría, pero no es posible proveer a una clase muy numerosa con potenciostatos comerciales que son muy costosos. Afortunadamente, ya existe una gran cantidad de equipamiento que se desarrolla a partir de Arduino, que es una interfaz o plataforma libre de bajo costo, flexible y fácil acceso, que se usa para la creación de electrónica de código abierto. A partir de Arduino se han construidos equipos muy versátiles (Kubínová, 2015; Mabbott, 2014; Meloni, 2016; Urban, 2014; Grinias et al, 2016), y muy atractivos por las librerías de libre acceso y a que existe una amplia comunidad en la red dedicada a compartir conocimiento.
El objetivo de este trabajo es comunicar el desarrollo y validación de un equipo electroquímico base Arduino de bajo costo (Hernández-Martínez, 2021), así como mostrar un ejemplo de aplicación en el aula con resultados para la investigación de lápices de grafito usados como electrodos en la reducción del protón en medio ácido acético. Con este equipo se pueden realizar potenciometrías, por lo que funciona como potenciómetro, y también voltamperometrías y cronoamperometrías, por lo que funciona como potenciostato. Estos experimentos se desarrollaron exitosamente durante el confinamiento provocado por la pandemia, y se comprueba que el equipo también puede usarse en el laboratorio en casa.
Metodología para construir el equipo de análisis electroquímico base Arduino
El equipo de análisis electroquímico base Arduino fue construido por estudiantes de las licenciaturas de Química e Ingeniería Química, a partir del desarrollo de Hernández-Martínez (2021).
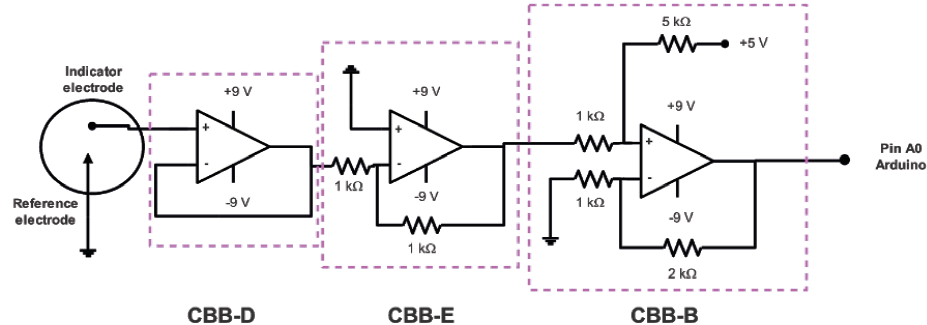
El sistema de bloques de circuitos propuesto para su diseño es el siguiente:
CBB-A Convertidor de señal unipolar a bipolar. Se utiliza para generar señales bipolares con potenciales positivos y negativos.
CBB-B Convertidor de señal bipolar a unipolar. Genera señales medibles para Arduino a partir de señales bipolares, compuestas por potenciales negativos o fuera de rango de lectura.
CBB-C Convertidor de corriente a potencial. Convierte proporcionalmente una señal de corriente a una señal de potencial; también permite la amplificación de corrientes muy pequeñas.
CBB-D Seguidor potencial. Reduce el ruido y permite obtener una señal potencial sin generar carga en el sistema a medir. Para este bloque, el valor potencial en la salida es igual al valor en la entrada.
CBB-E Multiplicador de potencial. Ajusta la magnitud de una señal de potencial o voltaje a un rango de valores medibles, se usa como un ajuste en "sensibilidad".
CBB-F Digital - analógico. Permite obtener una señal de potencial analógica a partir de una digital, concretamente a partir de una señal PWM (Pulse Width Modulated).
Potenciómetro
En potenciometría, la señal a medir es la diferencia de potencial entre dos electrodos. En una celda galvánica, esta diferencia de potencial es el resultado del potencial de interfase electroquímico en cada electrodo, y no requiere de ninguna señal externa para perturbar la celda. Se mide a través del transductor, que es el electrodo, por medio del potencial de celda establecido. Para el análisis potenciométrico, la magnitud de la señal que se mide generalmente se maneja en el orden de milivoltios. Para este potenciómetro, cuyo esquema de construcción de circuitos eléctricos se muestra en la Figura 1, la medición se realiza en un intervalo de ±1V. Sin embargo, el equipo no funciona si se utiliza un electrodo combinado o un electrodo de vidrio porque este electrodo tiene una impedancia que es un millón de veces mayor que la impedancia de entrada del amplificador operacional LM324 (que se usa como base en la construcción electrónica del equipo). Entonces, para hacer las potenciometrías se usan electrodos indicadores que establezcan equilibrios ácido-base y de esa manera se hace el seguimiento del pH a través de la ecuación de Nernst. Se usa el software Applet Circuit Simulator para simular cada circuito y verificar que funcione adecuadamente.
En el caso de las pruebas del potenciómetro, se usa soldadura de estaño-plomo (aleación 50/50) como un electrodo indicador en lugar de un electrodo selectivo a protón (pH) porque este último es costoso, requiere mantenimiento y muchos cuidados al utilizarse, pero principalmente por la dificultad impuesta para el equipo debido a su alta impedancia. El potenciómetro construido es capaz de realizar cualquier determinación del potencial de una celda galvánica mientras la impedancia total de sistema sea menor a 106 Ω, y esto ocurre para cualquier electrodo de primera y segunda clase, como es el caso de los metales y sus aleaciones. Se aprovecha que la soldadura es un material de fácil acceso que no requiere demasiadas precauciones al manipularse. Además, brinda un ejemplo poco común del uso de una aleación para monitorear el pH en un rango determinado, dejando ver que la potenciometría no está limitada a sistemas con electrodos puros.
Las reacciones de interés son las del estaño y plomo en agua, que se pueden expresar en función del pH a través de sus ecuaciones de Nernst, como se muestra en las ecuaciones de la 1 a la 4.
Para asegurar que en la aleación de Sn-Pb se presenten los óxidos metálicos respectivos, se le sometió al siguiente tratamiento: se lijó y enjuagó con agua desionizada, y posteriormente se le realizó una electrooxidación a +0.5V en buffer de pH 7 por 60 segundos. Este tratamiento forma una capa de color blanco sobre el electrodo. Esta selección de condiciones se corresponde con el voltamperograma mostrado en la figura 2, donde en la región denotada como (1 y 2) se observa la formación de los óxidos. Entonces, se puede proponer que la concentración de las especies oxidadas y reducidas involucradas en las ecuaciones de reacción 1 y 3 son constantes, por lo que el potencial de la semicelda es una función únicamente del pH, como se señala en las ecuaciones 2 y 4. Además, Kuhmann y colaboradores (1998), señalan que es el óxido de estaño quien predomina en aleaciones del tipo Pb-Sn, protegiendo la superficie de la aleación. Así, se puede simplificar el análisis considerando que es el SnO2 quien establece el potencial.
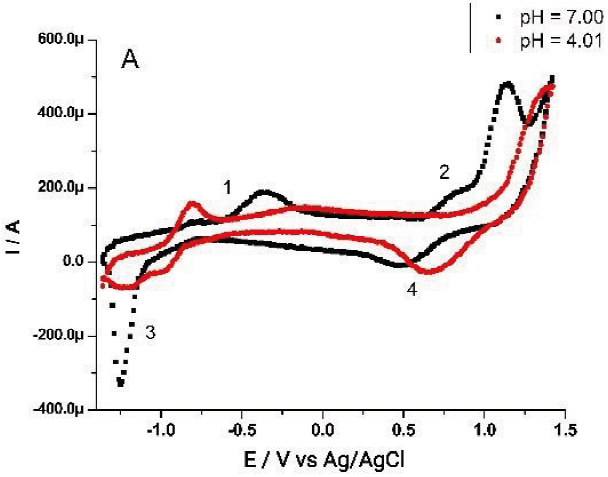
Figura 2 Voltamperometría cíclica obtenida de un electrodo de trabajo de Sn-Pb (50:50) en disoluciones buffer de pH 7.00 (fosfatos) y pH 4.01 (ftalatos). A velocidad de barrido de 20 mVs-1. Los voltamperogramas son obtenidos con uno de los equipos construidos.
Para muchos electrodos metálicos existe linealidad entre la respuesta del potencial con la concentración de H+ (Kurzweil, 2009). Para este caso, como el electrodo contiene una mezcla de Sn-Pb, se asegura la linealidad de la relación E - [H+] en un intervalo limitado de pH en donde se pueden considerar los equilibrios que se proponen para los óxidos metálicos, como se muestra en el voltamperograma de la Figura 2 para pH entre 7 y 4. Se propone que, para valores más ácidos, el pH es impuesto por el equilibrio de Sn, porque el metal se pasiva en intervalo de pH de 1 a 12 (Lyon, 2010)
Se realizaron una serie de potenciometrías en soluciones de pH 0.46, 4.01 y 7.00, a valores de resolución digital en Arduino de 10 a 13 bits, usando un electrodo de calomel saturado como referencia.
En la figura 3 se pueden observar los resultados de las potenciometrías hechas en disoluciones de pH 0.46, 4.01 y 7.00 a una resolución de Arduino de 10 bits. En este caso se determinó que las medidas se pueden realizar sin necesidad de aumentar la resolución. Las potenciometrías directas son técnicas de análisis muy sensibles, y en este caso la escala es lo suficientemente grande como para que la influencia del ruido no sea perceptible. La figura 3 muestra que existe una relación lineal entre la diferencia de potencial promedio y el valor de pH de las disoluciones. Una regresión lineal produce una pendiente de -33.4 mV y un valor R2 de 0.997. La respuesta obtenida mantiene la linealidad esperada, y esto asegura el funcionamiento correcto del potenciómetro.
Potenciostato
La celda electroquímica que se usa para investigar los fenómenos de interfase está compuesta por tres electrodos, y la parte que interesa ocurre en el electrodo de trabajo. El potenciostato debe aplicar una señal al transductor (electrodo) para obtener una respuesta. De esta manera se diseña el equipo de análisis electroquímico de acuerdo con la Figura 4. Para asegurar que la relación señal/ruido sea muy alta, y que los datos obtenidos sean de calidad, se utiliza el sobremuestreo (bloque CBB-E). Esto permite una reducción del ruido en la señal, un aumento digital de la resolución, una velocidad fija de adquisición de datos y la cantidad adecuada de datos (Laude, 2012). Para conseguir el sobremuestreo, se utiliza una resolución digital en Arduino de 12 bits. El potenciostato se controla a través de un pequeño menú en el monitor serial del programa Arduino IDE. Ahí mismo se obtienen los datos de los experimentos en formato de texto y se transfieren a una hoja de cálculo de Excel.
En su función de potenciostato, el equipo se validó para la voltamperometría cíclica y la cronoamperometría. Se utilizó un arreglo de 3 electrodos, con electrodo de trabajo de carbón vítreo con disco de 3 mm de diámetro; un electrodo de Ag/AgCl como referencia; y un electrodo auxiliar de alambre de platino. Para minimizar la caída óhmica (Artisan Technology Group, 2022), se hizo uso de un microelectrodo, se adicionó KCl al 0.1 M como electrolito soporte y se usó una microcelda donde los electrodos estaban lo más cerca posible (Figura 5).

Figura 5 Se muestra una microcelda para análisis electroquímico de tres electrodos: electrodo de trabajo de carbón vítreo; electrodo de referencia de Ag/AgCl; y electrodo auxiliar de alambre de platino, montados en una celda desechable de espectrofotómetro.
Se usó una disolución 9 mM de K3[Fe(CN)6] en 0.1 M de KCl, para la determinación del valor del coeficiente de difusión, que es un parámetro cinético cuyo valor es ampliamente conocido para esta sal y tiene un valor reportado en la literatura de 7.26 ×10-6 cm2s-1 (Konopka, 1970). La reacción redox que se estudia se muestra en la ecuación 5.
En el caso de la voltamperometría cíclica, los experimentos se realizaron a velocidades de barrido de 20, 50, 100, 200 y 300 mV/s, utilizando sobremuestreo de 12 bits ya que en esta resolución digital se percibe una menor influencia del ruido en las medidas. El potencial a circuito abierto se mide con un multímetro convencional y se establece el potencial de inicio como 0.6 vs Ag/AgCl. Se empieza con un barrido catódico para reducir el Fe(III) a Fe(II).
Con los voltamperogramas obtenidos, que se muestran en la figura 6A, se calculó el coeficiente de difusión del ferricianuro de potasio a partir de la ecuación 6, de Randles-Sevick (Bard, 2001).

Figura 6 A) Voltamperometrías cíclicas realizadas en un intervalo de velocidades de barrido entre 20 y 300 mVs-1 en una disolución 9 mM de K3[Fe(CN)6] en 0.1 M KCl, con electrodo de trabajo de carbón vítreo, electrodo de referencia de Ag/AgCl saturado, y contraelectrodo de alambre de Pt, entre -0.5 a +1 V, con el protocolo de sobremuestreo en el potenciostato base Arduino. El potencial inicial es +0.6 V y la flecha horizontal indica el sentido del barrido. B) Gráfica y ajuste lineal de corrientes pico (IP) de A, en función de la velocidad de barrido de potencial al cuadrado (v 1/2).
Donde IP es la corriente pico, v es la velocidad de barrido del potencial, C es la concentración de ferricianuro, A es el área geométrica del electrodo, D es el coeficiente de difusión, n es el número de electrones intercambiados para la reacción, y 2.69x105 es una constante a 25°C.
Para la determinación de D, se estiman las IP y se grafican contra v 1/2 (Figura 6B). Las corrientes pico se analizan con el software eL-Chem view (Hrbac et al, 2014). Se obtuvo un valor de coeficiente de difusión de 3.5x10-6 cm2/s, el cual se encuentra dentro del rango reportado en la literatura (Konopka, 1970; Ameur, 2013).
Para la cronoamperometría, se configura el potencial impuesto a -0.4 V con respecto a Ag/AgCl, por un periodo de 5 segundos, muestreando la corriente cada 100 ms. En la figura 7A se presenta el cronoamperograma de K3[Fe(CN)6] en 0.1 M de KCl obtenido con esta configuración.

Figura 7 A) Cronoamperometría realizada en una disolución 9 mM de K3[Fe(CN)6] y 0.1 M de KCl, con electrodo de trabajo de carbón vítreo, electrodo de referencia de Ag/AgCl saturado, y contraelectrodo de alambre de Pt, con el protocolo de sobremuestreo en el potenciostato base Arduino. Un potencial impuesto de -0.4 V con respecto a la referencia Ag/AgCl, por un periodo de 5 segundos muestreando la corriente cada 100 ms. B) Gráfica y regresión lineal de la corriente (I) de A, vs la raíz cuadrada del tiempo (t-1/2).
Para obtener el coeficiente de difusión se ocupa la ecuación 7, de Cottrell (Bard, 2001), a partir de la regresión lineal de la gráfica I vs t-1/2 mostrada en la figura 7B.
Donde n es el número de electrones intercambiados en la reacción, F es la constante de Faraday, A es el área geométrica del electrodo, C es la concentración de la especie electroactiva, y t es el tiempo.
El coeficiente de difusión resulta de 7.28×10-6 cm2/s para K3[Fe(CN)6], valor que se encuentra en concordancia para el reportado de 7.26 × 10-6 cm2s-1 para esta técnica (Konopka, 1970). Las discrepancias entre los valores de los coeficientes de difusión obtenidos mediante la cronoamperometría (7.28 × 10-6 cm2/s) y la voltamperometría cíclica (3.5 × 10-6 cm2/s) están asociadas a la naturaleza de los errores experimentales de cada técnica (Ameur, 2013).
Construcción desde casa de potenciostatos base Arduino.
El método CBB que se propone permitió que varios estudiantes de pregrado involucrados en el proyecto construyeran los equipos de análisis electroquímico base Arduino desde sus casas durante el confinamiento provocado por la pandemia. Se les proporcionaron kits de construcción que se llevaron a su casa, y sin complicarse demasiado en conocimientos profundos de áreas como la electrónica y electricidad, pudieron aproximarse al entendimiento de su funcionamiento a partir del uso de simulaciones y con el apoyo de breves asesorías a distancia.
Los equipos resultan ser baratos respecto a un equipo comercial, pues el costo total de los componentes no supera los 30 dólares.
Uso del potenciostato base Arduino en el aula.
En la clase de Electroquímica se propone a los estudiantes un trabajo en equipo, donde el problema es desarrollar una pila hecha con materiales caseros. Se realizó una prueba piloto del uso en el aula de un potenciostato base Arduino (en desarrollo inicial), durante los semestres 2020-1 y 2020-2. El par de electrodos más escogido en las celdas propuestas por los equipos fue un trozo de lata de aluminio como ánodo, y grafito de una mina de lápiz como cátodo. De los veintisiete proyectos participantes en el sondeo, once de ellos involucraron la oxidación de aluminio en el ánodo, y la reducción del ion hidronio en la superficie de un cátodo de grafito. A partir de esta primera experiencia, un estudiante de pregrado de la asignatura de Trabajo de Investigación de la carrera de Química realizó la investigación de lápices de grafito usados como electrodos en la reducción del protón en medio ácido acético. El estudiante pudo utilizar de manera exitosa el equipo electroquímico base Arduino en su casa durante el semestre 2021-1, que estuvimos ya confinados debido a la pandemia.
Voltamperometría lineal de barrido catódico con lápices de grafito.
A continuación, se muestra un ejemplo de uso del equipo electroquímico base Arduino con resultados para la investigación de lápices de grafito usados como electrodos en la reducción del protón en medio ácido acético. El estudiante de pregrado propone su hipótesis de estudio: El electrodo de mayor proporción de grafito y mayor porosidad, es decir, el más blando, resultará poseer los mejores parámetros cinéticos. En primer lugar, porque la presencia de grafito incrementa la conductividad del electrodo y en segundo, porque la alta porosidad de un electrodo se relaciona con una mayor cantidad de sitios activos por unidad de área para el intercambio electrónico.
Para investigarlo, propone el siguiente esquema experimental: en un frasco de vidrio de 25 mL se adicionó vinagre blanco Clemente Jacques ® (acidez total reportada como ácido acético al 5%) suficiente como para sumergir en su totalidad la superficie descubierta de la lámina de grafito. Como electrodo auxiliar se empleó una lámina de grafito 6B y como electrodo de referencia un sistema del tipo Cu/CuSO4(sobresaturado), a un pH de 3.18. El área de cada electrodo de trabajo de grafito se reporta en la Tabla 1, el resto de la superficie se cubrió con silicón caliente, a excepción de un tramo terminal suficientemente amplio que permaneció al exterior de la celda para hacer contacto con la conexión del potenciostato. Se utilizó un potenciostato base Arduino. Se realizó una voltamperometría lineal con barrido catódico, con sobrepotencial de 0 a -0.7 V vs Cu/CuSO4(sobresaturado), a 50 mVs-1, por triplicado para cada una de las láminas de lápiz (Figura 8). Todas las mediciones fueron realizadas bajo régimen de difusión pura. Se analiza el proceso de reducción de H+, de acuerdo con la ecuación 8, en cinco distintos tipos de láminas de grafito: 6H, 3H, H, 3B y 6B de la marca Prismacolor®, línea Turquoise.

Figura 8 A) Curvas de polarización de barrido catódico de las distintas láminas de grafito: H, 3H, 6H, 3B y 6B, en vinagre blanco (ácido acético al 5% v/v en agua). Electrodo auxiliar lápiz 6B. Con una velocidad de barrido de 50 mVs-1, T=293.15 K, sin agitación. B) Gráfica de Tafel y regresión lineal para el electrodo de grafito 3H.
De manera general, los lápices B tienen más grafito que los lápices H, y entre mayor es el número en la clasificación, más blando es el material. Tanto la dureza como la porosidad influyen en las propiedades cinéticas de los electrodos de grafito. Los resultados de la voltamperometría lineal de barrido catódico se muestran en la Figura 8A, en ellos se observa que el material con menor sobrepotencial para la reducción del protón es el lápiz H, mientras que los lápices 3B y 6B (que contiene mayor proporción de grafito, y son más blandos) presenta el mayor sobrepotencial.
A partir de los datos de las curvas de polarización de la Figura 8A, se realizaron curvas de Tafel (ecuación 9), expresadas como una ecuación lineal de acuerdo con la ecuación 10, para determinar
Donde j es densidad de corriente (I/A; intensidad de corriente entre área geométrica del electrodo), η es el sobrepotencial, b es la pendiente, y
De acuerdo con los resultados de obtenidos y mostrados en la Tabla 1, el mejor electrocatalizador de entre los electrodos de grafito analizados para la reducción del ácido acético, no es aquel que posee una mayor proporción de grafito ni el que tiene mayor porosidad. El lápiz 3H es el material con menor sobrepotencial para la reducción del protón y posee la mayor densidad de corriente de intercambio (j0), lo que implica que se trata del electrodo más eficiente para dicha reacción.
Tabla 1. Área geométrica de la superficie para cada electrodo de trabajo de grafito (H, 3H, 6H, 3B y 6B), potencial de equilibrio (Eeq), densidad de corriente de intercambio al equilibrio
| Lápiz | Área Geométrica (cm2) |
Eeq [V vs Cu/CuSO4sobresat] |
j0 [μAcm-2] |
|---|---|---|---|
| 6H | 0.0299 | -0.82 | 0.361 |
| 3H | 0.0274 | -0.44 | 0.389 |
| H | 0.0304 | -0.67 | 0.477 |
| 3B | 0.0691 | -0.31 | 0.176 |
| 6B | 0.0677 | -0.31 | 0.278 |
Conclusiones
Se desarrolló un equipo de análisis electroquímico base Arduino de bajo costo, a partir de un proceso de construcción en bloques (CBB), que se verifica mediante simulaciones electrónicas. Para validar el funcionamiento del potenciómetro, se ocupó un electrodo de aleación Sn-Pb, que funciona adecuadamente para el intervalo de pH de 0 a 7.
Se validó el equipo, en su función de potenciostato, a partir de la determinación del coeficiente de difusión para K3[Fe(CN)6], y se comprobó que funciona de manera adecuada para realizar experimentos de voltamperometría y cronoamperometría. Este equipo pudo ser construido por estudiantes, sin un entrenamiento formal de electrónica, de manera remota con el apoyo del uso de las simulaciones y breves asesorías a distancia.
Para mostrar un ejemplo de uso del equipo de bajo costo de análisis electroquímico base Arduino, un estudiante de pregrado desarrolló un protocolo para investigar la cinética de la reducción de H+, en medio ácido acético, usando varios lápices de grafito. El equipo pudo ser utilizado exitosamente para hacer esta investigación desde casa, durante el periodo de confinamiento, usando materiales caseros Esta propuesta puede trasladarse fácilmente a cursos experimentales para laboratorios de bajo costo.











 nueva página del texto (beta)
nueva página del texto (beta)