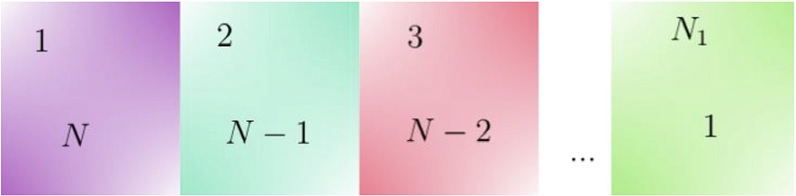Introducción
La actualización e incorporación de contenidos bibliográficos didácticos a cursos relacionados con la fisicoquímica de superficies (Novelo-Torres, M., et al, 2003; Novelo-Torres, M., et al, 2005; Viades-Trejo, et al, 2007; Sandoval-Ibarra, et al, 2015; Alanis-Garcia, et al, 2018), y con la termodinámica de mezclas (Novelo-Torres, M., et al, 2010; Duque-Vega, et al, 2015) que se han publicado en esta revista, Educación Química, a lo largo de los años, producto de nuestra experiencia docente, nos han permitido: i) contar con material en español, actualizado y disponible para nuestros estudiantes de diversas carreras de acuerdo al temario oficial, ii) tener material didáctico de apoyo en caso de requerir un refuerzo a los conocimientos, empleando la nomenclatura convenida, que no siempre se encuentra disponible en la bibliografía convencional de los cursos, iii) inducir a los alumnos a la búsqueda de bibliografía más especializada (libros, artículos de investigación, y tesis de diversos niveles) de acuerdo a cada tema y, iv) tener material de divulgación de temas obligatorios por el temario oficial pero, empleando mecanismos y visiones no tradicionales, con el fin de facilitar su comprensión. En ese sentido, el estudio de la estabilidad termodinámica de mezclas líquidas binarias en los cursos básicos de fisicoquímica a nivel licenciatura no se aborda, a excepción del modelo de mezclas ideales (Castellan, 1983; Levin, 2011; Engel et al, 2013), y del caso de mezclas poliméricas, en cursos más avanzados (Denbigh,1981; Prausnitz et al, 2000) empleando modelos como el de Flory-Huggins o haciendo uso de los coeficientes de actividad. Sin embargo, la pregunta sobre en qué circunstancias dos líquidos simples se mezclan y bajo cuáles casos no, prevalece y, responderla, empleando un modelo no ideal resultaría ilustrativo, enriquecedor y abriría la discusión sobre otros modelos más refinados, siendo también útil como texto introductorio para asignaturas como Termodinámica estadística. Adicionalmente, en el desarrollo de este modelo, se requieren diversas herramientas conceptuales de cursos de física básica que aquí son integradas y cuyo contenido se ha revisado en otros cursos del mismo nivel, por ejemplo, el empleo de una función de energía potencial, que es un tema estudiado en los primeros cursos de Mecánica Clásica de nivel licenciatura.
En este trabajo se propone el uso de un solo parámetro (A) en la función de energía libre de mezclado (ΔG mz ) para un sistema binario líquido-líquido. Empleando: i) el parámetro A, que contiene información sobre la interacción entre dos especies químicas iguales o distintas (A proviene del tipo más simple de interacción supramolecular por pares en la mezcla), ii) la configuración de especies químicas participantes por pares, es decir resultado de las combinaciones de n elementos tomados de dos en dos y, iii) la definición de la entropía propuesta por Boltzmann, es posible llegar a expresiones termodinámicas útiles, que pueden ser empleadas para la interpretación de datos experimentales. El modelo que se presenta en este trabajo considera a las fases condensadas, en este caso a los líquidos, como sistemas formados por partículas distribuidas en una malla. En esta representación se toman en cuenta únicamente contribuciones configuracionales en el sistema para el estudio microscópico del proceso de mezclado.
El interés del estudio de la estabilidad termodinámica de mezclas abarca campos como la formulación y manufactura de productos farmacéuticos, productos alimenticios, industriales, cosméticos etc., debido a que, en todos estos casos, la formulación de artículos que se requieran mezclas líquidas estables es imprescindible evitar la segregación en dos fases, ya que perderían su utilidad o beneficio. También, en procesos de separación por extracción líquido-líquido, común en la industria, cuando terceros componentes migran de forma selectiva de una fase líquida a otra.
Desarrollo
Cuando dos líquidos puros entran en contacto a la misma temperatura y presión, encontramos dos posibles escenarios: los líquidos se mezclan en todas proporciones formando una sola fase líquida homogénea o segregan formando dos fases líquidas; cada una de ellas homogénea o bien, mutuamente saturada. En el caso de la mutua saturación, la fase superior contiene mayoritariamente uno de los componentes mientras que la fase inferior contiene mayoritariamente al otro componente; cada una de las dos fases es homogénea con composición fija o de equilibrio con iguales temperatura y presión. Supongamos que, dadas la temperatura, T y la presión p, un líquido A que contiene N A moléculas se mezcla con un líquido B, con N B moléculas. La situación más simple de interacción entre moléculas es la formación de pares entre ellas. Los pares posibles en una mezcla binaria son de tres tipos: los pares de la primera especie consigo misma, los pares de la segunda especie consigo misma y los pares entre especies diferentes. Bajo este modelo, se intuye que el proceso de mezclado está favorecido cuando existen más interacciones y de mayor intensidad entre pares distintos. El proceso de segregación en dos fases implicaría un escenario contrario.
Antes de discutir cómo interactúan estos pares de partículas, primero es necesario establecer el conteo de número de pares, dado que se conoce tanto el número total de partículas y así como el número de partículas de cada especie. Con este fin, considérese un número reducido de partículas distinguibles (etiquetables) digamos cinco; marcadas como A, B, C, D, y E. Nos preguntamos sobre el número total de pares posibles a formar, para lo cual tomaremos dos celdas contiguas (Figura 1), donde en una primera celda colocamos cualesquiera de las cinco partículas y una vez seleccionado el primer compartimento, para el segundo sólo tendremos cuatro alternativas.

Figura 1 Pares de partículas formados a partir de 5 partículas distinguibles. El cinco debajo del cubo verde indica que de este primer conjunto se puede tomar cualquiera de sus cinco elementos; para el segundo conjunto sólo es posible tomar cuatro.
El número de pares totales, como se aprecia en la Figura 1, es 5 * 4 pero, como el par (i,j) es el mismo que el par (j,i), el número total de pares distintos será
De esta manera, el número total de pares de la primera especie con N A partículas es
De la misma forma para las N B partículas de la segunda especie
Como N A y N B son muy grandes, entonces (N A − 1) ≃ N A y (N B − 1) ≃ N B , por lo que las expresiones (2) y (3) se simplifican a
El número de pares en la mezcla de las dos especies (N A + N B = N), bajo los mismos argumentos es
El estado inicial (antes del mezclado) es el de los dos líquidos puros y el número de pares están indicados en las ecuaciones (3) y (4); una vez en contacto, el estado final y los pares correspondientes están dados por la ecuación (5.1). Las diferencias entre estado final e inicial, corresponde a la diferencia de la ec. (5.1) menos la ec. (4).
La ec. (6), es el número de pares (i, j), donde i es un elemento del conjunto de partículas del líquido A, y j un elemento del conjunto de partículas del líquido B, formados en el proceso de mezclado.
La formación de pares moleculares es el resultado de la interacción entre partículas mediada por la función de energía potencial entre ellas; este ordenamiento molecular compite con un mecanismo paralelo: la agitación térmica2, que se opone a la formación de estructura. Esta energía termo-cinética es la responsable de la no estructura y el azar molecular, donde ocurren todos los posibles arreglos en una mezcla líquida compuesta por N A partículas de una especie y N B partículas de una segunda especie.
Entropía de mezclado
Es posible extender el procedimiento de contar los pares posibles a partir de N partículas, para contar el número de subconjuntos posibles de tamaño N A a formar, partiendo de N partículas disponibles. El problema del cálculo de pares, extendido a N A partículas, se reduce a N A posiciones donde se puede instalar N partículas.
En la posición 1, podemos instalar una de las N partículas, en la posición dos N − 1 partículas y en la posición 3, N − 2 partículas, así hasta que en la posición N A , restan N − (N A − 1) partículas y entonces el número de arreglos es como
Sabiendo que N − N A = N B entonces al multiplicar y dividir la ec. (7) por N B ! obtenemos que
Al dividir por N A ! arreglos obtenemos
al dividir por N A !, se cancela el orden ya que el número de arreglos de N A partículas en N A posiciones es N A !, como se ilustra en la Figura 3.
La ec (9) representa el número de combinaciones de N partículas formadas de N A en N A o de N B en N B subconjuntos. De acuerdo con Boltzmann, la ec. (9) está relacionada con la entropía del sistema de acuerdo con
Donde S es la entropía, k la constante de Boltzmann y Ω total 3 el número de microestados accesibles al sistema consistentes con las restricciones de este mismo. En este caso, Ω es la ec. (9).
Tomando el logaritmo natural de 9 se tiene que
Mediante la aproximación de Stirling4, se tiene que para la ec. (11)
Sustituyendo las ecs. (12, 13, 14) en la ec (10)
Donde, ∆S mz conf representa el cambio en la entropía configuracional del sistema. S 1 y S 2 son cero debido a que para el estado formado únicamente por partículas de A ó B, sólo se tiene una única configuración del sistema, entonces
Dado que la fracción mol
Nótese que la ∆S mz es independiente de la temperatura, lo cual es consecuencia de haber asumido un modelo puramente configuracional y coincide con el cambio de entropía de una mezcla ideal. Para un mol total de mezcla, recordando que R = kN A , la ec. (17), adquiere la forma
Energía de interacción
Hasta aquí, sólo se ha cuantificado de número de pares posibles entre moléculas iguales y distintas, así como calculado los arreglos al azar en una mezcla binaria, pero ¿Cuál es la cantidad de energía para que dos o más partículas se reúnan por efectos atractivo-repulsivos, a una distancia tal que adquieran condiciones de equilibrio? Para responder esta pregunta, considérese dos moléculas simples, esféricas y de tamaño similar. La energía potencial entre esas dos partículas, Γ, es una función de la distancia r que las separa. La fuerza de atracción-repulsión entre estas dos moléculas, F, está relacionada con la energía potencial Γ(r) entre ellas, por la ecuación
Donde Γ(r) es la energía asociada para establecer una configuración espacial determinada del sistema, en este caso, dada una distancia r. También se suele interpretar como la energía necesaria para trasladar una molécula A desde una distancia infinita a una posición r, de otra molécula B.
A distancias de varios diámetros moleculares, la fuerza entre partículas es atractiva (F < 0), mientras que a distancias cortas la fuerza de interacción es repulsiva (F > 0); a distancias muy grandes entre partículas la fuerza de interacción es nula (F = 0)
Es sobre el esquema anterior, que la energía potencial total se expresa como la suma de dos contribuciones
Donde Γ rep se refiere a la energía potencial repulsiva y Γ at a la energía potencial atractiva.
En un primer panorama, en el que las fuerzas operan entre moléculas, éstas dependen únicamente de la posición relativa r, entre ellas, entonces, la energía potencial total se puede escribir de manera simplificada como
Donde A y B son constantes.
Dentro de la familia de modelos con la estructura matemática de la ec. (21), conocidos como Poteciales de Mie, el potencial de Lennard-Jones (LJ) ec. (22), es el más empleado (Figura 5)

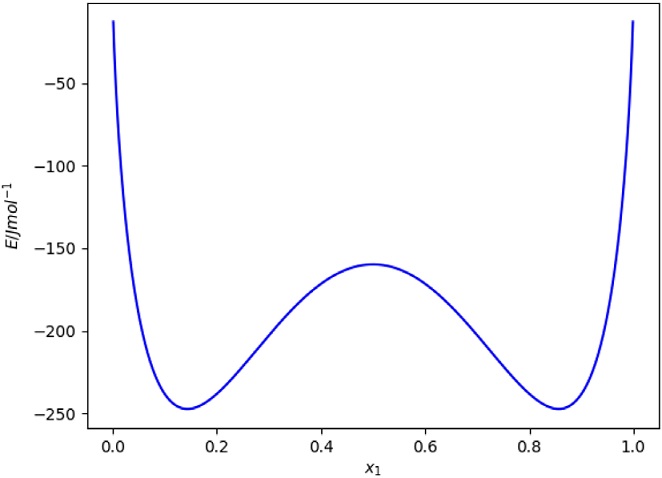
Figura 4 Gráfica de la ec. (18) en función de la fracción mol de uno de los componentes. Nótese que tiene un máximo cuando se mezclan al 50% de cada componente en fracción mol.
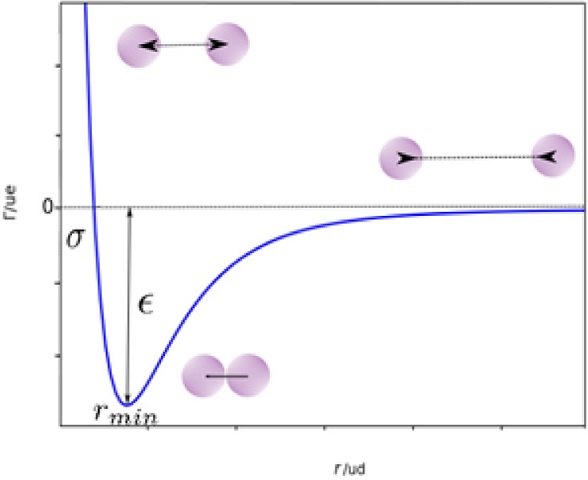
Figura 5 Gráfica de la ec. (21), representa un potencial típico de LJ. Las esferas de color magenta representan dos partículas; en el mínimo de la función existe un balance atractivo-repulsivo. ue : unidades de energía, ud: unidades de distancia.
La ec. (22) en la gráfica (Figura 5) presenta un mínimo en el punto (r min , ε); Γ min es la distancia o posición donde se ubica el mínimo y ε la profundidad del pozo del potencial o energía mínima o de equilibrio entre las dos moléculas. Para valores mayores a r min , la derivada es positiva, en r min es cero y para valores menores a r min la derivada es negativa
Así, de acuerdo con la ecs. (23, 24 y 25), cuando r > r min , la fuerza es atractiva (F < 0) mientras que para r < r min , la fuerza de interacción es repulsiva (F > 0); en r = r min , atracción-repulsión se compensan. Esta ecuación expresa que a distancias grandes se presenta atracción entre moléculas, mientras que a distancias cortas se repelen. Nótese que la distancia σ donde Γ(r) es cero, pero la fuerza es distinta de cero.
Entalpía de mezclado
Del conteo del número de pares posibles entre N A y N B moléculas ec. (7) ahora es posible calcular la contribución energética del proceso de mezcla debida a la formación de interacciones entre especies. Para facilitar cálculos posteriores consideremos que los volúmenes molares v 1 y v 2 son similares (esto lleva a que el volumen en exceso de la mezcla sea cero, y ΔV mz = 0), de modo que en términos de la entalpía de la mezcla se tiene que
Consideremos que la interacción entre moléculas sólo ocurre con los primeros vecinos en una red cuasi cristalina (malla) y, además, la molécula central se encuentra rodeada por z vecinos (Figura 6), entonces se tendrá tantos pares como primeros vecinos (típicamente entre 4 y 6 moléculas).

Figura 6 Molécula central A rodeada de seis moléculas y sus interacciones εij, i, j = A, B. En este caso z = 6.
Pensemos que la energía potencial entre las especies i, j = A, B está dada por la función Γ ij e interactúan con energía ε AA , ε AB y, ε AB es decir
donde r mez es la distancia entre las especies i, j en la mezcla. El cambio de energía potencial de la mezcla es
E mez corresponde a la energía neta de interacción entre todos los posibles pares formados en la mezcla y E A, puro y E B, puro son las energías de interacción en los líquidos puros.
Considérese la Figura 6. La energía ε mez tiene tres contribuciones: la energía de los pares A- B, los A-A y B-B, en la mezcla, que corresponden a ε AB , ε A, mez y ε B, mez, respectivamente. Cada uno de estos términos es proporcional al número de pares correspondiente P i,j , i, j = A, B.
y análogamente para ε A,mez y ε B,mez .
Para encontrar la cantidad de pares P
i,j
recuérdese las ecs. (4) y (7). La mezcla ocurre aleatoriamente de modo que, dada una molécula, como la mostrada en la Figura 6, la probabilidad de encontrar una molécula A en el sitio central es
Al aplicarse el mismo tratamiento a E A,mez , E B,mez , E A,puro y E B,puro se llega a las expresiones siguientes
Al sustituir las expresiones (35) en (30), tomando en cuenta las ecs. (31)-(33) se llega a que
Donde
El parámetro X es una cantidad que pone en competencia a dos términos: ε AB asociada a interacciones adhesivas, es decir, entre moléculas de distinta naturaleza química y los términos ε AA y ε BB , asociadas a interacciones cohesivas, interacciones de las especies químicas consigo mismas. La energía de interacción entre pares en la mezcla ec. (36) es proporcional a N A N B de acuerdo con la ec (7). Para estos procesos, ΔE = ΔU mz 5, entonces
Donde A = zX.
Nótese que la entalpía de la mezcla ec (38) es independiente de la temperatura.
Si A > 0, ΔH mz > 0 y se tiene un proceso endotérmico, lo cual se traduce que, en el estado de mezclado, la formación de interacciones entre especies distintas requiere suministro de energía; no es un fenómeno favorable bajo las condiciones establecidas. El caso contrario, A < 0, indica que la formación de interacciones entre especies distintas es favorable.
Energía libre de Gibbs de mezclado
Para el proceso de mezclado, la expresión de la energía libre de Gibbs de la mezcla (EGM) asociada es
Sustituyendo las ecs. (17 y 16.1) en la ec. (38) tenemos
o bien
Donde Δ mz g es la energía de Gibbs molar de mezclado.
Una disolución ideal es aquella donde la ΔG mz sólo tiene la contribución entrópica (ΔG mz ideal = −TΔS mz ), es decir, el proceso de mezclado ocurre sin intercambio de calor ni cambio de volumen. Recordando que
Entonces, el potencial químico del componente A, cuyas contribuciones sólo son entrópicas corresponde a
Por otro lado, el potencial químico del componente A para este modelo es
Nótese que la ec. (44) tiene un término adicional; A(1 − x A )2 . Sólo cuando A = 0, se recupera la ec. (43). Este término toma en cuenta al parámetro X , así como a los primeros vecinos, z y es proporcional a la fracción mol del segundo componente al cuadrado; de modo que cuando se tiene una solución de B en A diluida, salvo que el término |A| » 0, se tendría una disolución muy semejante a una disolución ideal.
A continuación, se va a analizar la forma de la función Δ mz , conocida también como diagrama de estabilidad termodinámica (DET), a partir de los principios de la termodinámica clásica para estudiar la solubilidad entre dos compuestos, dadas la T y la p.
La ec. (41) contiene una contribución entálpica y una contribución entrópica; la primera presenta una forma cóncava, mientras que la segunda convexa. La competencia de estas dos contribuciones genera dos tipos generales de comportamientos:
Una función negativa en todo el intervalo de composición y concavidad siempre convexa, lo cual indicaría solubilidad total (Figura 7).
Una función negativa en todo el intervalo de composición, pero con un máximo emergiendo en algún punto característico y por lo tanto, acompañada de dos mínimos (Figura 9). Como los mínimos representan valores menores en energía de mezclado, estos son estables y preferentes al máximo de la función. Estos mínimos representan las composiciones al equilibrio entre dos fases líquidas.

Figura 7 Δg mz en función de la fracción mol de alguno de sus componentes, cuando existe miscibilidad total a la temperatura T.
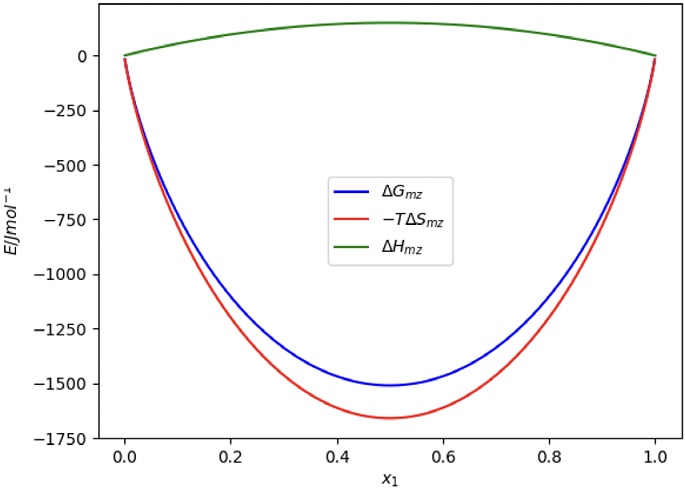
Figura 8 Contribuciones entálpica y entrópica a la EGM, en función de la fracción mol de algún componente. La ΔH mz es positiva (con A>0), mientras que la −TΔS mz es favorable (ΔS mz > 0).
De esta manera, la condición de solubilidad demanda no solo valores negativos en EGM, sino además que su segunda derivada sea positiva (convexa).
Estabilidad termodinámica de la mezcla a partir del análisis de la energía libre de mezclado
La característica del equilibrio estable es tal que el potencial termodinámico empleado para estudiar al sistema de interés se encuentre en un valor extremo, este caso
Sin embargo, la ec. (45) es una condición necesaria pero no suficiente de equilibrio estable. Para garantizar que ese extremo sea un mínimo debe cumplirse además que
para este sistema: (T, p, x j ) y las condiciones (45) y (46) son entonces
Aplicando la condición (47) a la ec. (41) se tiene que
y obteniendo la segunda derivada de (41)
donde se obtiene que
El sentido contrario de la desigualdad (51), indica la región de inestabilidad. Nótese que, para una disolución ideal, A=0, por consiguiente, dado que el lado derecho de la desigualdad (51) siempre es negativo, se concluye que, para ese modelo, no puede existir segregación de fases; una disolución ideal siempre es estable. Cuando A = 2kT, el valor más pequeño que satisface a (51), se tiene que la región de inestabilidad será cuando (Prausnitz, 2000)
En el caso donde A = 2kT , la temperatura T se denomina temperatura crítica de solubilidad (TCS) o temperatura consoluta T c .
Por debajo del valor A/2k, existirán dos fases líquidas estables, mutuamente saturadas, con determinadas composiciones cada una. Por arriba de A/2k, sólo existirá una sola fase líquida.
Cabe señalar que el signo y magnitud de A (determinado por X), juega un papel importante dentro de este modelo: i. cuando A » 0, indicativo de fuerzas intermoleculares cohesivas intensas, la temperatura T c , para logar una mezcla líquida homogénea es alta. El caso ideal y en el cual las interacciones adhesivas predominen, siempre se tendrá una sola fase líquida.
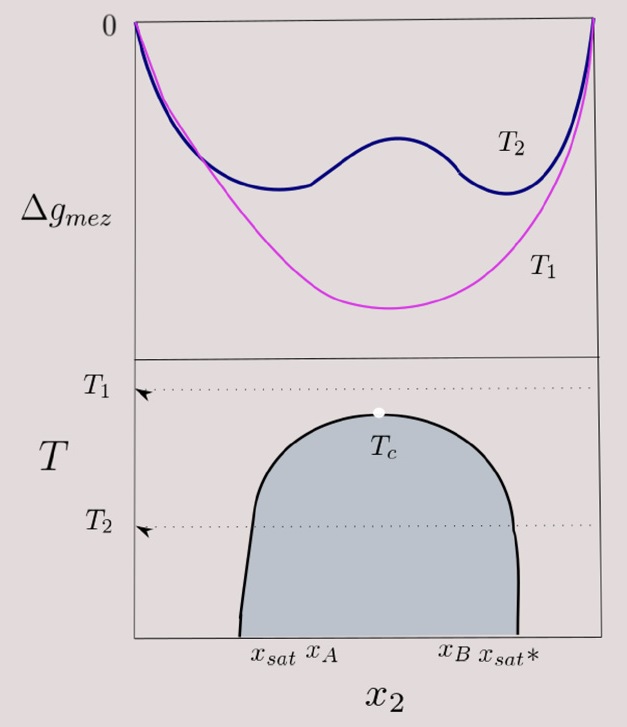
En la Figura 10 se muestra un sistema binario disolvente (1 − x 2) - soluto (x 2), i) diagrama de estabilidad termodinámica (parte superior) y, ii) diagrama de fases composición- temperatura (parte inferior) a dos temperaturas: T 1, T 2, con T 1 > T 2, en el se muestra la curva binoidal, que separa la región de una fase y la región de dos fases. El modelo desarrollado (ecs. (40) ó (41)) muestra la existencia de una temperatura máxima de solubilidad, llamada TCS, en este caso, superior, sin embargo, no es el único comportamiento observado en los sistemas reales pero sí presente en muchos de ellos. Por arriba de este punto crítico, e.g. a T 1, existe miscibilidad en todas proporciones de soluto y, el DET muestra que la EGM es convexa, es decir con valores de Δg mz < 0 y con segunda derivada positiva, (ec. (48)), indicando estabilidad termodinámica. Por otro lado, a T 2, debajo de la TCS superior, se tiene miscibilidad parcial, en el DET se observa un máximo, que indica inestabilidad de la mezcla como un solo líquido. En este caso, no todos los puntos de la curva de Δg mz tienen segunda derivada positiva, mostrando así problemas de estabilidad termodinámica, llevando a la segregación en dos fases líquidas; mutuamente saturadas con composiciones indicadas en el diagrama, x sat y x sat *, donde, una de ellas es principalmente disolvente con x sat cantidad de soluto y, la otra fase de soluto con x sat *.
Conclusiones
Se presenta un modelo de la energía libre de mezclado en mezclas binarias, a partir del cambio de la entropía configuracional de un sistema cuasicristaliano, cuantificando la formación de pares entre especies distintas, así como un modelo de interacción con energía constante entre los mismos, en condiciones isotérmicas e isométricas. Se muestran los dos tipos de comportamientos posibles para la energía libre de mezclado en términos de sus contribuciones entrópicas-entálpicas así como su representación en un diagrama de fases temperatura-composición.











 nueva página del texto (beta)
nueva página del texto (beta)