Para entender el premio Nobel de Química 2021 otorgado a Benjamin List y David W. C. MacMillan por la organocatálisis asimétrica, primero hay que explicar la parte de asimetría. En este sentido, habría que mencionar qué es la quiralidad. Ésta es una propiedad geométrica de los objetos en la cual la imagen de un objeto mostrada en un espejo no es superponible al objeto inicial. Por ejemplo, una silla no es quiral porque su reflejo se puede empalmar a la silla inicial respaldo con respaldo y las cuatro patas quedan en el mismo lugar. Por el contrario, una mano es quiral ya que la mano derecha en el espejo nos refleja la mano izquierda y colocando palma con palma, dorso con dorso, los pulgares y demás dedos quedan en sentido opuesto. En las moléculas orgánicas la forma más común de quiralidad es cuando se tiene un carbono tetravalente con cuatro sustituyentes diferentes, a este par de moléculas quirales se les denomina enantiómeros. El construir moléculas es un arte difícil y adicionalmente generar moléculas que tienen la misma constitución, conectividad y solo difieren por ser imágenes especulares no superponibles es complicado. Esta rama de la química orgánica se le conoce como síntesis asimétrica o síntesis estereoselectiva. Para conseguir la obtención de un nuevo estereocentro se consigue si la materia prima es quiral o un catalizador quiral lleva a cabo la transformación, cabe mencionar que la síntesis asimétrica que se realiza con catalizadores metálicos fue premiada con el premio Nobel en Química en el 2001.
Existen 4 tipos de catalizadores según su naturaleza. El primer tipo lo constituyen las superficies de minerales o metálicas. En particular, las metálicas puede que sean lo primero que viene a la mente por su presencia en el convertidor catalítico de un coche o porque sean de las primeras reacciones en cursos de química orgánica como lo son la reducción de alquenos a alcanos por hidrógeno y paladio. La segunda clase de catalizadores son los compuestos de coordinación de metales, los cuales pueden otorgar la química propia del metal, mientras que el ligando orgánico regula su reactividad y selectividad. Además, al ser una reacción homogénea requiere menor cantidad del metal. La tercera clase son las enzimas, que son macromoléculas en su mayoría constituidas de proteínas que funcionan como catalizadores en seres vivos. Resulta interesante que sólo una tercera o cuarta parte de las enzimas tienen metales en su sitio activo por lo que la naturaleza no requiere metales para llevar a cabo muchas transformaciones. Finalmente, el cuarto tipo de sistemas son los organocatalizadores los cuales son moléculas orgánicas pequeñas que sirven para acelerar transformaciones orgánicas (MacMillan, 2008). Cabe mencionar al lector los artículos en revistas de iberoamérica de libre acceso sobre organocatálisis por Alemán y Cabrera, 2009, Marqués-López y Herrera, 2009 y Juaristi 2011 para profundizar en temas particulares.
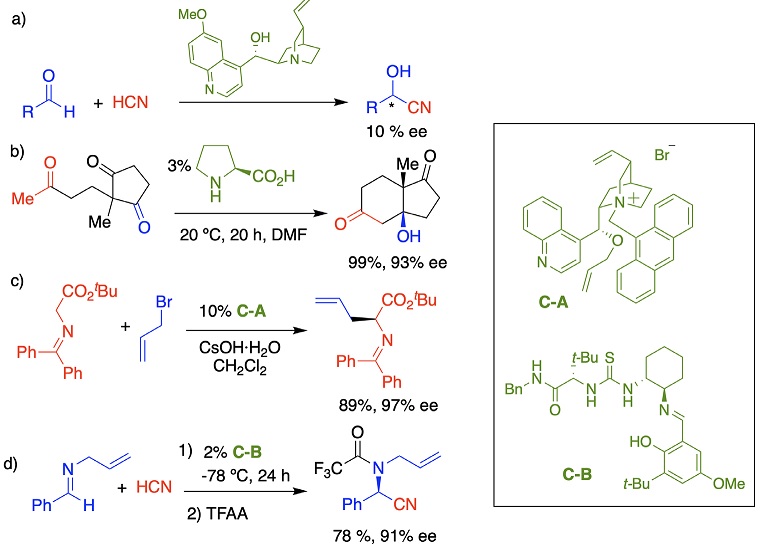
El desarrollo de estos catalizadores orgánicos es de reciente creación comparada con los otros tipos de catálisis. La organocatálisis empieza formalmente en el año 2000, a partir de dos artículos de los ganadores del premio Nobel en Química 2021. Antes de estos trabajos ya había reportes de moléculas orgánicas que catalizaran reacciones de manera enantioselectiva. El primero de ellos por Bredig y Fiske en 1912 sobre la adición de ácido cianhídrico a aldehídos promovida por alcaloides (Figura 1a). En 1960, Pracejus igualmente con alcaloides realizó la adición selectiva de metanol a fenilmetilcetena. Tal vez la reacción más representativa de esa época sea la reacción aldólica intramolecular catalizada por prolina, la cual fue reportada por dos grupos de manera independiente en los setenta conocida ahora como la reacción de Hajos-Parrish-Eder-Sauer- Wiechert (Figura 1b). En esos reportes se pensaban como curiosidades científicas las cuales ocurren de manera particular y no se extrapoló como una forma general de llevar a cabo las reacciones. En la segunda mitad de la década de los noventa hay varios reportes con muy buena enantioselectividad con catalizadores orgánicos como es la epoxidación enantioselectiva utilizando el acetónido de la fructosa como catalizador. Esta reacción se le conoce como la epoxidación de Shi. Por otro lado, Corey explora sales cuaternarias de amonio como agentes de transferencia de fase para la alquilación enantioselectiva (Figura 1c). Miller estudia péptidos artificiales de pocos aminoácidos capaces de tener funciones catalíticas y Jacobsen publica la reacción de Strecker catalizada por enlaces de hidrógeno (Figura 1d).
A continuación, se describen los trabajos del año 2000 que empezaron formalmente la organocatálisis, su conceptualización y generalización. Benjamin List concluyó su postdoctorado en los grupos de Barbas III y Lerner, donde trabajaban con anticuerpos de aldolasa que catatalizaban reacciones de condensación aldólica mediante la activación de grupos carbonilo vía enamina. Una vez contratado en The Scripps Research Institute como profesor asistente, su primer artículo (List, 2000) fue investigar la reacción aldólica ya no con una proteína, sino con un solo aminoácido. El encontró que todos los aminoácidos con una amina primaria no funcionaron, pero con aminas secundarias que forman anillos de pirrolidina sí procedía la reacción. En particular, la prolina que es uno de los 20 aminoácidos proteinogénicos dio muy buen resultado (Figura 2).
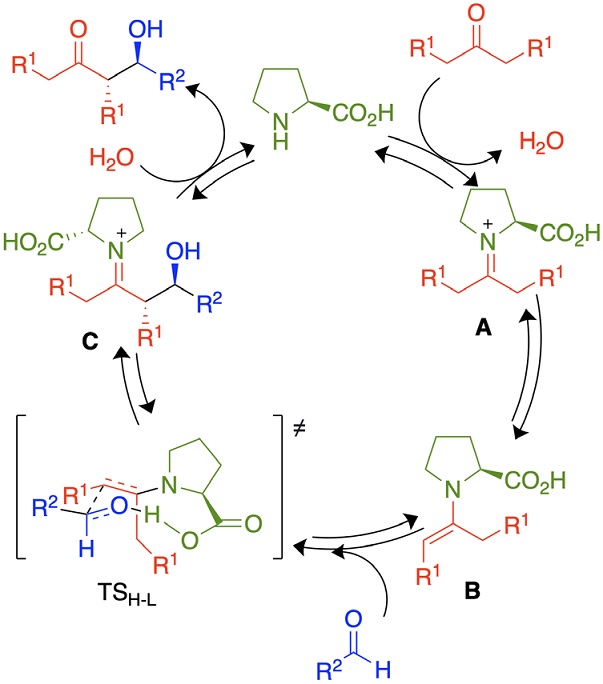
En la Figura 3 se muestra el mecanismo de reacción para la reacción aldólica con una cetona acíclica y un aldehído. El primer paso que ocurre es la condensación de la amina con la cetona formando el iminio A. La tautomerización a la enamina B genera la especie reactiva nucleofílica con un HOMO de mayor energía por la conjugación del par libre del nitrógeno con el doble enlace. De esta manera, en un estado de transición cíclico Houk-List TSH-L donde el ácido forma un enlace de hidrógeno con el carbonilo del aldehído se forma el enlace carbonocarbono obteniendo el intermediario C, el cual se hidroliza para liberar el aldol y la prolina.
Es interesante que, aunque por muchos años ya existía la versión intramolecular de la reacción aldólica catalizada por prolina, nunca se pensó en extrapolarlo en un mecanismo general para funcionalizar en posición alfa a carbonilos por un mecanismo enamina. Posterior al reporte de List se explotó este concepto al emplear otros electrófilos generando nuevas reacciones estereoselectivas. Para formar enlaces carbono-carbono se pueden usar aldehídos obteniendo aldoles como 1, iminas formadas in situ conducen, por una reacción de Mannich, a la formación de aminocetonas 2 y con aceptores de Michael los aductos 3. Adicionalmente, se pueden formar enlaces carbono-heteroátomo con azodicarboxilatos para obtener los compuestos 4 y 5, los cuales pueden derivarse a aminoalcoholes y con nitrosobenceno se pueden hidroxilar los compuestos una vez reducido el enlace O-N de 6 y 7 (Figura 4).
Por otro lado, D. W. C. Macmillan realizó su postdoctorado con David Evans en Harvard estudiando reacciones enantioselectivas con complejos de estaño donde se dio cuenta que muchas de estas reacciones, aunque son muy selectivas, son operacionalmente difíciles ya que se necesita excluir el agua de ellas y en algunos casos hasta trabajar en una caja de guantes. Al comenzar su carrera de investigador independiente en la Universidad de California en Berkeley su segundo artículo trató sobre la activación iminio y la definición de la organocatálisis (Ahrendt, 2000). Su razonamiento se basó en que la coordinación de un ácido de Lewis a un compuesto carbonílico se convierte en un electrófilo más reactivo con un LUMO de menor energía. De manera semejante, una amina secundaria se puede condensar de manera reversible con un compuesto carbonílico obteniendo un iminio con la misma activación de un ácido de Lewis, convirtiéndose en un electrófilo activado por disminución del orbital desocupado de menor energía (Figura 5).
Esta activación iminio la estudió en la reacción de cicloadición de Diels-Alder con el conocimiento que los dienófilos se activan por ácidos de Lewis. Con la imidazolidinona C-2 como catalizador forma los productos exo- y endo- 8 con muy buena enantioselectividad (Figura 6).
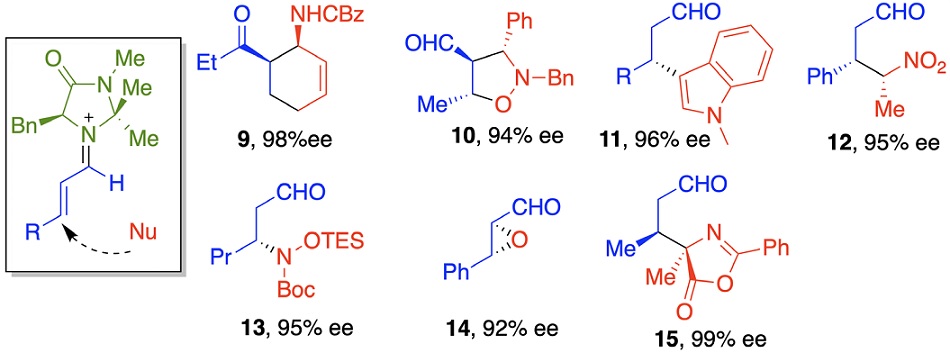
Una vez descubierto y probado el concepto, procedió a la generalización de la activación iminio para obtener otros productos de Diels-Alder como 9, cicloadición con nitronas generando 10, con arilos ricos en electrones conduce a 11 por una reacción de Friedel-Crafts, nucleófilos como nitroalcanos, carbamatos, hidroperóxido y azlactonas conducen a los compuestos 12 a 15 respectivamente (Figura 7).
Una vez formulada la organocatálisis, muchos grupos de investigación de todo el mundo lo vieron como una mina de oro para descubrir nuevas reacciones. Esto se refleja en el sentir de la comunidad con los títulos de artículos de revisión de esa época como son “En la era dorada de la organocatálisis” (Dalko y Moisan, 2004), “Aminocatálisis asimétrica - fiebre de oro en química orgánica (Melchiorre, et al., 2008) y “Organocatálisis - después de la fiebre de oro” (Bertelsen y Jørgensen, 2009). Está se volvió una área muy competida donde se traslapaban las ideas de diferentes grupos, y se ilustra con el catalizador de Hayashi-Jørgensen C-3, el cual se publicó por el grupo de Hayashi en Japón y el de Jørgensen en Dinamarca en 2005 con 5 días de diferencia. Este catalizador, al contrario de la prolina o prolinamidas, no tiene la capacidad de formar enlaces de hidrógeno y es únicamente por el efecto estérico que bloquea una de las caras proquirales de la enamina. Esto tiene como consecuencia que con la prolina el electrófilo está direccionado por el enlace de hidrógeno a la cara frontal (cara Re), mientras que con C-3 está bloqueado el frente y la adición tiene que ser por la cara posterior (cara Si) generando el estereoisómero opuesto (Figura 8).

Figura 8 Comparación de los catalizadores C-1 y C-3 para dirigir la introducción del electrófilo en enaminas.
Existen en la actualidad muchas formas para activar vía organocatálisis. Sayed y List en 2005, propusieron una clasificación por el mecanismo de reacción que tienen los catalizadores. De esta manera los clasifican como bases o ácidos de Lewis o de Brønsted. En el caso de Lewis, las bases (B:) donan y los ácidos (A) toman electrones del sustrato (S). La activación iminio y enamina previamente descrita son bases de Lewis ya que atacan de manera nucleofílica el carbonilo. En la la clasificación de Brønsted las bases (B:) toman y los ácidos (A-H) donan protones.
Para ejemplificar un catalizador tipo ácido de Brønsted y además una activación no covalente se mostrará la activación por enlace de hidrógeno. El primer artículo sobre activación catalítica por enlace de hidrógeno fue en 1994 y la primera de forma asimétrica en 1998. En la Figura 10 se ilustran algunas de las primeras reacciones por tioureas 1,3-disustituidas como catalizadores por enlace de hidrógeno. La adición nucleofílica de indol a nitroestireno para obtener 16, la reacción de Mannich que conduce al β-aminoácido protegido 17 y la reacción de Morita-Baylis-Hilman que genera 18. En todos estos casos el catalizador activa al electrófilo formando enlaces de hidrógeno con él, formando una especie más electrofílica de manera similar al efecto de un ácido de Lewis. En cada electrófilo mostrado, los oxígenos del grupo nitro, el nitrógeno de la imina y carbonilo del grupo Boc y el carbonilo del aldehído, forman dos enlaces de hidrógeno con la tiourea.
Una importante adición a la organocatálisis es el desarrollo de organocatalizadores bifuncionales por Okino, Hoashi, y Takemoto en 2003. Estos sistemas activan al electrófilo y al nucleófilo de manera simultánea con lo que generan una mayor reactividad y selectividad en la reacción de interés (Figura 11a). En particular, Takemoto propone que una tiourea activa al nitroestireno por enlaces de hidrógeno y la amina terciaria sirve como base de Brønsted para desprotonar compuestos 1,3-dicarbonílicos. Al estar unidos estos grupos en un andamio quiral la reacción de Michael procede de manera estereoselectiva (Figura 11b). Es curioso que en las hidrolasas de serina (Wharton, 1998), que llevan a cabo la hidrólisis de enlaces amida (RNH-C(O)R’), el mecanismo comienza con la activación del carbonilo electrofílico en el hoyo oxoaniónico formado por los enlaces de hidrógeno. Por otra parte, un -OH de la serina actúa como nucleófilo, el cual está activado por una base de Brønsted de un imidazol de histidina (Figura 11c). Por lo que, el carácter de catalizador bifuncional ya está incorporado en muchas enzimas, pero no se había explotado en catalizadores orgánicos sintéticos. El desarrollo de nuevos organocatalizadores bifuncionales puede ser guiado por conceptos o intuición en un enfoque netamente experimental, mediante el modelado molecular de los estados de transición diastereoméricos y una nueva aproximación es mediante estudios cuantitativos estructura-selectividad los cuales usan datos experimentales y teóricos. Un ejemplo de esta aproximación puede verse en el desarrollado por Díaz-Salazar, et al. en 2021.
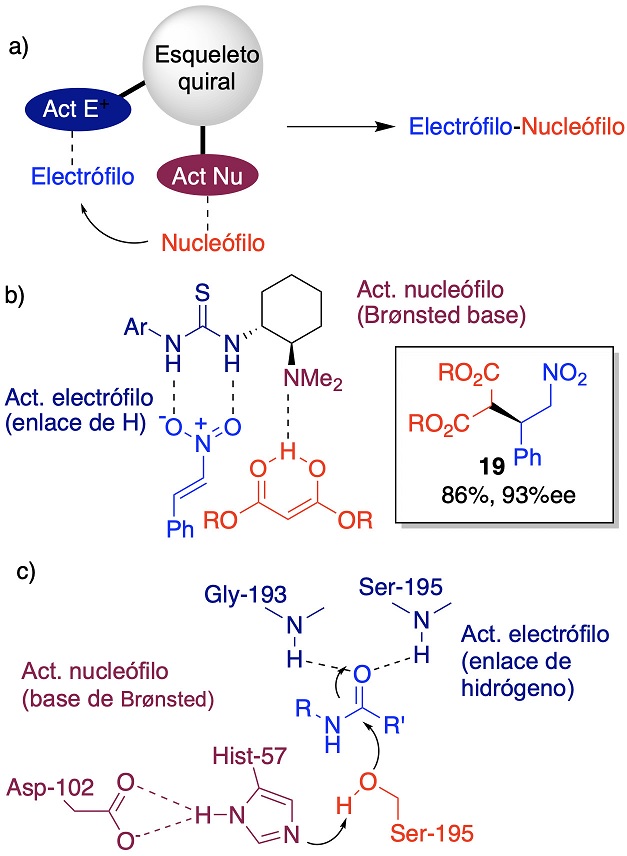
Figura 11 (a) Concepto de organocatalizador bifuncional. (b) Acción de la tiourea bifuncional de Takemoto. (c) Mecanismo bifuncional de las proteasas de serina.
A continuación, este artículo se enfocará en dos aspectos: los beneficios a la humanidad de la organocatálisis, en particular con fármacos quirales y la implementación de la organocatálisis en docencia en cursos de nivel universitario.
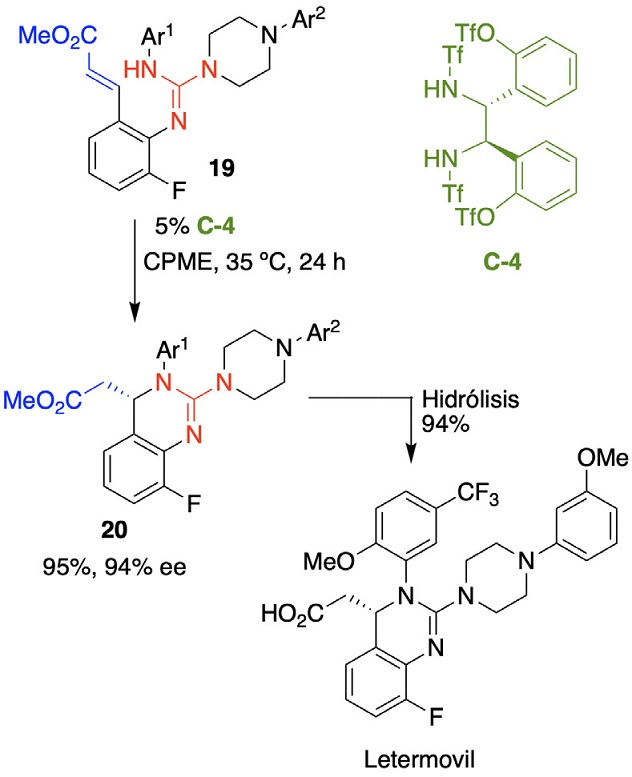
En el primer caso, la complejidad estructural de un fármaco para que se acople a la diana deseada y que no tenga otros efectos adversos se puede conseguir teniendo un volumen tridimensional específico, y para ello se requiere la introducción de estereocentros. Esto tiene por consecuencia que sean quirales y debido a la dificultad inherente de la síntesis estereoselectiva o la resolución, hace que sean más costosos. Un ejemplo de lo caro que puede ser el tratamiento por fármacos quirales son los antivirales contra el virus SARS-CoV-2 como el remdesivir y el molnupiravir. Mediante la organocatálisis asimétrica se pueden desarrollar nuevas síntesis estereoselectivas que permitan un menor precio del fármaco por una síntesis más eficiente, segura y amigable con el ambiente al reducir la cantidad de residuos. Un ejemplo de lo que puede hacer la organocatálisis es la síntesis del letermovil por Merck & Co., Inc. Esta síntesis fue premiada por la agencia de protección al medio ambiente de EU dentro del Desafío de la Química Verde: Premio rutas sintéticas más verdes 2017. La síntesis de este antiviral contra citomegalovirus tenía un rendimiento global del 10%, en parte debido al penúltimo paso de resolución y alta carga de paladio para la reacción de Heck. En la nueva reacción propuesta se logra por dos reacciones “one-pot” llegar al compuesto 19 con un 79% de rendimiento, el cual por una reacción aza-Michael promovida por el organocatalizador de enlace de hidrógeno C-4 (recuperable y reciclable), se genera el estereocentro de manera selectiva en el compuesto 20 (Figura 12). La síntesis reduce el costo de los materiales de partida en un 93%, aumenta el rendimiento global a más del 60% y reduce la huella de carbono y uso de agua en un 89 y 90% respectivamente.
Otro ejemplo es la síntesis del antiviral oseltamivir (Hayashi y Ogasawara, 2016) en donde todo se hace en un tiempo récord para una molécula de esta complejidad mediante una secuencia “one-pot”. La primera racción es la adición conjugada de 21 a 22 promovida por el organocatalizador C-5. En este paso se introducen 2 de los 3 estereocentros por la reacción organocatalítica formando el compuesto 23. Después de la formación del ciclohexeno 24, desafortunadamente, la configuración del carbono 5 es S por lo que se procedió a un proceso de racemización para lograr una relación 1 a 1 de los diastereómeros. Finalmente, la reducción del grupo nitro condujo al oseltamivir (Figura 13).
Finalmente, los contenidos referentes a organocatálisis se pueden incluir en los diferentes cursos de química orgánica durante la licenciatura. En asignaturas que aborden los compuestos carbonílicos, se estudia la condensación reversible de aldehídos a iminas (Figura 14a), la tautomería ceto-enol (Figura 14b) y la reacción aldólica (Figura 14c). Por lo que se podría incluir a la prolina como catalizador en una reacción aldólica y ejemplificar su mecanismo como una secuencia de condensación-tautomerización-reacción aldólicaregeneración del catalizador. Otra reacción que se estudia en licenciatura es la cicloadición de Diels-Alder promovida por ácidos de Lewis (Figura 14d). En este caso, la catálisis iminio de MacMillan resulta semejante. Adicionalmente, en laboratorio se pueden implementar prácticas de reacción aldólica (Wade y Walsh, 2011) o de condensación benzoínica catalizada por el clorhidrato de tiamina (vitamina B1) vía carbenos N-heterocíclicos (León-Cedeño, 2009) (Figura 14e).
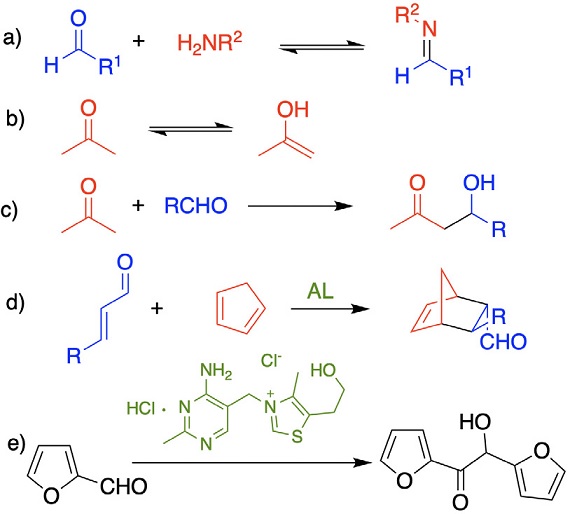
Figura 14 (a-d) Reacciones estudiadas en cursos de licenciatura que pueden formar un andamiaje para impartir organocatálisis. (e) Reacción de condensación benzoínica para llevarse a cabo en laboratorio.
En conclusión, el premio Nobel de Química 2021 otorgado a la organocatálisis asimétrica abrió una nueva rama de la catálisis estereoselectiva proporcionando nuevas reacciones, con metodologías sencillas y en condiciones suaves de reacción. Su importancia en la síntesis química es indiscutible y la forma en que impacta en la sociedad es en la obtención de fármacos quirales de manera creativa y menos costosa. Por otro lado, los conceptos de reactividad en los que se basa la organocatálisis ya están en los cursos de química orgánica por lo que su discusión o implementación en clase no será complicada.











 nueva página del texto (beta)
nueva página del texto (beta)