Amediados de la década de 1970, Mario Molina ayudó a predecir que las emisiones globales de clorofluorocarbonos (CFC) podrían agotar el ozono estratosférico. Una década mas tarde, los científicos del British Antarctic Survey informaron que había aparecido un gran agujero en la capa de ozono sobre el Polo Sur. La incansable defensa y diplomacia científica de Molina ayudaron a lograr el Protocolo de Montreal de 1987 sobre Sustancias que adelgazan la Capa de Ozono, un acuerdo internacional para eliminar los CFC y otras sustancias químicas que tienen este efecto en la capa de ozono. Molina compartió el Premio Nobel de Química de 1995 con su ex asesor F. Sherwood Rowland y el químico holandés Paul Crutzen por su trabajo sobre la química estratosférica. Murió el 7 de octubre de 2020, a los 77 años.
El Protocolo de Montreal, el primer tratado de las Naciones Unidas en lograr la ratificación universal, redujo el cloro y el bromo estratosféricos, y el agujero de ozono ha comenzado a recuperarse. En 2003, el ex secretario general de la ONU, Kofi Annan, describió el tratado como “quizás el acuerdo internacional mas exitoso hasta la fecha”. Su implementación, y el trabajo posterior de (los) Molina sobre la calidad del aire en las mega ciudades y sobre el cambio climático, mejoraron la calidad de vida de millones de personas en todo el mundo.
Una figura pública preciada en los Estados Unidos y México, fue un asesor de confianza del presidente estadounidense Barack Obama.
Nacido en la Ciudad de México, hijo de un diplomático, Molina fue a un internado en Suiza.
Estudió ingeniería química en la Universidad Nacional Autónoma de México, en su ciudad natal, y química aplicada en la Universidad de Friburgo, Alemania. Los estudios de doctorado en química-física en la Universidad de California (UC), Berkeley, lo llevaron a Estados Unidos, donde construyó su carrera.
En UC Irvine, él y Rowland calcularon la amenaza que representan los CFC para la atmósfera (véase M. Molina y F. Rowland Nature 249, 810-812; 1974). La inercia química que hizo que los CFC fueran valiosos como refrigerantes y propulsores, también evita que la oxidación los elimine de la atmósfera, donde se convierten en un caballo de Troya para introducir cloro a la estratósfera. Allí, el gas puede catalizar la destrucción del ozono, permitiendo que la dañina luz ultravioleta de alta energía (UVB) penetre en la superficie de la Tierra.
Comunicar este trabajo a los medios de comunicación y a los legisladores fue el inicio de Molina en la diplomacia científica. Estos esfuerzos crearon un impulso para la eliminación gradual de los CFC en las latas de aerosol, acelerados por el descubrimiento del agujero de ozono y concluidos con el Protocolo de Montreal. Sin embargo, quedaron sin respuesta preguntas básicas: ¿Por qué el agujero de ozono estaba localizado sobre el Polo Sur y era estacional?
Molina encontró la respuesta en la química de la superficie de las partículas de hielo que forman las hermosas nubes estratosféricas polares (PSC) de “madre perla” observadas durante el invierno sobre el Polo Sur. Durante el oscuro y frío invierno polar, el cloro estratosférico se almacena en formas relativamente inertes de nitrato de cloro en fase gaseosa, ácido hipocloroso y cloruro de hidrógeno.
Molina y su grupo de investigación, entonces en el Jet Propulsion Laboratory en Pasadena, California, hicieron experimentos creativos para imitar partículas de PSC: las reacciones entre las superficies de hielo y los compuestos de cloro llevaron a la liberación de cloro. La acumulación invernal del gas en el vórtice polar antártico debido a tales reacciones conduce a un agotamiento intenso del ozono cuando la luz solar regresa en la primavera polar.
Quedaba un misterio en cuanto a por qué el hielo debería ser un catalizador tan eficaz para estos procesos estratosféricos. Los cálculos basados en las reacciones del cloruro de hidrógeno con una superficie de hielo cristalino predijeron que la activación del cloro sería mucho menos eficiente de lo que se observa en el laboratorio o en el medio ambiente. Molina sugirió que la diferencia podría deberse a una capa superficial desordenada, o capa casi líquida, en el hielo. En el Instituto de Tecnología de Massachusetts (MIT) en Cambridge, su grupo de investigación realizó experimentos que confirmaron que el cloruro de hidrógeno a bajas temperaturas estratosféricas inducía tal desorden y que desempeñaba un papel en la activación del cloro.
Mientras era profesor de instituto en el MIT entre 1989 y 2004, Molina y su entonces esposa1 y colaboradora de mucho tiempo, Luisa Tan Molina, comenzaron a trabajar en la calidad del aire en mega ciudades (en general, aquellas con (alrededor) o mas de diez millones de habitantes) en el sur global. Para orientar la política, el Proyecto Ciudad de México combinó estudios de campo a gran escala sin precedentes de la química atmosférica en vecindarios urbanos, en los que participaron cientos de científicos internacionales, con análisis en profundidad y participación de las partes interesadas. Este trabajo mejoró la calidad del aire en su amada ciudad natal (Proyecto MILAGRO).
En 2004, Molina se mudó a UC San Diego y fundó el Centro Mario Molina de Estudios Estratégicos sobre Energía y Medio Ambiente, un grupo de expertos con sede en la Ciudad de México. En sus últimas décadas, pasó cada vez mas tiempo en México, pero siguió siendo un miembro inspirador de la facultad en UC San Diego. En 2014, encabezó una importante iniciativa de divulgación pública sobre el cambio climático, “Lo que sabemos”, para la Asociación estadounidense para el Avance de la Ciencia.
Molina podía comunicar la esencia de un tema técnico a cualquiera, con diplomacia amable y credibilidad científica.
Se desempeñó como asesor científico de varios presidentes de México y, como miembro de la Academia Pontificia de Ciencias del Vaticano, asesoró a tres papas y fue coautor del informe de 2017 ‘Menos de 2 grados Celsius: políticas de acción rápida para proteger a las personas y el planeta del cambio climático extremo’. En sus últimos meses, abogó apasionadamente por el uso de mascarillas para reducir la transmisión del SARS-CoV-2 en México.
Premio Nobel de Química 1995
“por su trabajo en química atmosférica, y particularmente en lo concerniente a la formación y la descomposición del ozono”
Semblanza autobiográfica
(conectada con el Premio Nobel en 1995, autorizada por el doctor Mario Molina y modificada por él en 2002).
Nací en la ciudad de México el 19 de marzo de 1943. Mis padres fueron Roberto Molina Pasquel y Leonor Henríquez de Molina. Mi padre fue un abogado; tenía un despacho particular, pero también era maestro en la Universidad Nacional Autónoma de México (UNAM). En sus últimos años representó a México como embajador en Etiopía, Australia y Filipinas.
Fui a la primaria y la secundaria en la Ciudad de México. Antes de entrar a la secundaria ya me fascinaba la ciencia. Aún recuerdo mi emoción cuando vi por primera vez paramecios y amibas a través de un microscopio de juguete más bien primitivo. Convertí entonces en laboratorio un baño de la casa que apenas usábamos, y pasé largas horas ahí entreteniéndome con juegos de química. Con la ayuda de una tía, Esther Molina, que es química, seguí realizando experimentos más desafiantes en la línea de aquellos realizados por estudiantes de química de los primeros años de universidad. Apegados a la tradición familiar de enviar los padres a sus niños a estudiar al extranjero por un par de años, y conscientes de mi interés en la química, fui enviado a una escuela en Suiza cuando tenía 11 años, bajo la convicción de que el aprendizaje del alemán era importante para un posible químico. Yo estaba muy entusiasmado de vivir en Europa, pero me desilusionó que a mis nuevos compañeros no les interesara la ciencia más que a mis amigos de México.
Para entonces ya había tomado la decisión de ser investigador en química; antes, había contemplado seriamente la posibilidad de dedicarme a la música (solía tocar el violín por ese entonces). En 1960 comencé los estudios de ingeniería química en la UNAM, toda vez que este camino, que ofrecía materias de matemáticas a las que no se tenía acceso en la carrera de química, era el más corto para llegar a ser un físico-químico.
Luego de terminar la carrera en México, decidí cursar los estudios de posgrado en físico-química. Esto no era fácil: si bien mi preparación en ingeniería química era buena, adolecía por el lado de las matemáticas y la física, así como en diversas áreas de físico-química básica -materias como mecánica cuántica eran totalmente ajenas a mí por aquel entonces. En un principio me trasladé a Alemania e ingresé a la Universidad de Friburgo. Luego de dedicar cerca de dos años a la investigación en cinética de polimerizaciones, caí en cuenta de que quería dedicar más tiempo al estudio de algunas materias básicas a fin de ampliar mis fundamentos y explorar otras áreas de la investigación. Así, decidí solicitar mi ingreso a algún posgrado en Estados Unidos. Mientras ponderaba mis planes futuros, pasé varios meses en París, donde pude estudiar matemáticas por mi cuenta y donde pasé ratos maravillosos en charlas sobre todo tipo de temas -desde la política hasta la filosofía y las artes- con muchos buenos amigos. Posteriormente regresé a México como Profesor Asistente de la UNAM, y creé ahí el primer posgrado en ingeniería química de México. Finalmente, en 1968 me trasladé a la Universidad de California en Berkeley para realizar mis estudios de posgrado en físico-química.
En mi primer año en Berkeley tomé clases de física y matemáticas, además de las materias obligatorias en físico-química. Seguidamente me incorporé al equipo de investigación del profesor George C. Pimentel, con el objetivo de estudiar dinámica molecular con ayuda del láser químico, que había sido descubierto por ese equipo de investigación algunos años antes.
George Pimentel fue también un pionero en el desarrollo de técnicas de aislamiento de matrices, que son ampliamente utilizadas en el estudio de la estructura molecular y los enlaces químicos en especies transitorias. Él fue un excelente profesor y un guía maravilloso; su afecto, su entusiasmo y su motivación me inspiraron para abordar importantes problemas científicos.
Mi trabajo de posgrado implicó el estudio de la distribución de la energía interna en los productos de reacciones químicas y fotoquímicas; los láseres químicos eran herramientas apropiadas para dichas investigaciones. En un principio yo tenía poca experiencia con las técnicas de experimentación que requería mi investigación, tales como el manejo de líneas de vacío, óptica infrarroja, instrumentación electrónica, etcétera. Mucho de esto lo aprendí de mi colega y amigo Francisco Tablas, que era entonces alumno de posdoctorado. Posteriormente gané la confianza necesaria para obtener resultados originales por mí mismo: mi primer logro consistió en explicar algunas propiedades de las señales de láser -que a primera vista aparentaban ser solamente ruido- pero que pude explicar como “oscilaciones de relajación” predecibles a partir de las ecuaciones fundamentales de las emisiones láser.
Los años que pasé en Berkeley han sido de los mejores de mi vida. Llegué allí justo después de la era del movimiento a favor de la libre expresión. Tuve la oportunidad de explorar muchos campos y de involucrarme en apasionantes labores de investigación dentro de un ambiente intelectual estimulante. Fue también en esos años que tuve mi primera experiencia en relación con el impacto de la ciencia y la tecnología en la sociedad. Recuerdo que me impresionó el hecho de que en otros lugares se estaban desarrollando láseres químicos de alto poder para fines bélicos: deseaba participar en investigaciones que fueran útiles para la sociedad, y no que derivaran en resultados potencialmente destructivos.
Una vez terminados mis estudios de posgrado en 1972, permanecí en Berkeley por un año más para continuar mis investigaciones en dinámica química. Posteriormente, en 1973, me uní al equipo del profesor Sherwood (Sherry) Rowland como becario de posdoctorado, para lo que debí trasladarme a Irvine, California. Sherry había desarrollado la investigación en química del “átomo caliente” al estudiar las propiedades químicas de átomos con exceso de energía de traslación y derivados de procesos radioactivos. Sherry me ofreció una lista de opciones de investigación; el proyecto que más me atrajo consistía en averiguar el destino de ciertos productos químicos industriales muy inertes -los clorofluorocarbones (CFC)- que se habían estado acumulando en la atmósfera, y que no parecían tener para entonces ningún efecto significativo en el ambiente. Este proyecto me brindó la oportunidad de aprender sobre el campo de la química atmosférica, del que sabía muy poco; el trabajo para resolver un problema desafiante parecía ser una forma magnífica de introducirme en una nueva área de investigación. Los CFC son compuestos similares a otros que Sherry y yo habíamos investigado desde el punto de vista de la dinámica molecular; estábamos familiarizados con sus propiedades químicas, pero no con su química atmosférica.
Tres meses después de mi llegada a Irvine, Sherry y yo habíamos creado la “Teoría del agotamiento del ozono por los CFC”. En un principio la investigación no parecía particularmente interesante: realicé una búsqueda sistemática de procesos que pudieran destruir los CFC en la atmósfera baja, pero nada parecía afectarlos. Sabíamos, sin embargo, que terminarían por alcanzar una altitud lo suficientemente elevada para ser destruidos por la radiación solar. El punto no era qué los destruye sino, más importante, cuáles son las consecuencias. Advertimos que los átomos de cloro producidos por la descomposición de los CFC destruyen por catálisis al ozono. Nos hicimos realmente conscientes de la seriedad del problema cuando comparamos las cantidades industriales de CFC con las de óxidos de nitrógeno que controlan los niveles de ozono; Paul Crutzen había identificado el papel de estos catalizadores de origen natural unos cuantos años antes. Nos alarmaba la posibilidad de que la liberación continua de CFC en la atmósfera pudiera causar una degradación significativa de la capa de ozono estratosférica de la Tierra. Sherry y yo decidimos intercambiar información con la comunidad de científicos atmosféricos. Fuimos a Berkeley a conversar con el profesor Harold Johnston; conocíamos bien su trabajo sobre el impacto de la liberación de óxidos de nitrógeno por parte de la proyectada aeronave de transportación supersónica (SST) en la capa de ozono estratosférica. Johnston nos informó que meses antes Ralph Cicerone y Richard Stolarski habían llegado a similares conclusiones sobre las propiedades catalíticas en la estratosfera de los átomos de cloro, en relación con la liberación de cloruro de hidrógeno debida a erupciones volcánicas o al combustible de perclorato de amonio cuyo uso se tenía proyectado para el transbordador espacial.
Dimos a conocer nuestros descubrimientos en un artículo que apareció en el número del 28 de junio de 1974 de la revista Nature. Los años siguientes a la publicación de nuestro artículo fueron agitados, dado que habíamos decidido difundir el asunto no sólo a otros científicos, sino también a autoridades públicas y a los medios de comunicación: Sabíamos que ésta era la única forma de asegurar que la sociedad tomara algunas medidas a fin de reducir el problema.
Para mí, Sherry Rowland siempre ha sido un maravilloso guía y colega. Me son entrañables los años de colaboración con él y mi amistad con él y Joan, su esposa. Cuando pasó su año sabático en Viena, durante el primer semestre de 1974, nos comunicamos por correo y teléfono. Hubo un gran intercambio de correo en ese corto periodo, lo que ilustra el agitado ritmo que imprimíamos a nuestra investigación a fin de refinar nuestra teoría del agotamiento del ozono. Poco después, Sherry y yo publicamos un buen número de nuevos artículos sobre el tema; presentamos nuestros resultados en reuniones científicas y también rendimos testimonio en audiencias legislativas sobre proyectos de control de emisiones de CFC.
En 1975 me integré al cuerpo de profesores de la Universidad de California en Irvine. Si bien mantuve mi colaboración con Sherry, tenía que demostrar que como profesor asistente era capaz de hacer mis propias aportaciones en investigación. Establecí entonces un programa independiente de investigación sobre las propiedades químicas de compuestos de importancia atmosférica, particularmente de aquellos que son inestables y difíciles de manejar en laboratorio, como el ácido hipocloroso, el nitrito de cloro, el nitrato de cloro y el ácido peroxinítrico.
Si bien mis años en Irvine fueron muy productivos, echaba de menos mi trabajo de investigación en el laboratorio, que no podía realizar personalmente debido a las muchas responsabilidades que implicaba mi cargo en la Universidad: Impartir clases, supervisar el trabajo de estudiantes de posgrado, asistir a reuniones, etcétera. Luego de pasar siete años en Irvine como profesor asistente y, posteriormente, como profesor asociado, decidí dejar mi cargo académico. Así, me uní en 1982 al Departamento de Física y Química Molecular del Laboratorio de Propulsión a Chorro. Tenía un equipo de trabajo más pequeño -tan sólo algunos becarios de posdoctorado- pero también tenía el privilegio de conducir experimentos con mis propias manos, lo que disfruto mucho. De hecho, pasé muchas horas en el laboratorio durante aquellos años, realizando cálculos y desarrollando técnicas para el estudio de los problemas que se iban presentando. Hacia 1985, luego de enterarme del descubrimiento que hicieron Joseph Farman y sus colaboradores del agotamiento temporal del ozono sobre la Antártida, mi equipo de investigación del Laboratorio de Propulsión a Chorro investigó la química peculiar propiciada por las nubes estratosféricas polares, algunas de las cuales están formadas de cristales de hielo. Pudimos demostrar que las reacciones de activación por cloro ocurren con más eficiencia en presencia de hielo bajo condiciones estratosféricas polares. Así, simulamos en laboratorio los efectos químicos de las nubes sobre la Antártida. Igualmente, a fin de entender las rápidas reacciones de la fase catalítica del gas que estaban teniendo lugar sobre el Polo Sur, realizamos experimentos con peróxido de cloro, un nuevo compuesto que nunca había sido reportado en textos de química y que resultó ser importante para explicar la rápida pérdida de ozono en la estratosfera polar.
En 1989 regresé a la vida académica, trasladándome al Instituto de Tecnología de Massachusetts, donde he continuado mi trabajo de investigación sobre temas generales de química atmosférica. Si bien ya no paso mucho tiempo en el laboratorio, disfruto mucho del trabajo con mis alumnos de posgrado y posdoctorado, cuya labor representa un gran estímulo intelectual para mí. La enseñanza también me ha beneficiado: Al explicar mi punto de vista a estudiantes con mentes críticas y abiertas, continuamente me veo obligado a examinar y recrear mis ideas. Ahora concibo la enseñanza y la investigación como actividades complementarias que se retroalimentan.
Cuando elegí por vez primera el proyecto de investigación sobre el devenir de los clorofluorocarburos en la atmósfera, fue simplemente por curiosidad científica. No consideré en ese momento las consecuencias ambientales de lo que Sherry y yo comenzábamos a estudiar. Me emociona y me mueve a humildad el que pude hacer algo que no sólo contribuyó a nuestra compresión de la química atmosférica, sino que también tuvo profundas repercusiones en el ambiente global.
Uno de los aspectos más gratificantes de mi trabajo ha sido la interacción con un grupo inmejorable de colegas y amigos de la comunidad internacional de científicos atmosféricos. Valoro en verdad estas amistades, que han perdurado en muchos casos por veinte años o más, y que espero que se mantengan por muchos años más. Considero que este Premio Nobel representa un reconocimiento al excelente trabajo de mis colegas y amigos en el campo del agotamiento del ozono estratosférico.
The apparatus that allowed us to isolate and study the impossible
Middle age can be tough. Years ago, I remember a seminar given by Martyn Poliakoff about the photolysis of transition metal carbonyls at low temperature. As he spoke of delicate noble gas complexes, a chemist in his 50s - who was clearly drunk - heckled Poliakoff, bellowing in broad Yorkshire tones that ‘It’s not real. You can’t put that in a bottle.’ The bizarre incident highlighted for me the way in which, through the 20th century, chemistry moved from the study of the ground state - starting materials and products - to the isolation and study of the fleeting intermediates and excited states that were being invoked to explain chemical reactions.

Source: © Lawrence Berkeley National Lab. George Claude Pimentel, American chemist (1922-1989). Developer of matrix isolation and inventor of the chemical laser
The period after the first world war saw the development of a raft of chemical techniques through the development of pumps, valves, cryogenics and, of course spectroscopy. Thus, by the early 1940s the existence of unstable molecules like imine had been conclusively established by detailed spectra in the gas phase. These in turn confirmed many of the predictions of the new molecular orbital theory. At Imperial College London, UK, the young chemist Kenneth Stewart, working with the inspirational inorganic chemist Harry Emeléus, generated imine (NH) in the gas phase and began to explore its chemical reactivity. He condensed it onto liquid air-cooled traps, noting a blue colour that disappeared on warming; when co-condensed with benzene it generated aniline. The work ended when Stewart abandoned chemistry to enlist in the armed forces in 1940 - he would later become a leading nuclear weapons expert at the UK’s Atomic Weapons Establishment at Aldermaston. But he had planted a key intellectual seed.
At the same time, at the University of California, Berkeley, US, the American chemist Gilbert Lewis was exploring a curious phenomenon that had been observed since the 1890s in Germany: that dyes like fluorescein, when dissolved in frozen organic solvents or boric acid (a material notorious for forming glasses rather than crystallising), would phosphoresce for long periods. Lewis wanted to understand the photophysics and began measuring their spectra and decay rates. Crucially, he and his students developed a solvent mixture that gave a consistently clear glass ideal for both photolysis and spectroscopy. Consisting of ether, isopentane and alcohol, they called the solvent EPA. With it, Lewis and student David Lipkin reported a detailed study of tetraphenylhydrazine and related molecules, in which ultraviolet light was used to generate Ph2N. radicals that could be observed for many hours when frozen in the solvent.
The use of EPA as a medium for low temperature photochemistry spread quickly at Berkeley: the photochemist George Gibson (who had been PhD supervisor to Henry Eyring and future Nobel prize winners William Giauque and Glenn Seaborg) used the glass to study the photolysis of benzene at low temperature. The work was also noticed by one of colleagues, George Pimentel, a young and ambitious chemist who was specialising in the study of hydrogen bonding and structures of unusual molecules by infrared spectroscopy. Born in California, his father was a builder who had barely finished third grade, while his mother’s education had gone only part way through secondary school. But as a teenager Pimentel would cycle to Caltech, where Robert Millikan gave public lectures, and he was soon hooked on science.
Pimentel studied chemistry at the University of California, Los Angeles (UCLA). When he graduated in 1943, he was seconded to Berkeley and the Manhattan project - the development of the atomic bomb - where he worked on isotope separation with Wendell Latimer, another former student of Gibson’s. When the second world war ended, Pimentel did a PhD at Berkeley with one of Latimer’s students, Kenneth Pitzer, one of the pioneers of infrared spectroscopy. Pimentel hoped to extend the use of IR to the study of unstable radicals, and as he and his British postdoc Eric Whittle pondered the project, they came across a detailed vibrational study of ammonium halides by Donald Hornig at Brown University.
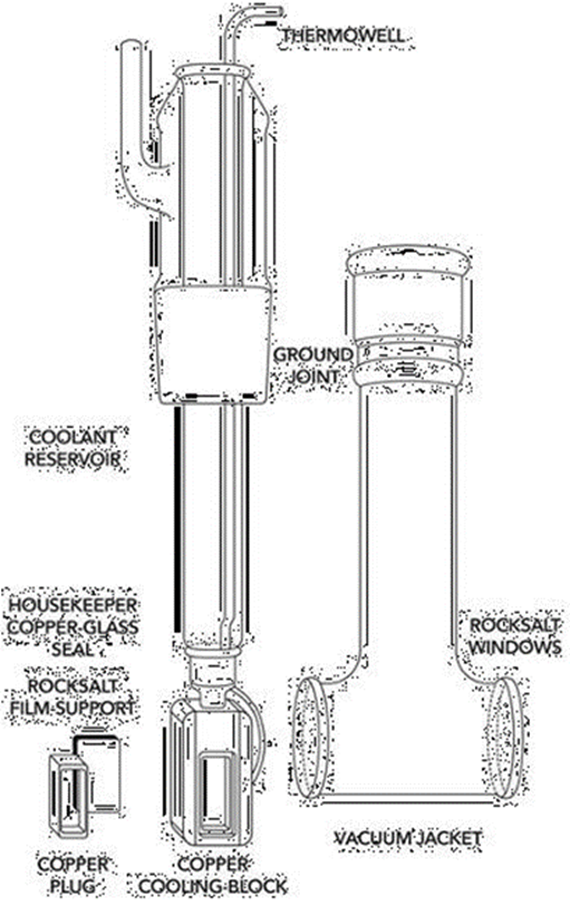
Hornig had constructed a copper frame, into which a flat slab of rocksalt could be mounted (see below right). The frame incorporated a thermally conductive copper block attached to a glass reservoir that could be filled with a cryogenic liquid to cool it to low temperatures. The entire assembly sat inside a vacuum jacket, so materials could be sublimed onto the window and studied spectroscopically.
Pimentel, Whittle and graduate student David Dows decided to try to catch free radicals, including imine, formed in the decomposition of hydrazoic acid (HN3) using Hornig’s apparatus. But then Pimentel had an idea - why not use frozen but IR-transparent noble gases to delicately cradle the trapped radicals? After months of failure to get the conditions just right, Dows and Whittle demonstrated proof of principle by trapping NO2 . radicals using frozen CO2.
They then moved to lower temperatures; with William Giauque’s low temperature thermodynamics lab nearby, supplies of liquid helium and hydrogen were plentiful. With its bigger heat capacity, hydrogen was a much more effective, if dangerous, coolant. Pimentel called their new technique ‘matrix isolation’.
A mere four days after the Pimentel’s paper was submitted in 1954, George Porter, at the University of Cambridge, UK, reported a very similar idea. Porter, who had developed the flash photolysis technique to study fast reactions in the gas phase, imagined being able to trap the intermediates using hydrocarbon or EPA glass. He and his American research fellow, Irwin Norman, designed Dewar flasks incorporating optically flat quartz windows. A solution of iodine in EPA, frozen onto the window, bleached beautifully on ultraviolet irradiation; the colour returned on warming, suggesting the splitting and recombination of the iodine molecules. Studies of many organic molecules would follow.
But Pimentel’s colder, vibrational approach that was the more structurally revealing, and caught on rapidly, especially as the group improved and optimised the apparatus to operate at the lowest temperatures. The spectral lines were sharp and the availability of isotopes made assignment straightforward. Jim Turner, a Pimentel postdoc in the early 60s, remembers the entire department being assembled at short notice for the electrifying announcement that Neil Bartlett had isolated compounds of xenon. Turner, who was in possession of Berkeley’s only cylinder of xenon, conducted experiments with fluorine in cold matrices of the element. Pimentel’s infectious enthusiasm - ‘Let’s try it!’ was his catchphrase - and his clarity of thought are beautifully captured in a short film that was made at the time (https://archive.org/details/research_problem_inert_gas_compounds) for Pimentel’s national CHEM Study education project (see below).
The education project also included an ambitious and influential textbook, Understanding chemistry, that was widely translated. The textbook was also memorable, however, for including a statement that rare earth chemists have never quite been able to forgive: ‘Lanthanum has only one important oxidation state in aqueous solution: the +3 state. With few exceptions that is the whole boring story of the other fourteen elements.’
Pimentel was not done with IR spectroscopy. Using molecules trapped in cryogenic matrices, he was able to demonstrate IR photochemistry, revealing for the first time how one could excite molecules to react in a specific way depending excitation mode. At the same time, he began to conduct flash photolysis experiments like Porter’s, but with IR detection. This required exceptionally fast and sensitive germanium detectors, along with cells with very long path lengths to detect radicals like CF2 and CF3. By rotating a grating at high speeds, it was possible to scan spectra at unprecedented speeds.
It was while using this ultrafast spectrometer in a multi-reflection cell to study the dissociation of CF3 I that Pimentel and his student Jerome Kasper observed a huge emission from atomic iodine that swamped their detectors - a serendipitous discovery that give birth to the chemical laser. Lasers based on the reaction of hydrogen with chlorine and fluorine followed, resulted in an explosion of understanding in chemical dynamics.
In 1969, Pimentel, then chairman of the Chemistry Department at Berkeley, applied to NASA to become a scientist-astronaut and was selected as one of the seven finalists. Although he never travelled into space, he proposed developing an infrared spectrometer for the Mariner 6 and 7 spacecraft to look for signs of life on Mars. The stringent low weight and power requirements were a massive challenge, but the instrument worked beautifully and provided the first detailed look not only of the composition of the atmosphere, but also of the ice caps and surface minerals. By looking at the intensity of the CO2 bands as the probes orbited Mars, the spectrometers also provided some of the earliest maps of the topography of the red planet.
Matrix isolation provided the ‘bottles’ to contain and study seemingly impossible species. That we are almost blasé about such studies today speaks to the success of Pimentel, Porter and the others who made it all possible. And a word of warning to anyone feeling too smug about Poliakoff’s heckler - if you’re not in the first bloom of youth, I bet there’s some technique around today that makes you feel uncomfortable, too.











 nueva página del texto (beta)
nueva página del texto (beta)