Introducción
El uso de equipo de bajo costo para el laboratorio presenta la ventaja de contar con el número de equipos necesarios para que cada estudiante pueda realizar la experiencia práctica de laboratorio en un grupo no mayor de 3 estudiantes en los casos en que el costo comercial de estos equipos es muy elevado (Alfaro & Alfaro, 2017) (Vilasó, 2014) (McClain, 2014). Así se han reportado en la literatura equipos de bajo costo tales como termómetros (Kubínová & Šlégr, 2015), fotómetros (McClain, 2014), pH-metros (Kubínová & Šlégr, 2015), termocicladores (Mabbott, 2014) y colorímetros (Martínez & Baeza, 2004). En lo que respecta a potenciostatos, Vilasó (2014) construyó un potenciostato de bajo costo y funcionamiento simple, sin utilizar un software para su operación, el cual consiste en un circuito que se compone de una fuente de poder, una resistencia, un reóstato, un multitester básico en función voltímetro, una celda electroquímica de 3 electrodos y otro multitester básico en función de amperímetro. Todo el circuito fue montado en una caja de plástico desechable (Vilasó, 2014). Por otra parte, Meloni (2016) diseñó y construyó un potenciostato versátil basado en la filosofía off the shelf capaz de realizar experimentos de voltamperometría cíclica que le permitieron calcular el coeficiente de difusión del ferricianuro en disolución acuosa, cuyo valor medido estuvo de acuerdo con el reportado en la literatura, transformando este equipo en una alternativa competitiva no comercial, para efectuar trabajo de laboratorio en los campos de la electrónica y la electroquímica (Meloni, 2016). Alfaro y Alfaro (2017) construyeron un potenciostato de bajo costo utilizando una fuente de poder de 12 V y 3 A Impotec, una resistencia de 5 kW, un potenciómetro en función reóstato de 10 kW, un voltímetro de alta resistencia UNI-T UT151 (Modern Digital Multimeters), una celda electroquímica de 3 electrodos, la cual está compuesta por el electrodo auxiliar, el electrodo de referencia y el electrodo de trabajo, y un amperímetro Nagachi DT830B (Digital Multimeter) lo utilizaron para determinar el potencial de corrosión y el comportamiento cronoamperométrico de acero al carbono SAE 1010 en solución de NaCl al 0,9% en volumen en presencia y ausencia de sulfato de atropina (Alfaro & Alfaro, 2017). Esto es comparativamente más simple que potenciostatos que han sido diseñados para estudios de corrosión, ya que estos requieren para su construcción conocimientos avanzados en electrónica y programación (Barrero et al., 2004) (Roa-Rodríguez et al., 2015). Los potenciostatos generalmente se utilizan para obtener las curvas corriente potencial de los metales en solución que se pueden determinar mediante el método de voltametría lineal (Cáceres, Vargas, & Herrera, 2007). Cuando la curva corriente potencial generada por esté método, presenta segmentos lineales en ambas ramas la anódica y la catódica como lo muestra la figura 1, los parámetros electroquímicos y la velocidad de corrosión se determinan por el método de extrapolación de Tafel y se dice que la cinética del proceso es controlada por activación (Khaled & Amin, 2009). Este método requiere que tanto la parte anódica, como la parte catódica de la curva corriente potencial presenten una región de Tafel (Tafel, 1905) (McCafferty, 2005) para lo cual el oxígeno disuelto en la solución debe ser retirado y no deben formarse compuestos adicionales sobre la superficie del metal; esto se logra burbujeando Ar o N2 en la solución, lo cual no ocurre en medio ambientes naturales (Cáceres, 2017).

Figura 1: Representación esquemática de la curva corriente potencial que presenta la región de Tafel mostrando cada una de las reacciones electroquímicas involucradas.
El principio de electroneutralidad de la materia dicta que, para evitar la acumulación de carga en el metal sumergido en el medio corrosivo, la suma de todas las corrientes de oxidación debe ser igual a la suma de todas las corrientes de reducción. De acuerdo a lo anterior cualquier metal sumergido en una solución tendrá en forma natural un potencial, llamado potencial de corrosión, que cumple con este requisito. Por lo tanto, en el potencial de corrosión se cumple que la suma de la corriente anódica es igual a la suma de la corriente catódica (G. S. Frankel, 2016) (Cáceres, 2017). No olvidando que las corrientes de reducción (Ic) son negativas y las corrientes de oxidación son positivas (Ia). El potencial de corrosión es también llamado potencial de circuito abierto o mejor conocido por sus ciclas en inglés OCP (open circuit potential), potencial libre o potencial de reposo (G. Frankel, 2007). El potencial de corrosión es un potencial mixto (Cáceres, 2017) que indica que su valor depende de las velocidades de las reacciones anódicas, así como las reacciones catódicas; además el potencial de corrosión estará entre los valores de los potenciales de equilibrio de las dos reacciones parciales o componentes de la corrosión. Se puede ver que el potencial de corrosión siempre toma un valor entre los potenciales de equilibrio de las dos reacciones parciales. El potencial de corrosión y la densidad de corriente pueden cambiar con el tiempo si la superficie o la solución cambian y las líneas de Tafel que representan las reacciones también van a cambiar. Debe tenerse en cuenta que el electrodo no está en equilibrio con el potencial de corrosión porque ocurren cambios netos: el metal se oxida y se reduce el agua u otros oxidantes. El potencial de corrosión y la densidad de corriente de corrosión están influenciadas entonces tanto por factores termodinámicos, a través de los potenciales de equilibrio de las reacciones, y por la cinética, a través de las densidades de corriente de intercambio y las pendientes Tafel de las reacciones anódica y catódica (G. S. Frankel, 2016). Lejos del potencial de corrosión, una de las reacciones, ya sea la reacción catódica o anódica, se produce a un ritmo mucho mayor, y entonces la relación tiende a seguir la línea recta de Tafel para la reacción anódica a altos potenciales y la línea recta de Tafel para la reacción catódica en bajos potenciales. En el potencial de corrosión, Ia = Ic, entonces la corriente medida o neta es igual a cero, para un sistema corrosivo en el que solo ocurre una única reacción anódica y una única reacción catódica. De esta forma, la corriente neta es una función de potencial aplicado y está dada por la ecuación de Wagner y Traud la cual es similar a la ecuación de Butler-Volmer, que describe la cinética de una única reacción a potenciales por encima y por debajo del potencial de equilibrio para dicha reacción (Spiro, 1986). Por el contrario, la ecuación de Wagner y Traud, describe la corriente neta cuando dos diferentes reacciones ocurren en la superficie de un solo electrodo y puede ser utilizada para determinar la velocidad de corrosion ajustando la curva corriente potencial a esta ecuación 1.
E es el potencial aplicado para polarizar el sistema, i es la densidad de corriente total o neta o también se conoce con el nombre de externa, E corr e i corr son el potencial y la densidad de corrosión respectivamente, b c y b a son las pendientes catódica y anódica de Tafel. Para el método de voltametría lineal, se recomienda utilizarla en un rango de potencial de ± 200-250 mV respecto al potencial de corrosión, siempre que las velocidades de las otras reacciones anódicas como las asociadas con reacciones redox secundarias sean despreciables en comparación con la reacción principal, que es requisito de todas las determinaciones electroquímicas de velocidad de corrosión (G. Frankel, 2008). Ambas reacciones deben estar en una condición de control de activación con un potencial de corrosión que debe estar lejos de los potenciales de equilibrio (G. S. Frankel, 2016). Cuando la curva corriente potencial generada por el método de voltametría lineal, presenta segmentos no lineales figura 2, los parámetros electroquímicos y la velocidad de corrosión no pueden determinarse por el método de extrapolación de Tafel ni por el ajuste a la ecuación de Wagner y Traud y se dice que la cinética del proceso es controlada por difusión o por una mezcla entre el control por activación y el control por difusión esto es por control mixto (Cáceres et al., 2007) (Flitt & Schweinsberg, 2010).

Figura 2: Representación esquemática de una curva corriente potencial que no presenta la región de Tafel mostrando cada una de las reacciones electroquímicas involucradas.
Por otra parte, el uso de inhibidores de corrosión es uno de los métodos más utilizados para prevenir la corrosión de acero al carbono en contacto con un medio acuoso (Novoa et al., 2019). Los inhibidores de corrosión son sustancias químicas que se adicionan a un medio ambiente dado, para disminuir la velocidad de corrosión de los metales expuestos a ese medio ambiente (Alhaffar, Umoren, Obot, & Ali, 2018). Muchos compuestos orgánicos que contienen nitrógeno, oxígeno y/o azufre en su estructura presentan propiedades de inhibición de corrosión para metales especialmente acero al carbono en medio ácido (Behpour, Ghoreishi, Soltani, Hamadanian, & Gandomi, 2008), ya que soluciones ácidas han sido ampliamente utilizadas para el decapado, descalcificación y limpieza de pozos de petróleo (Schmitt, 1984). La efectividad de estos compuestos como inhibidores de corrosión ha sido interpretada en términos de su estructura molecular, tamaño molecular y masa molecular, heteroátomos presentes y tendencias de adsorción (Ahamad & Quraishi, 2010). La primera etapa en el mecanismo de acción de estos compuestos en medio ácido es su adsorción en la superficie del metal (Rudesh & Mayanna, 1977). Esta adsorción requiere la existencia de fuerzas atractivas entre el adsorbato y el metal, de acuerdo a estas la adsorción puede ser fisisorción, quimisorción o una combinación de ambas. La fisisorción se debe a las fuerzas de atracción electrostáticas entre los iones orgánicos de inhibidor o dipolos y la superficie eléctricamente cargada del metal. La quimisorción se debe a la interacción entre pares de electrones no compartidos o electrones p del adsorbato con el metal para formar un tipo de enlace coordinado o dativo lo que debía tener lugar en presencia de un heteroátomo como fósforo, selenio, azufre, nitrógeno u oxígeno, que contengan un par electrónico y/o anillos aromáticos en su estructura (Abd El-maksoud & Hassan, 2007). Según este mecanismo, se genera una reducción de la reacción anódica o de la reacción catódica o ambas como resultado de la adsorción del inhibidor sobre la superficie del metal (Ahamad & Quraishi, 2010). Dentro de los compuestos cuyas propiedades anticorrosivas han sido investigadas, están los compuestos farmacéuticos (Vaszilcsin, Ordodi, & Borza, 2012) (Samide, 2013) y los denominados inhibidores verdes “Green inhibitors” ya que muchos inhibidores de corrosión comerciales no solo son de alto costo sino que también son peligrosos para el medio ambiente, por lo que su uso se ha reducido debido a las modificaciones en las normas, por ejemplo la norma ISO 14001, que hace referencia a la restricción en el uso de inhibidores de corrosión sintéticos (Mandujano-Ruíz, Morales-Hernández, Herrera-Hernández, Corona-Almazarán, & Juárez García, 2017), pero la mayoría de estos inhibidores no han sido investigados en soluciones que contengan cloruro de sodio, lo cual resulta vital para entender el comportamiento de estos materiales en condiciones marinas y en el tratamiento industrial de residuos que contengan cloruro (Cáceres et al., 2007). De éste modo nace la necesidad de crear formulaciones totalmente amigables con el ambiente, por lo que en los últimos años surge la propuesta del uso de inhibidores verdes generando una nueva línea de investigación de gran impacto tecnológico por su bajo riesgo de contaminación al medio ambiente (Cáceres, 2018). El efecto del inhibidor se puede entender y clasificar por la observación de las curvas corriente potencial del metal en la solución del electrolito en estudio en presencia y ausencia del inhibidor. La figura 3 muestra una representación esquemática de los tipos de inhibición y sus efectos sobre las curvas corriente potencial. Considerando lo anterior, los inhibidores se pueden clasificar como anódicos, catódicos o mixtos. Como los nombres implican, un inhibidor anódico reduce la velocidad de la reacción anódica mientras tiene menos efecto en la reacción catódica, un inhibidor catódico reduce la velocidad de la reacción catódica mientras tiene menos efecto sobre la reacción anódica, y un inhibidor mixto reduce la velocidad de ambas reacciones por igual. El potencial de corrosión a menudo será diferente en una solución que contiene inhibidor en comparación con el valor en una solución sin inhibidor, y la naturaleza del cambio también será diferente para las diferentes clases de inhibidor. El potencial de corrosión aumentará para un inhibidor anódico, disminución para un inhibidor catódico, y no presentará cambios para un inhibidor mixto siempre que la velocidad de corrosión se reduzca, el cambio en el potencial de corrosión se puede utilizar como un criterio diagnóstico respecto al tipo de inhibidor de que se trata (G. S. Frankel, 2016).
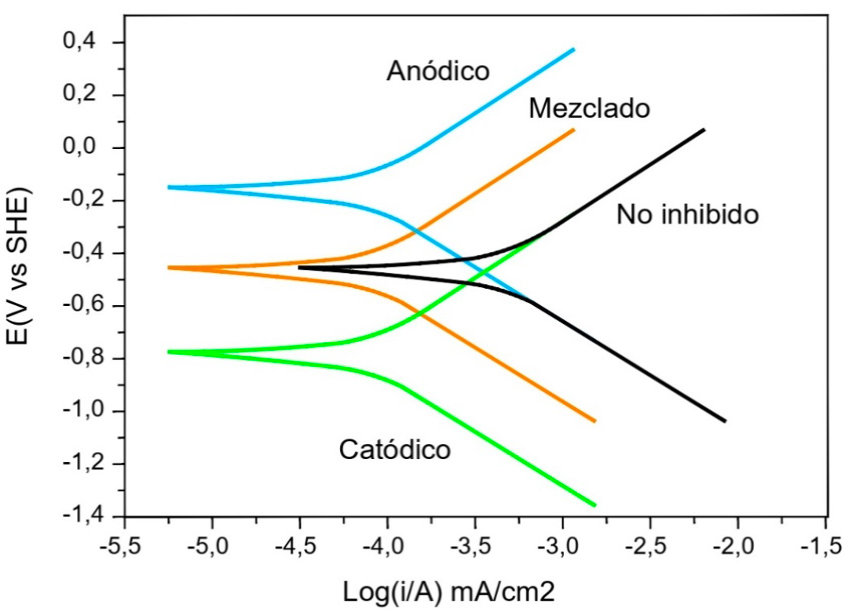
Figura 3: Representación esquemática de los efectos de inhibidores anódico, catódico y mixto o mezclado.
Generalmente, el medio en estudio es un medio ácido (ácido clorhídrico o ácido sulfúrico), Dentro de los compuestos cuyas propiedades anticorrosivas han sido investigadas en medio ácido está el 1-fenil-H-tetrazol-5-tiol (Ver Figura 4). Sin embargo, estas propiedades han sido investigadas sobre cobre (Xhanari, K., & Finšgar, 2016), Aluminio (Khaled & Al-Qahtani, 2009) y sobre bronce (Monticelli et al., 2019), pero no sobre acero ni en soluciones que contengan cloruro de sodio, lo cual resulta vital para entender el comportamiento de estos materiales en condiciones marinas y en el tratamiento industrial de residuos que contengan cloruro (Cáceres et al., 2007). La forma estándar de verificar la capacidad de inhibición de la corrosión de una molécula es la realización de experimentos potenciodinámicos, en los cuales se polariza el electrodo de trabajo a un potencial fijo versus el electrodo de referencia y se mide la velocidad de corrosión en presencia y ausencia del inhibidor. Si la velocidad de corrosión disminuye en presencia del inhibidor, se concluye que este inhibe la corrosión del acero (Krishnegowda et al., 2013). Así el crear una práctica de laboratorio que investigue las propiedades anticorrosivas de un inhibidor de corrosión que incluya el uso de un potenciostato de fuente abierta y bajo costo, no solo posicionaría al alumno en conocimientos, habilidades y destrezas para manejar una determinada técnica (Lagos & Camus, 2016), sino que también le permitiría integrar los conocimientos adquiridos en otras asignaturas de su plan de estudios. Considerando lo anterior, el objetivo del presente trabajo fue el uso de un potenciostato de fuente abierta de bajo costo para estudios de inhibición de corrosión de acero específicamente la determinación de la velocidad de corrosión.
Materiales y Método
Experimental
La figura 5 muestra el potenciostato de fuente abierta de bajo costo denominado Rodeostat, castellanizado Rodeostato. El Rodeostato es un potenciostato de código abierto (Cataldi. & Salgueiro, 2007) en cuanto a hardware y software. El Rodeostato está fabricado con una placa Teensy 3.2. que permite programar el potenciostato utilizando el IDE de Arduino (Rashtian & Ouyang, 2017) (Stoffregen & Coon, 2017) en el lenguaje de programación Python (Challenger-Pérez et al., 2014). El hardware trabaja con Rangos de salida de voltaje programable de 12 bits: +/- 1V, 2V, 5V y 10V, medición de corriente de 16 bits con rangos programables de +/- 1uA, 10uA, 100uA, 1000uA con entradas DIO y analógicas adicionales. Los Métodos implementados actualmente en el potenciostato son voltametría cíclica, voltamperometría de barrido lineal, cronoamperometría entre otros.
Una vez descargada la biblioteca de archivos desde la página del fabricante (https://iorodeo.com/products/potentiostat-shield), la cual contiene los programas en lenguaje Python necesarios para la operación del potenciostato. Se debe instalar el software “SerialPort-Bridge”. Esta interfase debe ejecutarse cada vez que se utilice el potenciostato para realizar adquisición de datos. En la Figura 6 se muestra la pantalla de acceso de la interfase “SerialPort-Bridge” al hacer clic en su ícono, posteriormente se desplegará lo que se muestra en la Figura 7.

Figura 6: Acceso a la interfase “SerialPort-Bridge” Al hacer clic en la parte superior de la pantalla activando la pestaña SERIAL PORTS.
En la Figura 7 se puede apreciar que la sección “Connection Status” está en estado “false”, lo que significa que no existe conexión entre el equipo y el computador. Esta condición debe cambiar a “true” para indicar que el potenciostao y el computador están conectados y listos para la ejecución de cualquiera de los test. Al mismo tiempo es posible ver en la sección “Available Ports” el puerto en el cual está conectado el equipo, que en nuestro caso corresponde al COM3. Esta interfase se debe mantener abierta durante todo el tiempo que se esté utilizando el equipo. En la carpeta “rodeostat_webapp_static” se puede abrir la webapp. Esta webapp permite la administración de los tipos de test a ejecutar, rango de parámetros a utilizar en cada test y la adquisición de datos de cada test ejecutado. La Figura 8 muestra la pantalla de acceso a la webapp al hacer clic en el archivo “index” en la capeta “rodeostat_webapp_static” como lo muestra la Figura 9.

Figura 8: Pantalla de Acceso a la webapp. En esta pantalla se debe activar el switch “connect to serialport-bridge” y se debe seleccionar el puerto serial donde está conectado el Rodeostato en nuestro caso es “COM3”.
Luego debe activarse el switch “open serial port”, modificando la pantalla anterior por la que muestra la Figura 10.
La adecuada conexión del potenciostato con el computador, se puede desplegar la interfase “SerialPort-Bridge” y verá que su estatus ha cambiado a “true” y se indica como “COM3” en color rojo como una señal de la correcta conexión del Rodeostato. Lo anterior se puede observar en la Figura 11.
Al hacer clic en la zona demarcada en rojo en la Figura 12, se desplegarán las pestañas “Device Connection”, “Test & Parameters” y “Data Acquisition”. En la Figura 13 se puede ver las 3 opciones de trabajo que el equipo permite como es la conexión del puerto serial, selección de test y parámetros y la adquisición de datos.
Luego se debe continuar con la selección de la opción “Test & Parameters”. Lo anterior permite el despliegue de la pantalla que se muestra en la Figura 14, desde donde se debe elegir el test que se aplicará. En nuestro caso corresponde a Voltametría lineal o “voltammetric test” opción “lineal sweep” como lo muestra la Figura 15.
En la Figura 15 se puede observar los valores asignados a los distintos parámetros involucrados en la toma de datos asociados al test de voltametría lineal, en nuestro caso se ha utilizado un rango de corriente de 100 uA; tasa de muestreo de 1 Hz para recolectar un dato por segundo; tiempo de silencio en 0 s y valor de silencio en 0 V. Se debe seguir con la asignación del valor de voltaje inicial como -1,5 V y voltaje final de 0,4 V. En nuestro caso se ha utilizado una velocidad escaneo de 0,002 V/s.
Una vez ajustados los parámetros asociados al test a aplicar, se debe hacer clic en la pestaña “Data Acquisition” para desplegar la pantalla que se muestra en la Figura 16. En esta ventana se puede iniciar el test y grabar los datos obtenidos de cada test. Previo a lo anterior se debe hacer clic sobre el ícono de grabado encerrado en el círculo rojo para activar la interfase donde se registran los datos del test aplicado, el que se muestra en la Figura 17. Para ello, se debe registrar como usuario y mantener la interfase abierta durante todo el tiempo de trabajo.
Una vez que se ha iniciado el test, al hacer clic en el botón “RUN TEST”, se mostrará una barra horizontal que permitirá conocer avance del test y el momento en que se ha completado el tiempo definido para la toma de datos y con ello se activará el botón “SAVE DATA”. Al hacer clic en el botón “SAVE DATA” se podrá guardar el archivo de extensión txt con los datos del test aplicado en la carpeta de descargas del sistema de su computador. En el presente trabajo se utilizó el modo de voltamperometría de barrido lineal en el cual la corriente de voltamperometría se mide mientras que el potencial entre el electrodo de trabajo y el de referencia barre linealmente en un cierto rango. Como electrodo de trabajo se empleó un electrodo de disco rotatorio de acero al carbono SAE 1020 con 98,5 % de hierro, 0,2 % C, 0,6 y trazas de Mn, P, S, Si, Sn, Cu, Ni, Cr, y Mo, todas las mediciones se realizaron a una velocidad de rotación del electrodo de 1200 rpm. Se optó por este tipo de electrodo para mejorar la calidad de las mediciones (Alfaro & Alfaro, 2018). El electrodo se construyó utilizando un cilindro de acero al carbono SAE 1020 el cual se embebió en resina epóxica, dejando su base expuesta con un área de 0,1257 cm2. Como electrodo de referencia se empleó un electrodo de Ag/AgCl KCl 0.1 M. y como electrodo auxiliar, un alambre de platino (Alfaro, 2014); si no se dispone de platino se puede usar grafito o acero inoxidable. Los 3 electrodos se montaron en una celda clásica. Debe tenerse especial cuidado en la colocación de los 3 electrodos en la celda, debiendo quedar estos en posiciones fijas separados por no más de 1,0 cm para que no se produzca interferencia entre ellos, ya que la corriente entra en la solución de electrólito (medio corrosivo) por el electrodo de trabajo y sale de la solución de electrólito por el electrodo auxiliar. Como medio corrosivo se utilizó una solución de NaCl al 3,0 % en peso saturada de O2 porque esta concentración ya ha sido utilizada para simular agua de mar (Cáceres et al., 2007). Como inhibidor de corrosión se utilizó 1-fenil-H-tetrazol-5-tiol.
Modelo cinético electroquímico
La velocidad de corrosión se determinó utilizando el procedimiento descrito por Alfaro y Alfaro (Alfaro & Alfaro, 2018), el cual se basa en un modelo cinético electroquímico y el uso de la función Solver de Excel la que permite resolver modelos no lineales (Alfaro, 2014). Esto es modelar curvas corriente potencial que no presentan una región de Tafel como la curva mostrada en la figura 17, fue desarrollado por Cáceres en 2009 (Cáceres et al., 2009) y utiliza el principio de superposición de Wagner y Traud (Mansfeld, 2006), que considera que la densidad de corriente total (it) es la suma algebraica de las corrientes anódicas (ia) y catódicas (ic), ecuación 2.
En la ecuación anterior, la densidad de corriente catódica corresponde a la densidad de corriente de reducción del oxígeno (iO2) en control mixto y la densidad de corriente anódica corresponde a la oxidación del hierro (iFe) en control de activación, lo cual puede ser expresado en la ecuación 3.
iO2 e iFe, pueden ser calculadas con las ecuaciones 4 y 5 respectivamente.
R corresponde a la constante universal de los gases, T a la temperatura absoluta, n al número de electrones involucrados en la reacción, α al coeficiente de trasferencia y F a la constante de Faraday. Se considerará que las variables temperatura, coeficiente de transferencia y el número de electrones transferidos son constantes, se definirá las pendientes catódica y anódica de pseudo Tafel con las ecuaciones 6 y 7 respectivamente.
Se utiliza el término “pseudo Tafel” debido a la ausencia de linealidad tanto en la rama anódica como en la rama catódica de nuestras curvas de corriente potencial, que en orden estricto solo puede utilizarse el término pendiente anódica y pendiente catódica de Tafel, para curvas corriente potencial que presenten una región lineal en su parte anódica y catódica (Khaled & Amin, 2009).
Remplazando las ecuaciones 6 y 7 en las ecuaciones 4 y 5 se obtienen las ecuaciones 8 y 9.
Remplazando las ecuaciones 8 y 9 en la ecuación 3, se obtiene la expresión para la densidad de corriente total, ecuación 10. La cual es una ecuación no lineal con 5 constantes, que no puede resolverse utilizando métodos analíticos y debe resolverse por métodos numéricos.
iL,O2 (A cm-2) es la densidad de corriente límite para la reducción del oxígeno, io,O2 (A cm-2) es la densidad de corriente de intercambio para el oxígeno, Eeq,O2 (V) es el potencial de equilibrio para la reducción del oxígeno, io,Fe, es la densidad de corriente de intercambio para el hierro, Eeq,Fe es el potencial de equilibrio para el hierro. La densidad de corriente de corrosión (icor) puede ser calculada de la ecuación 10, remplazando el potencial aplicado (E) por el potencial de corrosión (Ecor), obtenido directamente de la curva corriente-potencial experimental y los parámetros electroquímicos para la reacción catódica de la reducción del oxígeno y la oxidación del hierro, obtenidos previamente del ajuste de la ecuación 10 a los datos experimentales bajo la condición de corriente total cero (it = 0) ecuación 11.
Como en esta condición la densidad de corriente catódica es igual a la densidad de corriente anódica, puede utilizarse indistintamente la ecuación 8 o la ecuación 9 para calcular la densidad de corriente de corrosión y con este valor la velocidad de corrosión ecuación 12 (Alfaro, 2014).
Donde k1 = 3,28 mm mol/A cm año, la cual es concordante con la reportada por Khaled and Amin (Khaled & Amin, 2009) y por la ASTM en su reporte de 1999 (ASTM G 102-89, 1999). Donde la velocidad de corrosión para el acero al carbono viene dada en mm año-1, M es el peso atómico del hierro 55,85 g mol-1, n es el número de electrones transferido en la reacción de corrosión (2 en este caso) y d la densidad del hierro 7,88 g cm-3.
Resultados y discusión
La calibración del potenciostato se efectuó utilizando el método de la celda ficticia, figura 18, reportado por Vilasó (2014) a una velocidad de escaneo de 2,0 mVs-1 (Vilasó, 2014) siguiendo el procedimiento descrito por Hernández (Hernández, 2013). Se prefirió utilizar este método, en lugar del método de calibración por voltamperometría de una solución de ferricianuro de potasio (K3Fe(CN)6), por su simplicidad y bajo costo. La figura 19 muestra la relación corriente-potencial utilizando una celda ficticia, conformada por una resistencia de 50,0 kW. El comportamiento que presenta es lineal y sigue la ley de Ohm, lo que permite corroborar el funcionamiento adecuado del potenciostato. El coeficiente de correlación lineal fue de 0,9999; esto significa que la relación entre el potencial aplicado y la corriente que circula es lineal, por lo que el circuito es completamente funcional. La pendiente de esta gráfica fue de 1,99904E-05 W-1 y representa el inverso de la resistencia de la celda ficticia, esto es de 50.024,01153 W, aproximadamente 50,0 kW.

Figura 19: Relación corriente-potencial para la celda ficticia conformada por una resistencia de 50,0 kW utilizada en la calibración del potenciostato.
La figura 20 muestra las curvas corriente-potencial de acero al carbono SAE 1020 en presencia de solución de NaCl 3,0 % en peso, saturada de oxígeno O2, a diferentes concentraciones del inhibidor. De esta se puede apreciar que tanto la parte anódica como la parte catódica de la curva no presentan la región de Tafel, estos resultados son similares a los reportados por (Cáceres et al., 2007). Las figuras 21, 22 y 23 muestran la concordancia de los datos experimentales con el modelo de Cáceres para las diferentes concentraciones de inhibidor estudiadas. Finalmente, la Tabla 1 muestran los valores de los parámetros electroquímicos, la velocidad de corrosión y el porcentaje de inhibición y la Tabla 2 los estadígrafos para evaluar la calidad de ajuste del modelo a los datos experimentales a las diferentes concentraciones del inhibidor. Estos resultados obtenidos en una práctica de laboratorio con un potenciostato de fuente abierta y bajo costo, proporcionan al estudiante no solo conocimientos y habilidades en cinética electroquímica, sino que también logran que aplique conceptos de química orgánica y química analítica instrumental al interpretar sus resultados utilizando un instrumento con datos reales. Es decir, se cumpliría con todas las expectativas de la docencia en el laboratorio (Lagos & Camus, 2016). En este caso, el alumno comprende el concepto de velocidad de corrosión en una solución saturada de O2 y la técnica de medida utilizando un potenciostato (Alfaro, 2014) (Alfaro & Alfaro, 2018), incluso conocerá el lenguaje de las características de los electrodos de trabajo (tipo de electrodo, corrosión en solución acuosa, inhibición de la corrosión, etcétera), es decir, está ingresando al mundo de los instrumentos modernos de laboratorio al utilizar un equipo que es capaz de medir velocidad de corrosión de fuente abierta con un bajo costo en comparación con los equipos comerciales. Dado que en este caso permitirán resolver un problema relacionado con la investigación de las propiedades de inhibición de corrosión de acero, sino que también está realizando una experiencia práctica en cinética electroquímica. Además, la práctica de laboratorio propuesta permite realizar posteriores experimentos, con otros compuestos orgánicos para determinar sus propiedades anticorrosivas, y así el alumno podría relacionar la velocidad de corrosión del acero en presencia del inhibidor con la estructura molecular de este. La efectividad del inhibidor se calcula en porcentaje de inhibición, empleando la ecuación 13.
Donde CRo y CRi denotan el valor de la velocidad de corrosión del sistema sin y con inhibidor, respectivamente, obtenidas por ajuste del modelo de Cáceres de las curvas de polarización.

Figura 20: Curvas corriente-potencial para acero al carbono en una solución de NaCl a 3,0 % en peso, saturada de oxígeno O2, sin buffer para las diferentes concentraciones del inhibidor estudiadas.

Figura 21: Curvas corriente-potencial para acero al carbono en una solución de NaCl a 3,0 % en peso, saturada de oxígeno O2, sin buffer (X) y curva-corriente predicha por el modelo de Cáceres (línea roja continua).

Figura 22: Curvas corriente-potencial para acero al carbono en una solución de NaCl a 3,0 % en peso, saturada de oxígeno O2, sin buffer (X) para una concentración del inhibidor de 5,0 *10-4 y curva-corriente predicha por el modelo de Cáceres (línea roja continua).

Figura 23: Curvas corriente-potencial para acero al carbono en una solución de NaCl a 3,0 % en peso saturada de oxígeno, O2 sin buffer (X) para una concentración del inhibidor de 1,0 *10-3 y curva-corriente predicha por el modelo de Cáceres (línea roja continua).
Tabla 1: Parámetros electroquímicos, velocidad de corrosión y porcentaje de inhibición de acero SAE 1020 en una solución de NaCl al 3,0 % en peso saturada de oxígeno, O2 en presencia y ausencia de un inhibidor de corrosión.
| Parámetros Electroquímicos | Concentración del Inhibidor (M) | ||
|---|---|---|---|
| Blanco | 5,0E-04 | 1,0E-03 | |
| io,O2 (A m-2) | 1,09E-01 | 1,69E-03 | 1,04E-05 |
| tc,O2 (V dec-1) | 0,78 | 0,35 | 0,22 |
| iL,O2 (A m-2) | 312,85 | 9,53 | 12,52 |
| io,Fe (A m-2) | 1,88E-01 | 5,34E-02 | 1,65E-02 |
| ta,Fe (V dec-1) | 0,31 | 0,21 | 0,16 |
| Ecorr (V) | -0,274 | -0,300 | -0,342 |
| icorr (A m-2) | 1,94 | 1,54 | 1,00 |
| CR (mm año-1) | 2,26 | 1,80 | 1,16 |
| % I | 0 | 20,4 | 48,7 |
Tabla 2: Parámetros estadísticos de bondad de ajuste del modelo de Cáceres para acero SAE 1020 en una solución de NaCl al 3,0 % en peso saturada de oxígeno, O2 en presencia y ausencia de un inhibidor de corrosión.
| Parámetros Estadísticos | Concentración del Inhibidor (M) | ||
|---|---|---|---|
| Blanco | 5,0E-04 | 1,0E-03 | |
| R2 | 0,9981 | 0,9993 | 0,9909 |
| SSE | 1,10E-02 | 5,77E-03 | 1,30E-01 |
| RMSE | 1,05E-01 | 7,60E-02 | 3,60E-01 |
| χ2 | 1,12E-02 | 5,90E-03 | 1,32E-01 |
Conclusiones
Las prácticas de laboratorio que permitan realizar mediciones en forma directa son muy importantes en cinética electroquímica para la toma de conciencia del estudiante de cómo se miden la cinética de corrosión. De aquí la importancia de contar con una práctica de laboratorio para la determinación de la velocidad de corrosión en medios corrosivos reales, esto es sistemas que contenga oxígeno disuelto con un potenciostato de fuente abierta de bajo costo. Es aquí donde desde el punto de vista del proceso de enseñanza-aprendizaje para los alumnos de las Carreras de Licenciatura en Química, Ingeniería en Obras Civiles entre otras, les permitiría adquirir la destreza en el manejo de un equipo de medición que posibilite resolver un problema real, como lo es a (la) determinación de la velocidad de corrosión en agua de mar simulada, aireada esto es una solución de NaCl al 3,0 % en peso saturada de oxígeno, O2 en presencia y ausencia de un inhibidor de corrosión en agua de mar simulada aireada esto es una solución de NaCl al 3,0 % en peso saturada de oxígeno, O2 en presencia y ausencia de un inhibidor de corrosión.











 nueva página del texto (beta)
nueva página del texto (beta)















