Introducción
Con frecuencia ocurre que la forma en la que aprendimos algo en la escuela se implanta tan profundamente en nuestra forma de pensar que nos impide imaginar o aceptar otras formas de aprenderlo. Cuando estas formas de aprender pasan de una generación a la siguiente, se crean escuelas de pensamiento, tradiciones que ya no se cuestionan. Los maestros universitarios no somos la excepción y tendemos a enseñar de la misma forma y con el mismo enfoque que nos enseñaron lo que bien aprendimos.
En la enseñanza, la tabla periódica es un vehículo para introducirnos a la historia de la química, para mostrar cómo funciona la ciencia y para el aprendizaje de la reactividad química. En la Facultad de Química de la UNAM, la ley periódica se aborda en las asignaturas del tronco común: Química General I y Estructura de la Materia. En particular, la revisión de las propiedades periódicas y sus variaciones ilustran la ley periódica propuesta por Dimitri I. Mendeleiev en 1869 al tiempo que se las relaciona con los modelos atómicos. Esta forma de presentar la periodicidad es típica en la mayoría de los libros de texto con algunas variantes.
En los exámenes de diagnóstico que se aplican en los cursos de Química Inorgánica I se obtienen índices bajos en las preguntas relacionadas con las afinidades electrónicas y las energías de ionización (Escalante Tovar, 2018). Las causas precisas de esto no han sido estudiadas de forma sistemática en la Facultad de Química. Cabe decir que nuestros estudiantes conforman un abanico muy amplio de perfiles. Muchos poseen rezagos de diversos tipos en su formación previa lo cual dificulta su comprensión de la ley periódica y su explicación con base en modelos atómicos.
Descripción del problema
Entre las dificultades en el aprendizaje de las propiedades periódicas, quizás el factor más importante que dificulta la compresión de la afinidad electrónica en particular es que los libros de texto no ofrecen un discurso unificado sobre esta propiedad. Un alumno que estudie en un libro enfrentará dificultades para compartir lo aprendido con un compañero que estudió en un texto con un enfoque diferente. También ocurre que muchos profesores adoptan el enfoque de un solo texto y enseñan únicamente éste a sus alumnos. A veces ellos mismos se confunden con las posturas de los libros de texto y transfieren su confusión a los alumnos.
No es el objetivo hacer aquí una revisión exhaustiva de las diferentes definiciones de afinidad electrónica que hay en la literatura ni de cómo se determinan experimentalmente. Ver (Jonathan C. Rienstra-Kiracofe, 2002). Los enfoques más comunes empleados en los libros de texto se encuadran en una de las dos definiciones siguientes:
a) … está relacionada con la energía que se libera cuando un átomo neutro en fase gaseosa adquiere un electrón adicional (Rayner-Canham, 2000; Atkins, 2006; Housecroft, 2006). Ver reacción 1.
b) … está relacionada con la energía involucrada cuando se extrae un electrón de un anión en fase gaseosa (Chamizo, 1984; Cruz, 1987; Wulfsberg, 1991); Ortiz (1993); (Miesler, 2014). Ver reacción 2.
Algunos autores presentan los dos enfoques (Huheey, 1993).
Las reacciones 1 y 2 representan procesos en direcciones contrarias pero tienen en común que involucran diferencias de energía entre dos estados de un sistema.
Analicemos las principales dificultades a las que se enfrentan los estudiantes con algunas de esas definiciones.
Para empezar, las definiciones tipo a) mencionan energía que se libera, lo cual no es cierto en todos los casos. El nitrógeno es uno de éstos.
Otro de los problemas más importantes es el del lenguaje empleado. De inicio en las palabras afinidad electrónica no hay ninguna implicación energética explícita. En cambio el término energía de ionización ya contiene en su nombre la palabra energía. No obstante, en las definiciones de afinidad electrónica sí se habla de cambio de energía, de energía liberada o de energía requerida; unos autores prefieren hablar de energías involucradas o intercambiadas. También se la define en términos de cambio de entalpía de ganancia de electrones, etc. Todo esto representa problemas para los estudiantes de primeros semestres que están iniciando el estudio de la termodinámica. La segunda dificultad que hay que superar es que los valores reportados en tablas se refieren generalmente a entalpías por mol, no a energías por átomo. Algunos profesores no se detienen en este detalle y evitan mencionar que las diferencias entre cambios de entalpía ∆H y cambios de energía ∆E suelen ser pequeñas (difieren en 5/2RT) y de que las variaciones por átomo correlacionan o son escalables con las variaciones de energía por mol.
Pero hay otra dificultad: la cuestión de los signos. Dependiendo de la tabla que uno consulte encontrará valores que difieren no tanto en la magnitud pero sí en el signo. Hay quienes presentan los datos de las entalpías ∆H, otros los de las -∆H (Atkins, 1998); otros más los de las energías de ionización cero (Wulfsberg, 1991).
Todo esto contribuye a la confusión de alumnos y no pocos profesores.
Fundamentos de la propuesta
La propuesta que se presenta aquí tiene como punto de partida los argumentos que a continuación se exponen.
Si aceptamos que, en sentido amplio, afinidad electrónica es la cualidad de una especie química de retener electrones, sean estos sus propios electrones o electrones provenientes de otros átomos, entonces la energía involucrada en la remoción de esos electrones será una medida cuantitativa de la afinidad por esos electrones. Mientras más energía se requiera para extraerlos mayor será la afinidad de la especie por esos electrones y viceversa. Como se trata de extraer electrones, esa energía involucra un proceso análogo al de la ionización de una especie neutra. En los casos en que se requiera energía para extraer a los electrones el proceso será endotérmico, cuando, al contrario, se libere energía el proceso será exotérmico. Estos valores con sus signos son una medida de la propensión de una especie a aceptar o perder electrones.
Podemos, en consecuencia, unificar la discusión de la afinidad electrónica con la de las energías de ionización. Lo único que se requiere para lograrlo es adoptar el enfoque b) expresado por la reacción 2, la cual es una reacción de extracción de electrones análoga a las de ionización. La energía involucrada en esta reacción se conoce como energía de ionización cero, I 0. Esta definición ya ha sido adoptada por la IUPAC (McNaught, 2014) y Webelements (Winter, 2019) entre otras fuentes de consulta frecuente.
Adoptar en la enseñanza una forma unificada de discutir estas dos propiedades periódicas como manifestaciones de un mismo tipo de fenómeno tiene para los alumnos la enorme ventaja de requerir de un solo marco conceptual para explicar las variaciones cuantitativas de ambas propiedades en la tabla periódica. Además este enfoque va de acuerdo con la convención de signos comúnmente adoptada en termodinámica con lo cual se elimina el problema de los signos.
Se puede entonces generalizar y afirmar que “los átomos neutros, los cationes y la mayoría de los monoaniones requieren energía para ceder un electrón, es decir, lo ceden endotérmicamente. Mientras que el resto de las especies aniónicas liberan energía cuando ceden un electrón, es decir, lo ceden siempre exotérmicamente.”
Con esta definición los signos de estas magnitudes son fácilmente interpretables. Ver la Figura 1.

Figura 1 En todos los procesos que aparecen en la figura se extrae un electrón de la especie del lado izquierdo. Los primeros dos procesos están relacionados con las llamadas afinidades electrónicas.
Las generalizaciones anteriores provienen del análisis de los datos experimentales. En la Figura 2 se presentan energías de ionización para especies de oxígeno a manera de ejemplo. En ella se observa que solamente el anión O2- cede al electrón exotérmicamente. Estas energías pueden ser explicadas a los alumnos con argumentos basados en las configuraciones electrónicas y en las cargas nucleares efectivas de las especies involucradas. Con esta propuesta didáctica se eliminan las dificultades de aprendizaje mencionadas en la sección anterior pues no requiere hacer una diferencia conceptual entre afinidad electrónica y energía de ionización ya que ambas involucran procesos en donde se extraen electrones. Al eliminar
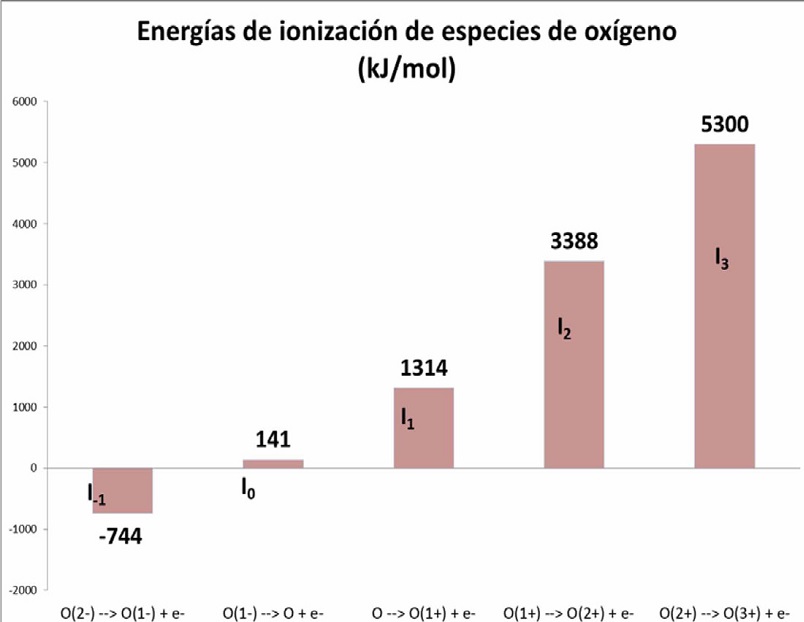
Figura 2 Las dos primeras barras corresponden a las afinidades electrónicas, la primera es exotérmica y la otra endotérmica respectivamente. Las últimas 3 son propiamente energías de ionización y son siempre endotérmicas.
este problema, los profesores pueden entonces enfocarse a resolver los otros problemas de aprendizaje comunes a todas las propiedades periódicas.
Algunos elementos poseen afinidades electrónicas tan bajas que no pueden formar aniones estables en fase gaseosa. Esto impide realizar con ellos experimentos de espectroscopía fotoelectrónica para medirlas experimentalmente. Entre éstos se encuentran los siguientes: He, Be, N, Ne, Mg, Ar, Mn, Zn, Kr, Cd, Xe, Hg, and Rn. (Jonathan C. Rienstra-Kiracofe, 2002)
Aun así, en la mayoría de estos casos es posible, con otros métodos, estimar sus afinidades electrónicas y explicarlas a los estudiantes con base en los conceptos ya mencionados: carga nuclear efectiva y configuraciones electrónicas. (Myers, 1990)
Estudios preliminares y comentarios finales
De acuerdo con nuestra propia experiencia consideramos que la enseñanza de este tema con la propuesta aquí presentada puede facilitar que los alumnos sean capaces de explicar con menos dificultades las variaciones periódicas de la afinidad electrónica. No obstante, muchos profesores aún emplean exclusivamente la definición expresada en la opción a). Afortunadamente esto está cambiando.
En una consulta realizada en 2019 entre 13 profesores de asignaturas del tronco común sobre la forma de enseñar afinidad electrónica a sus alumnos se obtuvieron los resultados siguientes:
También se aplicó una encuesta a dos grupos de Química Inorgánica I para conocer qué definición de afinidad electrónica conocían los alumnos. Ver el material suplementario.
| Grupo | Definición a) | Definición b) | Otra | Alumnos | Observaciones |
|---|---|---|---|---|---|
| 1 | 58.2 % | 32.7 % | 9.1 % | 55 | |
| 2 | 73.7 % | 24.6 % | 1.7 % | 57 |
Como se observa en la tabla anterior, la mayoría asume la definición a).
Al grupo 2 se le aplicó un cuestionario de cuatro preguntas sobre afinidad electrónica. Las primeras dos preguntas requerían el manejo de conceptos y eran de respuesta abierta y las dos últimas requerían de la aplicación de los mismos y eran de opción múltiple. Los porcentajes de aciertos se muestran en tabla siguiente.
| Pregunta | Definición a) | Definición b) | Tipo de pregunta |
|---|---|---|---|
| 1 | 0 | 0 | Conceptual abierta |
| 2 | 2.4 % | 14.2 % | Conceptual abierta |
| 3 | 57.1 % | 42.9 % | Opción múltiple |
| 4 | 19 % | 14.3 % | Opción múltiple |
Aunque son preliminares, de los resultados de las primeras dos preguntas se observa que, independientemente de la definición adoptada de afinidad electrónica que tengan los alumnos, su manejo de las configuraciones electrónicas y de la carga nuclear efectiva para apoyar sus explicaciones es insuficiente. Llama nuestra atención que en más del 40% de las respuestas los alumnos emplean la electronegatividad y no la carga nuclear efectiva o la configuración electrónica para justificar sus respuestas. En las preguntas 3 y 4 de opción múltiple no encontramos diferencias significativas que permitan alcanzar conclusiones ya que es probable que hayan contestado al azar pues, como se observó, no manejan mínimamente los conceptos requeridos para responder.
Como conclusión: es necesario primero garantizar el manejo adecuado de los conceptos para explicar las tendencias periódicas antes de poder cuantificar las ventajas asociadas a cada definición de afinidad electrónica.
Aunque la propuesta didáctica aquí presentada aparece desde hace tiempo en muchos artículos (Wheeler, 1997), (Myers, 1990) y en los libros ya mencionados, no ha sido adoptada aún de forma generalizada por los docentes. Pareciera haber una inercia, como se mencionó al inicio, que perpetúa el esquema tradicional el cual se repite por la vía de la costumbre. Tal vez aquí radique la explicación, la mayoría de nuestro cuerpo docente de carrera y muchos autores aprendieron a enseñar la afinidad electrónica hace 30 años o más y no parecen motivados a hacerlo de forma diferente a la que aprendieron en su juventud. Actualmente existen otros enfoques y datos precisos que si se incorporan a nuestra práctica docente evitarán que para nuestros alumnos la afinidad electrónica siga siendo, de entre todas las propiedades periódicas, la peor de todas.











 nueva página del texto (beta)
nueva página del texto (beta)


