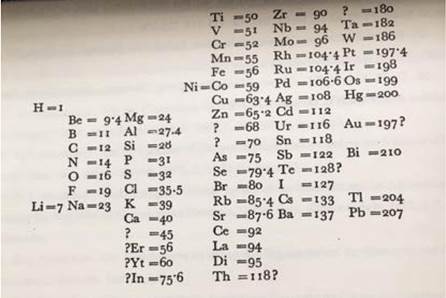Con frecuencia,
las trampas del lenguaje nos impiden entender el sentido de una oración
y nos empujan a interpretar mal una realidad determinada.
Por eso resulta siempre muy útil examinar el contexto en el que
se usan las oraciones o en que aparecen los hechos.
La descripción de la realidad es, pues,
una descripción de los contextos en que la realidad aparece:
a partir de esa descripción podemos saber en qué consiste
lo que estamos examinando y qué sentido tiene.
J.M Terricabras
Introducción
Toda descripción del mundo depende de cómo lo dividimos y cómo lo modelamos. Es decir, al dividirlo consideramos una parte cuyos efectos deben tenerse en cuenta y otra cuyos efectos deben ignorarse.
La historia es lo que contamos hoy, con la información que tenemos de ayer. En la historia y filosofía de las ciencias ocupa un lugar muy importante el libro Estructura de las revoluciones científicas, de T. Kuhn, donde el autor, contra la idea entonces sostenida de continuidad, propuso la de ruptura alrededor de la idea de revolución científica. Una revolución: es una clase especial de cambio, que abarca cierta índole de reconstrucción de los compromisos de cada grupo (Kuhn, 1971, p. 277). Los compromisos que comparten los grupos o comunidades científicas se reconocen con la palabra paradigma que significa: criterio para seleccionar problemas que, mientras se dé por sentado el paradigma, puede suponerse que tienen soluciones (Kuhn, 1971, p. 71). Así las diferentes comunidades científicas comparten a lo largo de su historia un paradigma y alrededor del mismo trabajan haciendo “ciencia normal”, que es: la actividad en que inevitablemente, la mayoría de los científicos consumen casi todo su tiempo, se predica suponiendo que la comunidad científica sabe cómo es el mundo. Gran parte del éxito de la empresa se debe a que la comunidad se encuentra dispuesta a defender esa suposición, si es necesario, a un costo elevado. Por ejemplo, la ciencia normal suprime frecuentemente innovaciones fundamentales, debido a que resultan necesariamente subversivas para sus compromisos básicos (Kuhn, 1971, p. 26). Cuando hay una revolución científica la comunidad cambia su paradigma, modificando las actividades relacionadas con la ciencia normal y de manera muy importante su enseñanza. Kuhn, más que ningún otro filósofo, insistió en la importancia de la educación en la conformación de lo que él llamó ‘ciencia normal’: Sin embargo, puesto que los libros de texto son vehículos pedagógicos para la perpetuación de la ciencia normal, siempre que cambien el lenguaje, la estructura de los problemas, o las normas de la ciencia normal, tienen íntegramente, o en parte, que volver a escribirse. (Kuhn, 1971, p. 214).
En los últimos años ha ido quedando claro que los paradigmas no son únicamente sistemas de creencias, lo son también de prácticas. Las prácticas consideran un saber tácito (Polanyi, 1966), aquel que no puede expresarse en palabras, propio de diferentes actividades de investigación que poco a poco se han ido reconociendo como fundamentales en la filosofía de las ciencias. Una práctica específica da por sentado conocer otras prácticas diferentes y, más en general, una serie de presupuestos culturales que permiten distinguir una práctica de otra (Olive, 2008). Así los paradigmas pueden caracterizarse también como maneras específicas de hacer cosas que involucran procesos de enseñanza-aprendizaje. Los paradigmas no son meros hábitos mentales, sino más bien hábitos-habilidades que incorporan expectativas de colaboración en el marco de prácticas y otras organizaciones. (Martínez y Huang, 2015, p. 191). Por ejemplo, en la enseñanza de la química las prácticas experimentales son imprescindibles (Nieto y Chamizo, 2013).
Con intenciones educativas la historia de la química puede dividirse en varias revoluciones (Jensen, 1998; Chamizo, 2014, 2015, 2018) caracterizadas por la incorporación de diferentes instrumentos a través de los cuales se modificaron las prácticas experimentales que contribuyeron a definir nuevas subdisciplinas (Figura 1). En el presente artículo se discutirá cómo fue cambiando el concepto de sustancia1 , en las tres primeras revoluciones, una vez que en la cuarta revolución el cambio de ese concepto fue motivo de un artículo en Educación Química (Chamizo, 2017).
Figura 1 Las cinco revoluciones químicas.
| Revolución (Período) | Características generales | Instrumentos | Protagonistas |
|---|---|---|---|
| Primera (1754-1818) | Oxígeno Química cuantitativa Lenguaje Átomos | Cuba hidróneumatica. Balanza. Calorimetro. Pila voltáica. | A. Lavoisier J. Dalton. A. Volta |
| Segunda (1828-74) | Congreso de Karlsruhe Moleculas Valencia Tabla periódica Química orgánica industrial | Kaliapparat. Polarimetro. | J. Liebig S. Cannizzaro A. Kekulé E. Frankland D. Mendeleiev W. Perkin |
| Tercera (1887-1923) | Química eléctrica Química nuclear Rayos X Fisicoquímica | Tubo de rayos catódicos. Espectrómetro de masas. | J. Thomson F. Aston M. Curie G.N.Lewis |
| Cuarta (1945-66) | Química instrumental Química cuántica Química y bioquímica orgánica sintética Química macromolecular | Espectrómetros (UV, IR) RMN. Cromatografía. | L. Pauling R. Woodward R. Hoffmann H. Staudinger A.J.P. Martin |
| Quinta (1974-99) | Química verde Química organometálica Química supramolecular Nanoquímica Femtoquímica | Detector de captura de electrones. Microscopio de barrido de efecto túnel. Fotólisis de destello con laser de zafiro-Ti. | M. Molina J.E. Lovejoy G. Wilkinson J.M. Lehn H. Kroto A. H. Zewail |
LA SUSTANCIA QUÍMICA
La química enfrenta la complejidad del mundo real,
mediante el ajuste del mundo material en el laboratorio,
a sus conceptos de clasificación...
A diferencia del ideal de universalismo,
la metodología de la química proporciona un tipo de conocimiento
parcial y pragmático,
que es paradigmático de las ciencias más experimentales,
que requiere la reconsideración del enfoque estándar de la filosofía de la ciencia,
así como la dimensión ética de la ciencia y la tecnología
J. Schummer
Las primeras prácticas experimentales presentes en todas las culturas antiguas, los primeros oficios que hoy reconocemos anteceden a la química fueron desarrollados por, alfareros, herreros, panaderos, y curanderos… Hay que recordar que la palabra latina laborare nos remite fundamentalmente al trabajo manual, el cual era realizado, tanto en el imperio romano como en las ciudades griegas que le antecedieron, por los esclavos. Sin embargo, seguramente fue en Alejandría, hace poco más de dos mil años, donde la especulación filosófica griega, al entrar en contacto con otras culturas de tradición más artesanal y con aprecio por el trabajo manual, se concretó en una actividad práctica que desde entonces conocemos como alquimia. Alquimistas fueron los primeros laboratorios y en ellos se llevaron a cabo los primeros experimentos sistemáticos para poner a prueba la explicación del mundo a partir de las cuatro sustancias elementales, agua, aire, tierra y fuego. Así empezó un largo y oscuro trayecto, en un vasto territorio que ocupó parcialmente África, Asia y Europa, que nos dotó de importantísimas técnicas experimentales, especialmente la destilación, y de “nuevas” sustancias, que no se encontraban en el mundo como hasta entonces era conocido, es decir sustancias “artificiales”, como algunos ácidos2, el fósforo o el alcohol. A finales de la edad media, la alquimia europea se fue desplazando poco a poco de sus intereses iniciales, más centrados en la mineralogía y la metalurgia, a la medicina con lo que fue objeto de interés de algunos de los más importantes y destacados personajes de la época. Si hay que destacar a un alquimista de ese periodo, éste es Paracelso (1493-1541), fundador de la iatroquímica, quién acuño la famosa frase, correcta hoy en día: “Todas las sustancias son venenosas. La dosis correcta diferencia el remedio del veneno.”
No es sino hasta el periodo conocido en Europa como la Ilustración, que coincide con lo que aquí caracterizamos como primera revolución química, cuando se construye una definición operativa de sustancia. Ésta se debe al francés A. Lavoisier (1743-1794) quien consideró 33 sustancias como elementos, usando su definición de sustancia, es decir aquella que no se podía “romper” en entidades más simples a través del análisis químico3. Como lo dice en su famoso Tratado Elemental de Química aparecido en 1789 y que es seguramente el libro de texto fundacional de la química tal y como hoy la conocemos4:
Todo lo que se puede decir sobre el número y la naturaleza de los elementos se limita -según pienso- a discusiones puramente metafísicas: son problemas indeterminados los que se trata de resolver, que son susceptibles de una infinidad de soluciones, pero que, muy probablemente, ninguna en particular está de acuerdo con la naturaleza. Me contentaré, por lo tanto, con decir que si por el nombre de elemento, entendemos designar las moléculas simples e indivisibles5que componen los cuerpos, es probable que no los conozcamos; que si por el contrario, atribuimos el nombre de elementos o de principios de los cuerpos la idea del último término al que llega el análisis, todas las sustancias que no hemos podido descomponer todavía por ningún medio, son, para nosotros, elementos; no significa que podamos asegurar que estos cuerpos que consideramos como simples no sean ellos mismos compuestos de dos o incluso de un número más grande de principios, pero dado que estos principios no se separan jamás, o más bien, dado que no disponemos de ningún medio para separarlos, se comportan desde nuestro punto de vista como cuerpos simples, y no debemos suponerlos compuestos más que cuando la experiencia o la observación nos haya ofrecido la prueba.
Y fue a partir del uso de nuevas técnicas experimentales, particularmente derivadas de la incorporación de la pila voltaica en los laboratorios, que el número de elementos creció de manera importante resultado de la electrólisis de sustancias que los contenían6. Todos los elementos son sustancias, pero no todas las sustancias son elementales; algunas lo son compuestas por diferentes elementos. El agua, por ejemplo, es una sustancia formada por los elementos hidrógeno y oxígeno en cantidades definidas. El agua oxigenada es otra sustancia, formada también por los elementos hidrógeno y oxígeno en cantidades definidas pero diferentes a las del agua que bebemos. Quedaba claro que no sólo la composición caracterizaba a una sustancia, sino que también la proporción en la que cada elemento se encontraba en ella. Todo ello se podía medir y experimentar en los laboratorios. A partir de esa época, particularmente a partir de la propuesta del inglés J. Dalton (1766-1844), se fue aceptando la idea de que los elementos estaban compuestos por átomos iguales, que los átomos conformaban las moléculas y que al ser ambos muy pequeños, enormes conglomerados de las mismas partículas integraban los elementos que entonces se conocían.
La segunda revolución se caracteriza por la aparición de la química orgánica7. La comunidad química se volcó a entender esta subdisciplina lo que permitió consolidar los conceptos de molécula8, isomería y valencia en el Congreso de Karslruhe (1860), el primer congreso científico de la historia. Uno de los asistentes al mismo, D. Mendeleiev (1834-1907), con fines didácticos propone su tabla periódica para organizar el creciente conocimiento que se estaba desarrollando.
La tabla periódica de los elementos fue elaborada para explicar la reactividad química de los elementos conocidos en la época, es decir la segunda mitad del siglo XIX. A continuación se reproduce el primer y muy corto artículo sobre la tabla periódica publicado por Mendeleiev en alemán (y posteriormente en inglés) aparecido en la revista Zeitschrift fur Chemie en 1869 y por el que fue conocido como el autor de la Tabla Periódica en toda Europa9. Como se podrá ver tiene errores y desde luego grandes aciertos.
Si se organizan los elementos en columnas verticales de acuerdo con el aumento del peso atómico, de modo que las filas horizontales contienen elementos análogos, también dispuestos de acuerdo con el aumento del peso atómico, se obtiene la siguiente tabla, de la cual es posible derivar una serie de deducciones generales
Cuando se organizan de acuerdo con la magnitud de sus pesos atómicos, los elementos muestran una alteración escalonada en sus propiedades.
Los pesos atómicos de elementos químicamente análogos tienen valores similares (Pt, Ir, Os) o aumentan de manera uniforme (K, Rb, Cs).
La disposición según el peso atómico corresponde a las valencias de los elementos y, en cierto grado, a las diferencias en su comportamiento químico, por ejemplo, Li, Be, B, C, N, O, F.
Los elementos más dispersos en la naturaleza tienen pequeños pesos atómicos, y todos estos elementos se distinguen por sus caracteres claramente definidos. Por lo tanto, son elementos típicos y, con justificación, el elemento más ligero, H, puede elegirse como el estándar típico.
La magnitud del peso atómico determina las propiedades del elemento, por lo tanto, en el estudio de los compuestos se debe tener en cuenta no solo el número y las propiedades de los elementos y sus interacciones recíprocas, sino también el peso atómico de los elementos. Por lo tanto, los compuestos de Se y Te, Cl y I muestran muchas analogías, por muy conspicuas que sean sus diferencias.
Permite prever el descubrimiento de muchos elementos nuevos, por ejemplo, análogos de Si y Al con pesos atómicos entre 65 y 75.
Es de esperar que algunos pesos atómicos requieran correcciones, por ejemplo, Te no puede tener un peso atómico de 128, sino más bien entre 123 y 126.
La tabla anterior sugiere nuevas analogías entre elementos. Por lo tanto, Bo (?) [U] aparece como un análogo de Bo y Al, como es bien sabido, y ha sido firmemente establecido por experimento. (Mendeleiev 1869- Jensen, 2002, pp.16-17)
Mendeleiev, como todos los asistentes al Congreso de Karlsruhe, era consciente de la confusión prevaleciente entre los términos empleados en las prácticas químicas10. Las palabras “molécula”, “átomo” y “equivalente” se usaban una por la otra, indiscriminadamente. Tal como se indicó anteriormente, fue sin duda una gran aportación de dicha reunión el acuerdo de que las moléculas estaban constituidas por átomos. En esa dirección de precisar el lenguaje indicó que: una sustancia simple es algo material, metal o metaloide, dotado de propiedades físicas y capaz de reacciones químicas ... [...] ... La palabra elemento corresponde a la idea de un átomo. Por lo tanto, el carbono es un elemento, pero el carbón, el grafito y el diamante son sustancias simples. (Mendeleiev 1869-Jensen, 2002, p.38)
Mendeleiev utilizó el concepto abstracto de elemento11 (Boyce, 2019) con un importante papel teórico. Debido a que la química se ocupa de la explicación del cambio químico, los elementos ‘abstractos’ sobreviven al cambio químico12, lo que significa que persisten y pueden explicar las propiedades de sus compuestos.
Sin embargo, todas las personas comprenden, que en todos los cambios en las propiedades de las sustancias simples, algo permanece sin cambios y que, en la transformación de los elementos en compuestos, este material determina las características comunes de los compuestos formados por un elemento dado. A este respecto, solo se conoce un valor numérico, este es el peso atómico apropiado para el elemento. La magnitud del peso atómico, de acuerdo con la naturaleza real y esencial del concepto, es una cantidad que no se refiere al estado momentáneo de la sustancia simple, sino que pertenece a una parte material del mismo, una parte que tiene en común con la sustancia simple libre y con todos sus compuestos. El peso atómico no pertenece ni al carbón ni al diamante, sino al carbono. (Mendeleiev 1869-Jensen, 2002, pp.24-25)
Así se tiene una importante distinción y cuando dos sustancias simples diferentes contienen el mismo elemento reciben el nombre de alótropos13 (Figura 2). La composición última de las sustancias simples a nivel atómico, es decir elemental, no es suficiente para su caracterización; se requiere saber además su estructura, que se manifiesta en las diferentes sustancias simples por sus diferentes propiedades físicas14.
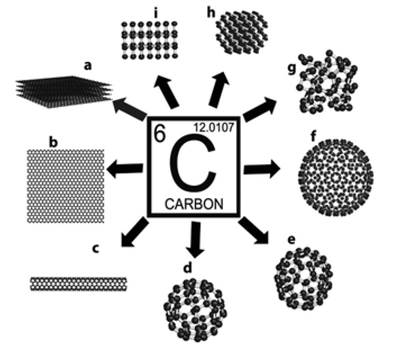
Figura 2 Diferentes alótropos, es decir diferentes sustancias simples del elemento Carbono15. (a) grafito, (b) grafeno, (c) nanotubos de carbono, (d) C60, (e) C70, (f) C540, (g) carbón amorfo, (h) lonsdaleita, y (i) diamante.
Durante la tercera revolución química caracterizada, como se indica en la Figura 1, por la incorporación de importantes instrumentos en las prácticas de la física y la química, como el tubo de rayos catódicos16, el espectrómetro de masas17 o la espectroscopia de rayos X, se descubrieron el electrón, el núcleo atómico y los isótopos. Todas estas nuevas entidades ‘ocultas’18, junto con los iones pasaron a formar parte de los nuevos libros de texto que se escribieron entonces. Fue durante la tercera revolución química, un siglo después de incorporarse a las prácticas químicas y a pesar del escepticismo sobre su existencia por importantes físicos y químicos, que J. Perrin (1870-1942) demostró la realidad de los átomos (y con ello de las moléculas) una vez que sólo a través de ellos se pueden explicar los resultados de diversos experimentos. El sustrato invisible y oculto de las sustancias químicas era por primera ocasión aceptado por la inmensa mayoria de la comunidad científica. El modelo atómico de G.N. Lewis (1875-1946) se entroniza en las prácticas químicas (particularmente en las de química orgánica ya que es capaz de explicar las reacciones moleculares) mientras que el de N. Bohr lo hace en la de física (particularmente las relacionadas con la espectroscopia), que poco a poco colonizan la enseñanza de la química (Chamizo, 2007; Chamizo y Garritz, 2014). Más aún el descubrimiento de los gases nobles por W. Ramsay (1852-1916) permitió identificar las primeras y únicas sustancias simples que también eran elementales. En 1913 H.G.J. Moseley (1887-1915) publicó en la revista Philosophical Magazine el artículo “The HighFrecuency Spectra of the Elements” en el que relaciona los valores de la longitud de onda de los rayos X emitidos por diferentes sustancias simples tras ser bombardeados por electrones y los números atómicos de sus elementos. De la regularidad de sus resultados19, Moseley remarcó el hecho de que los espectros de Co y Ni, con pesos atómicos semejantes, revelaban que el cobalto debía preceder al níquel en la tabla periódica. Más aún pudo identificar claramente el lugar de las llamadas “tierras raras” cuyos elementos tienen pesos atómicos y propiedades químicas semejantes. Así se reescribió la tabla periódica utilizando el número atómico en lugar del peso atómico. El número atómico es la característica física fundamental de los elementos, sin olvidar que en buena parte fue su reactividad química reconocida experimentalmente, como indica el filósofo J. Schummer en el epígrafe, la que permitió la construcción de la Tabla Periódica.
Conclusiones
…la experiencia de un hombre no es nada, si se mantiene solo.
Si ve lo que otros no pueden ver, lo llamamos alucinación.
No es ‘mi experiencia’ sino ‘nuestra’ experiencia sobre la que se ha de pensar
y este ‘nosotros’ tiene infinitas posibilidades
Ch. S. Pierce
Cada descripción del mundo depende de cómo lo dividimos y cómo lo modelamos. Hasta la observación más sencilla está condicionada por el modo como lo aprehendemos. Quizás vemos el mismo cielo que veían los griegos o los mayas, pero en ese mismo cielo hoy, vemos galaxias y un espacio infinito, mientras que los griegos y mayas veían la mansión de los dioses, la bóveda incorruptible que gira alrededor de la Tierra plana e inmóvil. Toda experiencia directa tiene por condición a la historia y hoy es fruto de la capacidad de abstracción.
Pero la abstracción, el pensar (Terricabras, 1999), no es suficiente, también en el mundo hay que intervenir (Hacking, 1983), experimentar (como lo hizo Lavoisier), crear; porque de lo contrario, como bien nos lo señaló Schwab (1962) hace ya muchos años, la educación termina siendo una ‘retórica de conclusiones’… ¡Basta pensar en cómo se enfrenta la enseñanza de los átomos y las moléculas hoy!
Las comunidades químicas asumen y defienden sus particulares prácticas que se basan en construir su propio objeto de conocimiento, lo que se hace, como indica el filósofo Pierce en el epígrafe, de manera compartida. Desde la tercera revolución química (Wray, 2018) la realidad de sus entidades ‘ocultas’ (como átomos, moléculas, iones), contrastadas contra las comunidades físicas no siempre coinciden. Ambas comunidades tienen prácticas y ambiciones diferentes. Una no es mejor que la otra. Si por ejemplo la mecánica cuántica se reconociera equivocada, los químicos seguirían sintetizando nuevas sustancias. Hoy los físicos, siguiendo la forma de pensar de los químicos, sintetizan nuevos elementos en sus aceleradores de partículas, elementos que en su precariedad de sustancias simples no tienen interés químico. Sin embargo, apelando al pluralismo ontológico y reconociendo que no existe una práctica sin un contexto social de transmisión (principalmente educativo) a través del cual dicha práctica se re-produce y re-crea a sí misma, hay que reconocer con Mendeleiev que hay sustancias simples (a las que podemos acceder en un laboratorio químico) y elementos… Para eso sirve conocer la historia de la Tabla Periódica…¡para pensar!











 nueva página del texto (beta)
nueva página del texto (beta)