Introducción
El conocimiento científico se desarrolla a través de las conclusiones generadas a la hora de diseñar y realizar un experimento, lo que implica que su enseñanza debe tener una fuerte base práctica o experimental. De ahí la importancia que tienen las actividades prácticas o de laboratorio para los cursos de Ciencias, puesto que el simple hecho de repetir acciones básicas como el uso de instrumentos o preparar soluciones ya genera habilidades que servirán posteriormente para desarrollar proyectos de investigación. Por todo esto es crucial tener bien en claro qué actividades se realizarán en las sesiones de práctica (Elliot et al., 2008). Los enfoques pedagógicos han ido cambiando con el tiempo, pero la tendencia actual es dar énfasis a la participación mucho más activa del estudiante, formando grupos de trabajo y planificando o diseñando sus propios experimentos, generando así un aprendizaje cooperativo, en el cual no sólo se desarrollen habilidades prácticas sino también de razonamiento y deducción (Adams, 2009). Dentro de las nuevas tendencias didácticas, el trabajo de laboratorio a través de proyectos cortos de investigación es el más favorable para la enseñanza en Ciencias, ya que se imitan todos los aspectos relacionados en crear y diseñar un experimento, lo cual será beneficioso para el aprendizaje de los estudiantes (Espinoza et al., 2016).
Para el desarrollo de estos proyectos de investigación dentro de las actividades de un curso semestral, es necesario considerar el tiempo que se dispone (en cursos semestrales, muchas veces menos de 4 meses) y, quizá lo más importante, tomar en cuenta las condiciones materiales, los modelos experimentales y los métodos a utilizarse, los cuales deben estar al alcance de los estudiantes. En nuestra experiencia, el tomate ha sido utilizado por largo tiempo para poder realizar experimentos respecto a los cambios metabólicos que pueden generarse al mantener los cultivos en ciertas condiciones, como por ejemplo el estrés salino (Salas et al., 1999; Rodrigo y Salas, 2001; Díaz y Salas, 2007; Salas, 2015). Los cultivos hidropónicos son una buena alternativa para mantener las plantas en condiciones de laboratorio y desarrollar trabajos de investigación (Tavakkoli et al., 2010; Ortega-Rodés et al., 2016; Zhang et al., 2016; Umar y Siddiqui 2017), pero para cuantificar diversos metabolitos en las plantas, las publicaciones al respecto utilizan técnicas modernas basadas en HPLC, cromatografía de gases o espectrometría de masas por ejemplo (Vewer et al., 2011), las cuales muchas veces no se encuentran disponibles para trabajos de pregrado, por lo que en estos casos es necesario buscar métodos más simples y asequibles, como los métodos químicos.
El objetivo del presente artículo es determinar el contenido de lípidos en cultivos semihidropónicos de tomate sometidos a estrés salino, utilizando métodos químicos que puedan ser usados para desarrollar trabajos de investigación en cursos semestrales de pregrado.
Materiales y métodos
Se utilizaron cultivos semi-hidropónicos de tomate comercial, Solanum lycopersicum, variedad Río Grande, a una temperatura ambiental de ± 20ºC, un fotoperiodo de 12 horas con luz natural y 70% de Humedad Relativa, utilizando como sustrato arena desinfectada con Hipoclorito de sodio al 2.5%. Se colocaron 25 plantas de tomate en bandejas de poliestireno expandido (unicel, telgopor o tecnopor). Las bandejas fueron agrupadas en bloques y regadas por capilaridad con solución hidropónica comercial para tomate, a la cual se le agregó Cloruro de Sodio hasta llegar a concentraciones finales de 0 mM, 40 mM, 85 mM, y 100 mM. Estos cultivos fueron mantenidos por 30 días dentro de un laboratorio y terminado este periodo se cortaron las plantas para poder determinar el porcentaje de materia seca por separado en hojas, tallo y raíz según Díaz y Salas (2007).
También se tomaron 1,5 gramos de cada muestra seccionada, se secaron a 60º C por 4 días, luego de los cuales se colocaron en paquetes de papel Whatman N°1 y se procesaron en un extractor Soxhlet, teniendo en cuenta las indicaciones de López-Mesas y Crespi (2000). Cada extracción duró 4 horas usando cloroformo como solvente, luego se retiraron las muestras y se resuspendieron los extractos obtenidos con cloroformo fresco para ser finalmente almacenados a 4ºC hasta su uso.
Los métodos de cuantificación descritos a continuación siguieron los protocolos del Vademécum de Laboratorios Wiener SA (1999), así como los reactivos utilizados, con una previa estandarización para extractos clorofórmicos.
Para la cuantificación de lípidos totales por el método químico (Wiener SA, 1999), se tomaron 50 µL del extracto clorofórmico y se le adicionó ácido sulfúrico concentrado, agitando antes de colocar por 10 minutos esta mezcla en baño maría hirviente. A 100 µL de cada uno de estos tubos se le agregó reactivo vainillin fosfórico y se procedió a una incubación en baño maría a 37°C y se le midió la Absorbancia a 530 nm.
Para cuantificar la cantidad de triglicéridos en los extractos clorofórmicos, se utilizó el método químico (Wiener SA, 1999), tomando 50 µL de cada muestra, realizando una extracción con ácido sulfúrico 0,15 N y nonano/isopropanol, para luego hacer una transesterificación con etóxido de potasio 0,50 M en butanol secundario. Luego se agregó una solución oxidante que contenía ácido peryódico 4 M en ácido sulfúrico 0,35 mM y se usó como reactivo de color acetilacetona (2,4 pentanodiona) disuelto en buffer acetato de amonio 5 M y arsenito de sodio 190 mM. Se midieron las Absorbancias a 420 nm.
Se usó el método enzimático de cuantificación de colesterol en sangre (Wiener, 1999) debido a que se consideró que la enzima utilizada también reconoce y actúa sobre fitosteroles (ver Discusión). Para esto se usaron 20 µL de cada uno de los extractos clorofórmicos, adicionándoles 2 mL de suspensión enzimática (colesterol oxidasa y peroxidasa) e incubando a 37°C por 5 minutos para realizar la lectura de Absorbancia a 505 nm.
Todas las determinaciones fueron realizadas por triplicado siguiendo un diseño completamente al azar con arreglo factorial, al igual que las curvas de calibración para mostrar repetibilidad de cada prueba espectrofotométrica. Los resultados mostrados corresponden a las medias y desviaciones estándar de las mediciones obtenidas.
Resultados
Los cultivos semihidropónicos de tomate en condiciones de laboratorio mostraron a los 30 días diferencias en cuanto a crecimiento y tamaño de hojas, demostrando un efecto significativo de la salinidad sobre el desarrollo de las plantas y sus hojas (Figuras 1 y 2).

Figura 1 Diferencias en tamaño de cultivos semihidropónicos de tomate mantenidos en diferentes condiciones de salinidad.

Figura 2 Comparación del tamaño y área de hojas de plantas de tomate mantenidas por 30 días en diferentes niveles salinidad.
El contenido de lípidos totales en tallos y hojas (Figura 3A) evidencia un incremento en relación con la salinidad de la solución hidropónica, sobre todo en hojas a concentraciones de sal en el medio mayores a 85 mM. En cambio, en la raíz se observa una disminución de lípidos totales con el aumento de la salinidad, tratando de mantenerse estable por encima de los 40 mM. El análisis de comparaciones múltiples (Tabla 1) muestra diferencias significativas entre las muestras Control y los diferentes tratamientos, con las plantas expuestas a 85 mM de NaCl en el medio, principalmente en hojas mientras que en raíz las diferencias fueron significativas entre las plantas Control y todos los tratamientos. Resultados prácticamente similares se observaron cuando se cuantificó el contenido de triglicéridos en estas plantas (Figura 3B), con un contenido de triglicéridos en hoja aumentando a medida que se incrementa progresivamente la salinidad del medio, mientras que en raíz es mucho menor y presenta una disminución con la salinidad del medio a partir de los 20 mM de NaCl tanto para hojas como raíz. Las comparaciones múltiples (Tabla 2) también muestras diferencias significativas entre las muestras Control y los tratamientos salinos, sobre todo en raíz.
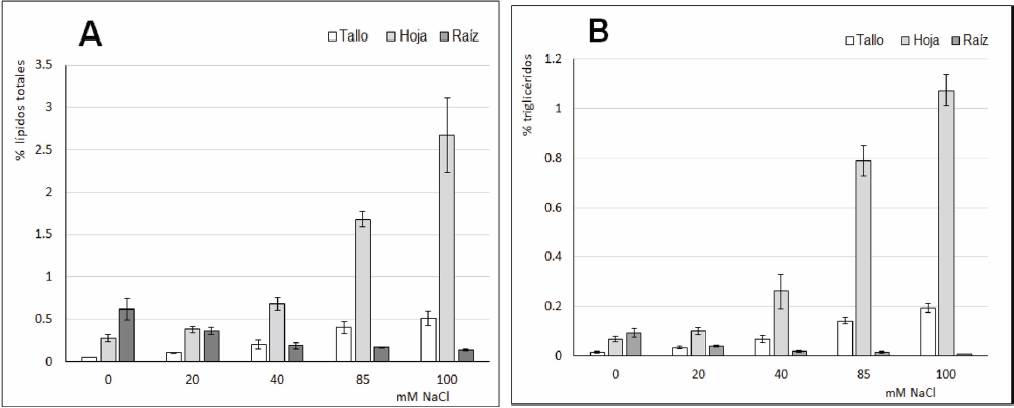
Figura 3 Contenido de lípidos totales (A) y de triglicéridos (B) en plantas de tomate mantenidas en diferentes condiciones de Salinidad.
Tabla 1 Comparaciones múltiples del contenido de lípidos totales en plantas de tomate mantenidas por 30 días en diferentes condiciones de salinidad.
| Comparaciónes múltiples | Significancia estadística | ||
|---|---|---|---|
| Tallo | Hoja | Raíz | |
| 0Mm - 20mM | 0,860 | 0,981 | 0,009* |
| 0Mm - 40mM | 0,077 | 0,282 | 0,000* |
| 0Mm - 85mM | 0,00* | 0,00* | 0,000* |
| 0Mm - 100mM | 0,00* | 0,00* | 0,000* |
| 20Mm - 40mM | 0,33 | 0,546 | 0,067 |
| 20Mm - 85mM | 0,001* | 0,00* | 0,042* |
| 20Mm - 100mM | 0,00* | 0,00* | 0,017* |
| 40Mm - 85mM | 0,017* | 0,002* | 0,998 |
| 40Mm - 100mM | 0,001* | 0,00* | 0,900 |
| 85Mm - 100mM | 0,239 | 0,003* | 0,976 |
*Significancia estadística por prueba Post hoc Scheffé (p<0,05)
Tabla 2 Comparaciones múltiples del contenido de triglicéridos en plantas de tomate mantenidas por 30 días en diferentes condiciones de salinidad.
| Comparaciónes múltiples | Significancia estadística | ||
|---|---|---|---|
| Tallo | Hoja | Raíz | |
| 0Mm - 20mM | 0,454 | 0,952 | 0,00* |
| 0Mm - 40mM | 0,005 | 0,015 | 0,00* |
| 0Mm - 85mM | 0,00* | 0,00* | 0,00* |
| 0Mm - 100mM | 0,00* | 0,00* | 0,00* |
| 20Mm - 40mM | 0,082 | 0,046* | 0,092 |
| 20Mm - 85mM | 0,00* | 0,00* | 0,041* |
| 20Mm - 100mM | 0,00* | 0,00* | 0,012* |
| 40Mm - 85mM | 0,00* | 0,00* | 0,985 |
| 40Mm - 100mM | 0,00* | 0,00* | 0,719 |
| 85Mm - 100mM | 0,006 | 0,01* | 0,940 |
*Significancia estadística por prueba Post hoc Scheffé (p<0,05)
Respecto al contenido de esteroles, la Figura 4 muestra un incremento gradual de estos compuestos en hojas a medida que aumenta las condiciones de salinidad en la solución de riego hasta los 85 mM, mientras que en raíz se observa una disminución gradual a medida que aumenta la concentración de sal en el medio. El análisis de comparaciones múltiples (Tabla 3) mostró diferencias significativas entre el Control y las muestras salinas a partir de 40 mM en hojas, mientras que en raíz las diferencias fueron significativas entre el Control y todos los tratamientos. Las pruebas estadísticas para lípidos totales, triglicéridos y esteroles mostraron en todos los casos diferencias significativas (p=0,000; 0,004 y 0,000 respectivamente).
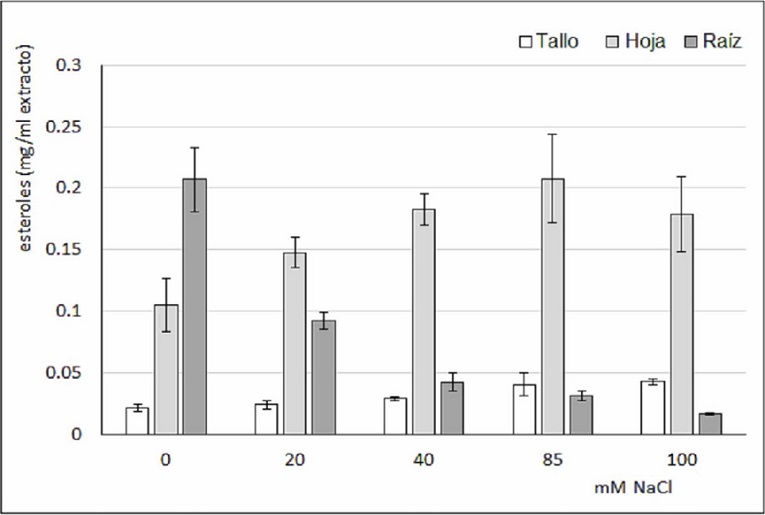
Figura 4 Contenido de esteroles en plantas de tomate mantenidas por 30 días con soluciones de riego con diferentes condiciones de Salinidad.
Tabla 3 Comparaciones múltiples del contenido de esteroles en plantas de tomate mantenidas por 30 días en diferentes condiciones de salinidad.
| Comparaciónes múltiples | Significancia estadística | ||
|---|---|---|---|
| Tallo | Hoja | Raíz | |
| 0Mm - 20mM | 0,952 | 0,393 | 0,00* |
| 0Mm - 40mM | 0,444 | 0,040* | 0,00* |
| 0Mm - 85mM | 0,008* | 0,007* | 0,00* |
| 0Mm - 100mM | 0,004* | 0,053 | 0,00* |
| 20Mm - 40mM | 0,829 | 0,569 | 0,011* |
| 20Mm - 85mM | 0,025* | 0,139 | 0,003* |
| 20Mm - 100mM | 0,012* | 0,669 | 0,001* |
| 40Mm - 85mM | 0,133 | 0,82 | 0,882 |
| 40Mm - 100mM | 0,062 | 1,00 | 0,256 |
| 85Mm - 100mM | 0,987 | 0,730 | 0,725 |
*Significancia estadística por prueba Post hoc Scheffé (p<0,05)
Discusión
El mantenimiento de los cultivos semihidropónicos de tomate por 30 días permite observar el efecto de la salinidad sobre el crecimiento vegetativo de las plantas (Figuras 1 y 2) y concluir que también debe haber un efecto sobre su metabolismo. Se ha observado un incremento del contenido de lípidos totales en las plantas de tomate, tanto en tallo como en hojas, mientras que disminuye en raíz a medida que aumentan las condiciones de salinidad (Figura 3A). Estos resultados podrían explicarse como que la salinidad está generando un estrés hídrico, durante el cual hay una disminución de lípidos en la membrana celular, una inhibición de su síntesis y más bien una activación de la lipólisis y lipoperoxidación (Gigon et al., 2004). Ya Shannon (1992) había reportado en Plantago media que las raíces sufrían una disminución de fosfolípidos, galactolípidos y sulfolípidos en respuesta a un incremento de NaCl en la solución de riego utilizada, y consideró que la permeabilidad de la membrana era la principal función afectada. Sin embargo, debido a que la Figura 3B muestra que el contenido de triglicéridos se comporta de manera prácticamente similar a la de lípidos totales, se podría concluir que el estrés salino estaría afectando principalmente a esta fracción, que cumple función en las plantas de almacenamiento
de carbono y/o energía (Yu et al., 2011). El análisis de comparaciones múltiples mostró diferencias significativas en hojas a partir de los 40 mM de NaCl, mientras que en raíz las diferencias fueron significativas a partir de los 20 mM de NaCl en la solución de riego, lo cual permite reforzar la conclusión de que la raíz es la primera estructura que genera sus ajustes metabólicos para lípidos y triglicéridos al percibir niveles relativamente bajos de sal.
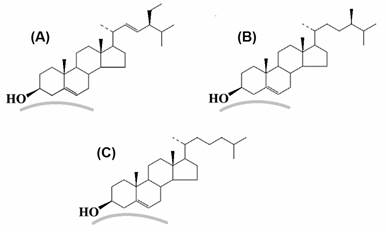
Si bien es cierto que la cantidad de colesterol en plantas es prácticamente despreciable (Schmid y Ohlrogge, 2002; López-Pérez et al., 2009), a cambio se pueden encontrar esteroles como el estigmasterol y el sitosterol, moléculas estructuralmente similares al colesterol, lo que hace posible el reconocimiento de estos compuestos por la enzima colesterol oxidasa usada para la cuantificación, debido al reconocimiento específico del hidroxilo en C-3 y el doble enlace a nivel de los carbonos ∆-4 o ∆-5 (Figura 5) (Lange, 1992; Richmond, 1973). La extracción clorofórmica tampoco estaría interfiriendo debido a que, en medios conteniendo solventes orgánicos y detergentes, la enzima mantiene su actividad (Kumari y Kanwar, 2012). En la Figura 4 se puede observar una disminución de la concentración de esteroles en raíz cuando el contenido de sal en el medio es de 40 mM, mientras que en hojas se incrementan los valores hasta los 40 mM, y en ambas estructuras, a mayores concentraciones de sal en el medio se mantienen constantes los contenidos de esteroles. Estos compuestos cumplen una función muy importante como componentes estructurales de las membranas celulares, regulando su fluidez (Ávalos y Pérez-Urria, 2009). Por otro lado, se considera que los esteroles libres regulan la actividad enzimática en membrana, así como su permeabilidad y la absorción de iones (Zamani et al., 2010). Por tanto, se podría considerar que en raíz, el estrés salino mantiene la membrana celular más fluida al disminuir su contenido de esteroles, mientras que en hojas la membrana estará menos fluida y permeable. Esta respuesta dependería de la especie de planta. Zamani et al. (2010) observaron que en algunos cultivares de canola (Brassica napus) la salinidad del medio disminuía la concentración de esteroles, mientras que en otros se elevaba, mientras que Wu et al. (2005) observaron un aumento de lípidos en cultivos de callos de Spartina patens si se mantenían con altas concentraciones de NaCl, siendo los esteroles la fracción con mayor concentración, principalmente el campesterol mientras que disminuyeron los niveles de sitosterol. Se han observado también cambios en la concentración de esteroles libres y de sus derivados en respuesta al frío y a patógenos (Schmid y Ohlrogge, 2002).
Conclusiones
Los resultados del presente trabajo permiten considerar a los cultivos semi-hidropónicos como un modelo de estudio de los cambios que ocurren en plantas de tomate sometidas a estrés salino, no sólo sobre parámetros morfológicos y productivos, sino también sobre parámetros metabólicos, tanto a nivel de planta entera como seccionando hojas, tallo y raíz. Los métodos químicos y enzimáticos utilizados son de uso común en laboratorios clínicos para la determinación de las fracciones lipídicas en sangre y (debido a que todas las pruebas así como sus curvas de calibración se han realizado por triplicado, así como que este proyecto ha sido repetido varias veces por alumnos en nuestro laboratorio) han mostrado tener sensibilidad y reproducibilidad al usarlos con muestras provenientes de extractos clorofórmicos de plantas. No se ha tenido hasta la fecha ninguna dificultad en la adquisición de los reactivos para estas determinaciones, ya que son de venta libre y directa. La extracción Soxhlet con cloroformo no interfiere en la reacción de color, al igual que no interfiere con la determinación enzimática de esteroles. Por esta razón, todos los resultados obtenidos concuerdan con lo señalado por la literatura, en cuanto a que hay una acumulación de triglicéridos en hojas, quizá con fines de ser usados como fuente de energía, mientras que hubo una disminución de esteroles en raíz y un aumento en hojas, implicando ajustes de la fluidez de las membranas celulares (ver Discusión).
Por todo lo expuesto, se considera que este tipo de experimento puede ser desarrollado en diversos cursos de pregrado, como por ejemplo Instrumentación Química (debido a las técnicas de extracción de lípidos y la determinación fotocolorimétrica) o Fisiología Vegetal (considerando el efecto del estrés salino sobre las plantas de tomate). En nuestro caso, los experimentos mostrados en el presente artículo fueron realizados por los autores a fin de medir los tiempos necesarios para cada etapa, pero experimentos similares fueron desarrollados de manera individual como parte del curso de Prácticas Prepresente profesionales. Si trabajando una sola persona el trabajo duró 54 días en total, se piensa que podría llevarse a cabo como proyecto de investigación dentro de cursos semestrales, ya que se cumpliría de manera holgada con el tiempo del trabajo experimental y la redacción del Informe Final (Tabla 4). Se propone que, a nivel de asignaturas, el trabajo puede ser realizado por equipos de 4 o 5 estudiantes a lo máximo, debido a la cantidad de muestras y tratamientos envueltos (4 tratamientos, y muestras de raíz, tallo y hojas por triplicado en cada tratamiento), permitiendo la evaluación de la responsabilidad y capacidad de organización del equipo (Tabla 5).
Tabla 4 Programación de actividades para un experimento similar al del artículo.
| Etapas | Tiempo calculado | Activades involucradas |
|---|---|---|
| Germinación mantenimiento de plántulas en condiciones normales | - 5 días germinación | Germinación en arena como sustrato |
| - 7 días | Mantenimiento de plántulas germinadas en medio hidropónico normal | |
| Cultivo semihidropónico de tomate en diferentes condiciones de sanidad | - 30 días | Cambio de solución hidropónica conteniendo concentraciones determinadas de sal |
| Secciónado de muestras y secado a estufa | - 5 días | Extracción de plantas y corte de tallo, hojas y raíz (1 día). Secado a estufa (4 días para determinar peso seco y extraer lípidos) |
| Extraccion Soxhlet | - 2 días | Cada extracción dura 4 horas. Las muestras son hoja, raíz tallo por triplicado y de 4 tratamientos, por lo que en total son 36 muestras, el equipo permite realizar 4 extracciones a la vez. Por tanto, el total de extracciones dura 36 horas. |
| Determinación de lípidos | - 1 día | En cada caso se realiza una curva de calibración de 5 puntos. Duración calculada de cada determinación: 40 minutos. |
| Análisis de datos y redacción del informe final | - 5 días | Cálculo de concentraciónes, análisis estadístico y redaccioón de informe final. |
| TOTAL TIEMPO REQUERIDO | - 54 días | El trabajo puede realizarse en grupos de 4 o 5 estudiantes. |
Tabla 5 Rúbrica para evaluar el desempeño de equipos designados a trabajos similares al expuesto en el artículo.
| Actividades | 4 puntos | 2 puntos | 0 puntos |
|---|---|---|---|
| Mantenimiento de los cutivos | El equipo muestra responsabilidad y coordinación entre los integrantes. | El equipo cumplió de manera irregular con el mantenimiento de los cultivos | Los cultivos no fueron mantenidos en las condiciones indicadas. |
| Estracción de las muestras. | Se mostró coordinación y participación de todos los integrantes. | El trabajo de extracción fue parcialmente desorganizado | No se mostró coordinación previa entre los integrantes. |
| Procesamiento de las muestras. | El equipo se dividió el trabajo de manera racional y eficiente. | Se evidenció fallas en la división y realización del trabajo. | El procesamiento de las muestras no fue organizado. |
| Determinación de lípidos | Se mostró conocimiento previo de las determinaciones a realizar. | Algunos integrantes no mostraron conocimiento de los protocolos. | Hubo total desconocimiento de los protocolos a seguir. |
| Análisisi de datos e Informe final. | El trabajo mostró participación de todos los integrantes. | El informe evidencia descoordinación en el informe redactado. | No se realizó el análisos de datos o no se prentó el informe final. |
El desarrollo de pequeños proyectos de investigación en cursos de pregrado se vuelve una alternativa en cuanto a la enseñanza en las carreras científicas, puesto que permiten desarrollar habilidades procedimentales sin dejar de lado los fundamentos teóricos, tanto de las técnicas que se usan como del fenómeno que se está estudiando, además de entrenar a los estudiantes a resolver problemas actuales, “de la vida cotidiana” (Viera et al, 2017), y a la par desarrollar también el pensamiento sistemático en el futuro científico (Elliot et al., 2008).











 nueva página del texto (beta)
nueva página del texto (beta)