Introducción
La electrodiálisis es un proceso electroquímico de separación en el que los iones disueltos en una fase líquida, agua u otro líquido, se mueven por influencia de un campo eléctrico y preferentemente atraviesan una membrana de intercambio iónico (MII). La electrodiálisis es ampliamente utilizadas en dominios diversos, como tratamiento de aguas residuales (Lillo et al., 2011), separaciones de un ion de interés de una mezcla (Ibáñez et al., 2007), desalinización de agua (Dévora-Isiordia et al., 2013), tratamiento de desechos lácteos (Ávila et al., 2000), producción de ácidos orgánicos (Huang et al., 2007) y tratamiento de vinos (Corti y Paladino, 2016). Para emplear la electrodiálisis y obtener los resultados deseados se requiere conocer y entender los diferentes fenómenos que ocurren en este proceso. Sin embargo, en la literatura se encuentran pocos trabajos que han abordado el tema desde un punto de vista didáctico (Montes- Rojas y Cerda-Alvárez, 2009; Schufle, 1961; García-García et al., 2000, Kendall y Gebauer-Fuelnegg, 1931). Hasta el momento, las curvas de polarización o curvas I-E no han sido utilizadas como herramienta para facilitar la comprensión de los fenómenos que ocurren cuando un ión atraviesa una MII, a pesar de que su forma es dependiente de éstos. En este trabajo se propone la realización de curvas de polarización para evidenciar cómo influyen diferentes factores en el transporte de iones a través de una MII.
Antecedentes
Las propiedades selectivas de las MII están asociadas a los tres tipos de especies cargadas que pueden encontrarse en su seno (Figura 1): (a) cargas fijas, que se encuentran inmovilizadas en la membrana; (b) contraiones, especies cargadas móviles que contrarrestan la carga de las fijas; y (c) coiones, éstos son especies móviles cuya carga es del mismo signo que la de las fijas.
Durante la electrodiálisis, por medio de dos electrodos se genera un campo eléctrico el cual actúa como una fuerza impulsora que mueve a los iones en la disolución y a través de la MII. Los aniones se moverán hacia el ánodo y los cationes al cátodo. El movimiento de los iones a través del dispositivo estará condicionado por las MII, debido a que se desarrollan interacciones entre los iones presentes en la solución y sus cargas fijas (Figura 2). Cuando éstas son negativas, se denominan membrana de intercambio catiónico (MIC), ya que solamente pueden ser atravesadas por cationes, porque repelen electrostáticamente a los aniones (Figura 2a). Mientras que si la membrana, denominada en este caso de intercambio aniónico (MIA), tiene cargas fijas positivas, entonces son atravesadas por aniones y rechazan a los cationes (Figura 2b). De esta forma, se produce una separación selectiva de las especies de acuerdo a su carga. Un arreglo con más de un tipo de MII (Figura 2c y 2d) permite obtener una solución concentrada y otra diluida en un ion particular. Adicionalmente, en este último acomodo se impide que los compuestos formados en los electrodos lleguen a los compartimentos centrales.

Figura 2 Diagrama esquemático del paso de iones a través de una celda de electrodiálisis empleando una: (a) MIC, (b) MIA, (c) y (d) ejemplos de celdas que emplean MIC y MIA.
Un concepto esencial asociado a una MII es sin duda su selectividad, la cual se puede definir como la capacidad que posee una MII de discriminar a ciertas especies. Ésta se puede cuantificar a través del número de transporte de un ion en la MII (tm), que es la fracción de corriente, del total que atraviesa a una solución, asociada a cada ión. Si se utiliza al contraión para cuantificar esta cantidad, debido a que es el único que atraviesa la MII, se puede definir la selectividad ideal de la membrana con un tm cercano a la unidad. Si otros iones atraviesan la MII, contribuyen al transporte de carga y por consecuencia a la disminución de tm.
Por otra parte, las curvas I-V, son representaciones gráficas entre la corriente que atraviesa a la membrana en función de la diferencia de potencial que se desarrolla entre sus dos caras. Una curva de polarización tiene una forma típica (Figura 3), en la que se distinguen tres secciones o zonas a las cuales se asocian a fenómenos específicos (Scarazzato et al., 2015).
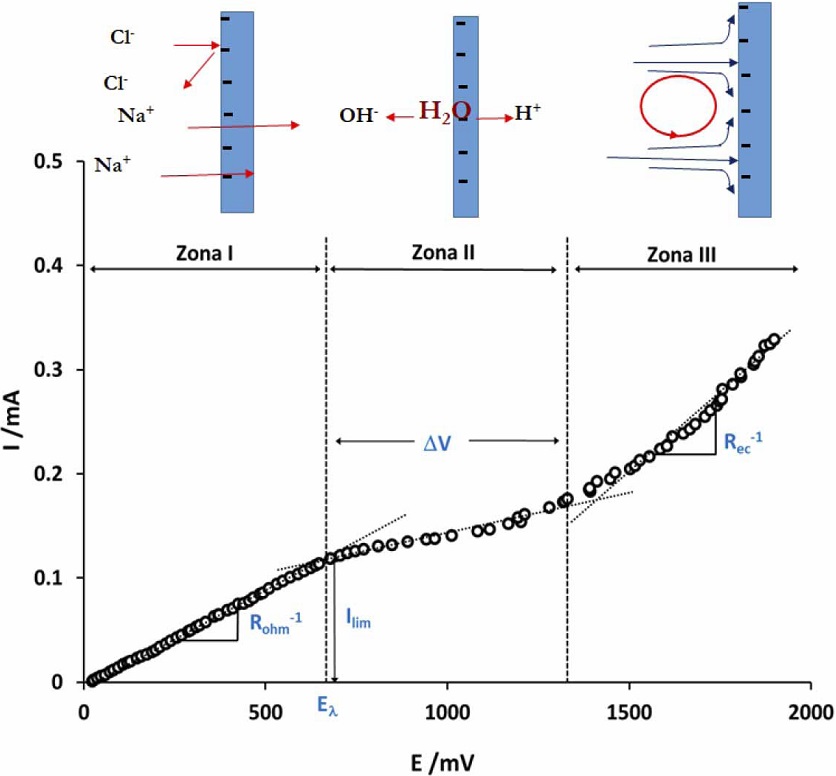
Figura 3 Forma típica de una curva de polarización para una MIC. En la parte superior se ilustran los fenómenos que predominan en cada etapa.
La zona I o zona óhmica, se caracteriza por una relación lineal entre la corriente y el potencial, es decir se cumple la ley de Ohm. Esto se debe a que el incremento de la fuerza impulsora (el potencial), incrementa el flujo de especies cargadas (corriente) que atraviesan la MII. La zona II o de pseudomeseta se reconoce porque la corriente es prácticamente independiente del potencial, debido a que en las cercanías de la MII los iones se agotan en un momento dado y al no existir portadores de carga la resistencia aumenta notablemente. Sin embargo, la corriente incrementa ligeramente con el potencial, debido a que la ausencia de portadores de carga, es compensada por los iones formados por efectos acoplados como el desdoblamiento del agua (Formación de H+ y OH-), la convección gravitacional y la electroconvección (Mikhaylin et al., 2016). En la zona III o región de electroconvección, la corriente y el potencial nuevamente adoptan una relación lineal. En efecto, los iones atraviesan la membrana a través de los poros, no solo perpendicularmente a la superficie de la membrana, sino que también tangencialmente; dado que la superficie de la membrana es rugosa y heterogéneas, las cargas se mueven en remolinos que llevan a una destrucción de la capa de difusión (Pis´menskaya et al., 2012) y el reinicio de la difusión.
De las curvas de polarización se obtienen parámetros que dan información sobre el transporte iónico a través de la MII (Figura 3):
a) Corriente límite (Ilím). Este parámetro permite fijar las condiciones de operación de la electrodiálisis y una forma de obtener su valor es de la intersección de las líneas tangentes de los segmentos de la curva en la zona I y II. La relación de la Ilím con otros parámetros se describe en la ecuación (Spiegler, 1971):
Donde z es la carga del contraión, F es la constante de Faraday (Cmol-1), D es el coeficiente de difusión (cm2s-1), A el área de la membrana (cm2), Ci o la concentración del contraión en solución (molcm-3), tm y ts son el número de transporte del contraión en la membrana y en la solución respectivamente, δ es el espesor de la capa de difusión (cm), como se observa en la Figura 4 corresponde a la longitud entre la MII y la solución, en la que la concentración del ion es distinta al resto de la solución. En efecto, durante la aplicación de un campo eléctrico en un lado de la MII, la especie disminuye porque atraviesa la MII, incrementándose la especie del lado opuesto. El valor de δ depende de si la solución está o no bajo agitación. De acuerdo con esta ecuación se deduce que Ilím depende de la naturaleza del ion (z, D, ts) y su concentración (Ci °), de las condiciones hidrodinámicas (δ), la selectividad (tm) y el área de la membrana (A).
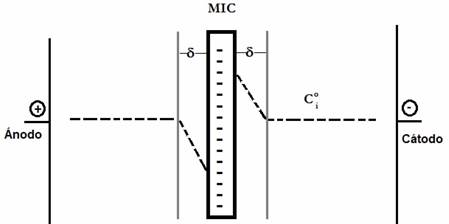
Figura 4 Representación del perfil de concentración de una especie que atraviesa una MIC en una celda de electrodiálisis. La línea punteada representa la concentración en el seno de la solución (Ci°) y en la capa de difusión (δ).
Como ya se mencionó, el valor de Ilim se usa para determinar el valor óptimo de corriente a aplicar durante la electrodiálisis, el cual se fija al 80 % del valor de Ilim, para evitar el efecto de reacciones secundarias como el desdoblamiento del agua sobre la separación selectiva del contraión. Asimismo, Ilim puede darnos información de la selectividad de diferentes membranas hacia un mismo ion. Cuando se estudian varias membranas en iguales condiciones, los parámetros de la ecuación 1 serán iguales para todas las membranas a excepción de tm. Entre más grande sea tm, mayor será la diferencia tm-ti y menor la Ilim, por lo que entre menor sea Ilim, mayor será la selectividad de la membrana.
b) Resistencia óhmica (Rohm). Corresponde al inverso de la pendiente de la zona I. Es una medida de la resistencia al paso de corriente desde la membrana hacia la solución. La Rohm corresponde a tres contribuciones: la resistencia de la membrana (Rm), de la capa de difusión (Rcd) y de la solución (Rs). Como la corriente sigue una sola dirección las resistencias se encuentran en serie y la Rohm se obtiene de la suma algebraica de las tres contribuciones. Este valor permite comparar por ejemplo la Rm de MII diferentes, cuando se utiliza la misma solución.
c) Potencial de transición (Eλ). Es el potencial donde finaliza la zona I e inicia la zona II. Este valor es proporcional a la energía necesaria para agotar la especie en la cercanía de la interfaz membrana/solución. Por lo que se incrementa con la concentración y con la carga del contraión.
d) Amplitud de la meseta (∆V). Este valor se obtiene de la diferencia de potenciales del punto donde inicia la zona III y donde termina la I. Esta magnitud se relaciona con el requerimiento energético para que el transporte de masa cambie de difusión a electroconvección (Choi et al., 2001). Por lo que diferentes factores afectan su valor como:
1) la rugosidad de la membrana, en efecto, entre mayor sea el número de imperfecciones, menor será ∆V, ya que las turbulencias que originan la electroconvección se formaran con mayor facilidad.
2) La concentración de la especie iónica. Cuando ésta incrementa disminuye ∆V, debido a que aumentan las interacciones del ion con las zonas no conductoras de la MII y se favorece la electroconvección.
3) La carga y el tamaño del ion. A mayor carga y tamaño del ion solvatado, menor ∆V, debido a que a mayor tamaño del ion solvatado, mayor será el número de hidratación y la capacidad de mover moléculas de agua.
d) Resistencia de electroconvección (Rec): Este parámetro se determina del inverso de la pendiente de la recta de la zona III. También es una medida de la facilidad con la que se produce la electroconvección. Una resistencia baja indica que hay muchas especies en las cercanías de la membrana y que la electroconvección es importante. Por lo que disminuye con las imperfecciones de la MII, concentración, carga y tamaño del ion.
f) Rec/Rcohm: ∆R (Rec - Rohm). Ambos parámetros comparan Rec y Rohm,, una diferencia grande indica que se favorece la electroconvección, por lo que se consideran al igual que ∆V inversamente proporcionales al requerimiento energético necesario para destruir la capa de difusión.
Parte experimental
Las MII fueron colocadas en la solución de trabajo durante una hora antes de obtener las curvas I-E. Éstas se pueden realizar de modo automatizado o manualmente. En este trabajo se realizaron de ambas maneras, en la primera se usó una celda de acrílico (Figura 5a), diseñada y elaborada en el laboratorio; formada por cuatro compartimentos (Figura 5b) separados por tres MII comerciales (ASTOM): dos catiónicas (CMX) y una aniónica (AFX) y ensambladas con tornillos. De acuerdo a las especificaciones del fabricante el espesor de la membrana CMX se encuentra entre 0.14 y 0.20 cm; mientras que la AFX tiene un grosor entre 0.13 y 0.18 cm. La MII de estudio (MIC) se colocó en el centro y las auxiliares (MIA) en los extremos. En los compartimientos adyacentes a la MIC se instalaron electrodos de referencia de Ag/AgCl/NaCl 3 mol L-1. Éstos se colocaron en extensiones de vidrio con punta de agar preparado con solución de NaCl 3 mol L-1. Estos electrodos tienen la finalidad de medir la diferencia de potencial, inducida por la diferencia de concentraciones en ambos lados de la MIC, la cual se debe a que en un lado de la membrana la concentración de iones disminuye debido a que éstos atraviesan la MIC, induciendo un incremento de la concentración de iones en el lado opuesto de la MIC. Para una óptima obtención de las curvas, las puntas de los capilares
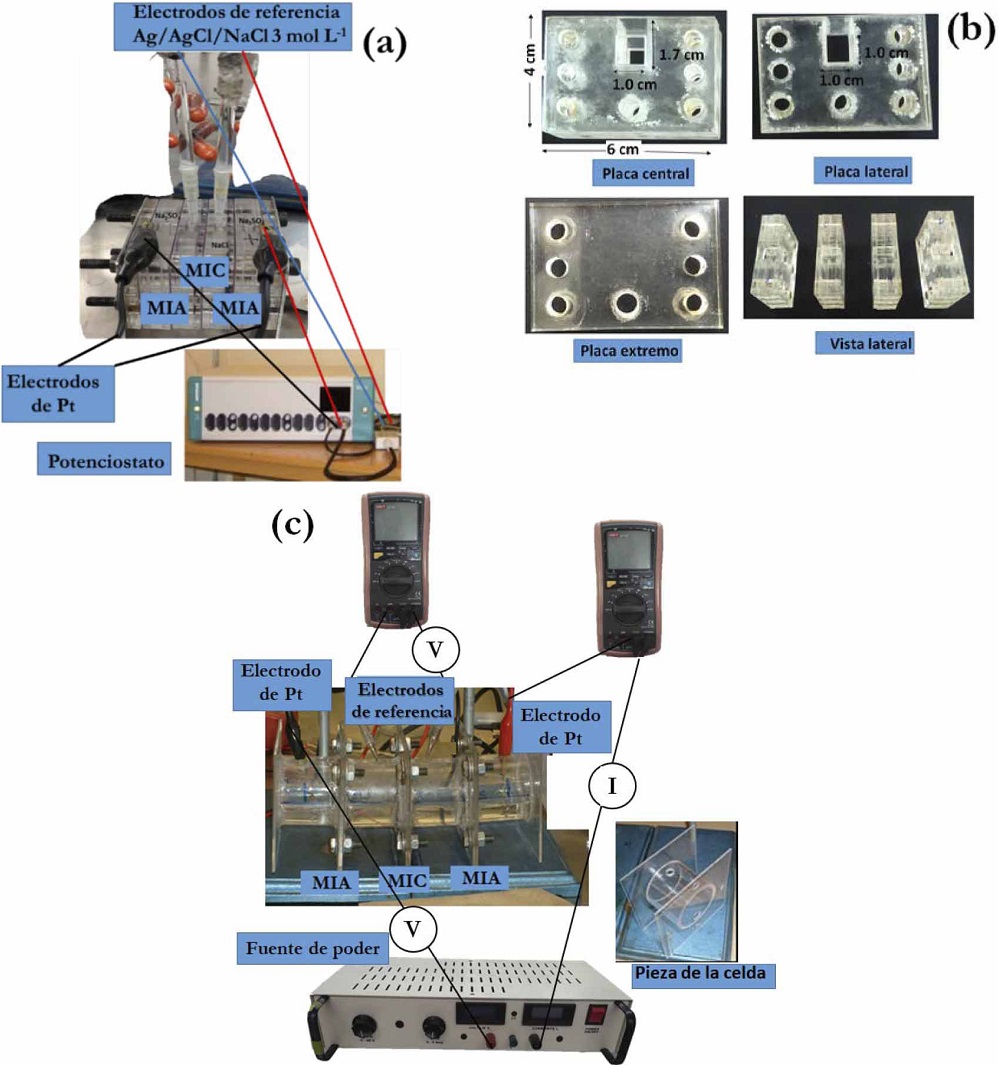
Figura 5 Dispositivo experimental para la realización de curvas I-E empleando (a) un potenciostato-galvanostato, (b) piezas de la celda empleada. (c) Dispositivo experimental con fuente de poder.
deben colocarse lo más cercanas a la superficie de la MII, una frente a otra en un mismo punto. En los compartimentos laterales se colocaron dos placas de platino de iguales dimensiones. Los compartimentos centrales se llenaron con las soluciones de estudio, que fueron preparadas con agua desionizada (18 MΩcm). Para los compartimentos laterales se empleó una solución de Na2SO4 1 M para evitar la formación de Cl2. Las curvas I-E se elaboraron empleando un potenciostato/galvanostato Autolab, el cual impuso la corriente y midió el potencial automáticamente.
Para realizar las curvas I-E manualmente se empleó una celda formada por cuatro piezas, elaboradas a partir de tubos y placas de acrílico, cada uno de ellos tiene orificios para la MII, los electrodos y los tornillos. El acomodo de las MII, soluciones y electrodos fue análogo al realizado con el potenciostato/galvanostado. Cada punto de la curva I-E se obtuvo aplicando con una fuente de poder una diferencia de potencial entre los electrodos de platino. Con un multímetro conectado en serie a las placas de platino se determinó la corriente; en tanto que la diferencia de potencial entre las dos caras de la membrana de estudio se midió con un multímetro conectado a los electrodos de referencia. Este procedimiento se repitió aumentando gradualmente el potencial hasta obtener los puntos necesarios para la curvas I-E. En ambos casos cada curva de polarización se realizó por triplicado. Cada curva de polarización se realiza en aproximadamente 10 minutos. El ensamble y llenado de la celda toma 15 minutos. Para cada replica, las soluciones fueron cambiadas, para esto la solución usada se extrajo de la celda succionando con pipetas a fin de que las MII permanecieran en la misma posición y el experimento fuera reproducible.
Resultados y discusiones
Primero se investigó el efecto de la carga del catión, por lo que se realizaron curvas de polarización empleando soluciones de NaCl, CaCl2 y AlCl3 a una misma concentración de catión. Las curvas obtenidas se presentan en la Figura 6a, todas tienen las tres regiones características de una curva I-E. Adicionalmente se observa que su forma es dependiente de la carga del ión, lo que muestra que este parámetro afecta el transporte del catión a través de la membrana. A fin de realizar un análisis más cuantitativo se obtuvieron los diferentes parámetros de las curvas de polarización y se agruparon en la Tabla 1. La Ilim se incrementa cuando aumenta la carga. Este efecto, puede predecirse de la ecuación 1, en donde se observa que la Ilim es directamente proporcional a la carga del ión. Esto se debe a que los iones multivalentes tienen una mayor carga, por lo que la carga transportada por unidad de tiempo, es decir la corriente, es mayor.
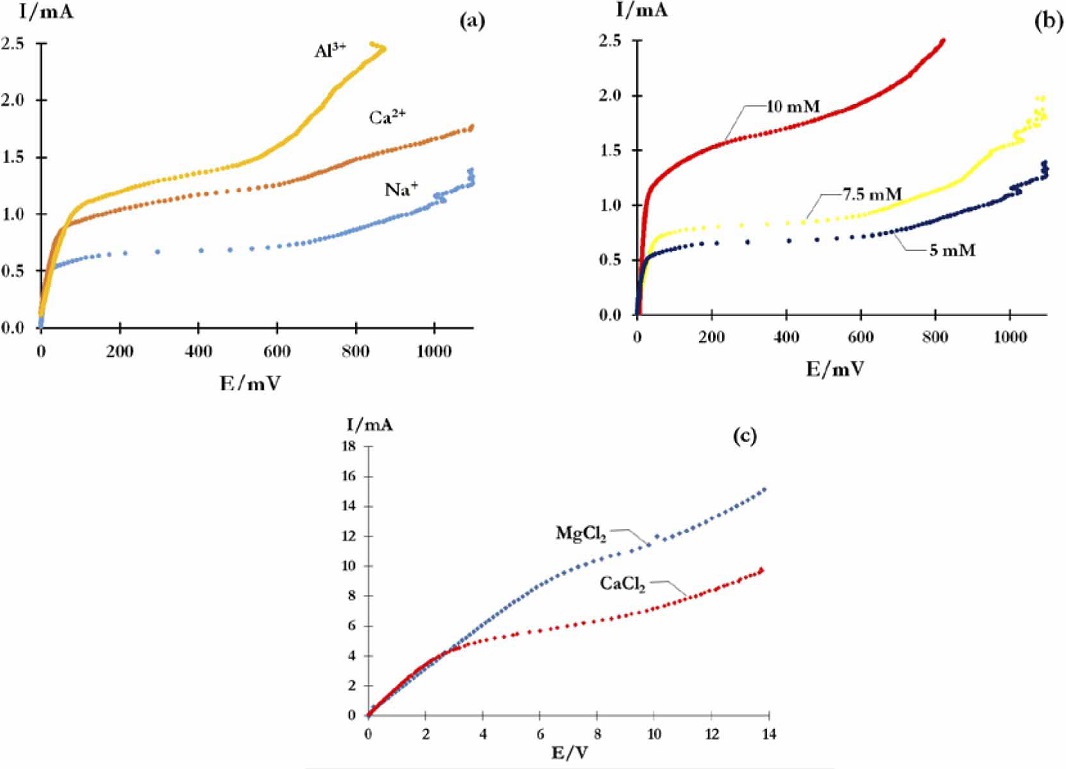
Figura 6 Curvas de polarización obtenidas con un potenciostato galvanostato, empleando una MII comercial CMX y soluciones: (a) 0.01 molL-1 de NaCl, CaCl2 y AlCl3, (b) NaCl a diferentes concentraciones. (c) Curvas I-E obtenidas con una fuente de poder, empleando una MII comercial CMX y soluciones de concentración 0.1 mol L-1.
Tabla 1 Datos obtenidos a partir de las curvas de polarización de la Figura 6.
| Efecto de la carga del catión (Figura 6a) | |||||||
|---|---|---|---|---|---|---|---|
| Ilím/mA | Rohm/Ω | Rec/ Ω | Eλ/mV | ∆V/mV | Rec/Rohm | ∆R/ Ω | |
| Na+ | 0.53 | 35.0 | 925.9 | 35.95 | 570.1 | 26.5 | 890.9 |
| Ca2+ | 0.90 | 41.7 | 909.0 | 44.93 | 517.2 | 21.8 | 867.3 |
| Al3+ | 1.2 | 71.4 | 297.6 | 80 | 475.6 | 4.2 | 226.2 |
| Efecto de la concentración de NaCl expresada en mmolL-1 (Figura 6b) | |||||||
| 5 | 0.533 | 34.96 | 925.9 | 35.95 | 570.1 | 26.48 | 890.94 |
| 7.5 | 0.75 | 62.11 | 729.42 | 50 | 558.67 | 11.74 | 667.31 |
| 10 | 1 | 54.05 | 409.83 | 59 | 508.15 | 7.58 | 355.78 |
En cuanto a Eλ, se observa que se incrementa con la carga del ión. Este resultado indica que la dificultad para agotar la especie en la interfaz incrementa con la carga. Esto debido a que los iones multivalentes tienen mayor atracción electrostática hacia especies cargadas, por lo que atraen mayor cantidad de moléculas de agua y su esfera de hidratación es mayor desplazándose más lentamente que los iones univalentes (Hamani et al., 2011). En lo que respecta a Rohm, se observó que su valor incrementa con la carga, como se señaló Rohm es la suma de tres contribuciones. Como la membrana es la misma Rm es la misma para todos los iones, y la concentración es la misma Rcd es igual para los tres iones, indicando que la diferencia es debida a Rs, la resistencia es mayor para los cationes multivalentes debido a que se desplaza más lentamente. También se observó que ∆V, ∆R y Rec/Ro aumentaron el siguiente orden: Al3+< Ca2+ < Na+. Estos parámetros son inversamente proporcionales al requerimiento energético para destruir la capa de difusión, lo cual indica que es más difícil agotar la especie en la interfaz cuando los iones son multivalentes, debido a que están más hidratadas y se desplazan más lentamente que las univalentes.
Una vez analizado el efecto de la carga del catión en las curvas, se analizó el de la concentración, para esto se empleó el Na+, se observa que la forma de las curvas depende de la concentración (Figura 6b), lo que muestra que el transporte iónico en la MII cambia con la concentración. Los datos obtenidos de las curvas I-E, se agrupan también en la Tabla 1. La Ilim de Na+ incrementa con la concentración tal como lo predice la ecuación 1, que indica que la Ilim es directamente proporcional a Ci° e inversamente proporcional a δ, siendo el resto de parámetros de la ecuación constantes para un mismo ión, en consecuencia Ilim incrementa con la concentración. Esto se debe a que a medida que aumenta la concentración es necesario un mayor paso de corriente para agotar al ion en la interfaz membrana/solución. Por otro lado Eλ incrementa con la concentración, puesto que cuando incrementa la concentración se requiere más energía para agotar la especie en la interfaz membrana/solución. También se observó que para las soluciones 7.5 y 10 mM Rohm disminuye cuando incrementa la concentración de los iones, dado que al incrementar la concentración se incrementa la cantidad de portadores de carga, disminuyendo la contribución de Rs. La solución 5 mM no siguió la tendencia, probablemente por algún detalle experimental. Finalmente se observó que Rec, Rec/Rohm, ∆R y ∆V disminuyen cuando incrementa la concentración. Esto indica que cuando aumenta la concentración es más fácil que ocurra la electroconvección, dado que cuando aumenta la concentración se incrementa el contacto de los iones con las partes no conductoras de las membranas facilitando la electroconvección.
Finalmente se estudió el efecto del ensuciamiento de la membrana, para esto se trabajó con soluciones más concentradas (0.1 mol L-1) de CaCl2 y MgCl2, ya que estas sales ensucian la membrana, puesto que tienden a formar costras de hidróxidos en la superficie de la MII, las cuales catalizan el desdoblamiento del agua (Andreeva et al., 2017), aunque el MgCl2 lo hace con mayor intensidad. Se observa que la Ilim de Mg2+ (8.5 mA) es casi el doble que la de Ca2+ (4.4 mA), contario a lo esperado de la ecuación 1, que predice un valor similar, ya que las variables involucradas son muy similares. Esto se debe a que el hidróxido de magnesio formado en la superficie de la MII cataliza el desdoblamiento del agua, por lo que el incremento de Ilím, se debe a esta contribución que no es considerada en la ecuación 1. Adicionalmente se observa que las pendientes de Ca2+ y Mg2+ en la zona I son prácticamente iguales, lo que indica que Rohm es muy similar para ambos cationes. En efecto, aunque se esperaría una resistencia más pequeña para Mg2+ que para Ca2+ debido a que en el caso de Mg2+ hay más iones en solución considerando los iones producidos por desdoblamiento del agua. Sin embargo, la resistencia global es la misma para ambos iones, ya que la Rm es más grande para Mg2+ que para Ca2+ debido a la costra formada de Mg(OH)2 en la superficie de la MII razón por la cual se eliminan partes conductoras e incrementa la resistencia de la MII y la resistencia total.
Conclusiones
En este trabajo se muestra que las curvas de polarización evidencian, de manera experimental, cómo cambia el transporte de diferentes contraiones a través de una MII selectiva a los cationes con diferentes parámetros de la solución y de la MII, lo que facilita la comprensión de los procesos que toman lugar.











 nueva página del texto (beta)
nueva página del texto (beta)



