Introducción
Gran parte de la importancia en el estudio de la química radica en el beneficio que ofrece a la humanidad, por ejemplo, la obtención de una inmensa variedad de compuestos para usos diversos en las diferentes ramas de la industria, textil, de construcción, farmacéutica y alimentaria, entre otras más. El uso que se les da a estos compuestos depende de su comportamiento químico y biológico, además de sus propiedades físicas, y todo esto es consecuencia, en última instancia de la estructura molecular, la cual a su vez tiene su origen en la estructura atómica. Esta es la razón por la cual los estudiantes que cursan química general deben poseer buenas bases conceptuales de la estructura atómica en la enseñanza de la química general.
Las modalidades de conducción del proceso de enseñanza-aprendizaje por parte del profesor en general, contemplan la exposición de los temas con la participación del alumno y las modalidades de evaluación que consisten en exámenes escritos, además de la entrega de tareas y exposición de temas por parte de los estudiantes, así como el uso de estrategias pedagógicas que favorezcan el aprendizaje de una manera significativa como el trabajo cooperativo, la elaboración de mapas conceptuales, el material audiovisual, el uso de aulas virtuales y el manejo de internet. Sin embargo, es relevante que el profesor realice una revisión del aprovechamiento de los temas vistos en clase, con el propósito de determinar dónde están las deficiencias en el aprendizaje, así como los niveles de dificultad del contenido sintético para poder mejorar la eficiencia en este proceso.
Para el estudio de la estructura atómica es conveniente que los estudiantes conozcan y aprendan que, en la tabla periódica, los elementos químicos están ordenados por su número atómico, configuración electrónica y sus propiedades químicas, los cuales entrelazados, forman una red conceptual que compone el entendimiento de la estructura atómica. Existen varias formas de armar una red para comprender la estructura atómica, una de ellas es integrar los conocimientos que, al correlacionarlos entre sí, permitan al estudiante asimilar el concepto de la estructura atómica y, por lo tanto, este preparado para la comprensión y manejo de la estructura molecular.
El rendimiento de un grupo de alumnos en el aprovechamiento del conocimiento de un tema particular tiene diversos vectores, de los cuales se consideran cuatro como los más relevantes: (1) la forma de exposición del tema por parte del profesor; (2) la dificultad misma de los temas para su aprendizaje; (3) la forma de evaluación del profesor; y (4) el tiempo dedicado a cada tema. Para atender esta problemática, en el presente trabajo se propone el uso de un reactivo de evaluación como material didáctico que permita conducir y evaluar el aprovechamiento en el proceso de enseñanza-aprendizaje de la estructura atómica de forma integral (Haro y col. 2003; Romero y col. 2007), enlazando y correlacionando los conocimientos fundamentales de este tema: número atómico; número másico; número de protones, neutrones y electrones; nombres y símbolos de los elementos químicos; el principio de exclusión de Pauli; la regla de Hund, y el principio de Aufbau (Chang, 1999; Whitten, y col. 1992; Richman, 1998); por último, la configuración electrónica (Darsey, 1988; Mabrouk, 2003; Garofalo, 1997); la capa de valencia y el kernel (gases nobles). La dinámica de trabajo en el ejercicio propuesto implica el uso frecuente de la tabla periódica para alcanzar mejores resultados. El objetivo general del presente trabajo es contribuir al mejoramiento del proceso de enseñanza-aprendizaje en el conocimiento de la estructura atómica.
Metodología
Características del reactivo de evaluación
El reactivo (figura 1) opera de acuerdo con el diagrama logístico de la figura 2, para dar como resultado la información indicada en el ejemplo resuelto del reactivo en estudio (figura 3). La figura 1 contiene los datos del problema (siendo el punto de partida para la resolución), que son los electrones representados con flechas, colocados en una distribución electrónica incorrecta, en la que se violan el principio de exclusión de Pauli, la regla de Hund y el principio de Aufbau. El propósito de lo anterior es que el estudiante reconozca estos errores para corregirlos en la misma figura 1, siguiendo las instrucciones indicadas en el diagrama de la figura 2 para dar la solución completa. Las variables para la elaboración del reactivo son: 1) número de electrones involucrados en la figura 1; y 2) el diseño de la configuración electrónica incorrecta elegida para aplicar el cuestionario.

Figura 1 Reactivo de evaluación para la estructura atómica con la interrelación de los 13 conocimientos involucrados en un concepto: configuración electrónica.

Figura 3 Ejemplo resuelto del reactivo de evaluación para la estructura atómica presentado en la figura 1
Respecto a la primera variable, para definir el número de electrones que se usará en el reactivo, se recomienda utilizar los elementos de los períodos 2 al 5, con el propósito de que el alumno no disperse su atención con un excesivo número de electrones. En el caso de la segunda variable, para el diseño de la configuración incorrecta, se pueden incluir errores en uno, dos o en los tres aspectos que determinan la entrada correcta de los electrones siguiendo el principio de Aufbau, la regla de Hund y el principio de exclusión de Pauli).
Bases del reactivo de evaluación
La representación de los electrones con flechas verticales.
Señalización correcta del espín de los electrones con direcciones opuestas en cada orbital completo (+½ y -½).
Considerar átomos neutros (es decir sin carga, no iónico), lo que implica que el número de electrones es igual al número atómico y consecuentemente también igual al número de protones.
El número atómico se encuentra en la parte superior derecha o izquierda de la casilla de cada elemento en la tabla periódica y se refiere al número de protones en el núcleo
El nombre, el símbolo y el número másico se encuentran también en la casilla correspondiente a cada elemento de la tabla periódica.
El número de neutrones se calcula con la siguiente operación: número de neutrones = (número másico) - (número atómico)
Principio de Aufbau (en español, aufbau significa construcción): los electrones van entrando en los subniveles de menor a mayor energía (como se puede ver en el eje “y” del esquema 2 en la figura3), siendo el orden: 1s, 2s, 2p, 2p, 3s, 3p, 4s, 3d … etc. En consecuencia, no deben haber electrones en un subnivel cuando no estén completos los subniveles anteriores.
Regla de Hund: en los subniveles “p”, “d” o “f”, primeramente se van ocupando cada uno de sus orbitales con un solo electrón y luego entrará el segundo en cada caso para completar el par. En los subniveles “s” no se aplica esta regla ya que solo existe un orbital.
Principio de Exclusión de Pauli: para que puedan existir dos electrones en un mismo orbital deben tener su espín contrario, es decir que el número cuántico “s” debe ser diferente (+½ y -½).
Capa de valencia: número máximo de electrones en un átomo, que pueden participar para formar enlaces químicos en una molécula. Normalmente es el mismo que su número de grupo en la tabla periódica.
Kernel: corresponde a los electrones de las capas (orbitales) más internos de un átomo. Se obtiene al quitar la capa de valencia en la configuración electrónica de un elemento.
Cómo resolver el reactivo:
De acuerdo con el diagrama logístico de la figura 3, el punto de partida se encuentra en los datos del problema de la figura 1 que consisten en: 1) contar las flechas para dar la respuesta a la primera pregunta del cuestionario (punto 1, inciso “c”), y 2) contar el número de electrones, que en este caso suman 20. A continuación, al conocer que el átomo en su estado elemental tiene el mismo número de electrones que de protones, se resuelve también la pregunta del inciso “d”, el número de protones es también 20. De lo anterior deriva la respuesta del inciso (f), también 20 ya que el número atómico se define por el número de protones, lo cual se puede considerar como la “huella de identidad” de cada elemento. Para resolver los siguientes incisos se requiere la tabla periódica y en ella se busca inicialmente la casilla correspondiente al número atómico del elemento en cuestión para encontrar su nombre que es calcio, el cual responde la pregunta en el inciso “a” del punto 1.1, luego su símbolo, Ca (inciso “b”, punto 1.1) y por último su número másico 40 (inciso “g”). Para finalizar las respuestas del punto 1.1 en la pregunta del inciso “e”, el número de neutrones se obtiene efectuando la resta: (número másico) - (número de protones) = número de neutrones: 40 - 20 = 20.
Al pasar al inciso del punto 1.2, se determina la violación al principio de Aufbau (inciso “a”) cuando en un par de subniveles, el inferior se encuentra incompleto (2s) y uno superior ocupado parcial o totalmente. En el presente caso existen varias respuestas correctas: 2s-2p, 2s-3s, 2s-3p, 2s-4s, 2s-3d, 3p-4s y 3p-3d, de las cuales basta expresar solo una de ellas para acreditar este inciso. En segundo término, para la regla de Hund se señala solo un subnivel, en el que sucede la violación y por lo cual la respuesta en este ejemplo es: 3d, ya que en este subnivel existe un orbital completo con dos electrones (3d-2) y 3 orbitales vacíos: 3d0, 3d+1 y 3d+2, aunque bastaría solo uno de ellos vacío para que hubiera violación al principio de Hund. En conclusión, en el punto 1.2, en el principio de exclusión de Pauli es necesario señalar el nivel, el subnivel y el orbital para indicar la violación, que en este ejemplo es 2p0, ya que en éste se encuentran dos electrones con el mismo espín, es decir dos flechas con la misma dirección y sentido.
En el punto 1.3 de la figura 2 está la respuesta al reactivo para el estudio de la estructura atómica de la figura 1 al colocar los 20 electrones de forma correcta. Por último, las dos respuestas al punto 1.4 de la figura 2 se contestan enmarcando la capa de valencia con un óvalo y el Kernel con un rectángulo.
Discusión de los resultados
Antes de resolver el reactivo, a los alumnos se les notifica que pueden utilizar la tabla periódica como apoyo, y el tiempo límite para resolver el reactivo es de 15 minutos. El primer ensayo del reactivo se aplicó a un grupo piloto de 30 alumnos de química general en el trimestre 2009-invierno (septiembre-diciembre, once semanas de clase), con cuatro ejemplos diferentes. Después de aplicar cada uno de los ejemplos, se resolvieron frente al grupo para que cada alumno verificara si tuvo errores y en el siguiente reactivo mejorar su conocimiento de la estructura atómica. En la figura 4, se observa que en los siete incisos correspondientes al punto 1.1 del reactivo de evaluación, los estudiantes adquieren los conocimientos para contestar correctamente con 100% de aciertos al final de resolver los cuatro ejemplos, sin embargo, en los incisos de los puntos 1.2, 1.3 y 1.4, se presentaron las mayores dificultades de aprendizaje, siendo el principio de Aufbau donde se hace más evidente el problema (27%), seguido de la capa de valencia (50%), el kernel (50%) y la distribución electrónica (63%) y con una mejoría en el aprendizaje, el principio de exclusión de Pauli (77%) y la regla de Hund (80%).
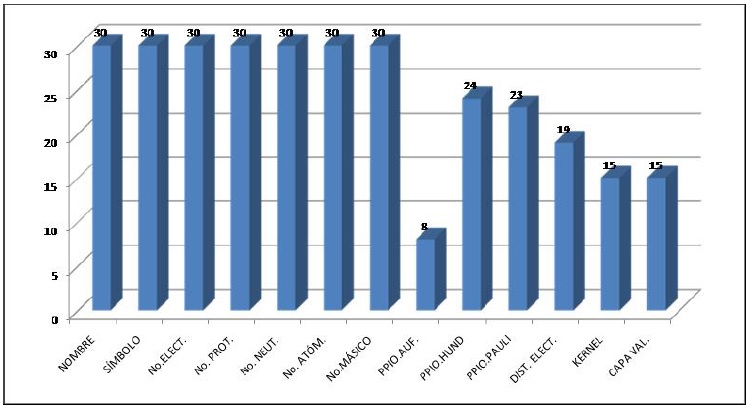
Figura 4 Resultados del nivel de comprensión de los 13 conocimientos básicos de la estructura atómica al final de aplicar cuatro ejercicios en un grupo de 30 alumnos durante el periodo del trimestre (2009-invierno).
Posteriormente, el reactivo se aplicó a tres grupos de 50 alumnos inscritos en la unidad de enseñanza-aprendizaje Química General en los trimestres 2009-primavera, 2009-otoño y 2010-primavera con seis, cuatro y cinco diferentes ejemplos, respectivamente. Los resultados obtenidos en la valoración del aprendizaje de la estructura atómica para estos tres grupos se muestran en las figuras 5, 6 y 7, los cuales presentan correlación positiva con los resultados obtenidos en el grupo piloto de 30 alumnos del primer grupo de química general evaluado con este reactivo durante el trimestre 2009-invierno.
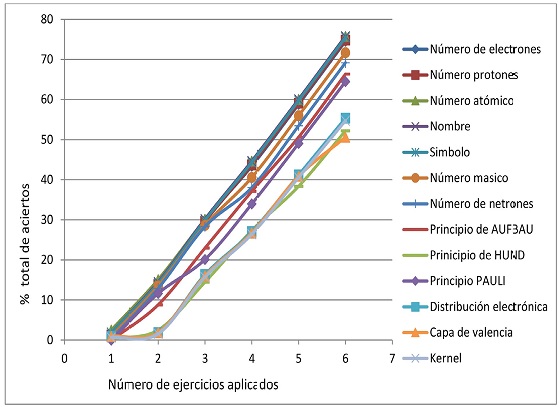
Figura 5 Resultados del nivel de comprensión de los 13 conocimientos básicos de la estructura atómica en un grupo de 50 alumnos durante el periodo del trimestre 2009-primavera después de la aplicación de seis ejercicios.
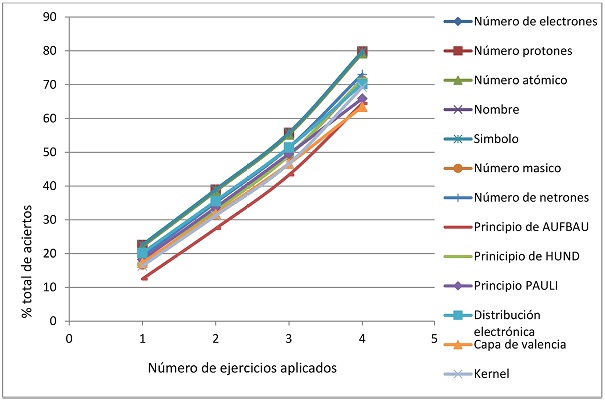
Figura 6 Resultados del nivel de comprensión de los 13 conocimientos básicos de la estructura atómica en un grupo de 50 alumnos durante el periodo del trimestre 2009-otoño después de la aplicación de cuatro ejercicios.
Conclusiones
Los anteriores resultados, han permitido evaluar el nivel de aprendizaje alcanzado por los alumnos en el tema estructura atómica de los cursos de química general y esto condujo a detectar las fortalezas y debilidades en el proceso de enseñanza-aprendizaje para esta temática. Derivado de lo anterior, los profesores tendrán la oportunidad de elegir nuevas herramientas para reforzar las estrategias de transmisión del conocimiento con el propósito de incidir en los puntos de difícil aprendizaje para que los estudiantes puedan conocer y aplicar estos conceptos con más certeza. El segundo aspecto de igual importancia es el reordenamiento de los tiempos de dedicación en clase para los diferentes conocimientos del tema estructura atómica, poniendo una mayor atención hacia los puntos más difíciles de comprender por los estudiantes: el principio de Aufbau, los electrones de valencia, el kernel y la configuración electrónica como quedó manifestado en los resultados de la evaluación, siendo necesario dedicarles a estos principios y conceptos un mayor tiempo para su enseñanza en los cursos, con el fin de mejorar los resultados del aprovechamiento en el aprendizaje de la estructura atómica, para hacer más eficiente el proceso de enseñanza-aprendizaje.











 nueva página del texto (beta)
nueva página del texto (beta)




