Introducción
Debido a la creciente curiosidad humana por explicar desde lo que somos, hasta lo que vemos, olemos y tocamos, la Química ha adoptado un rol fundamental para entender nuestro entorno. A pesar de que se trate de una ciencia experimental, se han desarrollado en torno a ella, metodologías de enseñanza fuertemente sustentadas en el uso de modelos, analogías o metáforas como un puente entre la teoría y la realidad (Raviolo, 2009). A raíz de esto, nace la necesidad de diseñar modelos representativos, con analogías testeadas y cuidadosamente preparadas, que permitan correlacionar la teoría con la realidad al utilizar materiales y situaciones cotidianas.
La enseñanza de la electroquímica ha hecho uso del indispensable esquema de la celda galvánica observada en la ilustración 1 (Briss & Truax, 1990), esta es representada como dos semi celdas de distintos metales, unidas por un conductor eléctrico y conectadas a su vez por un medio de compensación de carga, el denominado puente salino. Esto permite que los estudiantes distingan los componentes que actúan en los procesos de óxido y reducción. No obstante, la necesidad del alumno en plasmar los conceptos teóricos adquiridos, en evaluaciones, origina conocimientos no conectados con la realidad y sin una utilidad aparente (Martínez, 2013).
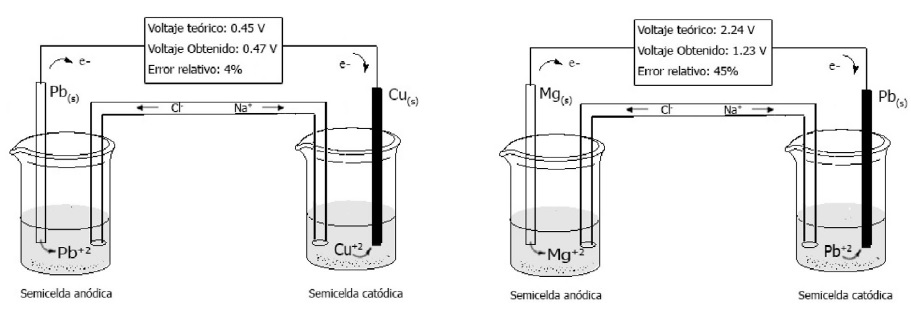
Ilustración 1 Esquema de los componentes de una pila galvánica en dos casos a) Pila plomo y cobre, con bajo error entre voltaje teórico y obtenido. b) Pila plomo y magnesio, con gran error entre voltaje teórico y obtenido.
De esta forma, si queremos enseñar una química más atractiva, que pueda ser comprendida como una herramienta para explicar el comportamiento de nuestro entorno, es necesario enfocarnos en los fenómenos relevantes del tema y conectarlos con escenarios en los que nos encontramos habitualmente (Izquierdo, 2003). En el caso de los procesos Redox, se deben considerar tanto los aspectos favorables de estos, utilizables para la generación de energía eléctrica, como los aspectos desfavorables, manifestados en la necesidad de evitar la corrosión de los metales especialmente los utilizados tanto en nuestras casas como a nivel industrial, protegiéndolos por medio del aislamiento, el uso de aleaciones o con ánodos de sacrificio (So, Valdéz, Schorr, y Carrillo, 2013).
Una vez pasado el contenido teórico de la unidad de Óxido-Reducción, nos encontramos con que frecuentemente las preguntas diseñadas para ejercitar y evaluar el conocimiento sobre este tema, son dirigidas a la aplicación directa de las fórmulas, la extracción de resultados y la memorización de esquemas (Vera, Montiel, Stoppello, y Gimenéz, 2010), lo que genera que el alumno no analice sus implicancias y por consiguiente, no pueda conectar íntegramente estos conceptos a la realidad ni a contenidos de cursos posteriores, desarrollando un aprendizaje de conocimientos mecanizados. Es por ello que utilizamos metales obtenidos de objetos de uso común (clavos de construcción, cables eléctricos de cobre, pesas de plomo etc), con la finalidad de que los alumnos fusionen conceptos teóricos de la electroquímica, con situaciones cotidianas a través del experimento clásico de la celda galvánica, centrándonos en tres aspectos:
Materiales y métodos
Construcción de pilas galvánicas con estructura clásica
La medición de los potenciales de reducción se realizó de la siguiente manera:
Se utilizaron soluciones 0,1 M en vasos de precipitados de 100 mL y se procedió a introducir los metales correspondientes previamente pulidos. Ambos metales se conectaron a un polo del voltímetro a través de cables con pinzas y se seleccionó la escala de 2V y se introdujo el puente salino de cloruro de sodio.
La visualización de la energía generada se hizo de la siguiente manera:
Para las combinaciones con voltaje superior a 1,6V, se conectó en serie el multímetro en modo amperímetro y un led rojo. Para los voltajes inferiores a 1,6V antes de conectar el amperímetro y el led, se unieron en paralelo y en serie al menos dos pilas de igual o distinta combinación de metales.
Se construyeron pilas con distinto número de puentes salinos (2 ó 3), de distintos tamaños (diámetros de 5 y 10 mm, largos de 11 a 25 cm). Tabla 2
Construcción de pilas galvánicas modificadas
Para replicar situaciones de corrosión de la vida cotidiana, se dispusieron los metales previamente lijados y limpios en un mismo vaso de precipitado de 200 mL, con solución de NaCl y conectados a los polos del voltímetro, con una separación entre ellos de 5 cm aproximadamente y se esperó 20 segundos hasta la estabilización del voltaje. De la misma forma que en el experimento anterior, se unieron dos o tres pilas modificadas conectadas en serie para encender el led. Se probaron distintas concentraciones de la solución de cloruro de sodio (hasta la saturación). Tabla 3
Resultados y discusión
Pila galvánica con estructura clásica
Como se puede visualizar en la ecuación de Nernst (1), las concentraciones de sales del cátodo y el ánodo no son importantes cada una por si sola, ya que la diferencia de potencial generada será afectada únicamente cuando estas son diferentes. Por lo tanto, con la finalidad de abaratar el costo del experimento, se utilizó en ambas soluciones concentraciones diluidas al 0,1 M, ya que se obtuvo el mismo voltaje. Es importante destacar que al utilizar bajas concentraciones se obtendrá menor intensidad de corriente y se debe tener mayor cuidado al momento de preparar las soluciones, ya que un pequeño error llevará a que reaparezca el término de corrección del potencial. Chang R. Química. 2010. (Cap. 19)
Dónde:
∆E = Diferencia de potencial corregido (V)
∆E°=Diferencia de potencial en condiciones estándar (V)
R= Constante universal de los gases ideales
T= Temperatura absoluta (K)
Z= Cantidad de electrones que participan en la reacción (mol)
F= Constante de Faraday (C/mol)
xi= Concentración de la sal del ánodo (M) x2= Concentración de la sal del cátodo (M)
En las pilas mostradas en la tabla 1, se observa que en la mayoría de casos los resultados de los voltajes experimentales difieren significativamente de los voltajes teóricos según fuentes como Milazzo, Caroli, y Sharma (1978), en donde, los que más se aproximan a los calculados son el del cobre, la plata, el cinc y el plomo, lo cual coincide con ser los elementos que poseen los mayores potenciales de reducción entre los metales utilizados y que corresponden también, con ser los de mayor utilización en la vida cotidiana como materiales puros. En el caso del cinc, se debe tener especial cuidado ya que al poseer un bajo potencial de reducción, se forma una capa de óxido la cual actúa como pasivante de este metal. Debido a que la combinación entre estos elementos da en todo los casos un error relativo inferior al 5%, los vuelve adecuados para comprobar el cálculo de la Fem de una pila.
Tabla 1 Valores de voltajes obtenidos
| Cátodo | Ánodo | Voltaje Teórico | Voltaje Experimental | Diferencia Teór./Exp. | Diferencia Teór/Exp. |
| (V) | (V) | (V) | (%) | ||
| Cobre | Plomo | 0,47 | 0,45 | 0,02 | 4,3 |
| Cobre | Hierro | 0,78 | 0,43 | 0,35 | 44,9 |
| Cobre | Cinc | 1,10 | 1,09 | 0,01 | 0,9 |
| Cobre | Aluminio | 2,02 | 0,75 | 1,27 | 62,9 |
| Cobre | Magnesio | 2,71 | 1,69 | 1,02 | 37,6 |
| Plata | Cobre | 0,46 | 0,42 | 0,04 | 8,7 |
| Plata | Plomo | 0,93 | 0,88 | 0,05 | 5,4 |
| Plata | Hierro | 1,24 | 0,85 | 0,39 | 31,5 |
| Plata | Cinc | 1,56 | 1,51 | 0,05 | 3,2 |
| Plata | Aluminio | 2,48 | 1,18 | 1,3 | 52,4 |
| Plata | Magnesio | 3,17 | 2,1 | 1,07 | 33,8 |
| Plomo | Hierro | 0,31 | 0,55 | 0,24 | 77,4 |
| Plomo | Cinc | 0,63 | 0,63 | 0 | 0 |
| Plomo | Aluminio | 1,55 | 0,32 | 1,23 | 79,4 |
| Plomo | Magnesio | 2,24 | 1,23 | 1,01 | 45,1 |
| Hierro | Cinc | 0,32 | 0,18 | 0,14 | 43,8 |
| Hierro | Aluminio | 1,24 | 0,36 | 0,88 | 71,0 |
| Hierro | Magnesio | 1,93 | 0,74 | 1,19 | 61,7 |
| Cinc | Aluminio | 0,92 | 0,4 | 0,52 | 56,5 |
| Cinc | Magnesio | 1,61 | 0,62 | 0,99 | 61,5 |
| Aluminio | Magnesio | 0,69 | 0,95 | 0,26 | 37,7 |
En cambio, otros elementos como el hierro, el magnesio y el aluminio, se alejan demasiado de los datos teóricos. En el caso del hierro la discrepancia se puede explicar debido a que en la mayoría de las ocasiones este se encuentra como aleación con el objetivo de favorecer sus características mecánicas y evitar su oxidación, por otro lado, con respecto al aluminio y al magnesio, a pesar de encontrarse en un estado de pureza relativamente alto, ambos poseen la capacidad de formar espontáneamente una capa de pasivación producto de la oxidación (Giudice & Pereyra, 2003), que aísla al elemento puro y frena las reacciones de oxidación.
Debido a la necesidad de conseguir al menos 1,6V para encender el led, se utilizaron las combinaciones cobre-magnesio y plata-magnesio, ya que otras combinaciones de metales no conseguían este voltaje, lo cual nos permitió recordar conceptos de electricidad y electrónica al conectarlas en serie. Una vez obtenido el potencial requerido o uno superior no siempre se observó la luminosidad adecuada, para solventar este punto fue necesario aumentar la corriente eléctrica a través de una mayor tasa de compensación de cargas, para lo cual, se hicieron pruebas variando las dimensiones (tabla 2) y el número de puentes salinos (de 1 a 3). Como resultado se obtuvo que la energía generada aumentaba significativamente al adicionar más puentes salinos y al disminuir su longitud y al aumentar su diámetro.
Tabla 2 Flujo de corriente variando las dimensiones del puente salino con electrodos de Mg/Ag
| Largo (cm) | Diámetro (mm) | Corriente (mA) |
| 25 | 5 | 0,98 |
| 16,5 | 5 | 1,54 |
| 11 | 5 | 1,94 |
| 11 | 10 | 3,67 |
| 11 y 11 | 5 y 5 | 3,88 |
| 11 y 11 | 5 y 10 | 5,61 |
También se variaron las concentraciones del puente salino, resultando una práctica beneficiosa para exponer cuál es su implicancia en el experimento, ya que a bajas concentraciones se obtuvo la misma diferencia de potencial, pero la energía generada es prácticamente nula. En cambio, al aumentar la concentración de sal, permitió observar su correlación directa con un aumento del flujo de corriente, correspondiendo a una mayor tasa de compensación de cargas y de oxidación por parte del elemento utilizado como ánodo. Lo cual, se puede asemejar al efecto generado por la humedad en ambientes altamente salinos como en las cercanías del mar, donde se observa un rápido deterioro de los objetos metálicos o deterioros paulatinos en ambientes como en el baño luego de una ducha con agua caliente, pudiendo ser un nexo entre la teoría y la realidad fácil de asimilar.
Pila galvánica modificada
Tratando de imitar el proceso corrosivo que se genera en los metales expuestos a ambientes marinos, es decir a la humedad con altos contenidos de sales, es que decidimos introducir ambos metales (magnesio y plata) en una solución de cloruro de sodio (ilustración 2), en donde pudimos comprobar que seguía existiendo un voltaje, el cual a pesar de no ser igual que los valores obtenidos en la tabla 1 permitieron encender el led. Notamos también que variaciones en la concentración de cloruro de sodio no producían variaciones en el voltaje, pero si en el amperaje (Tabla 3). Posteriormente, introdujimos los mismos metales en agua destilada y observamos nuevamente voltajes similares a los obtenidos en solución salina, pero la intensidad de corriente fue apenas perceptible por el amperímetro y no encendió el led. Debemos destacar el hecho que en el transcurso de pocos minutos se observó un pequeño aumento en el amperaje, simultáneamente con un aumento espontaneo del pH. Este hecho demuestra que trabajar en presencia de humedad (agua con oxígeno) provoca la corrosión y la presencia de sales acelera aún más este proceso.
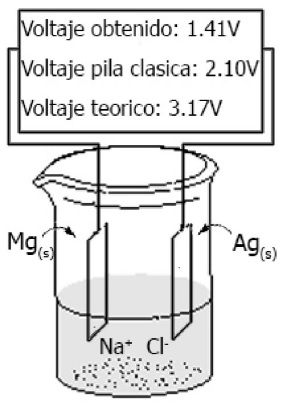
Ilustración 2 Pila galvánica modificada compuesta por una barra de magnesio y una de plata, inmersos en una solución de cloruro de sodio.
Tabla 3 Variación del Amperaje al variar la concentración de la solución de NaCl con electrodos Mg/Ag
| Conc (%m/v) | Corriente (mA) |
| 4 | 9.0 |
| 5 | 13.4 |
| 10 | 24.2 |
La mayoría de las combinaciones de metales mostradas en la tabla 4 permitieron encender el led al conectarse en serie (de 2 a 3 celdas), con lo que se logra demostrar la generación de corriente eléctrica por el proceso de corrosión. Así mismo observamos que la distancia entre electrodos es determinante para aumentar el amperaje, mientras más cercanos se encuentren los metales la corriente medida fue mayor, pero también producía mayor variabilidad en el voltaje, consiguiéndose los mejores valores entre 1 y 5 cm.
Tabla 4 Diferencia de potencial al sumergir ambos electrodos en un mismo medio salino (NaCl) a una distancia de 4 cm
| Cátodo | Ánodo | Voltaje Teórico | Voltaje pila Modificada | Diferencia Teór/Exp. |
| (V) | (V) | (%) | ||
| Cobre | Plomo | 0,47 | 0,39 | 17.0 |
| Cobre | Hierro | 0,78 | 0,19 | 75,6 |
| Cobre | Cinc | 1,10 | 0,82 | 25,5 |
| Cobre | Aluminio | 2,02 | 0,64 | 68,3 |
| Cobre | Magnesio | 2,71 | 1,52 | 43,9 |
| Plata | Cobre | 0,46 | 0,16 | 65,2 |
| Plata | Plomo | 0,93 | 0.50 | 46,2 |
| Plata | Hierro | 1,24 | 0,20 | 83,9 |
| Plata | Cinc | 1,56 | 0,82 | 47,4 |
| Plata | Aluminio | 2,48 | 0,72 | 71,0 |
| Plata | Magnesio | 3,17 | 1,41 | 55,5 |
| Plomo | Hierro | 0,31 | 0,11 | 64,5 |
| Plomo | Cinc | 0,63 | 0,41 | 34,9 |
| Plomo | Aluminio | 1,55 | 0,25 | 83,9 |
| Plomo | Magnesio | 2,24 | 1,07 | 52,2 |
| Hierro | Cinc | 0,32 | 0,09 | 71,9 |
| Hierro | Aluminio | 1,24 | 0,32 | 74,2 |
| Hierro | Magnesio | 1,93 | 1,20 | 37,8 |
| Cinc | Aluminio | 0,92 | 0,18 | 80,4 |
| Cinc | Magnesio | 1,61 | 0,70 | 56,5 |
| Aluminio | Magnesio | 0,69 | 0,21 | 69,6 |
Modelo de experimentación
Experimento pila galvánica común
Debido a que algunos metales de uso cotidiano se encuentran en estado puro y otros como aleaciones, se puede pedir al alumno la construcción de una pila que concuerde con lo teórico como cobre-zinc, y otra que discrepe, pero que genere un voltaje mayor a 0,5 V (ver en la tabla 1) para poder asegurar que encienda el led, por ejemplo la combinación cobre - aluminio y luego unirlas en serie. Junto a esto, es necesario incorporar variaciones que den lugar a preguntas que requieran raciocinio, utilizables tanto de forma experimental como teórica, si se les contextualiza correctamente durante la pregunta. Ejemplos de las actividades y preguntas que los alumnos deberían resolver son:
Construir una pila con metales que generalmente se encuentren en contacto en la vida cotidiana, describa la situación y compare los resultados teóricos y los obtenidos experimentalmente. Señale cual electrodo corresponde al agente reductor y cual al agente oxidante. Se aconseja recordar situaciones habituales en áreas como la construcción o en ambientes marinos.
Construir pila cobre-aluminio. ¿Por qué razón cree que el voltaje obtenido en la pila cobre-aluminio difiere del resultado esperado?
Construir una pila con un voltaje igual o superior a 1,6V, conecte un led y adicione puentes salinos. ¿Qué variaciones se producen y en qué afecta esto al led?
Imagine que en un ambiente marino se tiene cinc en contacto con dos clavos de hierro, el primero de ellos es una aleación utilizada en la construcción y el otro está compuesto por hierro puro, ¿cuál se oxidaría más rápido? ¿Por qué?
Si se tiene en contacto hierro y zinc en un medio húmedo ¿Cual se de los dos metales se esperaría que se deteriorara primero? ¿Qué tiene que ver este fenómeno con la protección galvánica?
Sabiendo que el zinc es utilizado como uno de los electrodos en una pila alcalina común de 1,6V ¿Cuál debería ser el otro electrodo? Señale cual corresponde al cátodo y cual al ánodo
Experimento pila galvánica modificada
Antes de iniciar la práctica, es necesario explicar que estas reacciones ocurren con mayor frecuencia gracias al contacto indirecto de los metales, ya que la humedad ambiental con presencia de sales crea un puente salino natural. Para lograr relacionar la implicancia tanto en la vida cotidiana como en el experimento, es imprescindible que se realice valorando en todo momento la intensidad de corriente eléctrica, ya sea midiendo directamente con un amperímetro, o indirectamente observando la intensidad de luz de un led.
Se sugiere seguir con preguntas como:
¿Por qué los metales suelen corroerse más rápido en ambientes marinos?
¿Cuál cree usted que sería una alternativa para evitar la corrosión galvánica?
Cuando se quiere proteger un objeto de cinc utilizando otro metal como ánodo de sacrificio, según la tabla de potenciales, ¿Qué metales se pueden usar?
Lo ideal de esta sección es que se utilicen en un mismo recipiente metales que usualmente estén juntos en la vida real, bien puede ser la combinación hierro cinc, semejando una bisagra de cinc en un marco de hierro u otra que pueda imaginar el propio estudiante.
¿Cuál de los metales se esperaría que se deteriore primero? ¿Por qué ocurre esto?
¿Qué aspectos favorecen la reacción?
¿Qué sucede cuando agregamos más sal? (compruebe el voltaje amperaje)
¿Qué sucede cuando se acercan y se alejan los electrodos?
Al agregar pilas en serie hasta obtener al menos 1,6V ¿Se enciende el led? ¿Cómo se puede mejorar su intensidad?
¿En qué situaciones de la vida real es útil favorecer las reacciones Redox y en cuáles no?
Una empresa de camiones notó, luego de iniciar un contrato para transportar piezas de cobre, que los camiones con rutas más cercanas al mar presentaban un avanzado deterioro en su carrocería compuesta principalmente de hierro. ¿Por qué ocurre este problema y qué medidas se pueden implementar para solucionarlo?
En un baño, al lado de la ducha se tiene en contacto un marco de hierro, una bisagra de cinc y un portaobjetos de cobre ¿Cuál de ellos se demorará menos en deteriorarse?
Conclusiones
La Química como todas las ciencias que estudian los fenómenos de la naturaleza, crea fórmulas matemáticas para poder entender y predecir lo que ocurrió y ocurrirá, identificando y cuantificando la importancia de las variables naturales que afectan a determinados fenómenos En los cambios de la materia identificados como procesos de Óxido Reducción, existe una ingente cantidad de ecuaciones que constituyen la teoría de estos fenómenos naturales, que si bien los estudiantes de esta disciplina deben conocer y manejar, muchas veces los aleja de la realidad si no visualizan sus aplicaciones de forma real en situaciones cotidianas.
Por esta razón, el que los estudiantes puedan realizar experiencias en el laboratorio que simulen situaciones reales, en que intervienen los procesos de óxido reducción utilizando materiales comunes, permitirá que ellos comprendan mejor la importancia de la teoría y aprendan a manejar las variables que afectan a dichos procesos, tales como en la generación de energía eléctrica y en la corrosión.
Es por ello que la utilización de una serie de pilas galvánicas con diferentes metales, la mayoría de uso cotidiano, poniendo especial atención en el contraste entre los resultados teóricos esperados y los resultados obtenidos, genera en los estudiantes un creciente interés en esta materia, provocando que ellos se formulen interrogantes y propongan respuestas a las mismas, conectando a su vez estos conocimientos con otras disciplinas en este caso con la Física en su unidad de Electricidad, al comprobar las variaciones del voltaje y de la intensidad de la corriente, al conectar las pilas en serie o en paralelo. También la utilización de leds, permite que ellos observen de forma real la generación de la energía eléctrica y no como un valor cuando es medida a través de un instrumento. Además, estos experimentos permiten evidenciar la importancia y la función del puente salino, al intensificar la luminosidad del led, cuando se utiliza más de uno de estos puentes o procurando que este sea lo más corto y ancho posible.
Para que los estudiantes visualicen el fenómeno de la corrosión, el modificar la pila galvánica introduciendo los dos electros en un mismo recipiente con solución salina de NaCl, permite que ellos puedan observar que el voltaje de la pila aproximadamente se mantiene y que la intensidad de corriente se incrementa al concentrar dicha solución evidenciando la importancia de esta variable en la corrosión en ambientes húmedos y salinos como es en zonas costeras y generando las interrogantes para evitarla o reducirla.











 text new page (beta)
text new page (beta)


