Introducción
Tecnología Farmacéutica I es una materia que se cursa en el último año de la carrera de Farmacia de la Universidad de Buenos Aires. El objetivo curricular es el estudio, diseño y elaboración de diferentes formulaciones farmacéuticas líquidas y semisólidas (formas de presentación de medicamentos, p. ej. jarabe, pomada, crema, etc.). En consecuencia el alumno adquiere los conocimientos sobre la preparación de soluciones, sistemas dispersos finos (coloidales), sistemas dispersos groseros (suspensiones, emulsiones), cremas, pomadas y supositorios. La materia consta de clases teóricas (seminarios) y clases prácticas de aplicación (trabajos prácticos).
A lo largo del curso observamos que los alumnos no presentan dificultad en el entendimiento conceptual y en la preparación de formas farmacéuticas soluciones (sistemas homogéneos y de una sola fase), también considerados por la United States Pharmacopeia (USP) como dispersiones moleculares. Sin embargo, al momento de trabajar con sistemas dispersos, esto es, sistemas heterogéneos de apariencia homogénea, donde la fase dispersa es de mayor tamaño que una solución molecular, se les hace más complicado conceptualizar lo explicado durante el seminario y luego desarrollar la práctica de formulaciones, así como también rendir satisfactoriamente en el momento de la evaluación. Según Perkins, 1995 y Cooper, 1955, en el proceso del aprendizaje, los alumnos adquieren primeramente el conocimiento y sólo entonces pueden elaborar lo asimilado.
El tema de sistemas dispersos es de suma importancia para el anclaje de conocimientos en esta materia, pues permite al alumno asomarse a un tema novedoso y también proponer nuevas formulaciones. Para el abordaje del mismo nos pareció importante durante el dictado del seminario desarrollar una parte demostrativa experimental y utilizar como herramientas de enseñanza preparados reales y material visual: imágenes fijas y un video. Según Camillioni (2001), es importante tener en cuenta las estrategias de enseñanza para que el proceso de formación del alumno constituya un genuino aprendizaje.
Dentro de los sistemas dispersos gruesos se encuentran las suspensiones, constituidas por partículas sólidas insolubles (de tamaño mayor a un micrón, fase dispersa) extendidas en un medio líquido (fase dispersante). Son preparaciones termodinámicamente inestables, dado el tamaño de la partícula que presenta problemas de humectación del sólido suspendido y la velocidad de sedimentación es considerable, se necesita aumentar la densidad del medio para disminuir la interacción entre partículas que podrían producir por depósito el crecimiento de cristales (Delgado Charro, Otero Espinar y Méndez, 2001). Las partículas dispersas en un líquido adquieren cargas ya sea por adsorción de iones provenientes del medio dispersante o por pérdida de iones de su superficie. Como estos iones presentan movimiento browniano tienden a difundir alrededor de la partícula. Solamente una parte de los iones de signo opuesto quedan adheridos a la superficie de la partícula formando una capa monomolecular que la acompañará en todos sus movimientos. Los iones restantes se distribuyen alrededor de esta primer capa formando una capa difusa. A cierta distancia se podrá definir un punto de neutralidad donde los efectos de la carga eléctrica de la partícula no se hacen sentir. Un parámetro experimental que caracteriza esta zona de cargas es la diferencia de potencial conocida como potencial Z (potencial ζ). En la bibliografía encontramos que este potencial electrocinético se modifica frente al agregado de electrolito, que actúa reduciendo la barrera eléctrica entre partículas, confiriendo estabilidad a la suspensión, en un cierto grado (Villalonga, 1982; Sinko and Singh, 2011).
La existencia de esta distribución de carga entre las partículas de una suspensión genera dos tipos de sistemas diferentes que poseen características particulares ver Figura 1: (a) uno de ellos es el floculado, donde las partículas en forma predeterminada quedan con carga neta débil, de modo que predominan las fuerzas de van der Waals que promueven la interacción de unas con otras generándose agregados voluminosos que contienen fase dispersante en su interior, resultando fáciles de re-dispersar por simple agitación, (b) el otro sistema es el defloculado, cuyas partículas insolubles poseen cierta carga que les permite evitar la agregación por repulsión mutua y conservar de este modo su individualidad.

Figura 1 Tipos de agregados que se pueden originar por sedimentación de suspensiones: (a) suspensiones floculadas, (b) suspensiones de-floculadas y coaguladas (Delgado Charro, Otero Espinar y Méndez, 2001).
Según bibliografía, el primer sistema está caracterizado por valores de potencial Z muy bajos, cercanos a 0 mV, mientras que el segundo por valores de alrededor de -30 a -50, o bien +30 a +50 mV.
Puede decirse que una suspensión defloculada presenta la ventaja de sedimentar lentamente, pero una vez que se desencadena este fenómeno las partículas se encastran unas con otras y forman un sedimento llamado caking que es muy difícil de redispersar. Por el contrario, una suspensión floculada origina sedimentos en forma rápida que engloban fase dispersante y por simple agitación se redispersan, de esta forma se asegura la uniformidad de dosis a lo largo de su vida útil.
Estos tipos de sistemas tienen la ventaja de hacer visible los fenómenos que se presentan y a partir de esto poder trabajar en el entendimiento del tema.
Tal como dice Mercer (1997), cada una de las modalidades de clase de enseñanza presenta ventajas que contribuyen a los distintos tipos de aprendizaje y al desarrollo de distintos tipos de comprensión. Con el objetivo de acercar a los alumnos al conocimiento de los fenómenos involucrados, nos pareció interesante utilizar como herramienta visual y gráfica, un experimento que consiste en la desestabilización de una suspensión defloculada por el agregado de concentraciones crecientes de electrolitos. Así, de esta forma los alumnos podrán evaluar esta importante variable fisicoquímica, mediante la visualización e interpretación de los efectos que se producen en este tipo de sistemas, logrando así determinar la concentración óptima de electrolitos que produce el mayor grado de floculación.
Como se puede observar por inspección del diagrama de la Figura 2, el aumento de la concentración de electrolitos reduce el espesor de la doble capa de carga que posee la partícula, facilitando la floculación del sistema. Este efecto puede evaluarse a través del punto máximo de floculación, medible como la altura máxima que alcanza el sedimento en el tubo graduado, tipo Falcon o probeta a la concentración óptima de electrolito. Concentraciones superiores a la óptima pueden producir la inversión de la carga y la desagregación del sistema (se visualiza como sedimentos de menor volumen), mientras que concentraciones insuficientes sólo logran un grado menor de sedimentación.

Figura 2 Floculación controlada de una suspensión mediante el agregado de electrolitos. Se muestra la variación del potencial Z (ζ) y la altura del sedimento (Delgado Charro, Otero Espinar y Méndez, 2001).
Para poder elaborar estos conceptos durante el desarrollo del seminario, de entre las diferentes formulaciones que preparan los alumnos en el trabajo práctico de sistemas dispersos groseros (SDG), seleccionamos aquella que a nuestro criterio mejor se adapta al experimento: el magma de hidróxido de magnesio (MHM), también conocido como crema, magma o leche de magnesia (Farmacopea Nacional Argentina, 1978). Los magmas son suspensiones de sustancias generalmente inorgánicas en gran cantidad. El MHM fue usado por primera vez en 1829, por el médico irlandés Sir James Murray, siendo una fórmula ligeramente alcalina patentada en 1873, dos años después de su muerte. En 1880, Charles Henry Phillips la vendió como Phillips Milk of Magnesia, siendo una suspensión de 8 g/100 mL, una fórmula tradicionalmente usada hasta la actualidad.
Al cabo de la realización de la preparación del MHM, se efectúan controles de calidad del producto terminado. Paralelamente, se evalúan los parámetros de velocidad de sedimentación y grado de floculación.
Materiales y Métodos
Se partió de los componentes utilizados en la fórmula oficial Magma de hidróxido de magnesio descripta en la Farmacopea Nacional Argentina (FNA, 1978) y se adaptó dicha formulación a un volumen final equivalente a 14 mL para poder utilizar tubos tipo Falcon graduados de 15 mL. Las materias primas utilizadas fueron: sulfato de magnesio e hidróxido de sodio (Parafarm, calidad Farmacopea), y agua destilada (obtenida de acuerdo con FNA).
Ensayo experimental
Se redujo en forma proporcional la formulación oficial del MHM según FNA, 1978. Para ello, individualmente el alumno disuelve 0,75 g de hidróxido de sodio en 7,5 mL de agua destilada. Luego se incorpora 2,63 g de óxido de magnesio hasta que se forma una crema homogénea y finalmente, se diluye hasta 125 mL con agua destilada. Así se obtiene una suspensión de hidróxido de magnesio que llamamos suspensión A. Nótese que se trata aquí de optimizar el proceso de floculación, de modo que no se continúa con la técnica descripta en FNA, en tanto no se efectúan los pasos posteriores de decantado, eliminación del sobrenadante, filtrado del sedimento, lavados con agua destilada (hasta que la eliminación del exceso de álcali y del ión sulfato den reacción débilmente positiva) y llevado a volumen final.
Por otro lado, cada alumno prepara una solución del electrolito de sulfato de magnesio al 20% p/v (8 g en 40 mL de agua destilada) que llamamos solución B.
Se numeran 9 tubos Falcon de 15 mL y se introduce en cada uno de ellos igual volumen de suspensión A y cantidades crecientes de la solución B de acuerdo a la Tabla 1. Cada uno de los tubos se lleva a igual volumen final con agua destilada, según se detalla:
Tabla 1 Concentraciones respectivas del electrolito de acuerdo con la cantidad de solución B
| Tubos | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Volumen de suspensión A (mL) | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
| Volumen de solución B (mL) | - | 0,2 | 0,4 | 0,7 | 1 | 1,5 | 2,5 | 3,5 | 7 |
| Volumen de agua destilada (mL) | 7 | 6,8 | 6,6 | 6,3 | 6 | 5,5 | 4,5 | 3,5 | - |
| Concentración final de sulfato de magnesio (mg/mL) | - | 2,9 | 5,7 | 10 | 14 | 21 | 36 | 50 | 100 |
Incorporar en cada tubo 7 mL de suspensión A.
Agregar cantidades crecientes de la solución B, comenzando desde cero.
Llevar cada tubo a un volumen final de 14 mL con agua destilada.
Agitar en forma continua hasta lograr total homogeneidad.
Colocar cada tubo en forma vertical, dejar en reposo durante 2 h, determinando la altura del sedimento.
Las suspensiones fueron evaluadas teniendo en cuenta los siguientes parámetros: volumen de sedimentación (F) y grado de floculación (β). El primero relaciona el volumen del sedimento con el volumen total de la preparación. El segundo vincula el volumen del sedimento de una suspensión floculada respecto de la misma sin flocular. De esta forma se caracteriza el tipo de suspensión: floculada o defloculada.
Utilizando la graduación del tubo, se pudo medir la altura del sedimento y por tanto determinar el volumen de sedimentación y calcular el grado de floculación de cada uno de los sistemas formados frente al agregado de diferentes concentraciones del electrolito. De esta manera se logra estudiar el proceso de floculación en forma controlada.
Resultados y Discusión
Determinación de la concentración óptima de electrolito que produce la mayor floculación del sistema disperso
Volumen de sedimentación
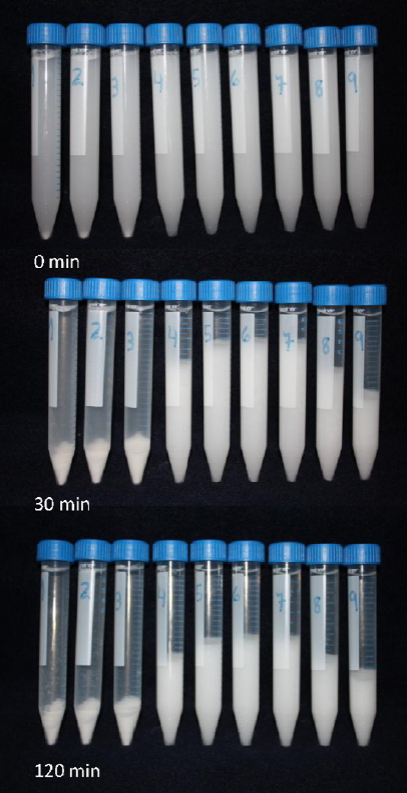
A fin de evaluar el comportamiento del sistema disperso propuesto, se procede a la determinación del parámetro F, medido como la relación entre el volumen del sedimento y el volumen de la suspensión a tiempo cero, igual al volumen total de cada tubo (F = Vsed/Vsusp). Para ello, se mide la altura del sedimento, relacionado directamente con el volumen que ocupa el mismo en los tubos graduados, frente a concentraciones crecientes del electrolito. Se repite dicha determinación a diferentes tiempos (0, 15, 30, 60, 90 y 120 min).
Una consideración de importancia a la hora de evaluar estas mediciones radica en el hecho de que es posible reproducir el proceso si se resuspende la preparación. De este modo, luego de preparar la batería de tubos, resulta práctico tomar como tiempo cero aquél que corresponde a la resuspensión del magma. Esta característica ilustra la importancia y robustez del experimento, agregando valor a esta práctica que es dirigida hacia un número considerable de alumnos.
Un valor de F cercano a uno representa el grado máximo de floculación, esto es, el hecho de que el sedimento ocupe todo el volumen de la suspensión. Esta circunstancia se verifica entre los tubos 4-7, donde F se maximiza. En estas condiciones, la carga de la partícula dispersa tiende a cero, minimizando la repulsión mutua, de modo que el sistema sedimenta englobando gran cantidad de fase dispersante, y consecuentemente dando lugar a flóculos algodonosos y voluminosos. Por comparación, la fórmula oficial, según FNA, 1978, utiliza un moderado exceso de sulfato de magnesio (similar a la situación ilustrada por el tubo 8), que se elimina a posteriori por lavados.
También se puede evaluar la variable tiempo (cinética de sedimentación) en un sistema termodinámicamente inestable como el presente. Así, observamos que F disminuye significativamente a medida que transcurre el tiempo. Por otro lado, se observa que son siempre las mismas aquellas concentraciones de la solución de electrolito que producen la máxima floculación, se refiere al intervalo de concentración, de modo que otros factores no modifican el resultado con el paso del tiempo. Esta propiedad resulta útil al momento de desarrollar una formulación de un sistema disperso grueso. La evolución de esta conducta se representa en la Figura 3.

Figura 3 Respuesta del cambio de volumen de sedimentación del sistema disperso (F) frente a las variables concentración de electrolito y tiempo.
Para generar un aprendizaje dialógico con los alumnos, que promueva su cognición (Murphy y Erduran, 2013) utilizamos herramientas didácticas como un breve video (presentación stop motion), que permita visualizar el fenómeno de floculación. En este se observa el curso temporal del proceso de sedimentación de la suspensión e imágenes fotográficas de las pruebas realizadas, tal como se muestra en la Figura 4. El presente trabajo incluye algunas fotos tomadas a tiempos representativos del proceso.
Grado de floculación
Una vez determinada la concentración óptima del electrolito necesaria para producir el grado máximo de floculación, de acuerdo con la Figura 3, se procede a calcular un segundo parámetro relevante: el grado de floculación (β), definido como la relación β = Vfloc/Vsed, entre el volumen de sedimentación de la suspensión floculada (Vfloc) respecto de la suspensión defloculada (Vsed). Nótese que este último valor corresponde a aquél alcanzado por el tubo 1, que carece de agente floculante y, por ende, presenta el menor valor de volumen de sedimentación.
La Tabla 2 muestra los valores de β calculados a partir de los tubos 4 al 7, donde este parámetro alcanza su mayor valor.
Tabla 2 Cinética del grado de floculación (β) del magma MHM
| Tiempo (min) | Grado de floculación (β) | Valor máximo de β | |||
|---|---|---|---|---|---|
| Tubo 4 | Tubo 5 | Tubo 6 | Tubo 7 | ||
| 15 | 26 | 27 | 27 | 26,5 | 27 |
| 30 | 25 | 26 | 25 | 24 | 26 |
| 60 | 20 | 22 | 21,5 | 19 | 22 |
| 90 | 17 | 19,5 | 19 | 17 | 19,5 |
| 120 | 15 | 17 | 17,5 | 16 | 17,5 |
Aquí se observa que la concentración de electrolito que produce el máximo grado de floculación se corresponde con los tubos 5 y 6 de la Tabla 1, de modo que la concentración ideal para rendir una suspensión floculada ocurre en el intervalo 14-21 mg/mL de sulfato de magnesio.
Definición del ión floculante
También se realizaron experimentos que permiten definir diferencialmente el efecto del ión responsable de desencadenar el proceso de formación de flóculos del magma de hidróxido de magnesio. Para ello se usan otras sales que contienen un ión común respecto de aquella usada en la preparación según FNA, 1978. Con este propósito, se utiliza sulfato de potasio, cloruro de magnesio y cloruro de potasio (Figuras 5 y 6).

Figura 6 Fotografías de los tubos mostrando las pruebas realizadas sobre la naturaleza del ión floculante. Las series de nueve tubos se corresponden con las concentraciones de cada electrolito ensayadas en la Figura 5.
Se representa el volumen de sedimentación (F) a 120 min en función de la concentración de otras sales, en un rango que incluye aquél en que ocurre la floculación del preparado con sulfato de magnesio.
Para cada tubo se calcula la concentración molar (M) de sulfato de magnesio usada en el experimento de floculación controlada (0,017; 0,042; 0,083; 0,12; 0,17; 0,25; 0,42; 0,83 M). Se preparan soluciones de cloruro de magnesio (MgCl2) y cloruro de potasio (KCl) a las mismas concentraciones molares. El rango de concentraciones ensayado para sulfato de potasio es menor debido a su menor solubilidad. No obstante, éste se encuentra dentro de la zona de floculación. El procedimiento se efectuó según la técnica de FNA, 1978.
A las mismas concentraciones, el anión sulfato (divalente) no presenta mayor efecto que el cloruro (anión monovalente). Claramente, se concluye que el ión responsable del fenómeno es el magnesio (catión divalente). Se verifica que el catión potasio posee un efecto precipitante casi nulo. De este modo, puede descartarse que la floculación se deba al mero incremento de la fuerza iónica del medio. En el proceso, hace falta la presencia del catión divalente para que se establezcan vínculos entre las partículas en suspensión, de modo que pueda lograrse la formación del flóculo.
Conclusiones
Al finalizar la mostración de este experimento, el alumno habrá podido observar cuál es la concentración óptima del electrolito, sulfato de magnesio, para que la formulación oficial del MHM genere el sedimento más alto. En estas condiciones las partículas que sedimentan, van perdiendo su carga y conforman flóculos que engloban medio dispersante conservando su identidad. Esta propiedad física permitirá que por simple agitación se reconstituya el contenido y adquiera homogeneidad, lográndose uniformidad de la dosis que se va a administrar.
Como ejercicio, el alumno podrá comparar la concentración del electrolito que presenta la formulación oficial con la hallada en el trabajo práctico individual. Finalizará su actividad con un informe escrito de todo lo observado y podrá reflexionar sobre el tipo de sistema disperso grosero obtenido y las características esperables. Entre las perspectivas para futuros trabajos prácticos, es nuestra idea proponer la realización de este ensayo en forma individual, dado que los alumnos integran comisiones de aproximadamente 30 personas. Esta circunstancia nos permitirá sumar a la práctica un tratamiento estadístico adecuado, demostrando la importancia y robustez de los resultados, de modo que el alumno pueda recibir además nociones básicas sobre procesamiento de datos experimentales.
La adquisición de conocimientos sobre este tema le proporcionará al alumno diferentes estrategias para el diseño en la formulación de suspensiones. Demostrar competencia (Moreneo y Pozo 2007) que conlleva resolver problemas de cierta complejidad, encadenando una serie de estrategias de manera coordinada e involucrando al alumno en el futuro escenario profesional.











 nueva página del texto (beta)
nueva página del texto (beta)