Introducción
Cada vez más, los docentes buscamos proponer actividades experimentales que representen situaciones reales. Este tipo de propuestas en general son muy bien aceptadas por los estudiantes y despiertan su interés, porque generan desafíos genuinos para resolver las distintas situaciones que se van presentando. (Meroni, Copello y Paredes, 2015) (Cereti y Zalts, 2000).
En este trabajo proponemos la determinación de la fecha de caducidad de una suspensión oral de amoxicilina, después de reconstituida. En donde los estudiantes deben buscar en la bibliografía y proponer la metodología analítica adecuada para la cuantificación del principio activo, en los tiempos de muestreo, a lo largo del estudio de estabilidad.
Es bien sabido que los medicamentos están destinados a ser usados por personas que presentan deficiencias en su salud, por lo tanto, tienen que ser seguros y eficaces. Es crítico que el o los principios activos estén dentro de las concentraciones del margen terapéutico y que sus productos de degradación estén dentro de los límites permitidos, de tal forma que no constituyan un riesgo para la salud.
En el currículum de la carrera de Químico Farmacéutico está incluido, habitualmente uno o más cursos de Control de Calidad de Medicamentos, en donde el tema estabilidad está presente. No es fácil implementar experimentalmente estudios de estabilidad de larga duración, debido a que se requieren en general, varios meses (24,30, 36 o más meses) para desarrollarlos y esto no es viable en un curso semestral.
Estas suspensiones de antibióticos están disponibles en el mercado, como polvo oral (seco), debido a la inestabilidad química que presenta el principio activo en las suspensiones reconstituídas.
Esta actividad experimental, se considera que constituye un aporte importante en la formación del futuro profesional Químico Farmacéutico, ya que puede diseñar el protocolo de estabilidad, registrar todos los datos crudos que sean trazables, realizar los cálculos, tener en cuenta los factores que inciden en las incertidumbres en las determinaciones, llevar acabo el tratamiento estadístico de datos y, en función de ellos, tomar decisiones para establecer la fecha de caducidad de la suspensión después de reconstituída.
Metodología de trabajo
La actividad se propuso para trabajar en tres equipos de cuatro personas. A cada uno de los equipos se le suministró una muestra de un lote de la suspensión oral que se comercializa en Uruguay. Se seleccionaron tres lotes que fueran consecutivos y además que las fechas de fabricación entre ellos, estuvieran muy próximas entre sí, lo que no es difícil, debido al alto consumo de este tipo de medicación (por su alta efectividad, bajo costo y caracteres organolépticos aceptables). Para el desarrollo del trabajo, se buscó que fuera en equipo para favorecer el proceso reflexivo, potencializar las ideas en el momento que es requerido encontrar soluciones, permitir compensar debilidades individuales, aumentar la seguridad del estudiante en el trabajo experimental y ayudar a fomentar las relaciones interpersonales. (Bandura, 1978; Pujolás, 2008; León del Barco, Gozalo, Felipe y Latas, 2005).
Marco teórico
La amoxicilina (Figura 1) es un antibiótico β-lactámico que pertenece al grupo de las penicilinas, es activo tanto frente a microorganismos grampositivos como gramnegativos. (Petri, 2011)
Para que este tipo de moléculas tenga actividad farmacológica, es indispensable que el anillo β-lactámico en la molécula esté intacto (Petri, 2011), ya que pierde la actividad cuando está abierto. En este caso, con el objetivo de que tenga una fecha de caducidad lo más amplia posible, está permitido en las farmacopeas una sobredosificación. (USP 40, 2017), (FEUM, 2014), (F. Argentina, 2010), (F. Brasileña, 2010). Los límites de aceptación en las farmacopeas antes citadas están comprendidos entre 90,0 y 120,0 % del valor de amoxicilina declarado en la rotulación de la especialidad farmacéutica. Varias son las metodologías analíticas propuestas en la bibliografía para cuantificar amoxicilina en la forma farmacéutica (Bird, 1994; Kaur, 2011 ; Rao y Nanda, 2011;Cielecka-Piontek, 2012; Ortega-Markman,Walter-Koschtschak y Wu-Meihuey, 2014) pero solo fueron consideradas aquellas que son específicas y selectivas no solo, frente a otros componentes de la formulación, sino también frente a los productos de degradación. En función de esto, los estudiantes eligieron un método iodométrico planteado en la monografía de Amoxicilina para suspensión oral (USP XXII, 1990), (Farmacopea Brasileña, 2010), por ser un método farmacopeico, rápido, económico y ser un método indicador de la estabilidad. Este método que data de muchos años (Alicino, 1946) y que aún es vigente, está basado en que la amoxicilina sin degradar no reacciona con iodo, mientras que si reacciona después de la hidrólisis a ácido peniciloico (Connors y Higuchi, 1961; Zdzieborska, Siedlecka y Orlowska, 2016)
Además este es un ejemplo de un método de cuantificación, mediante una volumetría cuantitativa no estequiométrica, que no es frecuente y que en general al estudiante le cuesta comprender. La reacción entre el ácido peniciloico y el iodo no tiene una estequiometría exacta. En este tipo de valoraciones, para obtener resultados reproducibles es necesario fijar las condiciones como el pH, la concentración de iodo, controlar la rapidez de adición de la solución de iodo (del agente valorante), proteger de la luz y realizar concomitantemente una valoración empleando amoxicilina estándar de referencia. También es llevado a cabo un blanco con el fin de restar concentración inicial de amoxicilina inactiva (con el anillo β-lactámico abierto).
Materiales y métodos
Amoxicilina trihidrato estándar de referencia (estándar USP o estándar secundario). Iodo, tiosulfato de sodio, almidón, ácido clorhídrico, hidróxido de sodio calidad reactivo. Muestra de 3 lotes consecutivos de polvo para suspensión oral de Amoxicilina (500 mg/5mL) del mercado uruguayo.
Procedimiento:
Previo a la reconstitución de la suspensión oral, agitar vigorosamente el frasco conteniendo el polvo seco, con el fin de eliminar posibles aglomerados y partículas adheridas a la pared del frasco.
Reconstituir la suspensión del antibiótico como se indica en su rotulación teniendo cuidado de obtener una suspensión homogénea y sin burbujas de aire. Se recomienda agitar con movimientos circulares suaves en sentido horario y antihorario e intercalando con repetidas inversiones verticales. Conservar la suspensión reconstituida a temperatura ambiente (25°C). Determinar su densidad, midiendo la masa de la suspensión contenida en un matraz aforado de 5 mL.
Preparación de la solución muestra
A partir de la suspensión, preparar una solución haciendo tomas en masa en matraz aforado de 100 mL, para obtener una concentración final de amoxicilina de 1.0 mg/mL. Agregar 40 mL de agua destilada y sonicar durante 15 min. Diluir a volumen con el mismo disolvente y homogeneizar la solución.
Preparación de la solución estándar
Preparar una solución en agua destilada de concentración 1 mg/mL de amoxicilina.
Inactivación y titulación
Tomar 2 matraces Erlenmeyers de 250 mL con tapa y rotularlos como estándar y muestra, en cada uno de ellos verter 2.0 mL de solución que corresponda, solución estándar y solución muestra. Adicionar con pipeta aforada 2.0 mL de hidróxido de sodio 1.0 N, mezclar y dejar reposar durante 15 minutos agitando de tanto en tanto. Luego, agregar con pipeta aforada a los respectivos matraces Erlenmeyer, 2.0 mL de ácido clorhídrico 1.2 N y 10.0 mL de iodo 0.01 N. Tapar los matraces inmediatamente y dejar reposar en la oscuridad durante 15 min. Titular el exceso de iodo con tiosulfato de sodio 0.01 N agregando cerca del punto final, unas gotas de pasta de almidón 0.5% (m/v) y continuar la valoración hasta desaparición del color azul. Registrar el gasto obtenido.
Solución blanco
Realizar con pipeta aforada una toma de 2.0 mL de agua destilada y verterlos en un matraz Erlenmeyer de 250 mL agregar con pipeta aforada 2.0 mL de ácido clorhídrico 1.2 N y 10.0 mL de iodo 0.01 N. En forma inmediata titular el exceso de iodo con tiosulfato de sodio 0,01N como se indica en el procedimiento de inactivación y titulación descripto anteriormente.
Realizar todas las determinaciones por duplicado a los tiempos de muestreo: 0, 4, 7, 11 y 14 días de reconstituída la suspensión oral. Este procedimiento se repite en las muestras de los 3 lotes empleados en cada uno de los tiempos de muestreo para el estudio de estabilidad.
A lo largo del estudio de estabilidad, además de la cuantificación del principio activo, también se controla la facilidad de resuspensabilidad y el pH de la suspensión oral, características que deben permanecer dentro de las especificaciones.
En todos los casos cuando se llevan a cabo las determinaciones usar bata guantes y tapaboca descartables. Limpiar cuidadosamente cualquier residuo de amoxicilina sobre las mesas.
Resultados y discusión
El anillo β-lactámico es muy reactivo y se puede hidrolizar tanto en medio neutro como en medio básico, resultando en su inactividad. También es susceptible a su destrucción por enzimas (β-lactamasas) de microorganismos.
La potencia no debe estar por debajo de 90.0 % del valor declarado de amoxicilina en la rotulación del envase.
Los resultados de cuantificación de amoxicilina obtenidos se muestran en la Tabla 1.
Tabla 1 Porcentajes de amoxicilina (promedio de dos determinaciones) encontrados en el estudio de estabilidad en cada uno de los lotes analizados.
| TIEMPO MUESTREO (días) | LOTE 1 (% amoxicilina con respecto al valor declarado) | LOTE 2 (% amoxicilina con respecto al valor declarado) | LOTE 3 (% amoxicilina con respecto al valor declarado) |
|---|---|---|---|
| 0 | 116,0 | 117,0 | 119,0 |
| 4 | 115,0 | 115,0 | 114,5 |
| 7 | 104,3 | 109,5 | 109,5 |
| 11 | 100,0 | 105,0 | 98,0 |
| 14 | 96,0 | 98,0 | 93,0 |
En todos los casos, al agitar el frasco el sedimento se resuspendió rápidamente (menos de un min) y el pH se mantuvo dentro del rango de especificación establecido en las farmacopeas (entre 5,0 - 7,5).
Uno de los objetivos de un estudio de estabilidad de larga duración de un medicamento es establecer con un alto grado de confianza un periodo de vida útil.
El tratamiento de datos, en un estudio de estabilidad, ha evolucionado en el tiempo con el objetivo de tener la máxima confiabilidad en la fecha de caducidad establecida en un medicamento.
Consideramos que es importante que el estudiante reflexione y tenga conceptos claros, sobre los factores que motivaron estos cambios.
En los comienzos se tenían en cuenta principalmente los principios de cinética, que aún hoy son de gran importancia en los programas de estabilidad. Se determinaba el orden, la constante de la reacción y el t90%, este último valor establecía la fecha de caducidad.
El orden de reacción es un concepto empírico, y su determinación, habitualmente se lleva a cabo mediante la representación gráfica, de las concentraciones de los reactivos, o una transformación matemática exactamente conocida de la concentración (C), en función del tiempo. Habitualmente se grafica C, log C y 1/C en función del tiempo para orden 0, 1 y 2 respectivamente. La curva que tenga mejor ajuste a una regresión lineal, establecerá el orden de la reacción. Al graficar los valores obtenidos, se obtuvieron resultados similares, en donde no se puede establecer si la reacción es de orden 0, 1 ó 2, como se muestra en la Tabla 2. A modo de ejemplo en la Figura 2 se muestran los gráficos correspondientes para el lote 1.
Tabla 2 Parámetros obtenidos de la representación gráfica en la determinación del orden de la reacción de los lotes 1,2 y 3 de amoxicilina suspensión oral. R coeficiente de correlación.
| orden | Lote 1 | Lote 2 | Lote 3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ecuación recta y = ax + b | R | t 90% (d) | Ecuación recta y = ax + b | R | t 90% (d) | Ecuación recta y = ax + b | R | t 90% (d) | ||||
| a | b | a | b | a | b | |||||||
| 0 | -1,5575 | +117,47 | 0,97 | 17,6 | -1,3591 | +118,69 | 0,98 | 21,1 | -1,9568 | +120,89 | 0,99 | 15,8 |
| 1 | -0,0064 | +2.071 | 0,97 | 18,2 | -0,0055 | +2,0756 | 0,97 | 22,1 | -0,008 | +2,0846 | 0,98 | 16,3 |
| 2 | 0.0001 | +0.085 | 0,97 | 26,1 | 0,0001 | +0,0084 | 0,97 | 27,1 | 0,0002 | 0,0082 | 0,98 | 14,6 |
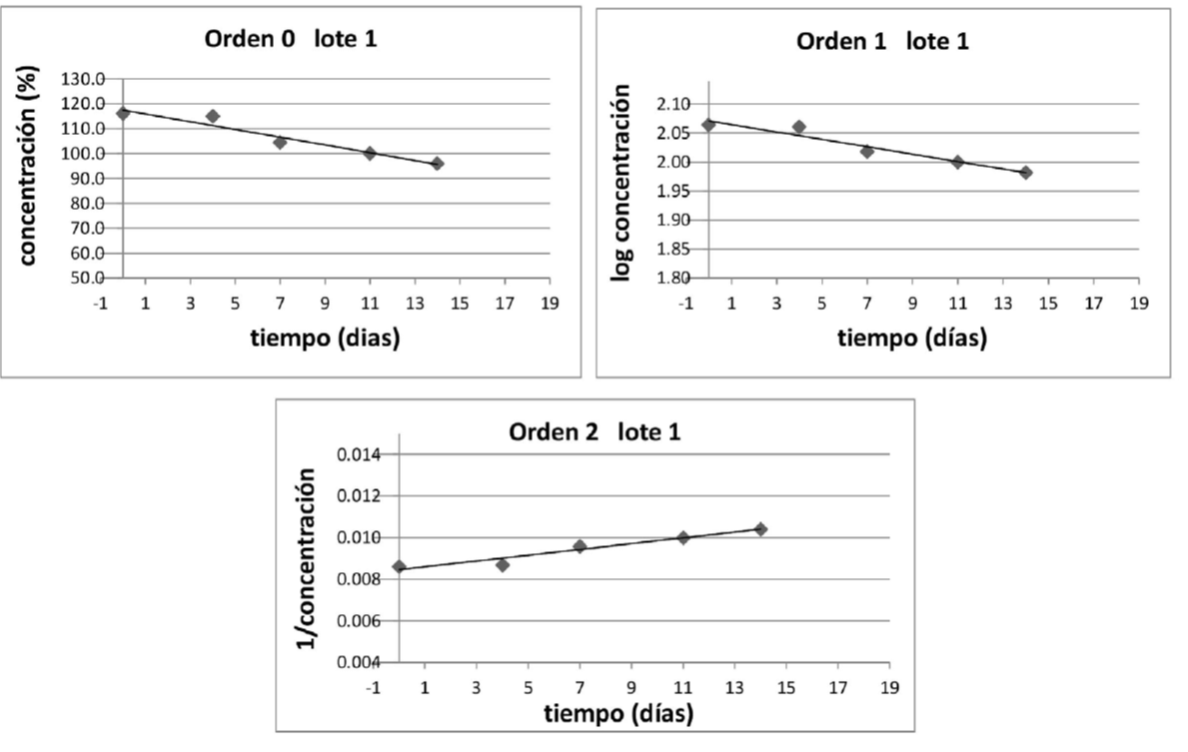
Figura 2 Perfiles de degradación de amoxicilina en suspensión oral reconstituída almacenada a 25ºC (lote 1), considerando orden de la reacción 0, 1 y 2.
Sin duda ninguna, la extrapolación de los datos de estabilidad depende del conocimiento sobre el patrón de cambio y el ajuste del modelo matemático. También se supone que continúa el mismo patrón a lo largo de todo el periodo del estudio de estabilidad.
Habitualmente en un estudio de estabilidad de larga duración a 25°C la potencia cambia muy poco, el grado de avance de la reacción es de un 10-20 % y puede resultar difícil establecer el orden de la reacción, ya que las curvas obtenidas en los casos mencionados pueden ajustarse a una recta. Por este motivo, en normas armonizadas como ICH Q1E, si no se conoce el orden de la reacción, suponen que la reacción presenta durante el almacenamiento del estudio de larga duración, una cinética de orden cero. En el caso de un error y que fuera de un orden superior, la fecha de caducidad será incorrecta por defecto y tiene entonces un margen mayor de seguridad para el valor extrapolado porque el t90% obtenido sería inferior al valor real. Es deseable desde el punto de vista comercial, un período de vida útil, seguro y lo más amplio posible, por ese motivo, los programas de estabilidad de las compañías farmacéuticas ponen mucho esfuerzo en la determinación de la fecha de caducidad para que se acerque al máximo a los valores reales. Con este fin, muchas compañías en la etapa de desarrollo del medicamento, determinan el orden de la reacción de degradación en donde el grado de avance sea mayor. Por otro lado, el tiempo en el cual se espera que un lote mantenga todos sus parámetros de calidad dentro de especificaciones depende, no solo del orden de la reacción de degradación, sino también del valor promedio inicial del lote, que tiene que tener un valor target fijo y presentar muy poca variabilidad entre lotes.
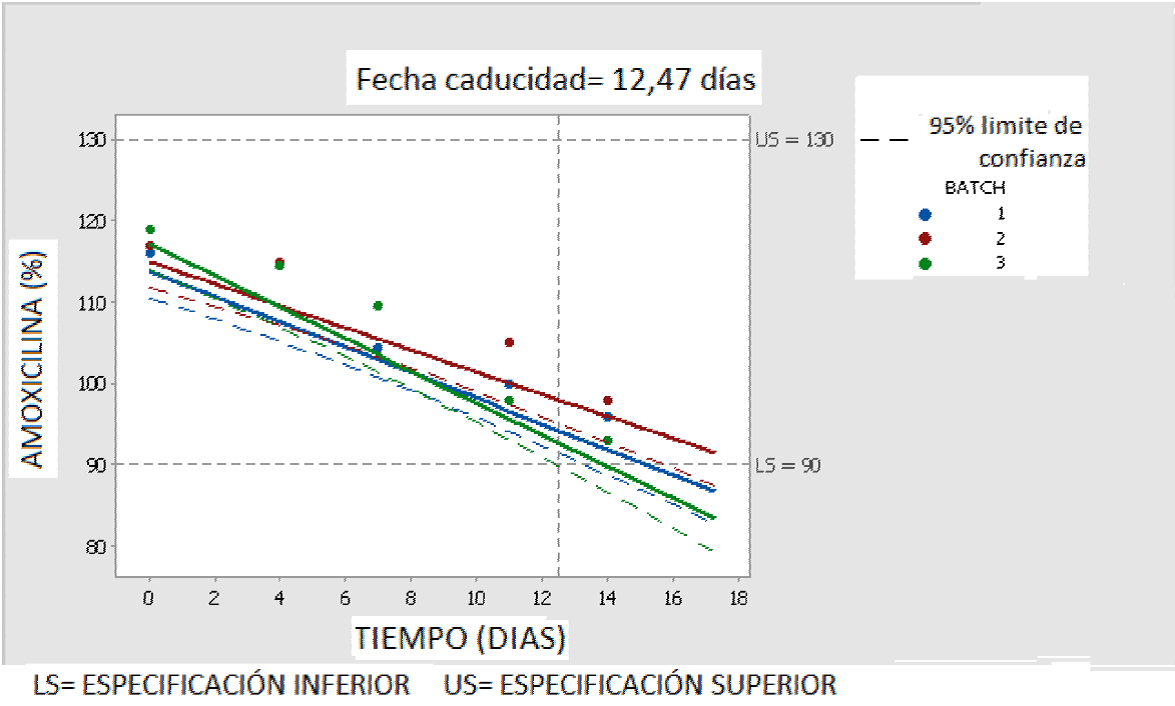
Las normas ICH, con el fin de incrementar la seguridad en la determinación de la fecha de caducidad, establecen no solo llevar a cabo los estudios sobre 3 lotes, sino también, determinar el límite de confianza al 95% . Esto último fue propuesto por primera vez por Cartstensen y Nelson (Carstensen, 1976) y luego fue tomado en las normas.
Por lo tanto, no es suficiente con proponer el promedio de los resultados analíticos de un lote, ya que hay variaciones propias tanto del proceso de fabricación de la forma farmacéutica como del proceso analítico. Por este motivo, para el registro ante la autoridad sanitaria de un medicamento, en el estudio de estabilidad se requieren como mínimo 3 lotes y no sólo determinar la curva de mejor ajuste por mínimos cuadrados sino también calcular los límites de confianza de la curva. En este caso particular la variabilidad analítica tiene especial importancia debido a que se monitorea un sistema heterogéneo.
En el procesamiento de los datos experimentales, para establecer si los resultados de los 3 lotes son promediables, es necesario llevar a cabo un análisis de covarianza. Este análisis estadístico, está incluido en la programación de los software empleados en el tratamiento de los datos. La fecha de vencimiento se determina para cada uno de los lotes o para el promedio de ellos (si los tres lotes son promediables). La fecha de caducidad proyectada se determina por el punto de intersección de la curva inferior de ponderación de la recta de decaimiento de la potencia de amoxicilina, con el valor del límite inferior de potencia aceptable. Por lo cual siempre va a ser menor que el t90% obtenido mediante los estudios cinéticos, lo que aporta mayor seguridad en la proyección de la fecha de caducidad y tiene en cuenta la variabilidad de los procesos analíticos y de fabricación. Con el fin de simplificar la complejidad de este proceso matemático, habitualmente se emplean softwares con paquetes específicos para proceso de datos de estudios de estabilidad. Si los tres lotes no son promediables, se toma como fecha de vencimiento el peor caso, es decir, la menor fecha de caducidad obtenida en los 3 lotes analizados.
Los datos obtenidos en el estudio de estabilidad de cada uno de los lotes, fueron procesados y graficados empleando dos software diferentes, con el fin de evaluar la sencillez de su uso y comparar los resultados que se obtienen con cada uno de ellos. Se empleó el software Minitab 17 (LeBlond, Griffith y Aubuchon, 2011) y el software R versión 3.3.2 con Stab for R v 0.2.8 (de acceso libre) (Lee y Lee, 2017)
Con ambos software se pueden graficar los datos obtenidos experimentalmente y tener la posible fecha de caducidad para cada uno de los lotes en forma individual, y si el software encuentra que los resultados son promediables (mediante un análisis de covarianza) también nos da la fecha de caducidad del promedio de los 3 lotes como se muestra en las Figuras 3 y Figura 4.
Para los datos obtenidos experimentalmente el software R (Figura 3) indica como fecha de caducidad 13 días, mientras que el software Minitab 17 (Figura 4) da como resultado 12,47 días. Los resultados obtenidos con ambos software son totalmente comparables siendo más amigable para cargar los datos, el Minitab 17. Los resultados obtenidos siguiendo normas ICH son menores que los obtenidos con el t90%.
Conclusiones
La actividad propuesta, en muchos casos, hace necesaria la consulta a distintas fuentes de información y requieren el ordenamiento y sistematización de los datos, y a través de su interpretación estimulan el razonamiento. Promueve la autoevaluación y la coevaluación grupal de la tarea, exige el manejo de información precisa y rigurosa y facilita la apertura interpretativa.
La propuesta de implementación de esta práctica permite a los estudiantes integrar los conocimientos de buenas prácticas de laboratorio (GLP), iodometría, factores experimentales que pueden incidir en la estabilidad de medicamentos y manejo de las normas (farmacopeas, ICH) También tiene que tener en cuenta habilidades como: desempeño en el trabajo experimental en el laboratorio, procesar información e interpretar resultados.
Otro aspecto importante a destacar es que el estudiante está acostumbrado a dar respuestas rápidas, muchas veces con poca o ninguna reflexión, sin detenerse a pensar. Este tipo de actividades dan los tiempos necesarios para la maduración de ideas y de reflexión, lo que conduce a un aprendizaje verdadero.
La actividad propuesta además constituye una forma de evaluación muy rica, porque permite observar a los estudiantes y ver en qué medida cooperan con eficacia y como diseñan y planifican las actividades, lo que conduce a una evaluación de su desempeño en forma individual y grupal a lo largo de las distintas instancias del trabajo.











 nueva página del texto (beta)
nueva página del texto (beta)