Introducción
Las ecuaciones de estado son relaciones entre las variables termodinámicas que determinan cada estado de equilibrio de un sistema. Estas relaciones proceden de modelos microscópicos o empíricos particulares (Zemansky y Dittman, 1968). La ley de los de gases ideales fue la primera ecuación de estado propuesta para fases volumétricas en 1834 por Clapeyron a partir de los resultados de los experimentos de Boyle-Mariotte, Gay-Lussac, Avogadro y Charles, realizados de forma independiente a lo largo de casi dos siglos (Lautrup, 2011). El modelo de gas ideal fue una primera aproximación en el estudio de gases reales, contribuyó al propio desarrollo de la termodinámica además de ser un modelo macroscópico que cuenta con una interpretación microscópica bien establecida resultado de la teoría cinética de los gases, retomada de los antiguos griegos por Daniel Bernoulli en 1738 y consumada por Maxwell y Boltzmann a final del siglo XIX (Boltzmann, 1896; Maxwell, 1867). A pesar de estos logros, la ecuación de estado del gas ideal no explica el equilibrio líquido-vapor, tampoco las propiedades críticas de los fluidos. Fue en 1863 cuando van der Waals propuso en su tesis doctoral dos modificaciones a la ecuación de gas ideal: consideró que las partículas que forman a un gas tienen un volumen finito e impenetrable e interacciones atractivas entre ellas (Bonilla y Herrera, 2015). La ecuación de van der Waals (vdW) en tres dimensiones para una sustancia pura es
En la expresión (1) a y b son los parámetros característicos denominados constantes de vdW que dependen de las condiciones críticas de cada sistema. Esta fue la primera ecuación de estado aplicable tanto a líquidos como a gases (Planck, 1917). Aunque a estas constantes se le suele atribuir un significado físico (b, covolumen y a, parámetro atractivo), en estricto sentido son dos cantidades que miden desviaciones respecto el gas ideal y, por tanto, representan el comportamiento de gases reales (Denbigh, 1971).
En analogía con el caso volumétrico la ecuación de vdW bidimensional (de Boer, 1954: Aveyard et al, 1973) puede emplearse en la caracterización y estudio de la estructura de superficies fluidas de anfífilos en la interfase líquido-vapor y líquido-líquido. Esta expresión y sus modificaciones, representan ecuaciones de estado de superficie (EES) que son funciones entre la presión superficial π (la correspondiente presión en dos dimensiones), el área específica A (el volumen molar en dos dimensiones) y la temperatura T (Adamson y Gast, 1997). Las constantes A 0 y α, representan un área característica y el parámetro atractivo respectivamente.
La ecuación de estado de Volmer (Volmer, 1925) corresponde a la ecuación de van der Waals en dos dimensiones la cual carece del término α, comúnmente asociado a las interacciones atractivas en la superficie
En este trabajo se muestra un modelo de disolución-superficie construido a partir de la ecuación (3) y las expresiones fundamentales que de aquí se derivan.
Ecuación de adsorción de Gibbs y ecuación de estado superficial ideal
Los anfífilos son compuestos que exhiben un comportamiento particular en disolución debido a que en su estructura química poseen grupos funcionales bien definidos; tanto polares (hidrofílicos), que aumentan la solubilidad acuosa, como no polares (hidrofóbicos) que la disminuyen. Cuando se encuentran en un ambiente polar o no polar, esta asimetría estructural los lleva a agregarse en conformaciones y sitios específicos como resultado de las interacciones intermoleculares con el medio. La región de acumulación preferente de estos materiales en disolución es la interfase líquido-líquido o líquido-vapor (Fenell y Wennestrom, 1999). Desde el punto de vista macroscópico, la tensión superficial e interfacial son variables termodinámicas que caracterizan a esta región y la ecuación de adsorción de Gibbs (EAG) es la expresión termodinámica central en el proceso de concentración superficial de anfífilos en sistemas binarios soluto (x) - disolvente (1 - x)
donde π es la presión superficial, Г es la concentración de exceso de Gibbs de soluto en la interfase 𝜇 y es el potencial químico del anfífilo (del bulto, 𝜇b, o de la superficie, 𝜇s, según convenga). La presión superficial se define como la diferencia entre la tensión superficial del líquido puro y la correspondiente a la mezcla (𝜋=𝜎0 1 ‒ 𝜎mez). Con el fin de determinar la concentración en exceso de soluto, se escribe la expresión (4) empleando el potencial químico ideal para la disolución
así, la concentración de superficie en términos de la concentración de soluto de la fase volumétrica es
la concentración superficial límite muestra valores del orden de 10-6 ‒10-5 mol/cm2. El área específica A se define como el recíproco de la concentración superficial
corresponde al área de una molécula proyectada sobre la superficie, típicamente se expresa en Å2 por molécula, esta cantidad proporciona información del arreglo y estructura de las moléculas adsorbidas.
La adsorción de moléculas en la interfase no es totalmente azarosa: las partes hidrofílicas tienden a ubicarse en contacto con el disolvente mientras que las partes hidrofóbicas al repeler el medio, se acomodan de manera tal que tengan poco o nulo contacto con moléculas de disolvente (Rosen y Kunjappu, 2012). A través de resultados experimentales, se conoce que la curva de equilibrio presión superficial-logaritmo natural de la composición es una función continua y monótona creciente en todo el intervalo de composición o en parte de él, de modo que, en cada punto, es posible determinar la concentración de superficie a través de la ecuación (6) y donde existe un valor característico de la composición donde la derivada es máxima1
la igualdad (8) señala que cuando la derivada es máxima, la concentración superficial alcanza un máximo o saturación superficial Г m, propia de cada sistema, que se adquiere cuando x=x sat (Bermúdez-Salguero, Gracia-Fadrique 2011). Dado que Г≤Г m, cuando x≤x sat, se define la cobertura superficial como el cociente de concentraciones de Gibbs2
Cuando esta cantidad, θ3, se expresa en función de variables volumétricas como la fracción mol o la presión de vapor (en el caso del equilibrio sólido-vapor) a temperatura constante, se cuantifica el reparto de una sustancia entre la fase volumétrica y la superficie, se le denomina isoterma de adsorción.
En régimen diluido existe una dependencia lineal entre la presión superficial y la composición de la disolución (Torres-Novelo y GraciaFadrique, 2004)
la pendiente 𝜙 caracteriza a cada sistema en este régimen y es una medida de la actividad superficial del soluto (Defay et al, 1966) así, la concentración de superficie siguiendo la EAG (4) es
que en términos del área específica conduce a la forma
dada su semejanza con el caso volumétrico, 𝑃𝑣 = 𝑅𝑇 a la expresión (12) se le denomina ecuación de estado de gas ideal bidimensional. La expresión (12) contiene información semejante a la ecuación tridimensional; a bajas concentraciones de soluto la distancia entre moléculas adsorbidas es muy grande y, por tanto, sin interacción, tanto atractiva como repulsiva, también considera que las partículas carecen de volumen, es decir, son puntuales (de Boer, 1953; Defay et al, 1966). La isoterma de adsorción de Gibbs correspondiente es
donde β se define como
la expresión (13) es la isoterma ideal; la constante β se denomina parámetro hidrofóbico ya que en general, β > 1 y por tanto, θ𝐺 > x indicando que la fase superficial se enriquece de material ya que el soluto “repele” al medio ambiente.
Interpretación de A 𝟎 en la ecuación de estado de Volmer
El parámetro A0 en la ecuación de Volmer es una “corrección” al área específica en la ecuación de gas ideal bidimensional debido al área propia de las moléculas, así el término A − A0 es el área “efectiva” (de Boer, 1954). Al término A0, también se le considera como el área límite que ocuparían moléculas de soluto en la interfase en el líquido subenfriado cuando la temperatura tiende a cero (𝑇 → 0). De las interpretaciones para A0, la más importante y fundamental, proviene del análisis de la ecuación de Volmer en términos de la ecuación de estado virial. La ecuación de estado virial en tres dimensiones propuesta por Kamerlingh Onnes en 1901, contiene fundamentos en la física estadística, describe el comportamiento de gases reales a partir del factor de compresibilidad Z en función de la serie de potencias en volumen específico o en presión. En términos del volumen específico se tiene que
en (15) B, C …, corresponden al segundo coeficiente virial, tercer etc., que para una sustancia pura son sólo función de la temperatura (Helrich, 2009). En el caso de superficies, el desarrollo de esta serie se expresa con las variables bidimensionales de área o presión superficial. Considérese la ecuación del Volmer en la siguiente forma
en términos del factor de compresibilidad bidimensional 𝑧
sea la cobertura superficial de Volmer, θ como
donde Γ es la concentración de superficie y Г 0 el recíproco de A0, que correspondería a una concentración límite para cada4 sistema y la expresión (17) en términos de la definición cobertura superficial es de la forma
al expandir el lado derecho de la igualdad (19) en suma de potencias de θ al rededor del cero, se obtiene la serie geométrica correspondiente
que en términos del área específica es
la expresión (21) muestra que en la expansión de 𝑧 de la ecuación de Volmer en potencias del área específica, A0 es directamente el “Segundo coeficiente del Virial Bidimensional” Bs. Arreglando la ecuación de Volmer (16) en términos de presión bidimensional
se muestra que la expresión (22) contiene el desarrollo del virial en presión superficial, así
es el segundo coeficiente del virial en presión
Desde el punto de vista microscópico, los coeficientes viriales reflejan el orden particular de las colisiones que tienen lugar entre moléculas. El segundo coeficiente cuantifica las colisiones que ocurren entre dos moléculas, el tercer coeficiente depende de las colisiones ternarias, y así sucesivamente (Wisniak, 2003). Más adelante, se mostrará cómo obtener este parámetro directamente de los datos experimentales.
Potencial químico en la ecuación de Volmer
En sistemas binarios donde el soluto se encuentra en equilibrio entre la fase superficial y la disolución, es indispensable contar con los potenciales químicos de cada componente en cada fase, para posteriormente recurrir a la igualdad entre los potenciales químicos entre fases. Para la disolución, se puede emplear la expresión (5), sin embargo, para la región superficial, la forma que toma el potencial químico depende de la ecuación de estado seleccionada y de su acoplamiento a la EAG escrita como
En donde 𝑑𝜇s, es el potencial químico de la superficie. En el caso de la ecuación de Volmer
acoplando (25) en la expresión (24) se llega a la forma del potencial químico de la superficie
La integración de la expresión (26) requiere de un estado de referencia para el potencial químico de superficie, 𝜇0,s, referido a un valor conveniente de presión superficial, 𝜋ref. Para un estado cualquiera se tiene que
llegando a
bajo la misma referencia en la fase volumétrica
el equilibrio de un componente entre diversas fases indica que
y por tanto de (28) y (29)
la expresión (31) relaciona la composición de la fase volumétrica con la presión superficial. Para emplear la expresión (31) es necesario elegir los estados de referencia y además por conveniencia, seleccionar un mismo estado en ambos potenciales (Gracia-Fadrique, et al, 2002). En la literatura, es común encontrar otros estados de referencia, los más comunes son: 1mN/m y 0.338 mN/m, este último corresponde a la presión superficial a 273.15 K de un gas ideal bidimensional donde la distancia promedio entre moléculas es la misma que en un gas ideal en condiciones normales de temperatura y presión (Aveyard y Haydon, 1973). A continuación, se presentarán dos casos de referencia idéntica tanto para la fase volumétrica como la fase superficial a partir de las cuales, se puede extraer información concerniente de cada región.
El estado de referencia a dilución infinita
La región donde el soluto se encuentra altamente diluido (x → 0) es una zona de alta sensibilidad de varias propiedades termodinámicas en disolución, donde la dependencia de estas propiedades con la concentración de soluto es generalmente lineal. Seleccionando el régimen diluido como referencia en ambas fases y sus potenciales químicos, es decir, cualquier punto a lo largo de curva presión superficial-composición que cumpla (10), de modo que x → 0 y a su vez π → 0. Es importante notar que debido a la forma matemática del potencial químico para la superficie y la disolución (28) y (29) respectivamente, se indeterminan en las vecindades de x = 0 y π = 0, esto no ocurre al acoplar la presión superficial y la composición, ya que en el régimen diluido se cumple la expresión (10). Bajo estas consideraciones , la expresión (31) es como
en (32), al seleccionar un estado común de referencia, el de dilución infinita; 𝜇0,s = 𝜇0,s Rearreglando términos se llega
donde
Sistemas que sigan la ecuación de estado de Volmer (33), mostrarán un comportamiento lineal en todo o algún intervalo de composición en la representación logaritmo natural del cociente de presión y la composición versus la presión superficial. En este análisis, la ordenada al origen corresponde a ln𝜙, mientras que la pendiente contiene el término Г 0 RT (que no debe confundirse con Г m RT de la ecuación de adsorción de Gibbs). La Figura 1, presenta al sistema binario ciclopentano-1,1,2,3-tetracloroetano (Lam y Benson, 1970) tipo Volmer en todo el intervalo de presión superficial. A partir del ajuste lineal, se obtienen los parámetros constitutivos de la ecuación de estado. En este sistema, A0 adquiere el valor de +- 0.44 17.28 Å 2 por molécula.
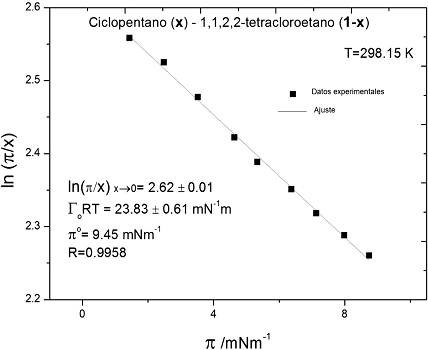
Figura 1 Sistema líquido-líquido que cumple con la ecuación de Volver, expresión (33), en todo del intervalo de presión superficial y composición; π° es la presión máxima de este sistema (Lam y Benson, 1970).
El sistema binario metanol-agua a 298.15 K (Vázquez, et al, 1995) en la Figura 2, presenta un comportamiento lineal solo para valores menores a 25 mN/m, más allá de esta región, se observa desviación respecto al modelo de Volmer; el modelo será válido solo para el intervalo lineal.
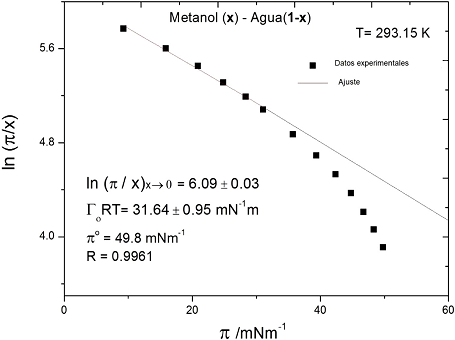
Figura 2 Sistema líquido-líquido que sigue con la ecuación de Volmer, expresión (33) en una parte el intervalo de presión superficial (Vázquez, et al, 1995).
El estado de referencia a saturación
Los sistemas binarios formados por disolvente y soluto, ambos líquidos no iónicos, de relativo bajo pesos moleculares y miscibles se denominan líquidos simples. En muchos de ellos, la concentración máxima de superficie se alcanza en vecindades de la fracción unitaria del soluto (𝑥sat = 1) y la presión superficial máxima corresponde a la diferencia de las tensiones superficiales de los líquidos puros:
una vez más; 𝜇0,b = 𝜇0,s de modo que la expresión (35) se reduce a
se define la presión superficial reducida 𝜋∗, como la presión adimensional normalizada a la presión superficial máxima
bajo esta normalización, la ecuación (36) adquiere la forma
el coeficiente de la ecuación (38) es el coeficiente de compresibilidad bidimensional evaluado en A 0
y la expresión (38) en forma condensada es
la expresión (40) indica que un sistema en representación logaritmo natural del cociente de la presión superficial reducida y la fracción mol de soluto vs uno menos la presión superficial reducida, se obtendrá una recta con ordenada al origen cero y pendiente z0. A continuación, se mostrará que las expresiones (33) y (40), resultado de la selección de dos estados de referencia diferentes en (31) son equivalentes. Tomando el límite de dilución infinita en (40)
Restando lnπ0 de ambos lados de (33) y usando la definición de presión superficial reducida
sustituyendo la expresión (41) en (42)
lo anterior muestra que la expresión (31) es independiente del estado de referencia. Es decir, se puede emplear indiscriminadamente la expresión (33) o (40) para representar e interpretar los datos experimentales; solos depende de la región de interés.
Consecuencias
Energía Gibbs estándar de adsorción
La energía de Gibbs estándar de adsorción
así (33) se puede escribir como
la expresión (45) permite encontrar
Tensoactivos
Los tensoactivos son anfífilos de alto peso molecular que, en disolución, generalmente acuosa, no se describen por una curva suave en presión superficial-logaritmo de la composición en todo el intervalo. Estas moléculas forman diversos agregados moleculares en el seno del líquido a diversas concentraciones, los más conocidos son las micelas que son las primeras estructuras en formarse en disolución a bajas concentraciones. En estos sistemas, la presión superficial máxima corresponde a la presión de saturación; πsat, y la concentración volumétrica de saturación es la 𝑥cmc, donde cmc, indica la concentración micelar crítica, que suele adquirir valores entre 10−7 y 10−6 en fracción mol. Es la concentración a la que se presentan discontinuidades en las propiedades termodinámicas de la mezcla debido a la presencia de las micelas. Considerando lo anterior en la expresión (31)
también; 𝜇0,b = 𝜇0,s, que es la referencia a saturación. Reacomodando términos
La expresión (47) predice un comportamiento lineal en las coordenadas indicadas (1 - 𝜋*) vs
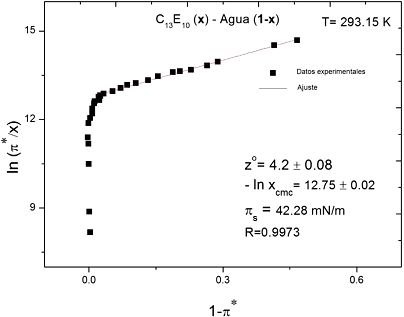
Figura 3 Sistema tensoactivo-agua volmeriano para 𝑥≤𝑥cmc; se ajusta a la expresión (45) (Pardo-Cervantes et al, 2011).
Retomando la expresión (33) e igualando a (47)
tomando el límite en la saturación; 𝜋∗ → 1
multiplicando (49) por RT y recordando que para tensoactivos no iónicos
se tiene que
y entonces
la desigualdad (52) indica, según el modelo de Volmer, que para tensoactivos el proceso de adsorción precede al de micelización (Bermúdez-Salguero, Gracia-Fadrique 2011; Viades-Trejo, Gracia-Fadrique, 2008).
Isoterma de Volmer
La ecuación de Volmer, expresada en términos de θ (Ao/A) es
Para encontrar la isoterma correspondiente a la ecuación de Volmer, se divide cada miembro de (53) por x, seguida por el logaritmo natural
sustituyendo (33) considerando (53) en el primer miembro de lado izquierdo de (54) se tiene que
re arreglando términos en (55) se tiene que
definiendo a β′ como
(56) contiene a la isoterma correspondiente a Volmer, aunque no de manera explícita (Adamson, 1997). Es importante notar que en (56), cuando x → 0, θ → 0 así, el término logaritmo predomina sobre el segundo miembro de lado izquierdo, de manera que la ecuación (56) se reduce al comportamiento ideal.
Conclusiones
El modelo de Volmer, permite linealizar los datos de presión superficial de mezclas binarias ideales en todo el intervalo de composición y de diversos tensoactivos desde la zona diluida hasta las vecindades de la concentración micelar crítica y por tanto, la opción inmediata para el cálculo de la energía estándar de adsorción y micelización en el caso de tensoactivos; propiedades conjuntas contenidas en la misma ecuación por sus extremos, donde la ordenada al origen contiene la concentración micelar crítica y la opuesta, el comportamiento a dilución infinita. También se obtiene el parámetro A0, que corresponde al segundo coeficiente virial bidimensional y es el área propia del soluto.
Lista de símbolos
Símbolos latinos
A |
Área específica |
a |
Constante de la ecuación de VdW volumétrica |
A 0 |
Constante de la ecuación de Volmer |
Z |
Factor de compresibilidad tridimensional |
B |
Segundo coeficiente del virial tridimensional en volumen específico |
b |
Constante de la ecuación de VdW volumétrica |
C |
Tercer coeficiente del virial tridimensional en presión tridimensional |
Bs |
Segundo coeficiente del virial bidmensional en ára específica |
|
Segundo coeficiente del virial bidimensional en presión superficial |
𝑅 |
Constante universal de los gases |
𝑇 |
Temperatura absoluta |
𝑃 |
Presión volumétrica |
𝑣 |
Volumen específico |
𝑥 |
Fracción mol |
𝑥 cmc |
Concentración micelar crítica |
𝑥→0 |
Límite de concentración a dilución infinita |
z |
Factor de compresibilidad bidimensional |
z0 |
Factor de compresibilidad bidimensional referido a A 0 |
Símbolos griegos
𝛼 |
Constante de la ecuación de VdW bidimensional |
β |
Parámetro liofóbico |
β′ |
Parámetro liofóbico de la ecuación de Volmer |
Г0 |
Recíproco de A 0 |
Г |
Concentración de superficie |
Γm |
Concentración máxima de superficie |
|
Energía estándar de adsorción |
|
Energía estándar de micelización |
𝜃𝐺 |
Cobertura superficial de Gibbs |
𝜃 |
Cobertura superficial de Volmer |
|
Potencial químico de bulto del componente 𝑖 |
|
Potencial químico de referencia de bulto del componente 𝑖 |
|
Potencial químico de superficie del componente 𝑖 |
|
Potencial químico de superficie del componente 𝑖 |
𝜋 |
Presión superficial |
𝜋 ref |
Presión superficial de referencia |
𝜋sat |
Presión superficial de saturación |
𝜋0 |
Presión superficial máxima en mezcla de líquidos simples |
𝜋∗ |
Presión superficial reducida |
𝜋→0 |
Límite de presión superficial a dilución infinita |
𝜎 |
Tensión superficial |
|
Tensión superficial del compuesto 𝑖 puro |
|
Constante a dilución infinita (constante de Henry en dos dimensiones) |
|
Derivada máxima |











 nueva página del texto (beta)
nueva página del texto (beta)


