Introdução
As diversas cores observadas nas plantas devem-se às antocianinas, compostos hidrosolúveis responsáveis pelas cores que vão do laranja ao azul; aos carotenoides, compostos lipossolúveis, que conferem a coloração do amarelo ao vermelho, (Castaneda-Ovando et al., 2009; Tanaka, Sasaki e Ohmiya, 2008); as betalaínas que conferem o tom amarelo e violeta (Azeredo, 2009; Gandía-Herrero e García-Carmona, 2013); e as chalconas, auronas, flavonóis e flavonas que conferem tom amarelo (Castaneda-Ovando et al., 2009). As antocianinas apresentam a função de diminuir a foto-inibição e aumentar ao máximo a fotossíntese (Gould et al., 1995). O uso de extratos de plantas como indicadores naturais de pH é uma ferramenta importante no processo de ensino e aprendizagem (Couto, Ramos e Cavalheiro, 1998; Dias, Guimarães e Merçon, 2003; Garber, Odendaal e Carlson, 2013; Martins et al., 2017; Ribeiro e Nunes, 2008), enfatizando os princípios da Química Verde (EPA/US, 2012) que visam o desempenho ambiental dos processos, impactando em menores custos, maior segurança, menor risco à saúde e ao meio ambiente (Bosiljkov et al., 2017; Buka, Osornio-Vargas e Clark, 2011; Byrne et al., 2016; Capello, Fischer e Hungerbühler, 2007). Na Parte I da coleção de experimentos utilizando indicadores alternativos de pH a partir de legumes e folhas foi investigado o comportamento colorimétrico de repolho roxo, beterraba, cebola roxa e berinjela na presença de produtos do cotidiano dos estudantes (vinagre incolor de álcool, refrigerante, álcool comercial 46o GL, água sanitária, ácido clorídrico (HCl), hidróxido de sódio (NaOH) e água potável). Neste manuscrito (Parte II) foi investigado o perfil colorimétrico e o tempo de armazenamento de extratos de açafrão-da-terra (Curcuma sp.), coleus-de-Java (Solenostemon sp.), feijão-preto (Phaseolus sp.) e trapoeraba-roxa (Tradescantia sp.) (Figura 1), utilizando os mesmos produtos do cotidiano dos estudantes utilizados na Parte I desta coleção. Dessa maneira, este manuscrito sugere novos extratos provenientes de raízes e de folhas, contribuindo para aumentar o conhecimento sobre o comportamento de diferentes plantas que podem ser usadas como indicadoras de pH além de apresentar o tempo de armazenamento dos extratos obtidos e testados.
Metodologia
Visando compor a coleção de propostas didáticas, foi proposta a extração de produtos naturais de quatro plantas: açafrão-da-terra (Curcuma sp.), coleus-de-Java (Solenostemon sp.), feijão-preto (Phaseolus sp.) e trapoeraba-roxa (Tradescantia sp.). A atividade foi implementada por estudantes dos cursos de Licenciatura em Química e Biologia com a proposta de desenvolver uma atividade experimental que pudesse ser acessível e aplicada em diversas realidades educacionais. Com a contextualização da atividade proposta, a partir de embasamento químico teórico e utilizando produtos do cotidiano dos estudantes é possível explorar o mundo da ciência, permitindo que a química ocupe seu papel na sociedade e contribua para a formação de cidadãos críticos, investigativos e reflexivos. A importância da experimentação no ensino é prática indiscutível para compreender a natureza, as transformações da matéria e os fenômenos do cotidiano (de Ávila e Matos, 2017).
Inicialmente a abordagem foi contextualizadora e investigativa com a participação de estudantes dos cursos de Licenciatura em Química e de Licenciatura em Ciências Biológicas. Após a otimização do procedimento de extração, a proposta foi implementada. O tema foi abordado em sala de aula, a partir do livro texto (Russel, 1994) estabelecendo correlações significativas entre produtos presentes no cotidiano dos estudantes e os conceitos: equilíbrio químico, pKa, pKb, teorias ácido-base e indicadores de pH. Após a discussão dos conceitos químicos foi realizada a correlação entre a coloração dos extratos e o equilíbrio químico dos constituintes presentes nos extratos vegetais, a serem abordados na atividade experimental. Em seguida, a partir do embasamento teórico sobre o tema, a atividade apresentada neste manuscrito foi implementada pelos estudantes, possíveis futuros profissionais da educação, explorando a observação macroscópica, a interpretação microscópica e a expressão representacional (de Ávila e Matos, 2017), estabelecendo correlações entre o comportamento observado pelos indicadores clássicos de pH (tais como a fenolftaleína e o alaranjado de metila) e os indicadores de pH obtidos.
A atividade foi desenvolvida por 32 estudantes do primeiro semestre do curso de Licenciatura em Ciências Biológicas, como proposta para a instrumentação da abordagem do tema ácido-base. Foram elaboradas questões problematizadoras sobre o tema para serem discutidas com estudantes do Ensino Médio. Nos resultados e discussões são apresentadas aplicações e características de cada indicador, contextualizando a atividade.
Há diversos estudos que discutem formas de abordar o tema ácido-base, visto que é um tema de ampla aplicação. Assim, diversos trabalhos são realizados nesse sentido, desde investigações com simulações realizadas através do uso de softwares específicos (Raviolo e Farré, 2017) ou com o uso de extratos vegetais para a determinação do pH, sendo essa uma ferramenta para o Ensino de Química bastante utilizada e conhecida (Choi et al., 2017; Couto, Ramos e Cavalheiro, 1998; Dias, Guimarães e Merçon, 2003; Gouveia-Matos, 1999; Khan e Farooqui, 2011; Soares, Cavalheiro e Antunes, 2001). Nesse manuscrito, enfatizamos o uso de trapoeraba-roxa e coleus-de-Java além do uso de feijão-preto e açafrão-da-terra como indicadores naturais de pH.
Para as extrações dos pigmentos vegetais foi utilizada a água como solvente, não gerando resíduos tóxicos para o estudante e para o meio ambiente após a atividade, enfatizando o verdor químico do experimento (Gonçalves et al., 2017; Martins et al., 2017).
Extrato aquoso: Para o desenvolvimento das atividades foram preparados indicadores naturais de pH utilizando 100.7 g de feijão-preto em 209 mL de água; 28.29 g de trapoeraba-roxa em 150 mL de água; 13.47 g de coleus-de-Java em 150 mL de água e 67.09 g de açafrão-da-terra em 200 mL de água. Os grãos de feijão-preto, os rizomas de açafrão-da-terra, as folhas de coleus-de-Java e de trapoeraba-roxa foram fervidos por 45 min e resfriados. Destes extratos, o volume de 120 mL foi dividido em duas frações. O volume de 60 mL (fração 1) foi reservado e resfriado, sendo assim obtido o extrato aquoso utilizado.
Extrato etanólico: O volume restante de 60 mL (fração 2 do extrato), foi evaporado até secura, por 50 min. A este extrato concentrado foi adicionado 50 mL de etanol comercial (92 oGL), sendo obtido o extrato etanólico.
Em seguida, para cada 10 mL das amostras testadas, foram usados 5 mL dos indicadores aquosos e etanólicos preparados.
As amostras testadas foram vinagre incolor de álcool, refrigerante de limão (incolor), álcool comercial 46 ºGL, água sanitária, ácido clorídrico (HCl, 0.1 mol L-1), hidróxido de sódio (NaOH 0.1 mol L-1) e água potável.
Para a determinação do pH das amostras, foi utilizado um pHmetro digital de bancada (pHS-38W microprocessor) utilizando soluções tampão (Vetec) pH 4.00 e pH 7.00 para calibrar o pHmetro. A água potável utilizada nas extrações, apresentou pH = 7.00 (frasco 5) e o etanol 46 oGL apresentou pH = 8.10 (frasco 6) sendo utilizados na escala colorimétrica obtida, como branco. Além disso, em cada conjunto de testes (Figura 1), é apresentado em todos os frascos de número 1 a amostra referência, com o valor do pH e a coloração do extrato aquoso (Figura 1, à esquerda) e do extrato etanólico (Figura 1, à direita). As amostras testadas têm pH entre 2.42 (vinagre incolor) e 12.88 (água sanitária) e os extratos armazenados em etanol tem pH mais básico que os extratos armazenados em água (Tabela 1). A basicidade do etanol é maior do que a da água pela presença dos dois pares de elétrons livres do oxigênio da hidroxila (CH3-CH3-OH), conferindo maior basicidade aos extratos etanólicos (Morrison e Boyd, 1992).
Tabela 1 pH dos extratos aquosos e etanólicos.
| Planta | pH | ||
|---|---|---|---|
| Extrato aquoso | Extrato etanólico | ||
| Açafrão-da-terra | 5.87 | 7.35 | |
| Coleus-de-Java | 5.95 | 6.17 | |
| Feijão-preto | 6.06 | 6.74 | |
| Trapoeraba-roxa | 5.18 | 5.85 | |
O procedimento metodológico é apresentado na Figura 2 e partir dele foram obtidas as escalas de cores a partir de cada extrato testado.
Resultados e Discussão
Os extratos conservados em etanol 92 oGL apresentaram as mesmas cores, no entanto, mais límpidos e em tons menos intensos que os extratos conservados em água. O pH das amostras foi medido e está apresentado na Figura 3 (açafrão-da-terra na Figura 3.1; coleus-de-Java na Figura 3.2; feijão-preto na Figura 3.3; e trapoeraba-roxa na Figura 3.4) juntamente com o pH das amostras testadas.

Figura 3 Representação das colorações obtidas pela variação do pH e o tipo de extrato. 1. Açafrão-da-terra. 2. Coleus-de-Java. 3. Feijão-preto. 4. Trapoeraba-roxa. À esquerda são apresentadas as imagens utilizando o extrato aquoso e à direita utilizando o extrato etanólico: (1) indicador; (2) vinagre incolor; (3) HCl 0.1 mol L-1; (4) refrigerante; (5) água potável; (6) álcool 46 oGL; (7) NaOH 0.1 mol L-1 e (8) água sanitária.
A extração completa das antocianinas ocorre utilizando metanol como solvente (Harborne, 1998, cap. 2.). A substituição de metanol por solventes alternativos é importante. Isso porque o metanol pode provocar acidose metabólica severa, alterações neurológicas, cegueira, doenças degenerativas como o Parkinson e a intoxicação aguda pode provocar a morte (Enriquez-Marulanda et al., 2016; Vares et al., 2012). Assim, o uso de água como solvente extrator reforça o verdor químico do experimento e os princípios de sustentabilidade e ambiente (Gonçalves et al., 2017).
A Figura 3.1 apresenta a variação das colorações obtidas nas amostras testadas a partir do extrato de rizomas de açafrão-da-terra que possuem curcumina. A curcumina apresenta equilíbrio ceto-enólico entre o pH 3 e o pH 7, tem baixa solubilidade em água, mas é solúvel em soluções aquosas básicas (Sueth-Santiago et al., 2015), além de apresentar caráter solvatocrômico (Jasim e Ali, 1989). Apresenta várias propriedades biológicas relevantes, dentre elas antioxidante (Wright, 2002), anti-inflamatória (Julie e Jurenka, 2009) e antitumoral (Liu e Chen, 2013). Os extratos de açafrão-da-terra aquoso e etanólico podem ser utilizados por até 22 dias após a extração, sem comprometer a detecção qualitativa do pH das amostras testadas, apresentando coloração amarela em vinagre, HCl 0.1 mol L-1, refrigerante, água e etanol; laranja em NaOH 0.1 mol L-1; e amarelo claro em água sanitária. A Figura 4 indica as estruturas da curcumina e dos derivados gerados pela variação do pH do meio (Priyadarsini, 2009; Sueth-Santiago et al., 2015).
Na Figura 3.2, observamos que o extrato de coleus-de-Java apresenta coloração rosa em pH ácido e torna-se amarelo escuro em pH básico. Os extratos aquosos e etanólicos podem ser armazenados por até 8 dias e após esse período as colorações esmorecem, principalmente entre o pH 3 e o pH 8, prejudicando a análise qualitativa. O coleus-de-Java é uma planta que tem aumento no teor de antocianinas totais quanto maior a exposição da planta à luz solar (Logan et al., 2015; Nguyen e Cin, 2009) diminuindo a razão entre os teores de clorofila α e clorofila β. A coloração vermelha se deve a presença de betacianinas (betalaínas ou antocianinas nitrogenadas) e do conteúdo total de antocianinas (Rife, 1948; Sahu e Dewanjee, 2012), que atuam como fotoprotetores, mantendo a coloração das folhas vermelhas, independente das alterações de pH vacuolar. A betacianina mais comum é a betanidina (Jain e Gould, 2015) (Figura 5) (Stintzing e Carle, 2004).
Os grãos de feijão-preto são ricos em derivados glicosilados de delfinidina, petunidina, malvidina (Mojica, Berhow e Gonzalez de Mejia, 2017; Takeoka et al., 1997) e cianidina (Choung et al., 2003), apresentando capacidade antioxidante (Akond et al., 2011), podendo atuar contra micotoxinas (Telles, Kupski e Furlong, 2017). Foram realizados estudos em ratos os quais demonstraram que o consumo de feijão-preto pode atuar como agente protetor a danos ao DNA (Azevedo et al., 2003), diminuindo a incidência de câncer de colón (Bennink e Hangen, 2002) e como potencial agente antidiabetes (Mojica, Berhow e Gonzalez de Mejia, 2017). Os extratos de feijão-preto (Figura 3.3) apresentam coloração preto azulada em água (pH 6.06); castanho-avermelhado em vinagre branco (pH 2.42); vermelho em HCl 0.1 mol L-1 (pH 2.96); violeta entre o pH 3.06 e o pH 8.10 (refrigerante, água potável e etanol 46 oGL); verde escuro em NaOH 0.1 mol L-1 (pH 12.14); e amarelo em água sanitária (pH 12.88). Os extratos de feijão-preto, após 8 dias de armazenamento, apresentam decréscimo na intensidade da coloração nas amostras testadas. As colorações observadas na Figura 3.3, a partir de extrato de feijão-preto indicam colorações semelhantes às obtidas a partir de extratos de repolho roxo, utilizando os mesmos produtos (Martins et al., 2017). Pietro et al. (2017) desenvolveram filmes de amido contendo extrato de feijão-preto e de repolho roxo como membranas sensíveis à variação de pH, podendo ser usadas como embalagens inteligentes, possuindo em comum as antocianinas glicosiladas petuninida e cianidina e a antocianina não glicosilada pelargonidina (Prietto et al., 2017).
A trapoeraba-roxa apresenta sensibilidade na investigação da genotoxicidade de vários compostos químicos (de Souza Lima, de Souza e Domingos, 2009; Khan e Siddiqi, 2014; Sinha et al., 2017; Sumita et al., 2003). A trapoeraba-roxa contém as antocianinas glicosiladas cianidina (Baublis e Berber-Jimenez, 1995), delfinidina e malvidina (Mendes et al., 2016) (Figura 6), que viabilizam o uso do seu extrato como indicador de pH. Os extratos de trapoeraba-roxa apresentam baixa estabilidade e após 8 dias de armazenamento formam precipitado coloidal. A coloração do extrato se mantém constante, no entanto, apresenta fraca resposta visual quando adicionado às amostras testadas, interferindo na análise qualitativa, havendo a necessidade da adição de maior volume do extrato aquoso ou etanólico para se obter a mesma intensidade de cor. A trapoeraba-roxa apresentou: cor rósea em vinagre (pH 2.42) e ácido clorídrico (pH 2.96); e cor violeta em refrigerante (pH 3.06), água potável (pH 7.00) e álcool 46 oGL (pH 8.10). Em hidróxido de sódio 0.1 mol L-1 (pH 12.14) o extrato de trapoeraba-roxa apresentou coloração verde e em água sanitária (pH 12.88) amarelo pálido (Figura 3.4).
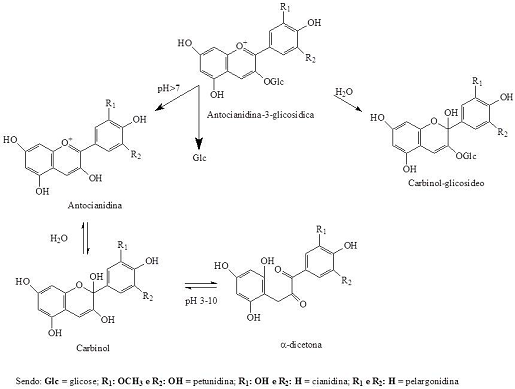
Figura 6 Equilíbrio da petunidina, cianidina e pelargonidina a partir da alteração do pH do meio (Adaptado de Stintzing e Carle, 2004).
As cores observadas nas amostras de vinagre; HCl 0.1 mol L-1; refrigerante; água potável; etanol 46 oGL; NaOH 0,1 mol L-1; e água sanitária devem-se aos constituintes das amostras, conforme discutido anteriormente na Parte I dessa coleção de experimentos (Martins et al., 2017).
Durante e após a implementação da atividade, os estudantes eram constantemente questionados sobre: i) o que estava acontecendo (fenômeno); ii) quais seriam os constituintes presentes nas plantas responsáveis pelo fenômeno observado; iii) se todas as plantas poderiam atuar com indicadores de pH. Com isso estabeleceu-se uma análise investigativa e problematizadora sobre o tema proposto e a atividade realizada, até porque as atividades experimentais são recursos pedagógicos eficazes na construção de conhecimentos, capacidades e habilidades (de Souza et al., 2015; Francisco Jr, Ferreira e Hartwig, 2008; Giordan, 1999; Pintrich, Marx e Boyle, 1993). Os estudantes demonstraram interesse, criticidade e olhar investigativo, o que pode ser observado nas afirmativas:
Estudante 1: “Os indicadores naturais de pH são melhores para serem usados pelo baixo custo e facilidade em serem adquiridos, como por exemplo, o feijão-preto.”
Estudante 2: “Um professor deve estar preparado diante de algumas situações, tais como: não são todas as escolas que possuem equipamentos e materiais laboratoriais necessários para a execução de atividades experimentais; cabe ao professor buscar novos métodos que proporcionem uma aula diferente aos seus alunos: por exemplo, na falta de fenolftaleína pode-se usar um indicador natural.”
Estudante 3: “Os indicadores de pH são de grande importância nas áreas da química e biologia, dentre outras. Eles auxiliam na determinação das faixas de pH de uma solução caracterizando-as como ácidos ou bases.”
Estudante 4: “Nós ficamos felizes com a possibilidade de utilizar indicadores naturais de pH, pois é uma forma simples e rápida para observar o que acontece.”
Estudante 5: “Para um biólogo é importante a determinação do pH, principalmente em atividades de pesquisas, como por exemplo no estudo de peixes, investigando os fatores abióticos de temperatura da água, pH e oxigênio dissolvido.”
Essas afirmativas reforçam que a (re)construção do conhecimento, proposta por Morin, a partir de atividades experimentais contribuem para o desenvolvimento de senso investigativo, crítico e científico dos estudantes, com reflexões pautadas no método científico e na análise investigativa (Martins et al., 2017; Morin, 2011). Haja vista que diante dos relatos dos estudantes esta abordagem metodológica proporciona estabelecer significações interdisciplinares de fácil aplicação, podendo ser implementadas em diferentes realidades educacionais promovendo a pesquisa nas ciências da natureza.
Além disso, os estudantes foram motivados a problematizar o tema ácido-base. As questões por eles propostas evidenciaram habilidade crítico-investigadora, reforçando o enfoque epistemológico e argumentativo proposto por Popper a partir de uma concepção de racionalidade plural, tão importante no desenvolvimento científico (Popper, 1985) contribuindo para o redimensionamento da prática docente e para o desenvolvimento de uma visão crítica sobre a ciência química (Oliveira, 2015) contribuindo na construção de conhecimentos científicos a partir da realidade de cada indivíduo. Foram selecionadas 2 questões problematizadoras elaboradas pelos grupos de estudantes envolvidos na atividade:
Grupo 1: “Sabendo que cada parte do corpo possui um pH diferente, por exemplo, a saliva, tem pH entre 6.8 e 7.2, enquanto o estômago possui pH ácido (entre 2 e 3) por conta do suco gástrico, que contém HCl. Como o corpo humano é capaz de manter o equilíbrio entre todas essas faixas de pH?”
Grupo 2: “Sabendo que nosso corpo apresenta ácidos e bases em equilíbrio. Se ingerirmos ácidos de uma maneira exagerada, haverá alteração no nível de pH do nosso corpo em seis meses?”
Estas questões elaboradas pelos estudantes demonstram o caráter disciplinar, interdisciplinar e transdisciplinar da atividade proposta, demonstrando que a experimentação no ensino se constitui em ferramenta fundamental para que os estudantes interajam em sociedade e compreendam o mundo que estão inseridos. Ainda se observa a partir das questões elaboradas pelos estudantes, que está havendo construção conceitual pelo estabelecimento de correlações entre diferentes áreas a partir de um mesmo conceito, sendo isso o que propõe Edgard Morin (Morin, 2011). No Brasil, os profissionais licenciados em Química e em Biologia podem atuar no Ensino de Ciências no 9º ano do Ensino Fundamental, pois nesta fase os estudantes têm introdução aos conceitos de química e de física. Nesse cenário, uma formação interdisciplinar permite a construção de conceitos que poderão ser contextualizados pelos futuros profissionais do ensino contribuindo assim para uma educação pautada na resolução de problemas a partir da metodologia científica.
Conclusões
Os extratos de coleus-de-Java, feijão-preto e trapoeraba-roxa podem ser armazenados em água ou em etanol comercial (92 oGL) por 8 dias e o extrato de açafrão-da-terra pode ser armazenado por 22 dias, sem prejudicar a qualidade visual das análises. Esta atividade contribuiu para resignificar a ação docente de futuros professores de Ciências Naturais, favorecendo a correlação entre questões químicas e biológicas, refletidas através das questões problematizadoras elaboradas pelos estudantes. Essa atividade permite construir propostas didáticas que podem ser implementadas em diferentes realidades educacionais, sempre pautado no método científico. O experimento proposto e realizado tem carácter interdisciplinar, pois permite ao professor estabelecer correlações entre diversos conteúdos e temas da Química, mas também conteúdos e temas da área da Biologia. Parâmetros físicos como a temperatura de extração, temperatura e tempo de armazenamento também podem ser explorados. Além disso, o experimento contribui para demonstrar ao estudante que a Química está presente em todas as coisas, e que as afirmativas de que algo “não tem química” são afirmativas com erros conceituais. Assim, através de diferentes estratégias de ensino e aprendizagem, podem-se abordar temas numa ampla gama de complexidade, de forma disciplinar, interdisciplinar ou transdisciplinar, cabendo ao professor estabelecer a mediação durante o processo de ensino-aprendizagem.











 nueva página del texto (beta)
nueva página del texto (beta)






