Introdução
A busca pelo saber perpassa as diversas áreas do conhecimento. A busca por estratégias de ensino que permitam um aprendizado significativo reflete a inquietude dos profissionais da educação. Pensar em um ensino que vise à preocupação com o meio ambiente, propondo metodologias que não comprometam o caráter científico do estudo, preocupando-se na não geração de resíduos tóxicos, minimizando o impacto ambiental da química no meio ambiente são características da química verde (Lenardão, Freitag, Dabdoub, Batista e Silveira, 2003). O termo química verde ou química sustentável define o conceito de produtos ou processos químicos que reduzem ou eliminam o uso ou a geração de substâncias perigosas (EPA/US, 2012). Desde o ensino infantil, há relatos sobre o compromisso e a complexidade que envolve educar os indivíduos em sua totalidade, permitindo-os construir uma personalidade específica (Brostolin, 2015). A discussão de conceitos químicos e sua relação com o meio ambiente (Leite e Rodrigues, 2011; Zuazagoitia e Villarroel, 2016) contribui positivamente no processo de ensino e aprendizagem, o que pode ser realizado através de projetos de estudo, proposta deste artigo, ou ainda através de estudos de caso (Faria e Freitas-Reis, 2016). A abordagem de um tema aos estudantes tem mais sentido a partir do cotidiano, de ações e discussões que sigam a metodologia científica, que deem novo significado às ações do estudante. Nesse sentido, buscam-se desenvolver competências e habilidades que os tornem agentes reflexivos e atuantes. Para Popper, a prática docente consiste em repensar, partindo da lógica. Suas discussões são pautadas basicamente em 3 pontos: 1) a hipótese; 2) as condições iniciais; e 3) as conclusões (Popper, 1985). Independentemente da metodologia utilizada e do nível de ensino, a interação professor-aluno (Corrêa e Mill, 2016; Fonseca e Lara, 2015; Valente, 2015) é de suma importância, pois é a ponte para que o processo de ensino e aprendizagem seja significativo, é o que articula a pedagogia com os saberes a serem ensinados.
Para o desenvolvimento deste projeto de estudo foram selecionadas amostras de produtos que fazem parte do dia-a-dia dos estudantes, sendo: vinagre incolor de álcool, refrigerante, álcool comercial 46◦ GL, água sanitária, ácido clorídrico (HCl), hidróxido de sódio (NaOH) além de água potável. As estruturas moleculares de alguns constituintes das misturas utilizadas são apresentadas na Tabela 1. Por definição, ácidos possuem potencial hidrogeniónico (pH) abaixo de 7.0; bases possuem pH acima de 7.0; e amostras neutras possuem pH igual a 7.0. Nesse projeto de estudo, propõe-se a compreensão do tema baseada na colaboração em sala de aula, conforme destacam Amantea e Rizolli (2015), os quais discutem a importância de formar os indivíduos em sua totalidade, pautados na ambiência criativa de Bauhaus e na educação colaborativa (Amantea e Rizolli, 2015).
Tabela 1 Características de alguns dos constituintes das amostras estudadas
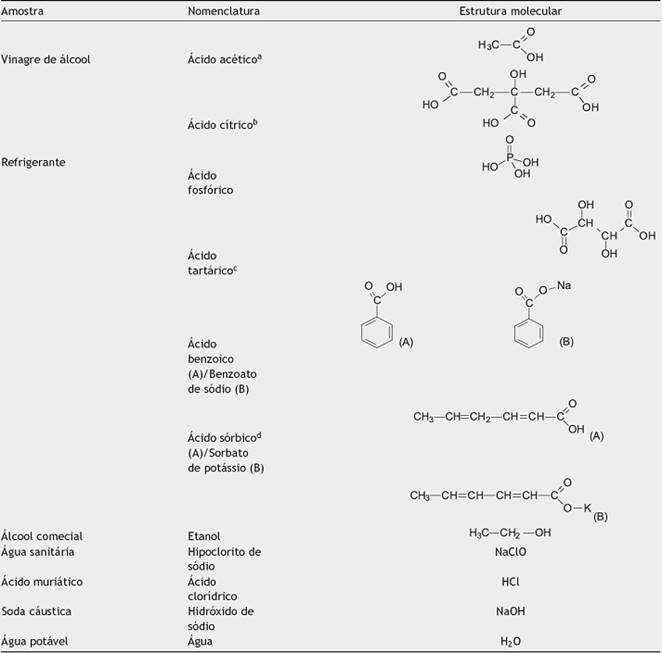
a Ácido etanoico.
b Ácido 2-hidróxi-1,2,3-propanotrioico.
c Ácido 2.3-diidróxi-butanodioico.
d Ácido 2.4-hexadienoico.
No processo de ensino e aprendizagem, o professor torna-se o mediador do processo, podendo contextualizar cada amostra que será analisada.
Metodologia
Usar metodologias que geram produtos com pouca ou nenhuma toxicidade para a saúde dos seres humanos e para o ambiente é um dos 12 princípios da química verde (Lenardão et al., 2003), sendo que o uso de vegetais como atividades práticas e de pesquisa reforça estes princípios (Hartwell, 2012). Este projeto de estudo utilizou água como solvente para extração dos pigmentos vegetais, não gerando resíduos tóxicos para o estudante e para o meio ambiente após a atividade realizada. Essa é uma das características mais importantes para definir o verdor químico dos experimentos.
Para o desenvolvimento deste projeto de estudo, foram preparados indicadores de pH utilizando para cada 100.0 g dos legumes picados testados (cebola roxa, casca de berinjela, repolho roxo e beterraba) 200.0 mL de água. Os legumes foram fervidos por 45 min e resfriados. O tempo de resfriamento pode ser otimizado através do banho de gelo do extrato aquoso obtido. O tempo de execução desta etapa do projeto é de 60 min para cada legume.
Em seguida, para cada 10.0 mL de cada meio testado usou-se 5.00 mL do indicador preparado. O tempo de execução desta etapa do projeto é de 15 min para cada extrato testado.
As amostras testadas foram: vinagre incolor de álcool, refrigerante de limão (incolor), álcool comercial 46◦ GL, água sanitária, HCl (concentração 0.1 mol L−1), NaOH (concentração 0.1 mol L−1) e água potável.
Para a determinação do pH das amostras, foi utilizado um pHmetro digital de bancada (PHS-38W-Microprocessor) utilizando soluções tampão (Vetec) pH 4.00 e pH 7.00 para calibrar o pHmetro. A água potável utilizada nas extrações apresentou pH = 7.00 e ela foi utilizada na escala colorimétrica obtida (Fig. 1, frasco 5) como branco. Além disso, em cada conjunto de testes (Fig. 1), é apresentado no frasco 1 a indicação do pH e da coloração do extrato aquoso (amostra referência). Os extratos aquosos têm pH de 5.20 para a berinjela, de 5.40 para a cebola roxa, de 5.68 para a beterraba e de 5.98 para o repolho roxo. Já as amostras testadas têm pH entre 2.42 (vinagre incolor) e 12.88 (água sanitária).

Figura 1 Representação das colorações obtidas pela variação do pH: (1) indicador; (2) vinagre incolor; (3) HCl 0.1 mol L−1; (4) refrigerante; (5) água potável; (6) álcool 46o GL; (7) NaOH 0.1 mol L−1 e (8) água sanitária.
A atividade foi desenvolvida com estudantes entre 14-16 anos.
Resultados e discussão
Os estudantes e o professor poderão acompanhar se a coloração obtida deve-se a uma solução ácida, básica ou neutra. A partir disso, foi desenvolvida uma escala de cores para auxiliar o professor e o estudante na investigação, conforme representado no Esquema 1.
Para a redação deste projeto de estudo foi medido o pH das amostras, que estão apresentados na Figura 1. A Figura 1 ainda indica que o extrato aquoso que apresentou as maiores variações colorimétricas foi o repolho roxo, seguido da cebola roxa, berinjela e beterraba.
Este manuscrito destaca a importância em substituir metanol, solvente clássico para a extração completa de antocianinas (Harborne, 1998, cap. 2.) por água, além de substituir indicadores clássicos de pH por indicadores alternativos de pH. Ambas as substituições contribuem para fortalecer os conceitos de química verde, ressaltando o verdor químico do experimento (Gonçalves et al., 2017), abordando assim os conceitos de sustentabilidade e ambiente (Sandri e Filho, 2016), não gerando resíduos tóxicos através do uso dos indicares de pH propostos.
As cores vermelhas e azuis presentes em flores e frutos são devidas, principalmente, às antocianinas, sendo derivadas do cátion flavínico e contém moléculas de açúcar ligada à sua estrutura (Okumura, Soares e Cavalheiro, 2002). Quando livres de moléculas de açúcar (agliconas) denominam-se antocianidinas. Antocianinas e antocianidinas costumam ser responsáveis pela alteração de coloração do pH do meio, designados como indicadores naturais de pH (Garber, Odendaal e Carlson, 2013; Soares, Cavalheiro e Antunes, 2001) (Fig. 2). Na cebola roxa, berinjela e repolho roxo, as alterações de pH devem-se ao equilíbrio ácido-base das antocianidinas (Boo et al., 2012; Chen e Gu, 2013; Fossen e Andersen, 2003; Fossen, Slimestad e Andersen, 2003; Noda, Kneyuki, Igarashi, Mori e Packer, 2000; Scalzo, Genna, Branca, Chedin e Chassaigne, 2008). No entanto, quando encontradas na forma aglicosilada, as colorações variam de vermelho em pH ácido a amarelo em pH básico.
Quanto à água sanitária, o cloro livre presente é um forte agente oxidante, capaz de degradar compostos orgânicos, inclusive antocianidinas (Gauche, Malagoli e Bordignon Luiz, 2010; Jacques et al., 2015). A solução esmorece, isto é, perde a cor rapidamente. Ao tornar-se incolor, o íon flavínico forma um hemiacetal ou uma cis-chalcona, que são incolores e podem apresentar equilíbrio tautométrico do tipo ceto-enólico (Fig. 3). O equilíbrio é reversível, pois uma nova adição do extrato indicador faz com que a solução recobre a coloração.
No processo de contextualização deste projeto, é importante destacar que na casca de cebola há alto teor de polifenois totais, especialmente carotenoides, incluindo xantofilas (Boo et al., 2012). As antocianinas identificadas nas cebolas roxas são derivados glicosilados da cianidina (Fossen e Andersen, 2003; Fossen, Slimestad e Andersen, 2003) e da peonidina (Fossen, Slimestad e Andersen, 2003).
Já na casca da beringela, há a antocianina malvidina, além das antocianinas nasunina e rubrobracissina (Noda et al., 2000). Conforme descrito por Noda et al. (2000), a nasunina apresenta alto poder antioxidante contra radicais livres e também age como protetor da oxidação lipídica.
No repolho roxo há alto teor de flavonoides totais, sendo majoritariamente de antocianinas (Boo et al., 2012). Segundo Boo et al. (2012), os constituintes presentes no extrato de repolho roxo também atuam com inibidores das bactérias Bacillus subtilis, Micrococcus luteus, Escherichia coli e Vibrio parahaemolyticus. É sabido da ampla aplicação do repolho roxo em testes como indicador natural de pH e Chen e Gu (2013) demonstraram que a imobilização do extrato de repolho roxo sobre um suporte inerte é eficiente em uma ampla faixa de pH (2-11). Isso se deve ao equilíbrio ácido-base, especialmente da cianidina, descrito por Chen e Gu (2013), que apresenta várias estruturas derivativas (Scalzo et al., 2008).
As mudanças de coloração do meio pela adição dos extratos aquosos de cebola roxa, berinjela e repolho roxo se devem as transformações estruturais das antocianinas que compõe os legumes (Fig. 3). As principais alterações de conformação do íon flavínico, responsáveis pela alteração da coloração do meio ocorrem nas posições 2, 7, 4’e 5’ (Brouillard, 1982; Chen e Gu, 2013; Malien-Aubert, Dangles e Amiot, 2001; Mazza e Brouillard, 1987). O aumento do número de grupos OH e OCH3 das antocinas favorece a mudança de cor do laranja para o violeta nos extratos (Malien-Aubert, Dangles e Amiot, 2001).
Quanto à beterraba, estas são ricas em betaninas e as alterações de pH do meio são devidas às conversões da betanina em função do pH do meio e/ou aquecimento (Dias, Guimarães e Merçon, 2003) (Fig. 4).
Com base na Tabela 1, observa-se que a composição de cada amostra reflete no pH que elas apresentam e isso se deve à estrutura química que cada composto apresenta. Observa-se que estão na faixa ácida os compostos que apresentam hidrogênio ionizável (H+), que é o caso da solução aquosa de HCl, que em água ioniza em H+ (aq) + Cl− (aq); do ácido fosfórico (H3 PO4) presente no refrigerante, que em água dissocia em 3 H+ (aq) + (PO4)3− (aq); e os compostos que contém o grupo ácido carboxílico (COOH), que se converte em COO− (aq) + H+ (aq) (Morrison e Boyd, 1992), presente no vinagre (ácido acético diluído, com um grupo COOH); e refrigerante, constituído principalmente por ácido cítrico (3 grupos COOH), ácido tartárico (2 grupos COOH), ácido benzoico (um grupo COOH) e ácido sórbico (um grupo COOH). O HCl e o H3 PO4 são exemplos de ácidos inorgânicos; já o ácido acético, ácido cítrico, ácido tartárico, ácido benzoico e ácido sórbico são exemplos de ácidos orgânicos. A amostra contendo NaOH 0.1 mol L−1 é uma base inorgânica, possui o grupo hidroxila (OH) e o metal alcalino sódio (Na), que em água dissocia em Na+ (aq) + OH− (aq). O etanol, uma base fraca pela presença do grupo OH, contém o oxigênio que com seus pares de elétrons não compartilhados conferem caráter básico ao etanol 46o GL. (Morrison e Boyd, 1992). A água sanitária tem caráter básico pela presença dos íons sódio e de cloro livre presente na constituição do hipoclorito de sódio (Jacques et al., 2015).
Durante a execução da atividade, os alunos demonstraram interesse investigativo, com afirmações e questionamentos como:
Estudante 1: «Então assim eu posso extrair pigmentos de plantas? Que legal!»
Estudante 2: «Esses indicadores naturais de pH apresentam colorações mais variadas que a fenolftaleína.»
Estudante 3: «Professora, eu posso fazer isso com outros vegetais ou plantas? Nossa! Eu vou fazer isso em casa!»
Estudante 4: «Professora, vamos testar outros indicadores?»
Estudante 5: «Eu adoro fazer esse tipo de prática, eu fico curiosa para saber qual a cor que cada planta vai apresentar.»
Essas afirmações e questionamentos demonstram como as atividades experimentais contribuem para o desenvolvimento de senso investigativo, crítico e científico dos estudantes, contribuindo para reflexões pautadas na metodologia científica.
Após o desenvolvimento deste projeto, podem ser propostas questões para discussão:
Quais as características de amostras ácidas, básicas e neutras?
Que é um indicador de pH?
Todos os indicadores de pH têm o mesmo comportamento?
Quais os cuidados que uma pessoa precisa ter quando manusear ácidos ou bases concentradas?
Qual o melhor método para saber se uma espécie é ácida ou básica na ausência de um pHmetro?
Elabore um texto a partir das experiências vividas no cotidiano que envolvem ácidos, bases e indicadores ácido-base.
Conclusões
Neste artigo, foi proposto um projeto de estudo utilizando produtos presentes no cotidiano dos estudantes para que as amostras fossem classificadas em ácidas, básicas ou neutras, a partir da extração de pigmentos naturais de cebola roxa, berinjela, repolho roxo e beterraba, que podem atuar com indicadores naturais de pH. Com essa atividade é possível: a) demonstrar que cada amostra tem um pH característico ‒ como exemplo, a solução de NaOH utilizada neste projeto, em concentração de 0.1 mol L−1, apresenta pH de 12.14 e apresenta coloração verde-musgo utilizando extrato de cebola roxa, amarela utilizando extrato de berinjela, verde-folha utilizando extrato de repolho roxo e vermelho intenso utilizando extrato de beterraba; b) pode-se caracterizar misturas ácidas e básicas por colorações distintas, dependendo do indicador de pH utilizado; c) abordar as regras de segurança em laboratório; d) contextualizar as características de cada amostra utilizada ‒ esse tipo de abordagem permite ao professor ressaltar as características de acidez e basicidade de diferentes amostras; e) e, ainda, ampliar o espaço de discussão a partir das vivências dos estudantes. Essa atividade contribui para que os estudantes possam relacionar a variação de cor do meio, na presença de um indicador, com a variação de pH. Esse projeto de estudo proposto destaca o que Morin afirma sobre a prática docente: «o conhecimento nunca é um reflexo ou espelho da realidade. O conhecimento é sempre uma tradução, seguida de uma reconstrução» (Morin, 2011). Além disso, os autores propõem o desenvolvimento de uma base de dados que utilize diferentes produtos naturais (legumes, tubérculos, folhas e flores, por exemplo) que apresentem sensibilidade a mudanças de pH do meio. Nesse sentido, os autores também convidam os leitores da Revista Educación Química para que contribuam nessa coleção.
Essa atividade, além de permitir discutir os conceitos de ácido e base, também ampliou a capacidade de contextualização do termo indicadores de pH e sua importância no cotidiano bem como na indústria.
Atenção durante o desenvolvimento do projeto de estudo
O NaOH e o HCl podem causar queimaduras graves na pele, nos olhos e nas mucosas. Se em contato direto com os olhos, causará até a perda da visão. O NaOH e o HCl concentrados devem ser manipulados pelo professor, que deve orientar os estudantes a utilizar os equipamentos de proteção adequados, como luvas, máscara, guarda-pó e óculos de proteção.
Recomenda-se que os legumes sejam picados pelo professor para evitar acidentes. Caso o professor prefira, ele pode trazer o indicador já pronto. No entanto, quando o aluno visualiza a obtenção do indicador alternativo, permite que novas discussões aconteçam, permitindo aos estudantes propor novas plantas para estudo, além de associar os conceitos com suas vivências.











 nueva página del texto (beta)
nueva página del texto (beta)






