Introducción
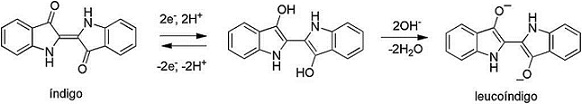
El índigo es uno de los colorantes más antiguos que se conocen: existen referencias a su uso en el Antiguo Egipto y en la época del Imperio romano. Más recientemente el índigo se ha usado para teñir de azul los "blue jeans", por mencionar un ejemplo de aplicación común. El colorante índigo propiamente dicho es insoluble en agua, lo que garantiza que no se elimine del tejido con los lavados. Sin embargo, este hecho impide, a su vez, la disolución y aplicación directa sobre el tejido virgen. En el caso del índigo se lleva a cabo la coloración del tejido mediante el procedimiento de tinción a la cuba. Dicho procedimiento convierte el índigo (azul, insoluble) en una forma soluble (e incolora) llamada leucoíndigo mediante reducción con el reactivo apropiado, todo ello dentro de una cuba en permanente agitación. En la figura 1 se pueden observar las fórmulas del índigo y leucoíndigo. Como reductores habituales se suelen utilizar ditionito sódico, sulfuro sódico o azúcares. A nivel industrial el ditionito sódico es el preferido, si bien existen trabajos de investigación que propugnan el uso de alternativas más respetuosas con el medio ambiente, como son la hidrogenación catalítica o los métodos electroquímicos (Roessler y Jin, 2003; Blackburn y Harvey, 2004; Vuorema et al., 2009; Hollmann, Arends y Holtmann, 2011; Xu, Li, Chu, Huang y Ma, 2014). Una vez que el colorante reducido se ha impregnado en la tela, tiene lugar el paso final de exposición a un oxidante (generalmente aire), con lo que la pieza se vuelve azul, dado que el leucoíndigo se transforma en índigo que queda fijado en el entramado de las fibras de la tela (Blackburn, Bechtold y John, 2009; Gilbert y Cooke, 2001; Clark, Cooksey, Daniels y Withnall, 1993).
Dado el carácter visual de las transformaciones que tienen lugar en la reducción y oxidación, esta reacción es muy interesante para usar en clases prácticas de Química Orgánica. En todos los casos descritos en la bibliografía, se menciona como denominador común la dificultad que reviste el paso de reducción del índigo. Este hecho ha sido constatado por nosotros en numerosas ocasiones, dado que esta reacción es habitual en las prácticas de laboratorio químico de la asignatura Química Orgánica II, de 2.° curso del Grado en Química de nuestra universidad. Con objeto de solventar dicha dificultad se han descrito en la bibliografía variantes procedimentales (Fernelius y Renfrew, 1983; McKee y Zanger, 1991; Roessler, Crettenand, Dossenbach, Marte y Rys, 2002; Blackburn y Harvey, 2004; Vuorema et al., 2009; Santhi y Moses, 2011; Park, Ryu, Seo y Hur, 2012; Bianda, Constenla, Haubrichs y Zaffalon, 2013). Una interesante modificación a escala de laboratorio propuesta por Boykin (1998) fue el empleo de un matraz kitasato aislado del aire mediante un tapón y una tetina de pipeta (con un corte para evitar la sobrepresión). En el trabajo ahora presentado hemos querido dar un paso más y proponemos una modificación adicional que permite mejorar el proceso de reducción y, por tanto, de tinción con índigo. El presente trabajo se enmarca dentro del ámbito de la docencia de la Química con colorantes orgánicos, tema de gran interés en la actualidad (Palácio, Alves y Borin da Cunha, 2012; Sosa y Zalts, 2012).
Resultados y discusión
El grupo de trabajo consistió en 28 alumnos (14 parejas de estudiantes) de la asignatura Química Orgánica II, los cuales siguieron un procedimiento común para la síntesis de la molécula de índigo, y posteriormente fueron divididos en 2 subgrupos, cada uno de los cuales llevó a cabo la reducción siguiendo un procedimiento diferente.
Fase 1
La práctica propuesta comienza con la obtención del índigo mediante una condensación aldólica cruzada, la reacción de Baeyer-Drewson (Fitton y Smalley, 1968, p. 13), la cual parte de 2-nitrobenzaldehído y acetona acuosa en medio básico, tal y como indica la figura 2 y se detalla en la parte experimental. Este primer paso de reacción es sencillo y suele llevarse a cabo sin dificultad por parte de los estudiantes. Los rendimientos de esta reacción son del orden del 70%.
Fase 2
En esta segunda fase se lleva a cabo la tinción de un trozo de tela de algodón mediante el índigo sintetizado en la fase 1, pero empleando 2 procedimientos experimentales diferentes. En todos los casos se introducen en un recipiente 200 mg de índigo y 2 mL de etanol que se mezclan hasta obtener una pasta con ayuda de un imán agitador para así poder mantener el sistema tapado y evitar el contacto con el oxígeno atmosférico.
Los estudiantes se dividen en 2 grupos, A y B. El grupo A realiza la experiencia usando un matraz kitasato, tapón y tetina de pipeta provista de abertura, es decir, siguiendo las recomendaciones de la bibliografía (Boykin, 1998)1. Por otro lado el grupo B realizó la experiencia usando un balón de fondo redondo de 50 mL, un tapón de tipo septum pinchado con aguja conectada a un globo. Los 2 montajes experimentales pueden verse en la figura 3. En ambos casos lo que se pretende es impedir la entrada de aire al sistema. La novedad del segundo montaje consiste en la utilización del recipiente con el menor volumen posible (un balón de fondo redondo de 50 mL) con lo cual se minimiza la cámara de aire en contacto con la disolución de índigo que se quiere reducir. Por otro lado, se introduce como novedad adicional el empleo de un globo (vacío) para compensar los aumentos de presión que pueden tener lugar por el desprendimiento de vapores durante el calentamiento de la disolución, en lugar de una tetina de pipeta con un corte (procedimiento descrito en la bibliografía), lo cual bloquea por completo la entrada de oxígeno del exterior.

Figura 3 Montaje experimental para los procedimientos A (kitasato) y B (balón de fondo redondo) descritos en esta práctica.
Tras la formación de la pasta de índigo se introduce el reductor, para lo cual se para la agitación, se retira el tapón y se añaden 3 mL de NaOH 2 M seguidos de 20 mL de ditionito sódico 0.2 M en agua. Se cierran los recipientes de nuevo y se inicia la calefacción. Al aumentar la temperatura se observa una decoloración de la mezcla líquida, de azul intenso a amarillento transparente, lo que corresponde al proceso de reducción y formación de leucoíndigo. Este cambio visual resultó ser problemático en anteriores experiencias, cuando no se empleaban recipientes cerrados, por la reoxidación causada por el oxígeno del aire: se necesitaba gran cantidad de tiempo y adición extra de reductor. Sin embargo, con los procedimientos A y B la reducción ocurre claramente con mayor facilidad, aunque con diferencias entre ambos. Con objeto de cuantificar dichas diferencias se procede a medir las temperaturas a las que tienen lugar los cambios de color en todos y cada uno de los matraces de reacción (tabla 1). Como puede observarse, la decoloración ocurre, en promedio, alrededor de 66 °C en el caso del procedimiento A, mientras que tiene lugar a 30 °C, en promedio, con el método B, es decir, una diferencia de 36 °C.
Tabla 1 Comparativa por parejas de las temperaturas de inicio y final de la reducción
| Método | Pareja | T inicial (°C) | T final (°C) |
|---|---|---|---|
| A | 1 | 80 | (a) |
| A | 2 | 68 | (a) |
| A | 3 | 70 | (a) |
| A | 4 | 50 | (a) |
| A | 5 | 60 | 84 |
| A | 6 | 60 | (a) |
| A | 7 | 73 | (a) |
| B | 1 | 20 | 80 |
| B | 2 | 35 | 80 |
| B | 3 | 26 | 80 |
| B | 4 | 37 | 80 |
| B | 5 | 35 | 80 |
| B | 6 | 25 | 80 |
| B | 7 | 31 | 80 |
(a) No se llega a apreciar con claridad el final de la reducción, ya que queda una ligera capa de índigo superficial sin reducir.
De manera ilustrativa, en la figura 4 se muestra la secuencia de imágenes típicamente observable en el caso del procedimiento de reducción propuesto en este trabajo.

Figura 4 Secuencia de imágenes correspondiente a la reducción de índigo (procedimiento B: en balón de fondo redondo de volumen reducido) en función de la temperatura del sistema.
Cuando las disoluciones están transparentes, se introduce un pequeño trozo de tela de algodón, el cual se mantiene totalmente sumergido en la disolución de índigo reducido (leucoíndigo) durante 30 min, a una temperatura constante de 90-100 °C. Se extrae la pieza de algodón y se lava con agua para arrastrar los posibles restos de índigo que no se hayan incorporado a las fibras de la tela, se seca con papel absorbente para eliminar el exceso de agua y se expone al aire para iniciar la oxidación del leucoíndigo a índigo, que quedará así depositado en la matriz de las fibras de la tela. En pocos minutos la tela se torna de color azul. Para completar la oxidación se introduce la tela en una estufa a 100 °C durante 5 min. La figura 5 muestra el resultado del teñido de 2 series representativas de telas, siguiendo los procedimientos A y B. Como puede observarse, en el caso del procedimiento B los teñidos son más homogéneos y no existen fallos, como sí ocurre con el método A.
Conclusiones
En el teñido con índigo por el método a la cuba el paso crítico es la reducción del colorante a su forma soluble (leucoíndigo). Se ha ensayado un procedimiento que mejora los resultados globales para la tinción con este colorante a nivel didáctico en una práctica de laboratorio de Química Orgánica. La innovación introducida consiste en el empleo de un balón de fondo redondo de dimensiones reducidas y el uso de un globo y una aguja para liberar la sobrepresión interior. En comparación con el procedimiento que emplea un matraz kitasato y una tetina de pipeta con una abertura, el nuevo método permite la reducción a temperaturas inferiores (30 °C vs. 66 °C) así como un teñido más homogéneo de las telas.
La mejora obtenida con los pequeños cambios realizados sobre el procedimiento habitual de reducción en sistema abierto puede ayudar a los estudiantes a visualizar y entender cómo enfocar los procesos de mejora de los procedimientos químicos para que sean más efectivos, a la vez que sostenibles.
Parte experimental
Fase 1: Síntesis de índigo
Procedimiento
En un erlenmeyer de 250 mL se disuelven 2 g de 2-nitrobenzaldehido en 40 mL de acetona, que posteriormente se diluye con 70 mL de agua destilada. Con ayuda de un agitador magnético se somete esta disolución a agitación vigorosa y se añaden lentamente 10 mL de NaOH 2 M. La disolución experimenta cambios de color: primero se vuelve amarillo claro y después se oscurece. En pocos segundos comienza la aparición de un precipitado de índigo. Se mantiene la agitación durante 5 min más y se filtra el precipitado obtenido (azul-violeta) en un embudo Büchner ayudados de vacío. El precipitado se lava con agua hasta que se observa que esta sale incolora y, después, con 40 mL de etanol. Se seca el precipitado en la estufa durante 15 min a 100 °C. Se pesa el sólido y se calcula el rendimiento.
Fase 2: Reducción de índigo a leucoíndigo
| Material |
| Matraz kitasato 100 mL |
| Tetina de pipeta |
| Tapón de caucho/corcho |
| Balón de fondo redondo |
| Septum |
| Globo |
| Agitador magnético |
| Placa agitadora/calefactora |
| Cristalizador grande |
Procedimiento
Tal como se ha descrito en el apartado de resultados y discusión, la reducción se realiza empleando 2 procedimientos experimentales distintos si bien las cantidades de índigo y de reductor son las mismas en ambos casos con el fin de que los resultados puedan ser comparados.
En el recipiente correspondiente se introducen 200 mg del índigo sintetizado en la fase 1, se añaden 2 mL de etanol y se mezclan hasta obtener una pasta con ayuda de un agitador magnético. De este modo se puede mantener el sistema tapado y evitar el contacto con el oxígeno atmosférico.
Tras la formación de la pasta de índigo se introduce el reductor: se para la agitación (para que no se incorpore oxígeno a la mezcla), se retira el septum y se añaden 3 mL de NaOH 2 M seguidos de una disolución de 0.6 g de ditionito sódico en 20 mL de agua, sin olvidar el plato poroso. Se tapan los recipientes de nuevo y se empieza a calentar la mezcla de reacción. Para conseguir una temperatura uniforme se emplea un baño de agua, utilizando un cristalizador como contenedor, ya que este sistema permite, además, tomar la lectura de la temperatura a la que ocurren los cambios de coloración asociados a la reducción. En este proceso se elimina la agitación magnética para evitar que el oxígeno de la cámara de aire, en contacto con la disolución a reducir, se incorpore a la mezcla y reoxide el leucoíndigo. Se calienta hasta que se observa desaparición del color azul y aparición de coloración amarillenta en la disolución, lo cual indica que la reducción se ha completado.
A continuación se explican de forma pormenorizada los puntos clave para operar con cada uno de los métodos.
Reducción con el método A (matraz kitasato; Boykin, 1998)
El montaje que se necesita para este procedimiento consta de un matraz kitasato provisto de una tetina de pipeta Pasteur que tape la salida lateral y un tapón de corcho que bloquee la boca del matraz, tal como se muestra en la figura 3A. A la tetina de pipeta se le ha practicado una incisión de aproximadamente 1 cm con el objetivo de que la presión generada en el interior del sistema pueda ser liberada y, además, quede limitada la admisión de aire. El tapón de corcho se envuelve con parafilm para asegurar que no pueda entrar aire por los poros que se observan en la superficie del corcho.
Reducción con el método B (balón de fondo redondo)
Para llevar a cabo este procedimiento se necesita un montaje como el de la figura 3B: un balón de fondo redondo tapado con un septum, lo cual asegura la estanqueidad del medio. Para garantizar que no existe sobrepresión en el interior del balón sin perder la estanqueidad del sistema, se acopla al septum un globo (vacío) mediante una aguja de jeringa. La aguja ofrece el canal de salida para liberar los vapores que se generan durante el calentamiento y la flexibilidad del globo permite contenerlos sin necesidad de que haya una abertura directa al exterior. La aguja se conecta al globo mediante un tubo de goma y las uniones en este segmento se refuerzan con parafilm para asegurar que no entra oxígeno del exterior.
Fase 3: Tinción de una pieza de algodón
Las disoluciones decoloradas obtenidas en la fase 2 se emplean en la tinción de una pieza de algodón. Para ello se abre el sistema, se introduce rápidamente un pequeño trozo de tela de algodón sumergiéndolo por completo en la disolución de índigo reducido (leucoíndigo). Se cierra de nuevo el sistema y se mantiene la tela sumergida durante 30 min a una temperatura de 90-100 °C. Tras ello se saca la pieza de algodón, se lava ligeramente con agua para arrastrar las partículas de índigo superficiales, se seca con papel absorbente para eliminar el exceso de agua y se deja al aire para oxidar el leucoíndigo. En pocos minutos la tela adquiere el color azul característico del índigo. La oxidación se completa introduciendo la tela en una estufa a 100 °C durante 5 min.











 nueva página del texto (beta)
nueva página del texto (beta)