Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.25 no.1 Ciudad de México ene. 2014
Didáctica de la química
El significado de las fórmulas químicas para estudiantes universitarios. El lenguaje químico como instrumento para la construcción de conocimiento
The meaning of chemical formulas for college students. Chemistry languaje as a tool for constructing knowledge
Andrea S. Farré,1 Santiago Zugbi 1 y M. Gabriela Lorenzo 1,2
1 Centro de Investigación y Apoyo a la Educación Científica (CIAEC), Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires. Argentina. Correo electrónico: asfarre@ffyb.uba.ar.
2 CONICET. Argentina. Correo electrónico: glorenzo@ffyb.uba.ar.
Fecha de recepción: 17 de noviembre de 2012.
Fecha de aceptación: 14 de febrero de 2013.
Resumen
En este trabajo nos propusimos investigar el impacto del lenguaje químico en los conocimientos previos de un tema central de la química orgánica, la estructura y reactividad del benceno. Diseñamos una tarea con preguntas abiertas y cerradas para indagar sobre diferentes aspectos del tema. Los estudiantes espontáneamente recurrieron a las fórmulas para responder las consignas principalmente de tipo abierta, lo que evidenciaría su uso como amplificador cognitivo. También se constató el condicionamiento del nivel simbólico sobre la interpretación submicroscópica. Sin embargo, todavía las fórmulas no se constituyeron en un instrumento de pensamiento, dada la limitación en la predicción de la reactividad. Estos resultados permiten replantear el punto de partida para la planificación de la enseñanza y reflexionar sobre la importancia de la apropiación del lenguaje a lo largo del aprendizaje de las ciencias.
Palabras clave: lenguaje químico, química orgánica, universidad, aprendizaje, conocimiento químico.
Abstract
In this work we decided to investigate the impact of the chemical language in previous knowledge of a central theme of organic chemistry, structure and reactivity of benzene. We designed a task with open and closed questions to study different aspects of this theme. Students spontaneously turned to formulas for answering open questions, so it evidenced its use as a cognitive amplifier. It was also found that symbolic level conditioned submicroscopic interpretation. However, formulas did not become an instrument of thought given students' limitations in predicting reactivity. These results permit us to raise again the starting point for planning teaching and reflect on the importance of the chemical language appropriation when learning science.
Keywords: chemical language, organic chemistry, university, learning, chemical knowledge.
Introducción
La enseñanza y el aprendizaje de la química orgánica en el nivel superior no han sido aún muy explorados (Bodner y Weaver, 2008), a pesar de que el primer curso universitario de la asignatura representa un obstáculo para la mayoría de los alumnos (Katz, 1996). Un origen posible de dicha dificultad se relaciona con la naturaleza de la química orgánica. Al igual que otras áreas de la química, requiere para su conocimiento de la capacidad de operar al mismo tiempo en diferentes niveles. El nivel macroscópico donde el químico trabaja simultáneamente con los fenómenos y las transformaciones que puede percibir directamente a través de los sentidos, utilizando el nivel simbólico para representar dichos cambios y un nivel submicroscópico para interpretar la reacción con la cual trabaja, es decir el mundo de las moléculas y átomos y las leyes que lo gobiernan (Johnstone, 1993, 2010). Tanto el nivel macroscópico como el subicroscópico corresponderían al plano ontológico, es decir al plano del objeto, y pueden ser descriptos en los planos lingüístico y matemático (Labarca, 2009). Pero, a diferencia de otras químicas, la química orgánica posee un enfoque eminentemente cualitativo (Hassan, Hill y Reid, 2004) y por lo tanto el nivel simbólico, perteneciente al plano lingüístico, resulta de vital importancia.
El lenguaje químico, como parte sustantiva del nivel simbólico, está constituido por un amplio vocabulario específico y por variados tipos de fórmulas y convenciones para representar sustancias, reacciones y mecanismos. Dicho lenguaje implica, por lo tanto, un complejo sistema de representación en permanente interacción con los modelos teóricos. Esta interacción se da en el seno mismo del lenguaje químico por la relación existente entre los niveles de abstracción creciente que lo conforman (Jacob, 2001). El primer nivel de abstracción (N1) es el simbólico, que corresponde a la simbología química utilizada para representar a las sustancias y las reglas formales que regulan su uso (ej: símbolos químicos, fórmulas y las ecuaciones químicas). El segundo (N2), el relacional, contiene el vocabulario apropiado para hablar sobre las sustancias, una especie de metalenguaje que incluye nuevos términos como abstractores (ej.: palabras como 'elementos' o 'compuestos'). El tercer nivel (N3), el modélico, incluye términos para usar y discutir sobre los abstractores, como parte de leyes, modelos y teorías en un contexto general (ej.: el lenguaje perteneciente a la teoría de las colisiones en la cinética química). Por último, el cuarto nivel (N4) es el epistémico que representa el lenguaje para la discusión epistemológica y filosófica de la química.
Es por tanto esperable que la distancia a recorrer entre el lenguaje cotidiano de los estudiantes hasta el lenguaje disciplinar (de la química orgánica en este caso) sea extensa y requiera de habilidades del profesor y del alumno para allanar ese camino. Esto es importante porque, el lenguaje químico al constituirse en mediador, es el que permite y condiciona la construcción de modelos y/o representaciones mentales de compuestos y reacciones, condición necesaria para el aprendizaje de la química en el nivel submicroscópico. Al mismo tiempo, como todo sistema de representación externa, se transforma en un amplificador cognitivo y un instrumento de pensamiento. Por lo tanto, habrá que tener en cuenta los procesos a través de los cuales los estudiantes aprenden a reconocer y a usar fórmulas particulares y las dificultades que comprende dicho aprendizaje (Lorenzo y Pozo, 2010).
En este marco, y entendiendo que el aprendizaje depende de los conocimientos previos, nos propusimos investigar la forma en que los alumnos se han apropiado previamente a la clase, de ciertas representaciones propias del lenguaje químico, principalmente del nivel simbólico (N1), en un tema central de la química orgánica como lo es el de los compuestos aromáticos.
Metodología
Escenario de la investigación. La asignatura Química Orgánica I es un curso cuatrimestral, que se imparte de agosto a diciembre en el segundo año de las carreras de Farmacia y Bioquímica. Las clases se dividen en teóricas, no obligatorias dictadas para todos los alumnos inscriptos en la materia y de resolución de problemas o seminarios, obligatorios, en las que los alumnos son divididos en grupos de clase o comisiones. Cada seminario tiene un temario prefijado con anterioridad el cual es conocido por los alumnos, así como una guía de ejercitación común con la cual se desarrollan las clases.
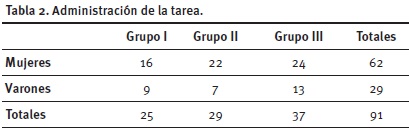
Participantes. En trabajos anteriores se validaron la homogeneidad y representatividad de las comisiones (Lorenzo, 2001) para trabajar con muestreo por conglomerados. Consecuentemente, elegimos al azar tres de un total de catorce. Participaron voluntariamente un total de 91 estudiantes (62 mujeres y 29 varones) que cursaban por primera vez la asignatura Química Orgánica I en la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires (http://www.ffyb.uba.ar). Los participantes tenían una edad promedio de 21 años.
Tarea. Diseñamos una actividad de lápiz y papel en la que se preguntaba sobre diez diferentes aspectos del tópico estructura y reactividad del benceno cuyos enunciados se diferenciaban en la modalidad de respuesta: cerradas (de reconocimiento) y abierta de respuesta corta (tabla 1). Dado que necesariamente un enunciado de respuesta cerrada indaga sobre un único aspecto decidimos duplicarlas en relación al número de preguntas de respuestas abiertas. En la tarea los enunciados fueron incluidos en orden alfabético.
Procedimiento. La tarea se aplicó al inicio de la sesión correspondiente al tema "Compuestos Aromáticos I" (clase n° 7 de un total de catorce). En cada grupo de clase se administraron aleatoriamente las tres modalidades de preguntas, quedando conformados tres grupos (tabla 2).
Diseño y análisis de datos. Dada la limitación del tiempo disponible para la aplicación de la encuesta en horario de clase, realizamos un diseño experimental intersujeto, teniendo en cuenta las respuestas de los tres grupos de acuerdo con el aspecto sobre el que se respondía. El tratamiento cuantitativo de los datos se realizó utilizando el test Chi cuadrado de Pearson para variables nominales (prueba de independencia entre variables).
Resultados y discusión
1. Composición: El 76,9% de los alumnos respondieron correctamente las consignas que evaluaban el conocimiento sobre la composición del benceno, y lo hicieron independientemente del grupo de pertenencia (χ2(4): 9,11, p > 0,05). En todos los casos los errores se presentaron en el número de hidrógenos y no en el número de carbonos, es decir que cuanto más simplificado sea el trazo de las fórmulas químicas, incluyen mayor contenido implícito y por tanto mayor es la dificultad para la apropiación de su significado.
Especialmente el grupo III (respuesta abierta) empleó la fórmula molecular del benceno, C6H6 (57,1%) o símbolos químicos (5,7%) en su respuesta, lo que muestra cierto grado de apropiación del lenguaje químico. Además, en el 13,5% de las respuestas del grupo III, los alumnos utilizaron fórmulas desarrolladas o de líneas de enlace (figura 1); aunque no todos lo hicieron correctamente. Por ejemplo, algunos que escribieron la fórmula de Robinson (figura 1, Alumno 27) e indicaron mal el número de hidrógenos. Por lo tanto para estos alumnos la escritura de la representación no se constituyó un amplificador cognitivo, es decir no representó una ayuda para ellos.
2. Hibridación de los átomos de carbono: La mayoría de los estudiantes (65,9%) respondieron correctamente a la pregunta sobre la hibridación de los átomos de carbono independientemente de la modalidad de pregunta (χ2(6): 6,2, p > 0,05). En este caso, los alumnos fueron capaces de aplicar un conocimiento previo adquirido probablemente en materias anteriores y/o en las clases previas de química orgánica. No obstante, un alto porcentaje de las respuestas incorrectas (41,9%) correspondió a la falta de respuesta (NS/NC) y tampoco se empleó ningún tipo de fórmula para responder sobre este aspecto.
3. Tipos de enlace presentes entre los átomos de carbono: En este caso se observó con claridad la importancia de la redacción de los enunciados y la modalidad de respuesta (χ2(6): 19,05, p < 0,05). Además, se evidenció el hecho de que las fórmulas pueden condicionar la interpretación submicroscópica. A pesar de que estrictamente no puede considerarse que en el benceno existan distintos tipos de enlaces entre los átomos de carbono, debido a su estructura resonante, una de las formas habituales de representación recurre a dos fórmulas de Kekulé relacionadas con una flecha de doble punta. Esto implicaría un obstáculo para la comprensión de la estructura del benceno debido a la posible confusión entre fórmula y estructura de un compuesto algo que comúnmente sucede por el carácter modélico de las fórmulas. En este sentido, solamente los alumnos del grupo II, quienes respondieron sobre si las uniones entre átomos de carbono tenían un carácter parcial de doble enlace, fueron los que pudieron reconocerla como correcta en un 48,3%. En los otros casos, cuando la modalidad de respuesta fue cerrada y se indicaba que el benceno posee tres dobles y tres simples enlaces conjugados (grupo I), el 64,0% de los alumnos estuvieron totalmente de acuerdo con esta afirmación. En forma similar, el 83,8% de los alumnos del grupo III indicaron que el compuesto posee tres dobles enlaces.
4. Longitud de enlace C-C: La mayoría de los estudiantes (65,9%) tuvieron dificultades al enfrentarse a las preguntas sobre la longitud del enlace entre los átomos de carbono en una molécula de benceno. Además, nuevamente existió una diferencia significativa en las respuestas de acuerdo con su modalidad (χ2(6): 32,96, p < 0,0001). Si bien la mayor parte de los estudiantes (60,0%) del grupo I pudieron reconocer como correcta que la longitud de enlace entre los átomos de carbono del benceno es intermedia comparada con la de una unión simple y una doble, los alumnos del grupo II que debían responder de manera contraria, demostraron mayores dificultades (31,0% de respuestas correctas). Por último, ante la pregunta de respuesta abierta (grupo III) solamente el 18,9% mencionó la longitud de enlace intermedia entre una unión doble y una simple característica del benceno. Tampoco en este caso los alumnos emplearon fórmulas para responder en las distintas modalidades de preguntas.
5. Geometría de la molécula de benceno: Al igual que en el caso anterior, la mayoría de los alumnos (61,5%) no respondieron correctamente con una asociación significativa entre las respuestas de los alumnos y el grupo de pertenencia (χ2(6): 13,51, p < 0,05). Para ellos resultó más fácil reconocer la planaridad de la molécula (56,0%, grupo I), e indicarlo explícitamente (35,1%, grupo III), que reconocer la coplanaridad entre los átomos de hidrógeno y de carbono (27,6%, grupo II). Esto pudo haber sido así, porque visualizar los átomos de hidrógeno en la molécula del benceno requiere una representación mental más completa de la molécula y esto podría estar influenciado por las fórmulas que generalmente no poseen los hidrógenos explícitamente representados.
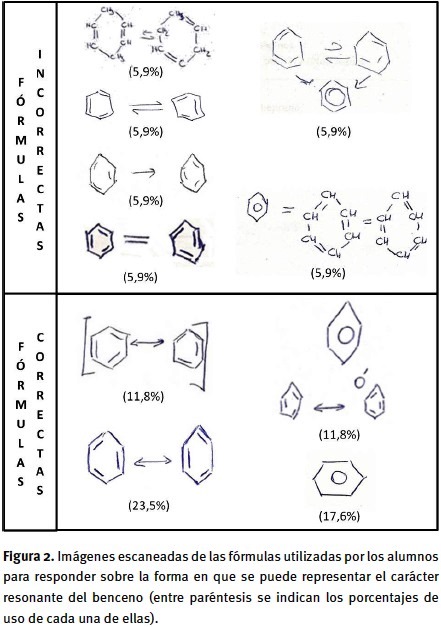
6. Fórmulas del benceno: Al preguntar sobre los distintos tipos de fórmulas del benceno, también se obtuvieron diferencias significativas según el grupo de pertenencia (χ2(6): 18,55, p < 0,05). La mayor proporción de respuestas correctas correspondió a la pregunta de respuesta abierta (62,2%, grupo III), seguidos de los del grupo I (56,0%) y por último el grupo II con un porcentaje bastante menor (31,0%). El 54,1 % del total de los estudiantes del grupo III relacionaron la existencia de distintas formas de representar al benceno con la necesidad de simbolizar la deslocalización electrónica y en especial con la posibilidad de representar la resonancia (40,5%). Por lo tanto, la mayor parte de los alumnos pudo explicitar y también reconocer la deslocalización electrónica en las fórmulas del benceno. En cuanto su utilidad para el planteo de mecanismo de reacción, los estudiantes mostraron un conocimiento menor. Por lo tanto, para los alumnos las fórmulas del benceno representan principalmente la resonancia y en menor medida, la reactividad. Esto último puede deberse a que pensar en la reactividad a partir de la fórmula del benceno implica ir más allá del sentido convencional y requeriría operar a un nivel conceptual (Postigo y Pozo, 2000) de mayor complejidad y que no forma parte de los conocimientos previos de los alumnos. Además, el 13,5% de los alumnos del grupo III (respuesta abierta), al mismo tiempo de indicar que la causa de la existencia de distintas formas de representar al benceno se debía a la resonancia o al movimiento de electrones, utilizaron también fórmulas para complementar y/o justificar lo expresado verbalmente. Hicieron uso, en este caso, de las fórmulas de Kekulé (separadas o relacionadas con flechas que indican equilibrio entre las estructuras) y/o Robinson, algunas de las empleadas también para responder sobre el significado de la resonancia (figura 2).
7. Características del benceno: A la pregunta de respuesta abierta (grupo III), los alumnos manifestaron en su mayoría no saber o no contestaron (64,9%). En el caso de que mencionaran características o propiedades, en su mayoría fueron correctas (20 de 23) y pudieron ser agrupadas en tres categorías relacionadas con: a) criterios estructurales, electrónicos y termodinámicos concernientes con las teorías de enlace (52,2%, por ejemplo su aromaticidad, la estabilidad energética o características ligadas a la deslocalización electrónica), b) propiedades químicas del compuesto (26,1%, por ejemplo su baja reactividad, que da reacciones de sustitución o las características de los productos que se obtienen en estas reacciones) y c) propiedades físicas y características relacionadas con su uso (21,7% por ejemplo su toxicidad). Además, la mayoría fue capaz de nombrar sólo una propiedad (46,2%) y nunca más de tres.
Frente a las preguntas de respuesta cerrada, los alumnos lograron asociar al benceno como un compuesto aromático (100% del grupo I) y en menor medida como una sustancia descripta mediante estructuras resonantes (55,2%, grupo II). Sin embargo, no supieron responder sobre la causalidad o no de estas dos características ya que el 69% de las respuestas del grupo II fueron incorrectas principalmente porque los alumnos manifestaron su desconocimiento (41,4%). Tampoco poseían una representación mental clara del concepto de resonancia y sus diferencias con el equilibrio químico ya que solamente un 20,0% de los alumnos del grupo I estuvo en total desacuerdo con que el benceno al ser un híbrido de resonancia está formado por dos estructuras que se encuentran en equilibrio. Es decir, que a pesar de que el concepto de resonancia lo han ido construyendo desde materias anteriores en la carrera y en la propia asignatura, los alumnos todavía no han podido diferenciarlo del concepto de equilibrio químico y mantienen concepciones erróneas sobre el mismo. Esto es consistente con el tipo de representaciones que luego utilizan para representar el carácter resonante como se verá en el siguiente punto.
8. Significado de la resonancia: El 28,6% del total de los alumnos respondieron correctamente cuando se les preguntó sobre el significado de la resonancia aunque existieron diferencias significativas en las respuestas de los diferentes grupos χ2(3): 16,81, p < 0,05). El 55,2% del grupo II pudo reconocer que la resonancia no se debe a la dispersión de electrones o pero solamente el 8,0% de los alumnos del grupo I estuvo en total desacuerdo con que en la resonancia existe un movimiento de electrones π que hace que se interconviertan las estructuras canónicas del híbrido. De hecho, en este caso los alumnos que se enfrentaron a la pregunta de respuesta abierta se desempeñaron mejor que los alumnos del grupo I (21,6%, grupo III).
Al analizar las respuestas incorrectas, un alto porcentaje de las del grupo I (47,8%), del grupo II (69,2%) y del III (44,8%) correspondieron a estudiantes que manifestaron no saber o no contestaron. Además, el 43,5% de las respuestas incorrectas del grupo I y el 48,3% del grupo III se debieron a errores en conceptos químicos. En el grupo I las respuestas erróneas se debieron al total acuerdo con la existencia en la resonancia de un movimiento de electrones π que implica la interconversión de las estructuras resonantes. Esto refuerza los resultados obtenidos en el apartado anterior sobre la confusión existente entre resonancia y equilibrio químico.
Los errores que se presentaron en el grupo III corresponderían a lo que Ferguson y Bodner (2008) han denominado la incapacidad de aplicar o entender. Por ejemplo se encontraron como causas de la resonancia: a) cambio conformacional (3,4%), b) rotación de dobles enlaces (6,9%), c) dispersión de cargas positivas (6,9%), d) electrones libres (6,9%), e) deslocalización de orbitales p vacíos u ocupados o unión de orbitales p libres (10,3%), f) estado de transición (3,4%). Las dos primeras (a y b) surgirían de la extensión de aspectos ligados a la estereoquímica, el tema precedente en la secuenciación de las clases de la materia. Al indicar la dispersión de la carga positiva (c) como causa de la resonancia estarían confundiendo la estabilización de los carbocationes con que un carbocatión o una carga positiva impliquen la fuerza impulsora. De la misma manera los alumnos que refirieron que la causa de la resonancia eran los pares de electrones libres (d) también podrían estar indicando que estos electrones son la fuerza propulsora de la misma y lo confunden con que los pares de electrones libres pueden tenerse en cuenta al escribir las distintas estructuras resonantes. En algunos casos existieron confusiones indicándose que la deslocalización era de orbitales p y no de electrones, confusión que fue más grave cuando se decía que los orbitales p estaban vacíos o libres (e), lo que sugiere que al apropiarse del lenguaje confundieron términos que a ellos les resultaban similares. Por último, también se atribuyó la causa de la resonancia a los estados de transición (f), esto también puede deberse a una confusión de términos que no pueden diferenciar como estado de transición e intermediario y con la posibilidad de estabilización por resonancia de algunos intermediario de reacción, entonces estaríamos frente a un error similar a los efectuados por quienes indicaron que la causa eran la dispersión de la carga positiva o los electrones libres.
9. Representación de la resonancia: Solo el 30,8% contestó correctamente a esta pregunta y no se hallaron diferencias significativas en las respuestas de los distintos grupos (χ2(6): 4,01, p > 0,05) ni tampoco según la modalidad de respuesta (cerrada y abierta, χ2(3): 3,77, p > 0,05). Sin embargo, es destacable que todos los alumnos del grupo III, y solamente ellos (ninguno de los otros dos grupos), que contestaron lo hicieron representando la resonancia mediante distintos tipos de fórmulas. Como puede observarse en la figura 2, los alumnos del grupo III relacionaron el carácter resonante principalmente con algún tipo de relación entre las dos estructuras de Kekulé. Para ello utilizaron el signo igual indicando una probable relación de equivalencia de estructuras o distintos tipos flechas que pueden interpretarse como de equilibrio, reacción completa o resonancia. Es importante mencionar que a todos los estudiantes les resultó difícil explicar verbalmente o reconocer la explicación de un procedimiento como la representación de la resonancia. Esto se evidencia en que todos los alumnos del grupo III recurrieron a formular y no explicitaron el procedimiento y solamente alrededor de un 30% pudo reconocer el procedimiento puesto en palabras.
10. Reactividad: Se encontró una asociación significativa entre la modalidad de pregunta y las respuestas obtenidas (χ2(6): 14,33, p < 0,05). Resultó ser significativamente más frecuente que los alumnos acordaran con que el benceno reacciona con electrófilos (37,9%, grupo II) que reconocerlo como un nucléofilo (24,0%, grupo I). Asimismo, solamente el 10,8% de los alumnos frente a la pregunta abierta indicaron que el benceno reacciona con los electrófilos o que interviene en reacciones de sustitución electrofílica aromática. En todo caso, la mayoría de los alumnos respondieron incorrectamente (81,3% del total de las respuestas) y esto principalmente se debió a que manifestaron su desconocimiento o no respondieron (53,9% del total de las respuestas incorrectas).
La mayor cantidad de errores se presentó en el grupo I, quienes no solamente no fueron capaces de reconocer al benceno como un nucleófilo sino que en muchos casos indicaron estar totalmente desacuerdo con esta afirmación (28,6% de las respuestas incorrectas del grupo).
Si bien el concepto de reactividad (tipos de reactivos, mecanismos de reacción) han sido trabajados de manera general y aplicados a otras familias de compuestos (por ejemplo, alquenos), los resultados obtenidos evidencian un conocimiento muy pobre sobre la reactividad del benceno antes de la clase y ponen de manifiesto las dificultades para la transferencia de conceptos.
El análisis de las respuestas mostró que los estudiantes espontáneamente recurrieron a las fórmulas para responder a las preguntas abiertas, lo que evidenciaría su uso como amplificador cognitivo. También se constató el condicionamiento del nivel simbólico (fórmula de Kekulé) sobre la interpretación submicroscópica tanto en la presencia de dobles enlaces conjugados como al entender la resonancia como un equilibrio. Sin embargo, todavía las fórmulas no se constituyeron en un instrumento de pensamiento, dada la limitación en la predicción de la reactividad.
Conclusiones e implicaciones
Estos resultados permiten replantear el punto de partida para la planificación de la enseñanza y la importancia de la apropiación del lenguaje a lo largo del aprendizaje de las ciencias.
Uno de los puntos importantes que surgen de este trabajo y que nos debería llevar a reflexionar sobre las estrategias de enseñanza es justamente el condicionamiento que implica la fórmula sobre el modelo mental que pueda generar el alumno. Para ellos la fórmula se constituye en la estructura y no en una representación icónica y simbólica de la misma debido al carácter modélico de la primera. Dicho carácter comenzó a construirse hacia mediados del siglo XIX, en el seno de la teoría estructural, en donde las hipótesis de estructura eran presentadas como fórmulas, algunas de las cuales, para el caso del benceno, resignificadas y modificadas continúan utilizándose hasta nuestros días (Farré y Lorenzo, 2012).
Otro punto importante es que, a pesar de que los alumnos fueron capaces de relacionar la fórmula con la estructura al punto de confundirla, les resulta difícil reconocer la reactividad del compuesto en ella. Es decir la fórmula no se constituye todavía en un instrumento de pensamiento. Además, en general reconocen más fácilmente pensar en los reactivos capaces de reaccionar con determinado sustrato que en las características del sustrato en sí. Esto podría relacionarse con la forma en que se denominan las reacciones y los mecanismos en química orgánica. Esta forma de nombrar puede estar dirigiendo la atención de los alumnos hacia las características de los reactivos y no al sustrato. Por lo tanto, se hace necesaria la reflexión sobre las características tanto de sustratos y reactivos al presentar el tema en las clases.
Por último, una vez más se evidencia la importancia de la redacción de las preguntas y enunciados. Si como docentes intentamos que los alumnos aprendan a emplear fórmulas, las preguntas de tipo abierto resultan ser las mejores ya que de este modo los alumnos pueden apropiarse de ellas principalmente como amplificadores cognitivos. Sin embargo, las fórmulas que utilicen nunca se apartarán de los significados que les den. Por lo tanto, la enseñanza no debería basarse en trabajar únicamente con fórmulas independientemente de su significación.
En cuanto a las implicaciones de nuestros resultados, este trabajo ilustra, sobre la necesidad de una correcta secuenciación de los contenidos, especialmente cuando se representan en el nivel simbólico, desde lo más explícito hacia lo más implícito para favorecer una apropiación del significado de la representación que permitan alcanzar el nivel de procesamiento conceptual. Así también, anticipar la transferencia de un concepto macro a distintos contextos particulares dado que no resulta obvia ni automática. Esto implica una responsabilidad a la hora de planificar las clases de química orgánica en la universidad.
Referencias
Bodner, G., y Weaver, G., Research and practice in chemical education in advanced courses. Chemistry Education Research and Practice, 9(2), 81-83, 2008, consultada por última vez en julio, 6, 2012 de la URL http://pubs.rsc.org/en/content/articlelanding/2008/RP/b806596a. [ Links ]
Farré, A. S. y Lorenzo, M. G., De la construcción del conocimiento científico a su enseñanza. Distintas explicaciones sobre la estructura del benceno, Educación Química, 23 (número extraordinario 2), 1-9, 2012, consultada por última vez en julio, 6, 2012 de la URL http://www.educacionquimica.info/articulos.php?Id_articulo=1319. [ Links ]
Ferguson, R. y Bodner, G., Making sense of the arrow-pushing formalism among chemistry majors enrolled in organic chemistry, Chemistry Education Research and Practice, 9(2), 102-113., 2008, consultada por última vez en julio, 6, 2012 de la URL http://pubs.rsc.org/en/content/articlelanding/2008/RP/b806225k. [ Links ]
Hassan, A., Hill, R. y Reid, N., Ideas underpinning success in an introductory course in organic chemistry, University Chemistry Education, 8(2), 40-51, 2004, consultada por última vez en julio, 6, 2012 de la URL http://www.rsc.org/images/p2_reid_tcm18-31146.pdf. [ Links ]
Jacob, C., Analysis and synthesis. Interdependent operations in chemical language and practice. HYLE. An International Journal for Philosophy of Chemistry, 7(1), 31-50, 2001, consultada por última vez en julio, 6, 2012 de la URL http://www.hyle.org/journal/issues/7/jacob.htm. [ Links ]
Johnstone, A. H., The development of chemistry teaching: A changing response to changing demand, Journal of Chemical Education, 70 (9), 701-705, 1993. [ Links ]
Johnstone, A. H., You can't get there from here, Journal of Chemical Education, 87 (1), 22-29, 2010. [ Links ]
Katz, M. Teaching Organic Chemistry via student-directed learning: A technique that promotes independence and responsibility in the student, Journal of Chemical Education, 73(5), 440-445, 1996. [ Links ]
Labarca, M., Acerca de la naturaleza de la química: Algunos comentarios, Educación en la Química, 15(2), 89-102, 2009. [ Links ]
Lorenzo, M. G., Química Orgánica: Su enseñanza y aprendizaje en la Universidad, Tesis Doctoral, Cátedra de Química Orgánica I, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, 2001. [ Links ]
Lorenzo, M. G., Pozo, J. I., La representación gráfica de la estructura espacial de las moléculas: eligiendo entre múltiples sistemas de notación, Cultura y Educación, 22(2), 231-246, 2010. [ Links ]
Postigo, Y. y Pozo, J. I., Cuando una gráfica vale más que 1.000 datos: la interpretación de gráficas por alumnos adolescentes, Infancia y Aprendizaje, 90, 89-110, 2000. [ Links ]