Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.23 no.1 Ciudad de México ene. 2012
Didáctica de la Química
Termoquímica: validez de la definición del cambio de entalpía aplicado a una reacción química
Thermochemistry: validity of the definition of enthalphy change of chemical reaction
Héctor E. Gsponer*
* Departamento de Química. Facultad de Ciencias Exactas, Físico-Químicas y Naturales. Universidad Nacional de Río Cuarto, Argentina. Correo electrónico: hgsponer@exa.unrc.edu.ar
Fecha de recepción: 9 diciembre 2010
Fecha de aceptación: 19 mayo 2011
Resumen
Se examina la validez de la definición de cambio de entalpía de una reacción química. En primer lugar se discuten conceptos fundamentales, tales como las primeras dos leyes de la termodinámica, para que se comprendan algunas ecuaciones derivadas de ellas. A continuación se analiza la aplicación de estos conceptos a las reacciones químicas que tienen lugar a presión constante. A partir de este análisis se concluye que las características de la reacción investigada en un experimento termoquímico son de crucial importancia para interpretar el calor que evoluciona o absorbe la reacción en cuestión. De aquí que deba tomarse en cuenta la posibilidad de intercambio de trabajo útil entre el sistema y los alrededores, adicionalmente al calor de reacción a presión constante.
Palabras clave: Termodinámica, cambio de entalpía, reacción química, trabajo útil.
Abstract
In this communication we have examined the validity of the definition of enthalpy change of a chemical reaction. In the first place, we have discussed fundamental concepts such as the first and the second laws of thermodynamics in order to understand some derivations from them. Next, we analyzed the application of these concepts to chemical reactions that take place at constant pressure. From this analysis, it can be concluded that the characteristics of the reaction being investigated in a thermochemical experiment are of paramount importance for interpreting the heat of the measured reaction. Hence, it should be taken into account the possibility of useful work exchange among the system and the surroundings in addition to the reaction heat at constant pressure.
Keywords: thermodynamics, enthalpy change, chemical reaction, useful work.
Introducción
Una meta esencial en la enseñanza de las ciencias es educar científicamente al ciudadano en un mundo cada vez más tecnológico. Es por lo tanto muy importante una buena formación en el tema de la energía si queremos que llegue a tomar decisiones bien fundamentadas. También se conoce y es generalmente aceptada la necesidad de realizar trabajos de laboratorio en la enseñanza de ciencias experimentales. Experimentos relacionados con el cambio de entalpía (ΔH) en procesos físicos y químicos son comúnmente descritos en libros de trabajos prácticos de laboratorio (Palmer, 1966). Por otra parte, es frecuente encontrar en textos de estudio deficiencias en la enseñanza de Termodinámica y Termoquímica de nivel introductorio. Una revisión sobre la presentación de estos temas en un número importante de libros de texto de nivel intermedio y universitario ha sido publicada (Furió, Solbes y Furió, 2005).
En este trabajo nos interesa discutir principalmente el enunciado de la primera ley de la Termodinámica y las derivaciones que pueden hacerse de ella teniendo en cuenta las condiciones experimentales en que se lleva a cabo el cambio de estado del sistema. Discutiremos la aplicación a reacciones químicas, en particular el caso de las reacciones que se producen a presión constante.
En general, en cuanto a condiciones experimentales que controlan el cambio de una propiedad termodinámica, lo primero que se discute en los libros de estudio (Chang, 1993; Glasstone, 1962) es la equivalencia que se produce en un proceso a volumen constante entre el cambio de energía interna del sistema (ΔU) y el calor intercambiado (QV).
ΔU = QV (1)
Por el contrario, cuando el cambio de estado del sistema ocurre con cambio de volumen pero a presión constante se asocia el calor intercambiado (QP) con el cambio de entalpía del sistema (ΔH).
ΔH = QP (2)
En ambos casos es posible medir el calor desarrollado en el proceso, QV o QP, en un experimento calorimétrico.
Con respecto al cambio de entalpía, nos preguntamos: ¿se tiene en cuenta la validez de la definición de ΔH cuando se analiza el calor intercambiado por un sistema en el que ocurre una reacción química a presión constante?
La respuesta a esta pregunta es de fundamental importancia, dado que hay en la bibliografía una gran variedad de experimentos de calorimetría, muchos de los cuales son simples, de sencillo diseño y de mínimo requerimiento de material e instrumentos de laboratorio (Brouwer, 1991; Harms y Lehman, 1993; Jansen, 1997; Marzzacco, 1999; Palmer, 1966). En estos trabajos, y como generalmente ocurre en trabajos sobre el tema, se destaca la parte experimental de la calorimetría y no se discute con detalles la equivalencia entre el calor a presión constante medido y el ΔH del proceso.
Por todo lo anterior, es importante destacar que el análisis conceptual correspondiente a esa equivalencia (ecuación 2) debe ser muy claro para lograr una mejor comprensión de las aplicaciones de la primera ley de la Termodinámica.
No haremos en este trabajo un desarrollo temático que nos permita introducir la primera y segunda ley de la Termodinámica, simplemente revisaremos sus enunciados y las derivaciones que pueden hacerse de los mismos. La presentación de estos temas pueden consultarse en libros de texto de Química General y de Fisicoquímica (Chang, 1993; Glasstone, 1962; Glasstone, 1966).
Desarrollo y discusión
Primera ley, cambios de energía interna y de entalpía
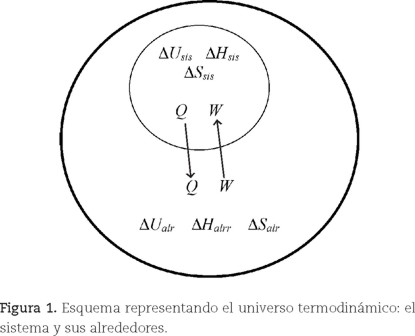
En la figura 1 se muestra un esquema de dos círculos, con el círculo menor —contenido en el mayor— representando al sistema (sis) y el mayor a los alrededores del sistema (alr). La circunferencia del círculo menor representa la pared del sistema a través de la cual intercambia calor y/o trabajo con los alrededores. El universo termodinámico (sistema + alrededores) constituye por definición un sistema aislado, y en esta figura se representa el aislamiento con una línea más gruesa en la circunferencia mayor. Para el sistema y sus alrededores se inscriben en los respectivos círculos los posibles cambios de propiedades termodinámicas como ΔU, ΔH y ΔS. Para el universo termodinámico la ecuación energética que representa a la primera ley de la Termodinámica puede aplicarse tanto al sistema como a los alrededores e implica que la variación de su energía interna se debe al intercambio de calor y/o trabajo, lo cual se expresa en la siguiente ecuación:
ΔU = Q + W (3)
En cuanto a la convención de signos, dado que el sistema termodinámico es el objeto de estudio, se puede tomar como referencia, y de esta manera aplicar la convención de signos siguiente: si el sistema gana energía como Q y/o W, éstos son positivos, mientras que si el sistema cede energía a los alrededores, los signos de Q y/o W son negativos. La combinación de los signos de Q y W proporcionan el signo para ΔU (ΔU < 0 el sistema cedió energía a los alrededores como Q y/o W, mientras que si ΔU > 0, el sistema absorbió energía de los alrededores).
De acuerdo a la primera ley de la Termodinámica, la energía en el universo termodinámico es constante (Uuniv = cte, o bien ΔUuniv = 0, principio de conservación de la energía) ya que el universo termodinámico es un sistema aislado, y por lo tanto
ΔUsis + ΔUalr = ΔUuniv = 0 (4)
o bien:
ΔUsis = −ΔUalr (5)
Supongamos que dentro del sistema en estudio ocurre una reacción química y que en el transcurrir de la reacción no se produce cambio de presión (P). De esta forma la presión del sistema será igual en todo momento a la presión exterior (Pext), la presión que ejercen los alrededores sobre el sistema. Por lo tanto P = Pext y se dice que hay equilibrio mecánico entre el sistema y los alrededores.
Aplicación de la primera ley de la Termodinámica en procesos químicos: termoquímica
La termoquímica es una rama de la Termodinámica experimental que estudia el intercambio de energía como calor que experimenta cualquier proceso químico. La vasija de reacción y su contenido forman el sistema, y la reacción química que se produce resulta en un intercambio de energía entre el sistema y los alrededores. Como ya se mencionó, con la técnica de calorimetría se puede medir el calor producido o absorbido por la reacción, y se puede identificar Q con un cambio de energía interna (si la reacción ocurre a volumen constante, ver ecuación (1)) o un cambio de entalpía (si la reacción ocurre a presión constante, ver ecuación (2)). Inversamente, si se conoce ΔU o ΔH de una reacción, se puede predecir el calor desarrollado por la reacción.
Si ejemplificamos la reacción química que ocurre en el sistema como,

y se lleva a cabo en un calorímetro, nos podemos preguntar si el "calor de reacción a presión constante" (QP) que medimos en el experimento de calorimetría, será una medida del cambio de alguna propiedad termodinámica del sistema químico, es decir de la reacción química que transforma A en B.
Para analizar este punto recurrimos a la ecuación (3). Es evidente de la ecuación (3) que haciendo mediciones del calor y el trabajo intercambiado por un sistema, se puede conocer el correspondiente ΔUsis. En el caso de P constante se reescribe la ecuación (3) como,
ΔUsis = QP + WP (6)
donde WP es el trabajo total intercambiado a P constante, que corresponde al trabajo de expansión-compresión (WPV) y el trabajo útil (Wútil).
WP = WPV + Wútil (7)
El trabajo útil —a veces llamado trabajo de no-expansión-compresión— es, por ejemplo, el trabajo que se hace en una pila o celda electroquímica. En este caso el trabajo útil es un trabajo eléctrico —o trabajo electroquímico— que se produce como consecuencia de que ocurre una reacción redox en la pila. Otros tipos de trabajo útil son el trabajo de superficie y el trabajo magnético (Moore, 1972; Atkins y de Paula, 2002).
El trabajo de expansión-compresión a P constante se debe a un cambio de volumen (ΔV) y se puede calcular como −PΔV. En realidad el trabajo de expansión-compresión se hace contra la presión externa y se debe calcular como −Pext ΔV, pero como se vio anteriormente, en condiciones de equilibrio mecánico P = Pext. El signo negativo se debe a que cuando el trabajo es realizado por el sistema (trabajo negativo para el sistema), el ΔV correspondiente es positivo, mientras que cuando los alrededores hacen trabajo sobre el sistema (trabajo positivo para el sistema) el ΔV correspondiente es negativo. Por lo tanto, la ecuación (6) puede escribirse como,
ΔUsis = QP − PΔV + Wútil
y
(ΔU + PΔV)sis = Δ(U + PV)sis,P = ΔHsis = QP + Wútil (8)
En la última expresión usamos la definición de entalpía como H = U + PV, donde P es la presión del sistema y V es su volumen. Dado que U, P y V son todas funciones de estado, la entalpía es también una función de estado. El producto PV tiene unidades de energía, por lo que también H, al igual que U, tiene unidades de energía. Como ocurre con cualquier función de estado, el cambio de entalpía, ΔH entre cualquier par de estados inicial y final es independiente del paso entre ellos. Aunque la definición de entalpía puede parecer arbitraria, tiene importante implicancia en termoquímica. Muchos sistemas químicos son contenidos en vasijas abiertas a la atmósfera y, por consiguiente, a presión aproximadamente constante.
Puesta en forma separada, la ecuación (8) es similar a la expresión matemática de la primera ley (véase la ecuación (3)), pero en términos del cambio de entalpía del sistema.
ΔHsis = QP + Wútil (9)
Aquí se observa que el cambio de entalpía que experimenta el sistema (ΔHsis), se encuentra relacionado con los intercambios de calor y de trabajo útil a P constante.
De acuerdo con la ecuación (9), la respuesta a la pregunta sobre lo que se está midiendo en el experimento de calorimetría de un sistema donde ocurre una reacción química a P constante, es la siguiente: el calor intercambiado medido en el calorímetro, corresponderá al calor de reacción a P constante e igual al ΔH que experimenta el sistema (la reacción química en estudio), a condición de que el sistema no intercambie trabajo útil con los alrededores (es decir Wútil = 0) (véase la ecuación (9)). De esta forma se especifica la validez de la definición del cambio de entalpía de una reacción química.
Ahora nos hacemos otra pregunta, ¿hay alguna función de estado termodinámico que nos permita evaluar el trabajo útil que puede realizar un sistema de reacción química?
Segunda ley, cambios de entropía y energía de Gibbs
Para aproximarnos a la respuesta de la pregunta anterior, se introduce la segunda ley de la Termodinámica expresándola matemáticamente de la siguiente forma:
ΔSsis + ΔSalr = ΔSuniv ≥ 0 (10)
donde S es la función termodinámica denominada entropía.
La interpretación de la ecuación (10) indica que en una transformación de un sistema aislado, como lo es el universo termodinámico, la entropía aumenta (ΔSuniv > 0) si el proceso es un proceso termodinámico irreversible, o permanece constante (ΔSuniv = 0) cuando la transformación se lleva a cabo en un proceso termodinámico reversible.
Tomando ΔSuniv ≥ 0, una expresión alternativa (Atkins y de Paula, 2002) de la ecuación (10) es la siguiente:
ΔSsis ≥ −ΔSalr (11)
La ecuación (11) puede reescribirse para el caso de una transformación a temperatura constante (T = cte), es decir en un proceso isotérmico. Teniendo presente que el sistema es cerrado pero intercambia calor con los alrededores, y aplicando el balance de energía Qsis = −Qalr, se obtiene:
ΔSsis ≥ −Qalr/T = Qsis/T
ΔSsis ≥ Qsis/T (12)
donde el cambio de entropía para el proceso isotérmico se ha calculado como el calor intercambiado dividido por la temperatura absoluta (Glasstone, 1962). En un proceso isotérmico se ha considerado que la temperatura del sistema es la misma que la de los alrededores. Durante la transformación termodinámica ambas temperaturas permanecen constantes e iguales entre ellas, y se dice que el sistema evoluciona en condiciones termodinámicas de equilibrio térmico. En este caso, la transformación se produce en forma termodinámica reversible, motivo por el cual ΔSsis = −ΔSalr = Qsis/T y, por lo tanto, ΔSuniv = 0 en ecuación (10).
Con la introducción del concepto de entropía a través de la segunda ley, y la forma de calcular el cambio de entropía en un proceso isotérmico dado en ecuación (12), ahora se puede relacionar esta ecuación con la ecuación (9) a través del término de calor que aparece en ambas expresiones, Qsis y QP. La aclaración que se debe hacer es que el proceso que se describe mediante la ecuación (9) es a P constante, mientras que el de la ecuación (12) es a T constante. Por consiguiente, el proceso puede describirse usando una combinación de ambas ecuaciones, y la ecuación resultante, representa un proceso a P y T constantes:
TΔSsis ≥ Qsis = QP = ΔHsis − Wútil
la que puede reescribirse como,
−ΔHsis + TΔSsis ≥ −Wútil (13)
o bien al multiplicar por −1, se invierte la desigualdad.
ΔHsis − TΔSsis ≤ Wútil (14)
Esta ecuación puede expresarse en términos de otra función termodinámica, llamada energía de Gibbs. La energía de Gibbs para el sistema Gsis está definida por la ecuación (G = H − TS)sis. Es importante destacar aquí que esta función energía de Gibbs, ampliamente usada en fisicoquímica, combina la primera y segunda leyes de la Termodinámica. Permite conocer, a partir únicamente de propiedades del sistema, si un determinado proceso será o no espontáneo a P y T constantes (Glasstone, 1966; Atkins y de Paula, 2002).
Por lo anterior se puede escribir la ecuación (14) como
Δ(H − TS)sis ≤ Wútil
ΔGsis ≤ Wútil (15)
De acuerdo con la ecuación (15), la respuesta a la pregunta formulada con respecto al trabajo útil, significa que el cambio de la energía de Gibbs en un proceso que ocurre a P y T constantes es una medida del trabajo útil que produce el sistema cuando experimenta un proceso reversible (signo igual en ecuación (15), trabajo útil máximo). En otras palabras, la energía de Gibbs Gsis representa la energía disponible para producir trabajo útil. Cuando el sistema realiza trabajo útil sobre los alrededores (Wútil < 0) implica que su energía de Gibbs Gsis disminuye (ΔGsis < 0), y significa que el trabajo útil que produce el sistema es a expensas de su energía de Gibbs.
Aquí es importante recordar el concepto de proceso termodinámico reversible e irreversible. Un proceso o transformación es reversible si se realiza mediante una sucesión de estados de equilibrio del sistema con su entorno y es posible devolver al sistema y su entorno al estado inicial siguiendo el camino inverso. Los estados de equilibrio a que se hace referencia en esta definición comprende a los estados de equilibrio mecánico, térmico y químico. Reversibilidad y equilibrio son, por tanto, equivalentes. La transformación que no cumple con estas condiciones es una transformación irreversible.
De lo anterior y volviendo a la ecuación (15), se deduce que la desigualdad ΔGsis < Wútil es válida en un proceso irreversible. Para ejemplificar estos conceptos, supongamos que se realiza una dada transformación en un sistema en el que se produce una reacción redox, y que para esa transformación el ΔGsis es de −100 J a una dada P y T. El trabajo útil máximo que se podría obtener es de −100 J. Esto sería así si se arma una pila en la que ocurre esa reacción química en forma termodinámica reversible. Por el contrario, si se produce la misma transformación en un proceso termodinámico irreversible el Wútil será de −90 J, o de −80 J... o de cualquier cantidad negativa pero de menor valor absoluto que 100, e incluso puede ser 0 J (pila cortocircuitada), pero ΔGS seguirá siendo de −100 J.
Por otra parte, se puede ver que cuando la reacción redox se produce por mezcla de los reactantes en una misma celda de reacción —no por reacción en las hemiceldas de una pila— no habrá producción de Wútil. Por lo tanto, en este caso (mezcla de reactantes) como en el caso de que la misma reacción se produzca en una pila en una transformación irreversible con Wútil = 0, se cumple que ΔHsis = QP (véase ecuación (9)). La energía de Gibbs disponible por el sistema para producir trabajo útil se degradaría completamente como calor.
Finalmente, partiendo de la definición de energía de Gibbs (G = H − TS)sis, se deduce para una transformación del sistema a temperatura constante ΔG = ΔH − TΔS. De esta ecuación se puede despejar ΔH = ΔG + TΔS y llevar esta expresión de ΔH a la ecuación (9). Así se obtiene:
ΔHsis = QP + Wútil = ΔG + TΔS (16)
Concluyendo, a partir de la ecuación (16) se puede ver que sólo en un proceso reversible a P y T constantes se identifica el ΔG con el Wútil (máximo) y paralelamente el calor intercambiado QP con el TΔS y no con el ΔH (Moore, 1972). Para cualquier transformación (reversible o irreversible) las igualdades en la ecuación (16) obviamente son válidas para un dado cambio de estado. Los valores de QP y Wútil que se obtengan en una transformación a P y T constantes son variables puesto que dependen de como se lleve a cabo la transformación, reversible o irreversible. No obstante, la suma de QP y Wútil será siempre igual al ΔHsis, pero únicamente será el calor a presión constante igual al ΔHsis cuando en la transformación no se produzca trabajo útil.
Bibliografía
Atkins, P. y de Paula, J., Physical Chemistry. New York, USA: W. H. Freeman and Company, 2002. [ Links ]
Autores, VII Jornadas Nacionales de Enseñanza Universitaria de la Química, Comodoro Rivadavia, Argentina, 9–12 abril, 2006. [ Links ]
Brouwer, H., Smallscale termochemistry experiment, Journal of Chemical Education, 68(7), A178–A184, 1991. [ Links ]
Chang, R., Química, México: McGraw Hill, 1993. [ Links ]
Furió, C., Solbes, J. y Furió, C., Enseñanza de las Ciencias. 2005. Número Extra. VII Congreso internacional sobre Investigación en la Didáctica de las Ciencias, Granada, España, 7-10 septiembre, 2005. [ Links ]
Glasstone, S., Termodinámica para Químicos, Madrid, España: Aguilar, 1966. [ Links ]
Glasstone, S. y Lewis, D., Elementos de Química Física. Buenos Aires, Argentina: Editorial Médico-Quirúrgica, 1962. [ Links ]
Harms, G. S. y Lehman, T. A., Heat of solution of hydrogen chloride: A laboratory experiment, Journal of Chemical Education, 70(11), 955–955, 1993. [ Links ]
Jansen, M. P., How Efficient is a Laboratory Burner in Heating Water? Journal of Chemical Education, 74(2), 213–215, 1997. [ Links ]
Marzzacco, C. J., The Enthalpy of Decomposition of Hydrogen Peroxide: A Gral Chemistry Calorimetry Experiment, Journal of Chemical Education, 76(11), 1517–1518, 1999. [ Links ]
Moore, W.J., Physical Chemistry. London, Great Britain: Longman Group Limited, 1972. [ Links ]
Palmer, W. G., Química Física Experimental. Buenos Aires, Argentina, EUDEBA, 1966, pp. 140–159. [ Links ]














