Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.23 no.1 Ciudad de México ene. 2012
Didáctica de la química
Determinação de ácidos e bases por meio de extratos de flores
Determinación de ácidos y bases por medio de extractos de flores
Determination of acids and bases by extracts of flowers
Soraya Moreno Palácio, Conceição de Fátima Alves Olguin, Márcia Borin da Cunha*
* Universidade Estadual do Oeste do Paraná/Unioeste - Núcleo de Ensino de Ciências/NECTO. Brasil. Correos electrónicos: soraya_palacio@yahoo.com.br, cfolguin@unioeste.br, marciaborin@uol.com.br.
Fecha de recepción: 25 octubre de 2010.
Fecha de aceptación: 28 mayo de 2011.
Resumen
La enseñanza experimental de la química con materiales de bajo costo fáciles de obtener ha sido una buena alternativa para estimular a los profesores y estudiantes al proceso de aprender conceptos a menudo abstractos y difíciles de entender. En este trabajo se presenta una propuesta de trabajo experimental para determinar el carácter ácido o básico de una disolución, mediante el empleo de extractos de flores de Hibiscus rosa-sinensis y Catharanthus roseus. Ambas plantas provienen de China, pero hoy se encuentran fácilmente en nuestros jardines. El color de estas flores varía del blanco (transparente) al rojo y puede ser utilizado como un indicador debido a cambios estructurales en las antocianinas que contiene.
Palabras clave: flores, ácido-base, indicadores, trabajo experimental.
Abstract
The teaching of chemistry, through experimental classes, with easily obtained materials, has been an alternative to stimulate teachers and students the learning of concepts, often abstract and difficult to understand. We present a proposal for experimental work to determine the acid or basic character of a solution, using an extract of flowers of Hibiscus rosa-sinensis and Catharanthus roseus. Both plants are from China but actually easily founded in our gardens. The color of the flowers varies from white to red and can be used as an acid-base indicator due to some changes in the structure of the anthocyanin.
Keywords: flowers, acid-base, indicators, experimental work.
Introdução
O ensino das Ciências e da Química torna-se mais atraente quando relaciona seus conteúdos ao cotidiano e esta introdução pode ser feita de várias maneiras: como coletâneas de fatos curiosos, ilustração da aplicação do conhecimento químico, a propaganda de produtos de consumo, entre outras (Terrazzan, 1994).
O ensino de química deve possibilitar, através da compreensão e aplicação do conhecimento químico, a passagem do nível de aparência do senso comum para a interpretação científica (Terrazzan, 1994), isto é, na formação do pensamento químico, os conceitos cotidianos podem ser usados para avançar em direção a formação dos conceitos químicos. Uma das formas utilizadas para realizar a transposição do conhecimento é partir de elementos presentes no cotidiano do estudante e destes realizar atividades e práticas que levem o estudante a pensar na presença da Ciência em suas vidas.
As plantas fazem parte do cotidiano dos estudantes e muitos pigmentos podem ser extraídos destas. A utilização de pigmentos de plantas como indicadores de sistemas ácido-base vêm de encontro, especialmente, à desmistificação da Química como algo estéreo e distante da realidade. Além disso, uma atividade deste tipo dispensa o uso de aparatos sofisticados e laboratórios com estruturas ideais, muitas vezes inexistentes em algumas escolas.
O uso de indicadores de pH é uma prática bem antiga que foi introduzida no século XVII por Robert Boyle (1663; 1744). Ele preparou um licor de violeta e observou que o extrato desta flor tornava-se vermelho em solução ácida e verde em solução básica. Gotejando o licor de violeta sobre um papel, este se tornava vermelho. Assim foram obtidos os primeiros indicadores de pH em duas formas: solução e papel (Baccan, et al., 1979). Inúmeras plantas são citadas na literatura (Dias, et al., 2003, Terci, et al., 2002, Couto, et al., 1998, Ferreira, 1996) por apresentarem pigmentos que, quando submetidos a diferentes graus de acidez ou basicidade, alteram sua coloração, podendo ser utilizadas como indicadores ácido-base. Uma proposta apresentada em 1995 pelo GEPEQ utilizou extrato de repolho roxo para determinar o efeito tampão de comprimidos efervescentes. Também, Gouveia-Matos (1999) apresentou em um artigo uma análise dos princípios teóricos associados às mudanças de cores dos extratos em sistemas ácido-base.
A mudança de coloração do extrato de tecidos vegetais foi apresentada em 1941 por Geissman (1941) que atribuiu esta mudança à presença das antocianinas na composição das plantas. As antocianinas são compostos da classe dos flavonóides e as transformações estruturais provocam mudanças de cor em função do pH (Cortes, et al., 2007).
No experimento que vamos descrever neste artigo utilizamos extratos alcoólicos das flores das plantas Hibiscus rosasinensis conhecida popularmente como hibisco, graxa de soldado ou graxa de estudante e Catharanthus roseus, conhecida como vinca. O hibisco (figura 1a) é um arbusto perene originário da China, que produz flores grandes, em cores que vão do branco ao vermelho, passando pelo rosa, amarelo e laranja. Segundo Brouillard, 1988 (Couto, et al., 1998), a coloração rosa, laranja, vermelha, violeta e azul da maioria das flores é devido as antocianinas. A vinca (figura 1b) é uma planta bastante rústica e pouco exigente, com delicadas flores. Muitas vezes nasce espontaneamente nos jardins, sem que seja preciso semeá-la. A vinca possui algumas variedades, com flores nas cores que variam do branco ao vermelho.

Parte experimental
Parte A – Preparo das soluções ácida e básica e do extrato de flores (hibisco e vinca)
Material:
— Solução de ácido clorídrico (HCl) 0,12 mol L−1
— Solução de hidróxido de sódio (NaOH) 0,12 mol L−1;
— Flores de hibisco vermelho e flores de vinca púrpura;
— 4 Béqueres de 250 mL;
— Álcool comum;
— Água destilada;
— Peneira fina;
— Pilão para amassar as flores.
Procedimento
— Preparar uma solução de ácido clorídrico (HCl) 0,12 mol L−1 da seguinte maneira: dilua 1 mL de ácido clorídrico concentrado (ou ácido muriático – nome comercial) em água destilada até completar o volume de 100 mL.
— Preparar uma solução de hidróxido de sódio (NaOH) 0,12 mol L−1 da seguinte maneira: dissolva 0,5 g de soda cáustica em 100 mL de água destilada.
— Preparar um extrato das flores, misturado duas partes de flores com uma parte de álcool comum em um béquer, amassar com um pilão para extrair os pigmentos, deixar em repouso por 15 minutos. Após repouso, coar a mistura com a peneira fina.
Parte B – Preparo do papel indicador de pH
Material:
— Papel de filtro qualitativo (ou filtro para café) cortado em tiras finas;
— Extrato de flores preparado na Parte A.
Procedimento:
— Mergulhar as tiras de papel de filtro no extrato de flores previamente preparado;
— Retirar o papel de filtro lentamente da solução e colocar para secar sobre um papel-toalha;
— Depois de seco, colocá-los novamente no extrato, repetindo o processo anterior;
— Guardar os papéis em saco plástico para o seu uso posterior.
Parte C - Preparo da escala padrão de pH
Material:
— 10 tubos de ensaio;
— Suporte para tubos de ensaio;
— Solução de HCl e solução de NaOH preparada na Parte A;
— Vinagre branco;
— Produto de limpeza a base de amoníaco;
— Pipepas de 5 mL graduadas;
— Água destilada;
Procedimento:
Numere 10 tubos de ensaio com as soluções indicadas no Quadro 1. Os valores de pH apresentados no quadro 1 foram obtidos com um pHmetro, porém pode ser utilizado papel indicador universal.
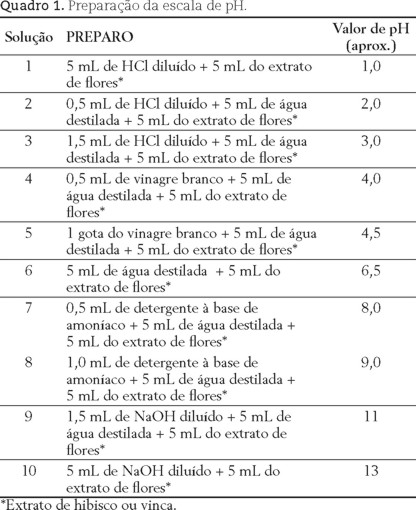
Para cada um dos extratos são obtidas as escalas de pH diferentes. A figura 2 mostra a coloração da solução obtida com o extrato de hibisco e a figura 3 a coloração da solução com o extrato de vinca.


Parte D - Testando o pH de diferentes materiais de uso doméstico
Para realização do teste de pH, materias de uso doméstico podem ser escolhidos pelo professor. No Quadro 2 sugerimos algumas substâncias que podem ser testadas. Sugerimos a realizaçao dos testes de duas formas: 1) utilizando-se o extrato de flores; 2) utlizando o papel indicador preparado.
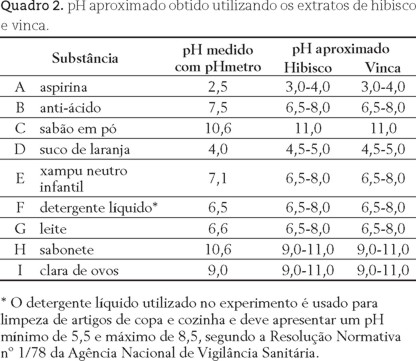
1) Teste do pH com extrato: Colocar em um tubo de ensaio 5 mL de água, 5 mL do extrato de flores e 5 gotas do material a ser testado. No caso da aspirina (ácido acetil salicílico), antiácido (composição: bicarbonato de sódio, ácido cítrico (anidro) e; carbonato de sódio) e sabão em pó prepare uma solução pouco diluida destas substâncias.
Comparar a cor obtida com a escala padrão, preparada na Parte C (figuras 2 e 3) e medir o pH com um pHmetro para comparação dos resultados.
O Quadro 2 mostra a comparação dos valores de pH das substâncias testados quando medidos em um pHmetro e quando testados com as escalas obtidas na Parte C. Os resultados obtidos com os extratos de flores de hibisco e vinca apresentam valores dentro de uma faixa aceitável, quando comparados aos valores obtidos em pHmetro.
2) Teste com papel indicador: Os papéis indicadores devem ser mergulhados nas substâncias testes e as cores obtidas (figura 4) comparadas com as escalas apresentadas nas figuras 2 e 3. Os papéis preparados com os extratos de hibisco e vinca foram denominado de papH e papV, respectivamente.

Comparando-se a coloração obtida nos papéis indicadores com a escala obtida na parte C é possível inferir o caráter ácido ou básico das soluções das substâncias testadas, sem contudo haver atribuição de valores de pH. Os resultados da caracterização das substâncias testadas utilizando os papéis papH e papV são mostrados no quadro 3.
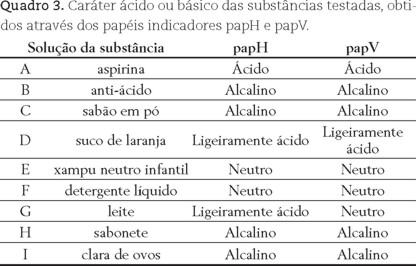
Os resultados com os papéis indicadores apresentaram concordância com aqueles obtidos com os extratos (Quadro 2), indicando que os papéis indicadores testados podem ser utilizados em ensaios nos quais não seja necessário o estabelecimento de valores numéricos. A escolha pelo uso dos extratos ou papéis indicadores depende do objetivo do experimento ou do nível de ensino que será desenvolvido. Desta forma, sugere-se a utilização dos papéis indicadores em experiências voltadas ao Ensino Fundamental e o uso de extratospara o Ensino Médio, nos quais é possível o aprofundamento dos conhecimentos relacionados.
Conclusões
Os extratos de hibisco e vinca, assim como os papéis indicadores papH e papV podem ser utilizados como indicadores de pH, considerando que os papéis indicadores papH e papV limitam-se a determinar o caráter ácido ou básico das substâncias sem estabelecer valores numéricos de pH.
Os extratos de vinca e hibisco apresentam viragem na faixa de pH compatível com os valores obtidos com aparelhos destinados a determinação de pH (pHmetro).
Em relação ao aspecto didático, a proposta apresentada é viável uma vez que estas plantas são facilmente encontradas, podendo ser utilizadas na sala de aula como um recurso para ensinar os conceitos de acidez e basicidade, no nível básico de ensino. Além disso, essa abordagem proporciona ao estudante um contato maior com uma Química relacionada com o seu cotidiano.
Referências bibliográficas
Baccan, N.; Andrade, J. C.; Godinho, O. E. S.; Barone, J. S.; Química Analítica Quantitativa Elementar, 2ª ed., Ed. Unicamp: Campinas, Brasil, p. 46, 1979. [ Links ]
Brasil, Ministério da Saúde. Resolução Normativa nº 1/78 da Agência Nacional de Vigilância Sanitária. Disponível em: http://www.anvisa.gov.br/legis/resol/01_78.htm. Acesso em, 03/03/2011. [ Links ]
Boyle, R. Experiments upon Colors. London: 1663, apud Bishop, E., ed.; Indicators, vol. 2. Oxford: Pergamon Press, 1973, p. 2. [ Links ]
Boyle, R. Works. London: 1744, apud Bishop, E., ed.; Indicators, vol. 2. Oxford: Pergamon Press, 1973, p. 2. [ Links ]
Cortes, M. S., Ramos, L. A, Cavalheiro, E. T. G. Titulações espectrofotométricas de sistemas ácido-base utilizando extrato de flores contendo antocianinas, Revista Química Nova, 30(4), 1014-1019, 2007. [ Links ]
Couto, A. B.; Ramos, L. A.; Cavalheiro, E. T. G. Aplicação de pigmentos de flores no ensino de Química, Revista Química Nova, 21(2), 221-227, 1998. [ Links ]
Dias, M. V; Guimarães, P. I. C; Merçon, F., Corantes naturais: Extração e Emprego como indicadores de pH, Revista Química Nova na Escola, (17), 27-31, 2003. [ Links ]
Ferreira, V. F., Aprendendo sobre os conceitos de ácido e base, Revista Química Nova na Escola, (4), 35-36, 1996. [ Links ]
Geissman, T. A., Flowers coloration, Journal Chemica Educacion, 18(3), 1941. [ Links ]
GEPEQ. Estudando o equilíbrio químico ácido-base, Revista Química Nova na Escola, (1), 3233, 1995. [ Links ]
Gouveia-Matos, J. A. M., Mudanças nas cores dos extratos de flores e do repolho roxo, Química Nova na Escola, (10), 6-10, 1999. [ Links ]
Terci, D. B, L; Rossi, A. V. Indicadores naturais de pH: usar papel ou solução?, Revista Química Nova, 25(4), 684-688, 2002. [ Links ]
Terrazzan, E. A. Perspectivas para inserção da Física moderna na escola média. Tese de doutorado apresentada no Programa de Pós-Graduação do Instituto de Física e Faculdade de Educação da Universidade de São Paulo / FEUSP, Brasil, 1994. [ Links ]














