Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.22 no.1 Ciudad de México ene. 2011
2011 año internacional de la química
Organocatalizadores quirales y su aplicación en síntesis asimétrica*
Chiral organocatalysts and their application in asymmetric synthesis
Eusebio Juaristi1
1 Departamento de Química, Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, Apartado Postal 14-740, 07000-México, D. F. Correo electrónico: juaristi@relaq.mx
Resumen
La organocatálisis constituye uno de los avances más importantes en el área de la química del siglo XXI. En particular, las reacciones organocatalíticas se han constituido como una herramienta poderosa para la construcción estereoselectiva de estructuras moleculares quirales. En este artículo se presentan los fundamentos y el enorme potencial de la organocatálisis, junto con algunos ejemplos particulares de desarrollos que se han dado en nuestros laboratorios. Es evidente que es necesario consolidar el campo de la organocatálisis en México, y en efecto varios grupos de investigación están iniciando trabajos originales en esta área.
Abstract
Organocatalysis constitutes one of the most relevant advances in the science of chemistry in the XXI Century. In particular, organocatalytic reactions are now a powerful strategy for the stereoselective synthesis of chiral molecules. In this article, the fundaments and enormous potential of organocatalysis are presented, together with some particular examples of developments taking place in our laboratories. It is evident the necessity to consolidate the area of organocatalysis in Mexico in order to benefit from the academic (i.e., developing new conceptual models and novel organocatalytic systems) and practical uses (for example, application of efficient and environmentally friendly production of chemicals at an industrial scale).
Keywords: Organocatalysis, asymmetric synthesis, enantioselective reactions, chiral catalysts.
Antecedentes
Entre los métodos que permiten obtener sustancias quirales enantiopuras destacan:
1) la síntesis enantioselectiva estequiométrica, donde cada molécula del reactivo quiral genera una molécula de producto quiral, y
2) la catálisis asimétrica, donde se alcanza una "multiplicación" de la quiralidad, ya que una molécula del catalizador quiral puede generar cientos o miles de moléculas quirales. Obviamente, este segundo método es muy atractivo pues permite aprovechar los reactivos requeridos de manera más eficiente y sustentable (Química "verde").
En catálisis asimétrica podemos distinguir entre biocatalizadores, como son las enzimas, que se conocen desde mediados del siglo XIX a través de los trabajos de Pasteur, y los catalizadores organometálicos que se desarrollaron durante la segunda mitad del siglo XX. Ejemplos sobresalientes en este campo fueron reconocidos con el otorgamiento del Premio Nobel de Química 2001 a William Knowles (producción de la (S)-Dopa, medicamento fundamental para el tratamiento del mal de Parkinson), Ryori Noyori (síntesis enantioselectiva del agente antiinflamatorio (S)-Naproxen) y Barry Sharpless (oxidación enantioselectiva de alcoholes alílicos) (Juaristi, 2002).
Los catalizadores organometálicos incorporan metales como el rodio, rutenio y titanio. Asimismo, biocatalizadores como son las enzimas frecuentemente requieren de la participación de metales como el cobre, el hierro, cobalto, etc. para llevar a cabo su función. Sin embargo, es notable que aproximadamente la mitad de las enzimas conocidas no requieren de la presencia de metales en el sitio activo para ejercer su actividad. Surge así la posibilidad de utilizar moléculas orgánicas pequeñas para catalizar reacciones químicas evitando el uso de metales.
Efectivamente, la Química es una ciencia en pleno desarrollo y un ejemplo sobresaliente lo constituye la organocatálisis —es decir, la utilización de pequeñas moléculas orgánicas para catalizar reacciones orgánicas (MacMillan, 2008). En particular, aunque las primeras aplicaciones de la organocatálisis se llevaron a cabo con compuestos aquirales de modo que los productos obtenidos resultaron por fuerza racémicos, pronto se descubrió que los organocatalizadores enantioméricamente puros no sólo promueven la reacción de interés sino que pueden inducir alta enantioselectividad. Esto explica el enorme desarrollo del campo de la organocatálisis en la última década.
Algunas de las ventajas de esta estrategia, es decir del uso de organocatalizadores, son:
1. No se requiere de condiciones inertes para su empleo; en contraste, los complejos organometálicos generalmente son sensibles a la humedad y al oxígeno.
2. No es necesario utilizar disolventes secos, lo que permite reducir costos en la planta de producción.
3. Las moléculas orgánicas pequeñas presentan una mayor estabilidad. En contraste, las enzimas generalmente se degradan a temperaturas superiores a los 25 grados centígrados.
4. Bajo costo en comparación con el precio de enzimas y muchos metales de transición y sus complejos con propiedades catalíticas.
5. Accesibilidad, ya sea mediante el aprovechamiento de sustancias naturales abundantes (acervo quiral) como son los aminoácidos y los carbohidratos, o porque su preparación en el laboratorio es sencilla.
6. Amplio rango de aplicación, ya que pueden actuar sobre una gran variedad de sustratos, y
7. Protección del medio ambiente al evitar el empleo de metales que pudiesen ser intolerables en la producción de fármacos, alimentos y derivados agroquímicos.
Así pues, la organocatálisis está adquiriendo día con día una mayor importancia en el área de la síntesis asimétrica, complementando las metodologías que se basan en bio y metalocatálisis.
Aunque no todos, la mayoría de los organocatalizadores se pueden clasificar como bases de Lewis, ácidos de Lewis, bases de Br0nsted y ácidos de Bransted (Seayad y List, 2005). La figura 1 muestra de manera simplificada los ciclos catalíticos correspondientes. De esta forma, un organocatalizador que actúa como base de Lewis (B:) inicia el ciclo catalítico a través de la adición nucleofílica al sustrato (S). El complejo resultante sufre una transformación química en la que el fragmento que proviene del sustrato se convierte en el futuro producto que es entonces liberado (P), recuperándose el catalizador que se reincorpora en un nuevo ciclo.

Asimismo, los organocatalizadores que actúan como ácidos de Lewis (A) activan a sustratos nucleofílicos (S:) de manera similar (figura 1). En contraste, los ciclos catalíticos que involucran bases o ácidos de Bronsted se inician mediante un proceso de desprotonación o protonación, respectivamente (figura 1).
Así pues, la organocatálisis utiliza pequeñas moléculas orgánicas para emular la actividad catalítica y la estereoselectividad que alcanzan las enzimas, con su estructura molecular tan compleja. En este sentido, un ejemplo pionero lo constituye la hidrocianación biomimética desarrollada por Inoue y colaboradores en 1990 (Tanaka, et al., 1990). Efectivamente, el ciclo-dipéptido ciclo[(S)-fenilalanil-(S)-histidil] cataliza de manera eficiente la adición de ácido cianhídrico al benzaldehído para generar (R)-mandelonitrilo con un excelente rendimiento (94%) y alta enantioselectividad (97% ee). Es sorprendente que la estereoselectividad que se encuentra en procesos enzimáticos pueda ser reproducida por una pequeña molécula orgánica compuesta únicamente por dos aminoácidos. En contraste, las enzimas están formadas por cientos o miles de residuos de aminoácidos.
Un área de investigación que ha sido desarrollada con éxito en México es la que concierne a la síntesis asimétrica de aminoácidos (Juaristi, 2008). En este contexto, recientemente se reportó un método organocatalítico para la aminación enantioselectiva de acianoacetatos con azodicarboxilato de t-butilo, utilizando como organocatalizador a alcaloides quirales naturales (cat* = quinina, quinidina); es decir, bases de Bronsted quirales (Marigo, et al., 2006). En particular, los productos aminados se pueden convertir fácilmente en α- o β-aminoácidos enantiopuros, que juegan un papel muy relevante en biología, química y medicina (Juaristi, 1997) (Juaristi y Soloshonok, 2005).
Aunque el empleo de productos naturales (acervo quiral) como organocatalizadores constituye un concepto importante en el campo de la organocatálisis (Berkessel y Groeger, 2005), la complejidad estructural de los productos naturales puede ser una limitante en su aplicación. Por esta razón el diseño de moléculas orgánicas simples y baratas como organocatalizadores es muy deseable. En particular, varias aminas quirales que contienen el grupo feniletilo resultan ser bastante eficientes (rendimientos de casi el 100% y excesos enantioméricos superiores al 80%) en la aminación enantioselectiva del α-fenil-α-cianoacetato de etilo (Liu et al., 2007).
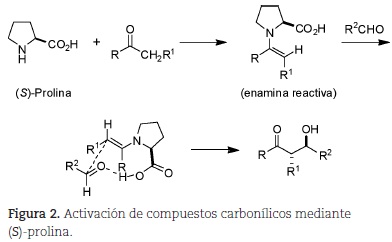
En este contexto, la reacción de aminas derivadas de la (S)-prolina con aldehídos y cetonas para generar enaminas quirales permite la funcionalización en la posición alfa de compuestos carbonílicos, por ejemplo mediante la reacción aldólica (Mukherjee et al., 2007). El mecanismo de esta reacción involucra la formación de una enamina reactiva (figura 2).
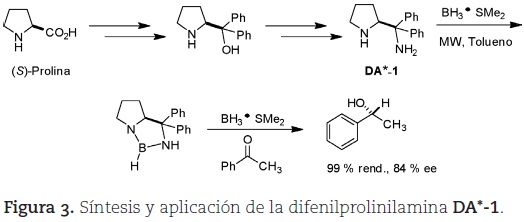
Recientemente, desarrollamos un método para la síntesis de una nueva diamina quiral análoga a la (S)-prolina (DA*-1, figura 3), que fue utilizada como organocatalizador en la reducción enantioselectiva de cetonas proquirales (Olivares-Romero y Juaristi, 2008) (figura 3) y ofrece un potencial enorme como organocatalizador (vide infra).
Una clase importante de organocatalizadores actúan mediante la formación de enlaces de hidrógeno; por ejemplo, las tioureas presentan dos N-H ácidos que son muy efectivos en este mecanismo de activación (Hernández Rodríguez y Juaristi, 2007; Wenzel y Jacobsen, 2002; Bui, et al., 2009). Otro ejemplo importante de ácidos de Br0nsted quirales lo constituyen derivados del ácido fosórico utilizando el eje de quiralidad presente en el BINOL (figura 4). Estos compuestos contienen tanto un segmento ácido (P-OH) como básico (P=O), por lo que se denominan organocatalizadores bifuncionales y están siendo aplicados en reacciones como la reacción de Strecker (hidrocianación de iminas proquirales para dar precursores de a aminoácidos), en la que la imina es activada por el grupo ácido P-OH mientras que el fosforilo P=O básico activa al HCN (Simon y Goodman, 2009).

En resumen, la organocatálisis constituye uno de los avances más importantes en el área de la química del siglo XXI. En particular, las reacciones organocatalíticas se han constituido como una herramienta poderosa para la construcción estereo selectiva de estructuras moleculares quirales. Es evidente que es necesario consolidar el campo de la organocatálisis en México, y en efecto varios grupos de investigación están iniciando trabajos originales en esta área.
Referencias
Berkessel, A. y Groeger, H. Asymmetric organocatalysis: from biomimetic concepts to applications in asymmetric synthesis", Wiley-VCH: Weinheim, 2005. [ Links ]
Bui, T., Syed, S. y Barbas, C.F., Thiourea-Catalyzed Highly Enantio- and Diastereoselective Additions of Oxindoles to Nitroolefins:Application to the Formal Synthesis of (+)-Physos-tigmine, J. Am. Chem. Soc. 131, 8758-8759, 2009. [ Links ]
Hernández-Rodríguez, M. y Juaristi, E., Structurally simple chiral thioureas as chiral solvating agents in the enantiodis-crimination of carboxylic acids, Tetrahedron 63, 7673-7678, 2007. [ Links ]
Juaristi, E. Premio Nobel de Química 2001: La importancia de la síntesis asimétrica, Educ. quím. 13, 6-7, 2002. [ Links ]
Juaristi, E. Síntesis asimétrica de aminoácidos valiosos, en Aportaciones científicas y humanísticas mexicanas en el siglo XX, Paredes, O. y Estrada, S., Eds., Fondo de Cultura Económica: México, 2008, p. 440-446. [ Links ]
Juaristi, E. Enantioselective synthesis of ft-amino Acids, Wiley-VCH: Nueva York, 1997. [ Links ]
Juaristi, E. y Soloshonok, V. A. (Eds.) Second edition of enantioselective synthesis of β-amino acids, Wiley: Nueva York, 2005.
Liu, Y., Melgar, R. y Juaristi, E. Enantioselective amination of a-phenyl a-cyanoacetate catalyzed by chiral amines incorporating the α-phenylethyl auxiliary, J. Org. Chem. 72, 1522-1525, 2007.
MacMillan, D. W. C., The advent and development of organocatalysis, Nature 455, 304-308, 2008. [ Links ]
Marigo, M., Juhl, K. y Jorgensen, K. A., Catalytic, highly enantioselective, direct amination of beta-ketoesters, Angew. Chem., Int. Ed. 42, 1367-1369, 2003. [ Links ]
Mukherjee, S.; Yang, J.W.; Hoffmann, S.; List, B., Asymmetric enamine catalysis, Chem. Rev. 107, 5471-5569, 2007. [ Links ]
Olivares-Romero, J. L. y Juaristi, E., Synthesis of Two Novel Chiral Diamines Derived from (S)-Proline and their Evaluation as Precursors of Diazaborolidines for the Catalytic Borane-Mediated Enantioselective Reduction of Prochiral Ketones, Tetrahedron 64, 9992-9998, 2008. [ Links ]
Seayad, J. y List, B., Asymmetric organocatalysis, Org. Biomol. Chem. 3, 719- 724, 2005. [ Links ]
Simon, L. y Goodman, J. L., Mechanism of BINOL-Phosphoric Acid-Catalyzed Strecker Reaction of Benzyl Imines, J. Am. Chem. Soc. 131, 4070-4077, 2009. [ Links ]
Tanaka, K., Mori, A. y Inoue, S., The cyclic dipeptide cyclo[(S)-phenylalanyl-(S)-histidyl] as a catalyst for asymmetric addition of hydrogen cyanide to aldehydes, J. Org. Chem. 55, 181-185, 1990. [ Links ]
Wenzel, A. G. y Jacobsen, E. N., Asymmetric catalytic Mannich reactions catalyzed by urea derivatives: enantioselective synthesis of β-aryl-β-amino acids, J. Am. Chem. Soc. 124, 12964-12965, 2002.
* Trabajo invitado por el Consejo Editorial Nacional de la revista.














